Способ очистки фактора свертывания крови viii
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу очищения или обогащения фактора свертывания крови FVIII с использованием хроматографии. Способ включает обеспечение фракции, содержащей рекомбинантный FVIII, в водном растворе с высокой ионной силой, где водный раствор содержит рекомбинантный FVIII в растворе с большой концентрацией соли, соответствующей проводимости в диапазоне от приблизительно 25 до приблизительно 200 мС/см при 25°C, приведение фракции, содержащей рекомбинантный FVIII, в контакт с многомодальной смолой, которая представляет собой Capto Adhere или Capto ММС. Элюируют содержащие рекомбинантный FVIII фракции водным элюирующим буфером, содержащим, по крайней мере, одну аминокислоту, которая положительно заряжена при величине pH 6-8, где аминокислота, которая положительно заряжена при величине pH 6-8, выбрана из группы аминогрупп, включающей аминокислоты, такие как лизин, аргинин, гистидин и их комбинаций, в концентрации более 0,4 М. Предложенное изобретение позволяет получить очищенный или обогащенный фактор свертывания крови FVIII с высоким выходом. 13 з.п. ф-лы, 8 ил., 22 табл., 10 пр., 3 прилож.
Реферат
Настоящее изобретение касается способа очистки фактора свертывания крови VIII (далее используют аббревиатуру FVIII) и фракции, содержащей FVIII, которая может быть получена в соответствии со способом настоящего изобретения.
Предпосылки к созданию изобретения
Гемофилия представляет собой группу наследственных генетических расстройств, которые ослабляют способность организма контролировать свертывание крови или коагуляцию. В наиболее общей форме, при гемофилии A наблюдается дефицит свертывания FVIII, и гемофилия A встречается у приблизительно 1 из 5000-10000 родившихся мальчиков. Белок FVIII является важнейшим кофактором при коагуляции крови, который обладает способностью выполнять множество функций. Дефицит FVIII можно устранять с помощью выделенных из плазмы концентратов FVIII или с помощью FVIII, полученного рекомбинантными методами. Лечение с помощью концентратов FVIII позволяет больным гемофилией вести нормальный образ жизни. Исторически гемофилию A лечили с помощью FVIII, полученного из плазмы крови человека. В плазме крови при нормальных условиях молекула FVIII всегда связывается с ее кофактором, фактором Виллебрандта (vWf), который придает молекуле FVIII устойчивость к различным формам дегенерации.
На рынке появились выделенные из плазмы продукты на основе FVIII различной степени чистоты, в которых присутствуют бóльшие или меньшие количества vWf. Как правило, продукты с небольшими количествами vWf содержат добавленный альбумин человека или другие стабилизаторы, в том числе включают повышенное содержание соли для стабилизации молекулы FVIII. Способы, которые используют для очистки FVIII, обычно представляют собой сочетание различных способов осаждения, таких как криоосаждение, осаждение с помощью гидроксида алюминия и т.п., а также хроматографические стадии, в основном стадии ионообменной хроматографии, аффинной хроматографии и гель-хроматографии.
Для улучшения продуктов на основе FVIII применяли аффинную хроматографию, которая эффективно удаляет примеси и позволяет получить FVIII высокой степени чистоты, в том числе позволяет снизить и содержание vWf (Farrugia et al., Biotechnology and plasma fractionation industry; The impact of advances in the production of coagulation FVIII. Biotechnology, Vol. 3, No. 1, February 1993). Недостаток аффинной хроматографии заключается в том, что она является сравнительно дорогостоящей, а также в том, что моноклональные антитела, которые используют в качестве аффинных лигандов, имеют животное происхождение.
В середине 80-х годах наблюдались случаи переноса вирусов, связанные с продуктами на основе FVIII, выделенными из плазмы. Несмотря на то, что указанная проблема была решена за счет применения специфических стадий удаления вируса, она явилась толчком для разработки рекомбинантных продуктов на основе FVIII (rFVIII). В 90-е годы на рынке появился первый продукт на rFVIII, и в настоящее время на рынке имеются три различных продукта rFVIII (две полноразмерные молекулы и одна молекула с удаленным B-доменом, в которой неактивная часть молекулы FVIII удалена, с целью повысить продуктивность клетки-хозяина (Eriksson et al., The manufacturing process for B-domain deleted recombinant FVIII. Seminars in Hematology, Vol. 38, No 2, Suppl. 4 (April), 2001: pp. 24-31)) высокой степени чистоты (все без vWf).
Все способы очистки, которые используют для очистки rFVIII, представляют собой сочетание различных методов хроматографии (см. Bhattacharyya et al., обзорная статья; Recombinant FVIII for Haemophilia "An overview of production technologies". CRIPS Vol.4, No.3, July-September 2003). Одним из них является хорошо известный иммуноаффинный метод (даже имеются вещества, позволяющие решить указанную проблему, например, вещества, обладающие сродством к пептидам (Kelly et al., Development and validation of an affinity chromatography step using a peptide ligand for cGMP production of FVIII.), или выделенные из дрожжей фрагменты антител (FVIII аффинная смола VIIISelect - GE Health сare, каталожный № 17-5450, которая уже поступает на рынок), применяемые для FVIII, выделенного из плазмы.
Поскольку во всех продуктах rFVIII отсутствует vWf, то определенные меры должны быть предприняты для стабилизации молекулы FVIII с тем, чтобы она не теряла своей активности (стабилизации от агрегации, от протеаз, от абсорбции на поверхности и т.д.). В один из продуктов добавляют хелатообразующий агент (ЭДТК и т.п.) с тем, чтобы защитить FVIII от разложения под действием металлопротеаз (US-A-5831026). Стратегиями, которые были опробованы для повышения устойчивости молекул rFVIII, являются добавление альбумина, апротинина, инсулина или даже совместная экспрессия rFVIII с vWf (с последующим его удалением на стадии очистки) (см. Bhattacharyya et al., обзорная статья; Recombinant FVIII for Haemophilia "An overview of production technologies". CRIPS Vol. 4, No. 3, July-September 2003).
Другая стратегия (для разработки процесса, в котором не используются добавки, полученные от млекопитающих, и хелатообразующие агенты) приводится в EP-A-1707634, где сочетание повышенного содержания солей приводит к стабилизации получаемого rFVIII и увеличению его выхода (Wang et.al, Coagulation FVIII, structure and stability. International Journal of Pharmaceuticals, 259 (2003), 1-15.). Однако указанный метод имеет определенные недостатки. Например, относительно высокое содержание соли делает указанным способ непригодным для проведения прямой обработки в ионообменнике без разбавления (и возможной дестабилизации, см. Parti et al., In vitro stability of recombinant FVIII. Haemophilia (2000), 6, 513-522. Biotechnology and Bioengineering, Vol. 87, No. 3, Aug 5, 2004.).
В WO-A-2009/007451 раскрывается способ очистки FVIII с использование полимера со смешанной модальностью или многомодальной смолы. Способ очистки основан на взаимодействии белка FVIII со смолой со смешанной модальностью или многомодальной смолой, содержащей лиганды, которые включают гидрофобную часть и отрицательно заряженную часть, и элюировании указанного белка FVIII с помощью элюирующего буфера, который включает, по крайней мере, 1,5 М соли, по меньшей мере, 40% (масс./об.) этиленгликоля, пропиленгликоля или их смеси и ионы кальция.
В EP-A-1707634 раскрывается способ выделения белков, полученных рекомбинантными методами, в том числе такие способы, как иммуноаффинная хроматография, аффинная хроматография, осаждение белка, буферные обмены, ионообменная хроматография, роматография с гидрофобными взаимодействиями, смешанная хроматография с гидрофобными взаимодействиями/ионообменная хроматография, хроматография с хелатообразованием, углеводная аффинная хроматография, такая как лектиновая или гепариновая аффинная хроматография, эксклюзионная хроматография, электрофорез, диализ, использование различных осадителей, таких как полиэтиленгликоль, сульфат аммония, этанол, адсорбция на гидроксиапатите, адсорбция на фильтрующих мембранах, применение лигандов, связанных с магнитными частицами, и т.д. Тем не менее, он идентифицирует конкретные стадии хроматографической очистки.
В WO-A-2005-082483 раскрыт способ очистки антител от одной или более примесей в жидкости, который включает приведение указанной жидкости в контакт с первой хроматографической смолой, состоящей из основы, на которую иммобилизованы многомодальные лиганды, с целью абсорбции антител смолой, при этом каждый многомодальный лиганд содержит, по меньшей мере, одну катионообменную группу и, по меньшей мере, одну ароматическую или гетероароматическую циклическую систему. Чтобы высвободить антитела из смолы, добавляют элюат, и полученный элюат вводят в контакт со второй хроматографической смолой.
В WO-A-2005/121163 раскрыт способ выделения одного или нескольких белков из раствора белка. Способ включает стадию получения раствора белка, содержащего один или более специфичных белков и имеющего заранее заданную величину рН и заранее заданную ионную силу или проводимость, стадию нанесения указанного раствора белка на насадочную колонку или расширенную насадочную колонку, содержащую адсорбент, и получение одного или более белков с колонки; где в белковый раствор добавлен спирт.
Описание изобретения
Одной из целей настоящего изобретения является устранение недостатков известного из области техники способа очистки за счет разработки нового способа. Другой целью настоящего изобретения является способ очистки FVIII, в частности, получаемого из источников, которые содержат много соли, в частности, в том виде, в каком они используются для приготовления рекомбинантного FVIII.
Указанные цели достигаются в способе очистки фактора свертывания крови FVIII за счет проведения последовательности стадий очистки с помощью хроматографии, при этом, по крайней мере, одну операцию хроматографии осуществляют с использованием многомодальной смолы. Термин “многомодальная смола” в настоящем описании означает применяемое в хроматографии вещество, включающее основу и присоединенные в основе функциональные группы, при этом указанные функциональные группы взаимодействуют с химическими группами соединения, которое необходимо выделить. В конкретном варианте осуществления настоящего изобретения многомодальная смола включает присоединенные к матрице функциональные группы, и указанные функциональные группы способны взаимодействовать с FVIII путем ионных взаимодействий и других типов взаимодействий, таких как образование водородных связей и/или гидрофобное взаимодействие.
В соответствии с настоящим изобретением, предлагается способ очищения или обогащения фактора свертывания крови FVIII с использованием хроматографии, который включает стадии обеспечения фракции, содержащей FVIII, в водном растворе с высокой ионной силой; приведения фракции, содержащей FVIII, в контакт с многомодальной смолой; необязательного промывания многомодальной смолы, на которую абсорбирован FVIII, водным промывочным буфером; элюирования содержащих FVIII фракций водным элюирующим буфером, содержащим, по крайней мере, одну аминокислоту, которая положительно заряжена при рН 6-8; и необязательно сбор содержащих FVIII фракций в очищенной или обогащенной форме.
Многомодальная (или смешанная) хроматография представляет собой инструментарий для очистки белков. Она описана, например, в спецификации компании GE Health Care (11-0035-45AA) для Capto Adhere, спецификации компании GE Health Care (28-9078-88AA) для Capto MMC и патентной заявке EP 07114856.3 "A process for the isolation and purification of a target protein, free of prion proteins".
Указанные способы обладают определенными преимуществами и недостатками. Одним из преимуществ является возможность связывать белки в среде с большой концентрацией соли, по сравнению с той, которая часто используется при проведении обменной хроматографии. Недостаток заключается в том, что элюирование часто включает использование относительно жестких условий, таких как, например, рН меньше или больше нейтрального значения рН, как индивидуально, так и в сочетании с другими параметрами элюирования. FVIII является относительно нестойким белком, например, по отношению к значениям рН за пределами нейтрального значения; рН 6-8 (Wang et. al., Coagulation FVIII, structure and stability. International Journal of Pharmaceuticals, 259 (2003), 1-15.). Настоящее изобретение решает указанную проблему путем проведения элюирования в мягких условиях при рН, близком к нейтральному, что позволяет сохранить активность молекулы FVIII и облегчает применение многоодальной хроматографии в сочетании со стабилизирующим действием повышенной концентрации соли, что описано, например, в EP-A-1707634.
В соответствии с одним вариантом осуществления настоящего изобретения, многомодальную хроматографию можно провести на хроматографической колонке. Ее можно рассматривать как первый этап захвата. Способ по настоящему изобретению можно также осуществить как порционный процесс. Настоящее изобретение также облегчает процесс очистки без добавления полученных от человека или животного стабилизирующих добавок и позволяет провести процесс, вовсе их не используя (иммуноаффинные смолы на основе моноклональных антител). Использование многомодальной смолы, в частности, как стадии захвата, обеспечивает также более сильное связывание по сравнению с обычными ионообменными смолами, что приводит к получению на этой стадии продукта в виде более концентрированного элюата, что оказывает благоприятное влияние на устойчивость продукта.
Способ настоящего изобретения в общем случае относится к очистке рекомбинантного FVIII (rFVIII), в частности, рекомбинантного FVIII, у которого удален В-домен.
Как правило, раствор содержит FVIII в растворе с большой концентрацией соли, соответствующей проводимости в диапазоне от приблизительно 25 до приблизительно 200 мС/см при 25°С.
В другом варианте осуществления настоящего изобретения FVIII наносят на многомодальную смолу, и после связывания с многомодальной смолой проводят последующее элюирование с использованием подходящего буфера.
После нанесения смеси, содержащей FVIII, и связывания FVIII с многомодальной смолой молекулу FVIII элюируют из многомодальной смолы с помощью элюирующего буфера, содержащего, по крайней мере, одну аминокислоту, которая положительно заряжена при рН 6-8, и, в частности, аминокислотой, которая положительно заряжена при рН 6-8, является лизин, аргинин и/или гистидин.
Кроме того, буфер может включать, по крайней мере, одно органическое соединение, содержащее гидроксильную группу, такое как спирт, по крайней мере, одно органическое соединение, содержащее аминогруппу, такое как аминокислота, источник ионов Ca2+, по крайней мере, одно соединение для регулирования ионной силы буфера, такое как неорганические соли, например, NaCl, в частности, с концентрацией ≤ 1 М, неионогенный детергент и буферное вещество для поддержания рН в диапазоне от приблизительно 6 до приблизительно 8, в частности, для поддержания приблизительно нейтрального значения рН.
В еще одном варианте осуществления настоящего изобретения спирт может быть выбран из группы, включающей метанол, пропанол и этиленгликоль; аминокислота может быть выбрана из группы, включающей аргинин, лизин и гистидин; источником Ca2+ может быть CaCl2; неорганические соли могут быть выбраны из группы, включающей KCl и NaCl; неионогенный детергент может быть выбрано из группы, включающей Tween 20, Tween 80 и Pluronic F68; буферное вещество может быть выбрано из группы, включающей цитрат натрия, гистидин, HEPES, MES и ацетат натрия при рН 6-8.
В частности, концентрация аминокислоты, которая положительно заряжена при рН 6-8, составляет, по меньшей мере, >0,4 М, в частности, >0,5 М. Если использовать концентрацию конкретной аминокислоты больше, чем 1 М, то дальнейших преимуществ не наблюдается. Как правило, количество аргинина находится в диапазоне от приблизительно 0,4 М до приблизительно 1 М, в частности, в диапазоне от приблизительно 0,7 М до приблизительно 0,9 М. Органическое соединение, содержащее гидроксильную группу, такое как спирт, например, этиленгликоль, содержится, в частности, в количестве от 0% (об./об.) до 30% (об./об.), в частности, от приблизительно 5% до 15%. Концентрация ионов кальция должна быть в диапазоне от 0,0001 М до приблизительно 0,1 М, в частности, от приблизительно 0,001 М до приблизительно 0,03 М. Концентрация соединения для регулирования ионной силы буфера должна быть в таком диапазоне, чтобы обеспечивалась проводимость от приблизительно 15 до приблизительно 200 мС/см при 25°С. Количество неионогенного детергента, как правило, составляет от приблизительно 0,001% до 1%.
В одном варианте осуществления настоящего изобретения многомодальную смолу обрабатывают промывочным буфером. Его используют для того, чтобы вымыть примеси и сохранить FVIII прежде, чем FVIII будет высвобожден.
В еще одном варианте осуществления настоящего изобретения используемая “многомодальная” хроматографическая смола включает, по крайней мере, один из следующих фрагментов:
i) положительно заряженный лиганд N-бензил-N-метилэтаноламин,
ii) отрицательно заряженный лиганд 2-(бензоиламино)бутановую кислоту,
iii) фенилпропильный лиганд,
iv) N-гексильный лиганд,
v) 4-меркаптоэтилпиридиновый лиганд,
vi) лиганд 3-((3-метил-5-((тетрагидрофуран-2-илметил)амино)фенил)амино)бензойную кислоту, или их сочетания.
В частности, в способе настоящего изобретения “многомодальная” хроматографическая смола выбрана из следующих коммерчески доступных смол HEP Hypercel™; PPA Hypercel™; Capto Adhere™; Capto MMC™; MEP Hypercel™.
В другом варианте осуществления настоящего изобретения стадию многомодальной хроматографии комбинируют со стадией аффинной хроматографии FVIII, где аффинность обеспечивает белковый лиганд, такой как фрагмент антитела, который экспрессируется в дрожжах.
В соответствии со способом настоящего изобретения, последовательность операций очистки включает также стадии удаления/инактивации патогенов, которые представляют собой стадию инактивации с использованием химических реагентов, стадию отделения по размерам, хроматографические стадии или их комбинации, которые основаны на различных физиологических свойствах, нацеленных против удаляемого патогена.
В конкретном варианте осуществления способа по настоящему изобретению последовательность операций очистки включает также следующие стадии:
i. использование анионной мембраны, такой как Sartobind Q, в частности, для уменьшения содержания ДНК;
ii. катионная многомодальная смола, такая как Capto MMC;
iii. катионообменная смола, такая как SP Sepharose FF;
iv. использование второй анионной мембраны, такой как Sartobind FF, в частности, для дальнейшего уменьшения содержания ДНК;
v. стадия инактивации с использованием химических реагентов для вирусов с липидной оболочкой, в частности, стадия инактивирующей обработки типа “растворитель/детергент” с использованием три-н-бутилфосфата и Triton X-100, как раскрыто в EP-A-131740;
vi. аффинная смола на основе белкового лиганда, который экспрессируется в дрожжах, такая как VIIISelect, или анионная многомодальная хроматографическая смола, такая как Capto Adhere;
vii. стадия удаления патогенов путем фильтрации с использованием фильтра со средним размером пор приблизительно 20 нм, такого как Planova 20N;
viii. анионообменная смола, такая как Q Sepharose FF;
ix. смола для эксклюзионной хроматографии, такая как Superdex 200pg.
В частности, в способе настоящего изобретения условия элюирования на стадии катионного обмена основаны на использовании ионов Ca2+, концентрация которых находится в диапазоне 0,15-0,25 M, а общая проводимость элюирующего буфера не превышает 25 мС/см при 25°С.
При осуществлении способа настоящего изобретения чистота получаемого продукта составляет >4000 IU/мг, после последней стадии очистки предпочтительно составляет >9000 IU/мг и более предпочтительно >10000 IU/мг белка, а содержание примеси ДНК составляет <1000 пг/1000 IU FVIII, предпочтительно <100 пг/1000 IU FVIII и более предпочтительно <10 пг/1000 IU FVIII.
Кроме того, целью настоящего изобретения является композиция вещества, при этом композиция вещества содержит очищенный рекомбинантный FVIII, который может быть получен способом по настоящему изобретению (без добавления или использования любых добавок человеческого или животного происхождения, таких как альбумин или иммуноаффинные лиганды на основе моноклонального антитела).
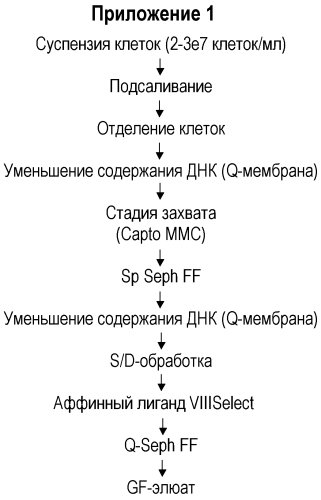
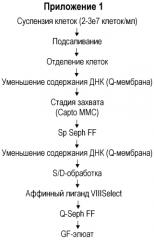
В Приложении 1 приведена последовательность операций в соответствии с настоящим изобретением, где стадию захвата проводят с использованием многомодальной смолы. Суспензию клеток подвергают обработке путем добавления соли, отделения клеток с последующей стадией уменьшения содержания ДНК, которую, преимущественно, проводят на Q мембране. Q мембрана (например, Sartobind Q от компании Sartorious) представляет собой обладающую сильными основными свойствами анионообменную смолу, содержащую четвертичные аммониевые группы в качестве анионообменного фрагмента. В определенном диапазоне значений рН и проводимости Q мембрана специфично связывает ДНК, в то время как продукт (и белки клетки-хозяина) остаются в фильтрате. В отличие от обычной ионообменной колоночной хроматографии, заряженный лиганд связан с основой мембраны, что обеспечивает высокий выход и простоту применения. Стадия захвата представляет собой способ настоящего изобретения с использованием многомодальной смолы. За стадией захвата следует разделение на катионообменной смоле, SP Sepharose FF™ (GE HealthCare) с последующим дополнительным удалением ДНК на Q мембране. Проводят обработку для инактивации вируса по типу “растворитель/детергент” (метод S/D), которая раскрыта, например, в EP-A-131740, а затем следующую стадию очистки, например, на аффинной смоле VIII Select™. Дальнейшее концентрирование/чистовую обработку проводят на ионообменной колонке, например, на Q Sepharose FF™ (GE HealthCare). Концентрированный продукт затем подвергают обработке на колонке гель-хроматографии (в частности, Superdex 200 p.g.™ (GE HealthCare)), чтобы сменить буфер и удалить возможные агрегаты и фрагменты. Полученный продукт, GF элюат, собирают. Соответствующие стадии более подробно разъясняются в примерах.
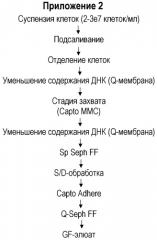
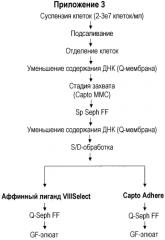
В Приложениях 2 и 3 приведен альтернативный вариант осуществления настоящего изобретения, где специфическая аффинная стадия (VIIISelect™ (GE HealthCare)), показанная в Приложении 1, заменена многомодальной хроматографией; Capto Adhere™ (GE HealthCare). Неожиданно последовательность стадий очистки, показанная в Приложении 2, обеспечивает ту же самую степень чистоты, что и последовательность стадий очистки, описанная в Приложении 1 (включая специфическую аффинную стадию с использованием антител). Указанный результат повторяют для тех же исходных веществ, как описано в Приложении 3. Полученный результат подтверждает достаточный потенциал неоднократного использования многомодального метода очистки (как на стадии захвата; Capto MMC ™ (GE HealthCare), так и последующей стадии очистки с использованием Capto Adhere™ (GE HealthCare), как показано в Приложении 2 и 3) с применением специфических условий элюирования для FVIII в соответствии с настоящим изобретением.
Настоящее изобретение далее поясняется следующими неограничивающими примерами.
ПРИМЕРЫ
Во всех примерах действительные значения в М (молярные) приведены в мол/кг (т.е. 10 г соли добавляют к 1000 г воды, а не 10 г соли добавляют к воде для получения 1000 мл раствора).
Пример 1: Получение суспензии клеток, содержащей FVIII
Клетки
Используемая клеточная линия является производной клеточной линии эмбриона человека 293 (HEK 293), которая адаптирована для выращивания в не содержащей сыворотки среде. Указанный хозяин, HEK 293F, устойчиво трансфицируют полигенным экспрессирующим кластером, несущим ген FVIII человека с удаленным В-доменом под управлением сильного промотора (EP-A-1739179).
Способ культивирования
Клетки выращивают в не содержащей сыворотку среде, используя обычное оборудование и в соответствии с обычными способами, хорошо известными из области техники, например, во встряхиваемых или перемешиваемых культурах в колбах для тканевых культур, в колбах на качалках или в биореакторах (в системах для одноразового использования или обычных перемешиваемых корпусных реакторах) в виде порционных клеточных культур, культур с подпиткой, перфузионных клеточных культур или непрерывных хемостатных культур (Freshney, R.I. (2000), Culture of animal cells: a manual of basic technique, 4th ed, Wiley-Liss; Spier, R.E. ed. (2000), Encyclopedia of cell technology, Wiley, New York; Enfors, S-O and Häggström, L. (2000), Bioprocess technology: fundamentals and applications, Högskoletryckeriet, Royal Institute of Technology, Stockholm; Vinci, V.A. and Parekh, S.R. (2003), Handbook of industrial cell culture: mammalian, microbial, and plant cells, Humana Press, USA). Как правило, для увеличения числа клеток и титров продукта, превышающих стандартные уровни при использовании порционных методов выращивании культур, используют перфузионную среду. Выход продукта и количество белков клетки-хозяина меняется в зависимости от способа культивирования:
- титр продукта, как правило, увеличивается с числом клеток;
- содержание общего белка и содержание ДНК, как правило, увеличивается с числом клеток;
- содержание общего белка и содержание ДНК может также возрастать с увеличением ожидаемого жизненного цикла;
- получаемые порционно клеточные культуры накапливают белок и ДНК; ничего извне не добавляется, ничего не удаляется;
- в перфузионных способах клеточная культура отмывается от продуктов обмена веществ, белка, ДНК и других примесей; для улавливания клеток, как правило, используют фильтры или клеточные центрифуги.
Поскольку рекомбинантный продукт связан с клетками, то результатом сбора клеток, выросших в культуре, является суспензия клеток. Свойства выросших в культуре клеток (титр продукта и вышеуказанные примеси) различаются в зависимости от используемого способа культивирования.
Пример 2: Получение исходного FVIII, освобожденного от клеток
Освобожденный от клеток исходный FVIII для проведения хроматографической очистки получают следующим образом. Маточный раствор хлорида натрия и хлорида кальция добавляют к суспензии клеток, полученной в соответствии с Примером 1, таким образом, чтобы их конечная концентрация составила 0,3 М и 30 мМ, соответственно, а проводимость составила 30-40 мС/см при 25°С. Раствор перемешивают в течение приблизительно 30 мин, а затем клетки удаляют центрифугированием с последующей фильтрацией, чтобы удалить любые клеточные остатки (для предотвращения засорения на последующих стадиях с использованием колонок).
Пример 3: Условия элюирования при использовании многомодальной катионной смолы Capto MMC
Проводят следующую серию экспериментов с целью сравнения условия элюирования при использовании многомодальной катионной смолы Capto MMC.
Пример 3а. Оценка различных концентраций соли и рН на элюирование FVIII из смолы Capto MMC (справочный пример)
Колонка и смола
В колонку С10/20 помещают слой смолы Capto MMC высотой 10 см (1 объем колонки (CV) = 8 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 5 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 1, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
| Таблица 1 | ||
| Условия элюирования | Элюированный объем (CV) | Найденное значение FVIII:C в элюате (%) |
| 0,1 М NaCl, рН 6,5* | 10 | 0 |
| 0,3 М NaCl, рН 7,0* | 90 | 0 |
| 1 М NaCl, рН 6,5** | 20 | 0 |
| 2 М NaCl, рН 6,5** (OgH07-626) | 15 | 0 |
| * Элюирующий буфер содержит 0,01 М L-гистидина, 0,01 М CaCl2 и 0,02% масс./масс. Polysorbate 80.** Элюирующий буфер содержит 0,05 М L-гистидина, 0,05 М CaCl2 и 0,02% масс./масс. Polysorbate 80. |
Выводы из справочного примера 3a
Как видно из Таблицы 1, связывание FVIII в колонке с Capto MMC не является ионным взаимодействием.
Справочный пример 3b. Оценка условий элюирования для Capto MMC при различных концентраций NaCl при постоянном 50%-ном содержании этиленгликоля
Колонка и смола
В колонку XK16/20 помещают слой смолы Capto MMC высотой 10 см (1 объем колонки (CV) = 4 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 1 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 2, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
| Таблица 2 | ||
| Условия элюирования* | Элюированный объем (CV) | Найденное значение FVIII:C в элюате (%) |
| 0,5 М NaCl + 50% этиленгликоля, рН 6,5 | 3 | 23 |
| 1 М NaCl + 50% этиленгликоля, рН 6,5 | 6 | 52 |
| 1,5 М NaCl + 50% этиленгликоля, рН 7,5 | 4 | 73 |
| 1,5 М NaCl + 50% этиленгликоля, рН 6,5 | 2 | 82 |
| 2,5 М NaCl + 50% этиленгликоля, рН 6,5 | 3 | 84 |
| *Все элюирующие буферы содержат 0,02 М L-гистидина, 0,02 М CaCl2 и 0,02% масс./масс. Polysorbate 80. |
Выводы из справочного примера 3b
Как видно из Таблицы 2, связывание FVIII в колонке с Capto MMC можно ингибировать с помощью комбинации этиленгликоля и NaCl. 50%-ный этиленгликоль обычно используют в качестве буфера для элюирования для обычных аффинных смол на основе белка. Элюирование FVIII улучшается, этиленгликоль комбинируют с повышенными концентрациями хлорида натрия вплоть до 1,5 М. Два исследованных значения рН (рН 6,5 и 7,5) не изменяют степень выделения FVIII в пределах границ устойчивости белка (приблизительно рН 6-8). Повышение концентрации NaCl до 2,5 М не улучшает извлечение FVIII:C в элюате.
Пример 3c. Варьирование содержания аргинина в качестве компонента элюирования для Capto MMC
Колонка и смола
В колонку Tricorn 5/100 помещают слой смолы Capto MMC высотой 8 см (1 объем колонки (CV) = 1,6 мл). Смолу Capto MMC получают от компании GE HealthCare (каталожный № 17-5317-10).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как указано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью 0,6 мл/мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования (в каждом случае используют объем, приблизительно равный 10 объемам колонки (CV)), как указано в Таблице 3, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
| Таблица 3 | |
| Условия элюирования* | FVIII, обнаруженный в элюате (%) |
| 20% этиленгликоля | 0 |
| 0,1 М аргинина + 20% этиленгликоля | 0 |
| 0,2 М аргинина + 20% этиленгликоля | 0 |
| 0,3 М аргинина + 20% этиленгликоля | 0 |
| 0,4 М аргинина + 20% этиленгликоля | 1 |
| 0,5 М аргинина + 20% этиленгликоля | 10 |
| 0,6 М аргинина + 20% этиленгликоля | 37 |
| 0,7 М аргинина + 20% этиленгликоля | 32 |
| 0,8 М аргинина + 20% этиленгликоля | 8 |
| 0,9 М аргинина + 20% этиленгликоля | 1 |
| 1,0 М аргинина + 20% этиленгликоля | 0 |
| *Все элюирующие буферы содержат 0,01 М L-гистидина, 0,3 М NaCl, 0,01 М CaCl2 и 0,02% масс./масс. Polysorbate 80 при рН 6,5 |
Выводы из примера 3c (по настоящему изобретению)
Как видно из Таблицы 3, связывание FVIII в колонке с Capto MMC неожиданно можно ингибировать с помощью комбинации этиленгликоля и аргинина. Элюирование FVIII наблюдается в элюатах, содержащих вплоть до 0,9 М аргинина вместе с 20% (масс./масс.) этиленгликоля.
Пример 3d (по настоящему изобретению). Сравнение аргинина и лизина в качестве компонента элюирования для Capto MMC
Колонка и смола
В колонку Tricorn 50/100 или С10/20 помещают слой смолы Capto MMC высотой 4-8 см (1 объем колонки (CV) = 1,6-3 мл). Смолу Capto MMC получают от компании GE Healthcare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют раствор белка, содержащий rFVIII, который получают, как описано в Примере 2.
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества со скоростью, которая соответствует времени контактирования 1-2 мин. FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям элюирования, как указано в Таблице 4, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
| Таблица 4 | ||
| Условия элюирования* | Элюированный объем (CV) | FVIII, обнаруженный в элюате (%) |
| 0,5 М лизина + 20% этиленгликоля | 40 | 3 |
| 0,65 М лизина + 20% этиленгликоля | 40 | 16 |
| 0,75 М лизина + 20% этиленгликоля | 40 | 13 |
| 0,4 М аргинина + 20% этиленгликоля | 20 | 4 |
| 0,75 М аргинина + 20% этиленгликоля | 20 | 89 |
| *Все элюирующие буферы содержат 0,01 М L-гистидина, 0,3 М NaCl, 0,01 М CaCl2 и 0,02% масс./масс. Polysorbate 80 при рН 6,5 |
Выводы из примера 3d (по настоящему изобретению)
Как видно из Таблицы 4, связывание FVIII в колонке с Capto MMC исследуют, используя 20% этиленгликоля в сочетании с лизином и аргинином при различных концентрациях. Аргинин элюирует FVIII лучше, чем лизин, а концентрация 0,75 М, видимо, позволяет извлечь приблизительно 90%. Вероятно, можно использовать меньшие количества любой из аминокислот в сочетании с этиленгликолем в качестве промывочной стадии для удаления примесей из молекулы FVIII, прежде чем элюировать VIII, например, используя 0,75 М аргинина.
Пример 3e. Оценка чистоты и степени извлечения с использованием различных условия промывки и элюирования для смолы Capto MMC
Колонка и смола
Смолу Capto MMC помещают в различные колонки (высота слоя 2-9 см, объем колонки 1,6-48 мл). Смолу Capto MMC получают от компании GE Healthcare (каталожный № 17-5317).
Исходные вещества
В качестве исходных веществ используют растворы белка, содержащие rFVIII, который получают, как описано в Примере 2, с типичной чистотой приблизительно 100 IU FVIII/мг белка (как видно в Примере 19, Таблица 18)
Выравнивающий буфер
0,01 М L-гистидина, 0,01 М CaCl2, 0,3 M NaCl, 0,02% масс./масс. Polysorbate 80, pH 7,0, проводимость 31±3 мС/см при 25°С.
Колонку выравнивают с помощью выравнивающего буфера, а затем загружают исходные вещества с соответствующими скоростями (в зависимости от размера колонки они приблизительно составляют 13-300 см/час). FVIII связывается со смолой в указанных условиях обработки выравнивающим буфером (невозможно обнаружить FVIII в фильтрате). Затем колонку подвергают различным условиям промывки и элюирования, как указано в Таблице 5, и полученное в итоге на выходе из колонки количество FVIII анализируют по методу FVIII:С и рассчитывают в процентах по отношению к взятому количеству FVIII.
| Таблица 5 | |||
| Промывочный буфер | Элюирующий буфер | Степень извлечения FVIII (%) | Чистота** элюата (IU/мг) |
| 20% этиленгликоля + 0,4 М аргинина, 40 CV | 0,8 М аргинина + 20% этиленгликоля | 83 | 5741 |
| 20% этиленгликоля + 0,45 М аргинина, 20 CV | 0,8 М аргинина | 69 | анализ не проводился |
| *Все буферы содержат 0,01 М L-гистидина, 0,3 М NaCl, 0,01 М CaCl2 и 0,02% масс./масс. Polysorbate 80 при рН 6,5** Определяют методом Брэдфорда |
Выводы из примера 3e
Как видно из Таблицы 5, комбинация 20% этиленгликоля и 0,4 М аргинина на стадии промывки до применения больших концентраций аргинина в элюирующем буфере позволяет получить с более высоким выходом более чистый продукт, при этом концентрация аргинина в промывочном буфере не должна превышать 0,4 М, поскольку в противном случае наблюдается относительно низкая степень извлечения FVIII.
Выводы из примера 3
Очевидно, что катионную многомодальную смолу (Capto MMC) нельзя элюировать, используя обычные условия элюирования для ионообменной смолы (высокое содержание соли) или для смолы с гидрофобными взаимодействиями (низкое содержание соли). Повышенное содержание несущей заряд аминокислоты как индивидуально, так и в сочетании с этиленгликолем, неожиданно позволяет высвободить связанную молекулу FVIII из смолы Capto MMC. Кроме того, концентрации NaCl, аргинина, лизина и этиленгликоля можно варьировать в процессе промывки и элюирования смолы, чтобы оптимизировать степень извлечения и чистоту полученного из Capto MMC элюата.
Пример 4: Условия элюирования для многомодальной анионной смолы Capto Adhere (сравнительный пример)
Проводят следующую серию экспериментов, чтобы оценить различные условия э