Способ отбора подкожной интерстициальной жидкости при помощи микроигольного аппликатора
Иллюстрации
Показать всеИзобретение относится к медицинской диагностике, в частности к способам получения образцов физиологической жидкости. Проводят формирование на участке кожи посредством микроигольного аппликатора, содержащего ряд игл, множества микропор, путем прикладывания положительного давления на указанный аппликатор, и извлечение подкожной интерстициальной жидкости через указанные микропоры посредством игл. При этом положительное давление на микроигольный аппликатор оказывают не менее 1 минуты. Производят экспозицию аппликатора на коже в течение 20 минут и после съема аппликатора с кожи подвергают его центрифугированию в режиме 210 об/мин в течение 2 минут. Причем в качестве микроигольного аппликатора используют аппликатор площадью поверхности 1 см2 и содержащий 100 полимерных игл высотой 300 мкм, выполненный с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости. При этом участок кожи, на который накладывают микроигольный аппликатор, предварительно обрабатывают антисептиком. Способ позволяет унифицировать метод получения подкожной интерстициальной жидкости для различных диагностических направлений, при одновременном обеспечении практически полного заполнения объема игл указанной жидкостью и достаточно полного извлечения отобранной жидкости из них. 6 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к медицинской диагностике, в частности к способам получения образцов физиологической жидкости.
Следует пояснить, что для современного общества определение концентрации анализируемого вещества в физиологических образцах представляет постоянно возрастающее значение. Такие проверки находят использование в разнообразных применениях, включая клинические лабораторные исследования, домашние исследования и т.д., где результаты такого исследования играют важную роль в диагностике и лечении разнообразных патологических состояний. Представляющие интерес анализируемые вещества включает в себя, например, глюкозу для лечения сахарного диабета, холестерин для контроля сердечно-сосудистого состояния, лекарственные препараты для контроля уровней терапевтических средств или распознавания запрещенных/незапрещенных уровней лекарственных препаратов. В ответ на это возрастающее значение определения концентрации анализируемого вещества было разработано множество методик и устройств определения концентрации анализируемого вещества как для клинического, так и для домашнего исследования.
Для определения концентрации анализируемого вещества в физиологическом образце сначала должен быть получен физиологический образец. Получение и исследование образца ранее часто включало в себя обременительные и сложные процедуры, например, традиционные способы отбора предусматривают отбор биоматериала (крови) для исследований с помощью инъекционной иглы, что обусловливает: травматичность; негативное психологическое воздействие (особенно на мужчин и детей); риск инфицирования (до 30%); необходимость выполнения процедуры в лицензированных медицинских учреждениях обученным персоналом; значительные затраты на утилизацию расходных материалов (на 1 шприц ценой 4 руб. необходимо затратить около 9 руб.).
Учитывая незначительные объемы вещества, необходимые для современной клинической диагностики, альтернативой крови может быть подкожная межтканевая (интерстициальная) жидкость. Состав подкожной интерстициальной жидкости (далее - ПИЖ) из-за разветвленности подкожной капиллярной сети идентичен набору биомаркеров и метаболитов в крови.
Широкомасштабный отбор ПИЖ можно проводить с помощью микроигольных аппликаторов (далее - МИА) [2, 3]. МИА проникают сквозь кератиновый слой кожи и входят в эпидермис, поверхностный слой живых клеток, в котором нет нервных окончаний, поэтому их введение является безболезненным. Также использование МИА безопасно, поскольку именно в эпидермисе находятся важнейшие элементы иммунной системы человека, клетки Лангерганца, и вероятность проникновения инфекции значительно меньше, чем при обычной подкожной инъекции, когда игла проникает глубже этого защитного слоя. Таким образом, введение в кожу МИА не требует специальной медицинской подготовки, что делает их особенно востребованными для систем самодетекции и широкомасштабного скрининга.
Однако не существует универсальной методики отбора ПИЖ с помощью МИА, при реализации которой была бы получена физиологическая жидкость в нужном объеме для различных диагностических направлений при минимальном количестве используемых МИА, т.к. имеются сложности при извлечении ПИЖ из игл.
Наиболее близким к предлагаемому изобретению является техническое решение, изложенное в источнике информации [4]. В этой статье рассматриваются перспективы использования микроигольных аппликаторов для отбора подкожной интерстициальной жидкости для задач лабораторной диагностики. При реализации указанного известного способа отбора производят формирование на участке кожи множества микропор, посредством микроигольного аппликатора, содержащего ряд игл, путем прикладывания положительного давления на указанный аппликатор и извлечение подкожной интерстициальной жидкости через указанные микропоры внутрь игл.
Однако для указанного известного способа характерны те же недостатки, что и для вышеприведенных аналогов. Кроме того, некоторые микроиглы могут забиваться компонентами эпидермиса, что может обуславливать снижение качества отбора подкожной интерстициальной жидкости.
Технический результат, достигаемый предлагаемым изобретением, заключается в унификации способа для получения ПИЖ для различной диагностической направленности при одновременном обеспечении практически полного заполнения объема игл указанной жидкостью и достаточно полного извлечения в последующем отобранной жидкости из них.
Поставленный технический результат достигается предлагаемым способом отбора подкожной интерстициальной жидкости при помощи микроигольного аппликатора, включающим формирование на участке кожи посредством микроигольного аппликатора, содержащего ряд игл, множества микропор, путем прикладывания положительного давления на указанный аппликатор, и извлечение подкожной интерстициальной жидкости через указанные микропоры посредством игл, при этом новым является то, что положительное давление на микроигольный аппликатор оказывают не менее 1 минуты, далее производят экспозицию аппликатора на коже в течение 20 минут, и после съема аппликатора с кожи подвергают его центрифугированию в режиме 3,5 герц в течение 2 минут, причем в качестве микроигольного аппликатора используют аппликатор площадью поверхности 1 см2 и содержащий 100 полимерных игл высотой 300 мкм, выполненный с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости.
Положительное давление на микроигольный аппликатор прилагают вручную, нажимом на него для формирования микропор.
При экспозиции аппликатора на коже его фиксируют лейкопластырем.
Центрифугирование аппликатора производят в пробирке Эппендорфа, в положении фиксации на внутренней стороне крышки последней.
Полимерные иглы микроигольного аппликатора выполнены из кроссшитых полимеров в соотношении поли(метил)винилэфир-ко-малеиновой кислоты (PMVE/MA) (Sigma) 1980 кДа - 15 г и полиэтиленгликоль (ПЭГ) 10 кДа (Sigma) 7 г в 77 мл дистиллированной воды при реакции полимеризации катализом при температуре +80°С.
В качестве микроигольного аппликатора используют одновременно несколько указанных аппликаторов в зависимости от требуемого количества отбираемой подкожной интерстициальной жидкости.
Участок кожи, на который накладывают микроигольный аппликатор, предварительно обрабатывают антисептиком.
Указанный технический результат достигается за счет следующего.
Благодаря формированию на участке кожи посредством микроигольного аппликатора, содержащего ряд водопроницаемых (позволяющих впитывать жидкие компоненты) игл, путем прикладывания положительного давления на указанный аппликатор, обеспечивается проникновение игл сквозь кератиновый слой кожи и выход их в эпидермис, поверхностный слой живых клеток, где и происходит последующее извлечение подкожной интерстициальной жидкости через указанные микропоры внутрь игл.
Экспериментальным путем было установлено, что положительное давление на микроигольный аппликатор, например, посредством ручного нажима (но возможны и другие примеры формирования положительного давления), следует оказывать не менее 1 минуты. Только в этом случае будет достигнуто соприкосновение практически всех игл аппликатора с подкожным слоем, создание микропор на коже и обеспечена диффузия подкожной интерстициальной жидкости в иглы (иглы сродни водопоглощающей матрице).
Благодаря тому, что, наряду с вышеуказанным режимом по положительному давлению, производят последующую экспозицию аппликатора на коже в течение 20 минут, обеспечивается практически полное заполнение объема пор игл подкожной интерстициальной жидкостью, что позволяет применять для отбора пробы для конкретного диагностического направления строго конкретное количество аппликаторов (а не больше). Время экспозиции менее 20 минут не позволит обеспечить полноту заполнения объема пор игл, а время экспозиции более 20 минут будет обуславливать потерю подкожной интерстициальной жидкости за счет испарения с поверхности микроигл. Следует указать, что физически процесс заполнения полости игл подкожной интерстициальной жидкостью обусловлен капиллярными силами и осмотическим воздействием.
При экспозиции аппликатора на коже его можно зафиксировать, например, лейкопластырем или другой подобной системой.
Благодаря тому, что после съема аппликатора с кожи его подвергают центрифугированию в режиме 3,5 герц в течение от 2 минут, обеспечивается наиболее полное извлечение подкожной интерстициальной жидкости из пор игл при одновременном исключении повреждения игл аппликатора и микропробирки Эппендорфа, исходя из того, что в преимущественном варианте центрифугирование аппликатора производят в пробирке Эпенндорфа, в положении фиксации на внутренней стороне крышки последней.
Также было установлено, что для успешной реализации предлагаемого способа при вышеуказанных режимах и для достижения поставленного технического результата в качестве микроигольного аппликатора можно использовать только микроигольный аппликатор площадью поверхности 1 см2 (это вызвано удобством для размещения его в крышке центрифужной пробирки Эппендорфа) и содержащий 100 полимерных полых игл высотой 300 мкм, выполненный с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости (исследования показали, что указанный в предлагаемом способе микроигольный аппликатор такой конструкции позволяет отбирать 0,6-1,1 мкл ПИЖ, в зависимости от индивидуальных особенностей кожи и подкожной клетчатки). Использование, например, микроигольных аппликаторов с высотой игл менее 300 мкм не обеспечит проникновение через кератиновый слой, а с высотой более 300 мкм - может обуславливать возникновение болевых ощущений при пенетрировании кожи, поскольку чувствительные нейроны располагаются в подкожном слое на глубине от 400 мкм. Наличие меньшего количества игл (т.е. менее 100) с такой высотой не позволит осуществлять отбор подкожной интерстициальной жидкости в нужном объеме, а размещение более 100 игл на площади 1 см может привести к склеиванию игл при пенетрации кожного покрова. Диаметр основания игл составляет 0,1 мм2. Выполнение аппликатора площадью 1 см2 обусловлено тем, что он размещается в крышке пробирки Эппендорфа.
Использование микроигольного аппликатора, выполненного с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости, вызвано необходимостью (если будет больше игл, то тогда неудобно будет центрифугировать и иглы будут гнуться, что затруднит равномерность прокалывания кожи).
В качестве микроигольного аппликатора можно использовать одновременно несколько указанных аппликаторов, в зависимости от требуемого количества отбираемой подкожной интерстициальной жидкости. Например, для отбора 10 мкл подкожной жидкости, необходимой для определения уровня глюкозы на автоматическом биохимическом Konelab 20 (Финляндия "ThermoFisher"), необходимо 10 микроигольных аппликаторов. Это позволит обеспечить унификацию способа для получения ПИЖ для различной диагностической направленности, т.к. при различных заболеваниях требуется разный объем информационной среды, т.е. ПИЖ.
Причем в указанном аппликаторе полимерные иглы (они просто всасывают воду, как губка) выполнены из кроссшитых полимеров в соотношении поли(метил)винилэфир-ко-малеиновой кислоты (PMVE/MA) (Sigma) 1980 кДа - 15 г и полиэтиленгликоль 10 кДа (Sigma) - 7,5 г на 77 мл дистиллированной воды. Полимерная сшивка осуществлена при температуре +80°С [1].
Также предлагается в заявляемом способе участок кожи, на который накладывают микроигольный аппликатор, предварительно обрабатывать антисептиком для снижения риска инфицирования.
Таким образом, благодаря совокупности последовательности операций, заявляемых режимов и особенностям микроигольного аппликатора будет обеспечено достижение унификации способа для получения ПИЖ для различной диагностической направленности и одновременно обеспечено практически полное заполнение пор игл указанной жидкостью и полное извлечение в последующем отобранной жидкости из них.
Предлагаемый способ осуществляют следующим образом.
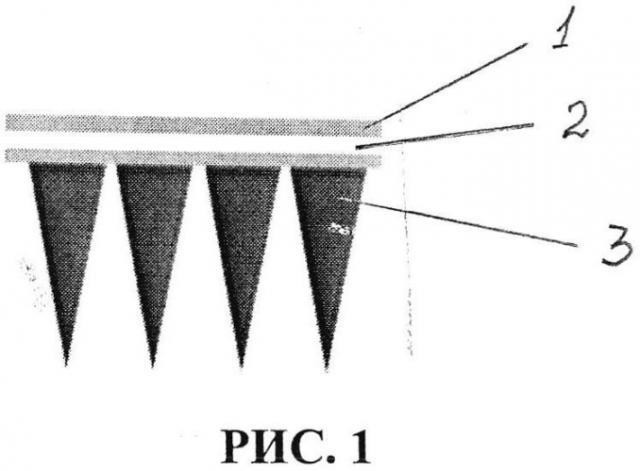
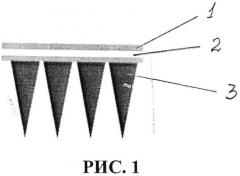
1. Для реализации заявляемого способа были использованы полимерные микроигольные аппликаторы, изготовленные в Технологическом институте штата Джорджия, Атланта, США [5]. Микроигольный аппликатор представляет из себя массив микроскопических игл, установленных на подложку из полистирола преимущественно округлой формы, площадью поверхности 1 см2 и содержащий 100 полимерных игл высотой 300 мкм, выполненный с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости. Полимерные микроиглы выполнены из кроссшитых полимеров в соотношении поли(метил)винилэфир-ко-малеиновой кислоты (PMVE/MA) (Sigma) 1980 кДа - 15 г. и полиэтиленгликоль (ПЭГ) 10 кДа (Sigma) - 7,5 г на 77 мл дистиллированной воды. Полимерная сшивка осуществлена при температуре +80°С [1]. Микроиглы имеют трехгранную форму. Указанные микроигольные аппликаторы представлены на рисунке 1, где показано схематическое изображение аппликатора в разрезе. При этом показаны: клеевой слой - 1, пленка - 2, микроиглы - 3. Клеевой слой совместно с пленкой образуют подложку.
При этом в качестве микроигольного аппликатора можно использовать одновременно несколько указанных аппликаторов, в зависимости от требуемого количества отбираемой подкожной интерстициальной жидкости. Например, для глюкозы требуется 10 мкл ПИЖ, для хлоридов - 10 мкл ПИЖ, для мочевины - 20 мкл ПИЖ. В зависимости от этого, в первом случае необходимо 10 вышеуказанных микроигольных аппликаторов, во втором случае - 10, в третьем - 20.
2. Для нанесения микроигольных аппликаторов наиболее оптимальными являются участки кожи с наименьшей толщиной эпидермиса и степенью оволосения. В связи с этим аппликация выполняется предпочтительно на внутреннюю поверхность предплечья. Непосредственно перед нанесением аппликатора участок кожи обрабатывается водорастворимым антисептиком. Выжидается время, необходимое для высыхания антисептика с кожи.
3. Микроигольный аппликатор извлекается из индивидуальной упаковки и прислоняется иглами к коже. Большим пальцем осуществляется нажим, т.е. положительное давление, на тыльную сторону аппликатора в течение 1 минуты, для формирования на участке кожи множества микропор.
4. Затем производится экспозиция аппликатора на коже в течение 20 минут, при этом аппликатор фиксируется к коже, например, лейкопластырем. Во время этой экспозиции производится извлечение подкожной интерстициальной жидкости через указанные микропоры внутрь пор игл посредством осмотических и капиллярных сил.
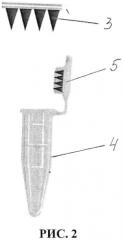
5. После съема с кожи микроигольный аппликатор помещается в микропробирку Эппендорфа 4 с крышкой 5 в положении фиксации на внутренней стороне крышки 5 последней (Рис. 2). При этом пробирка может содержать 50 мкл дистиллированной воды. Пробирка подвергается центрифугированию в режиме 3,5 герц в течение от 2 минут для перемещения содержимого микроигл в указанную микропробирку.
6. Затем извлеченную из пор иглу ПИЖ используют для выполнения аналитических процедур по установлению уровня биохимических показателей.
Предлагаемый способ осуществляют следующим образом, реализуя его на конкретном примере с участием группы добровольцев:
- в рамках данного клинического исследования было привлечено 15 добровольцев. Добровольцу на область живота наносятся десять вышеуказанных микроигольных аппликаторов и выполняются соответствующие операции в соответствии с описанным ранее алгоритмом по предлагаемому способу;
- для выполнения процедуры сравнительного анализа на область живота добровольцу также накладывается вакуумная помпа, для формирования везикул, из которых отбирается подкожная интерстициальня жидкость по методике, предложенной U. Kiistala [6];
- сравнительный анализ уровня биомаркеров в подкожной жидкости также выполнен с аналогичными показателями в сыворотке крови. Для этого в конце исследования у добровольца отбирали 10 мл венозной крови;
- полученные образцы биологические жидкости после выполнения процедуры пробоподготовки подвергались биохимическому исследованию на автоматическим биохимическом анализаторе Konelab-20 (Thermo Scientific, Финляндия);
- выполненный биохимический анализ позволил установить уровень глюкозы в подкожной интерстициальной жидкости.
Сравнительный анализ позволил установить, что уровень глюкозы в подкожной интерстициальной жидкости, отобранной при помощи микроигольных аппликаторов указанной конструкции, достоверно не отличается от уровня аналогичного показателя в сыворотке крови и ПИЖ, отобранной методом вакуумной помпы, при этом вариантивность значений при отборе микроигольным аппликатором была меньше, что свидетельствует о большей точности предлагаемого способа.
Кроме того, в ходе экспериментальных исследований было подтверждено, что использование микроигольных аппликаторов другой, чем указанной в заявляемом способе, конструкции (меньше или больше 100 игл на площади 1 см при их высоте больше или меньше 300 мкм) не обеспечивает в первом случае безболезненный отбор подкожной интерстициальной жидкости, а во втором - в максимальном объеме.
Отступление от режимов выполнения операций предлагаемого способа приводит к недостаточному для анализа отбору подкожной интерстициальной жидкости, к неполноте отделения ПИЖ из пор игл.
Таким образом, предлагаемый способ имеет следующие преимущества:
- способ удобен тем, что человек может сам отобрать у себя необходимое количество по объему ПИЖ и принести аппликатор(ы) в лабораторию для анализа, где они будут обработаны предлагаемым способом. Применение в этом случае лабораторного оборудования более информативно и позволяет смотреть не один показатель, чаще всего это глюкоза, а широкий спектр биохимических показателей. То есть преимущество в унификации способа для получения ПИЖ для различной диагностической направленности;
- обеспечивается практически полное заполнения объема пор игл ПИЖ и полное извлечение в последующем отобранной жидкости из игл микроигольного аппликатора, что позволяет без дополнительного травматизма и использования лишних аппликаторов отбирать нужное количество ПИЖ;
- предложенный способ отбора безболезнен и прост в применении;
- себестоимость отбора значительно ниже, т.к. не задействуется медицинский персонал, нет необходимости в сложной процедуре утилизации, и стоимость самих микроигл в разы дешевле шприцов, и уж тем более указанных аналитических приборов. Реализация операций предлагаемого способа также проста и последний может быть использован в любой лаборатории;
- заявляемый способ намного эффективнее при проведении широкомасштабных исследований и скрининге.
Источники информации
1. Donnelly R.F., Singh T.R., Alkilani A.Z., McCrudden M.T., O′Neill S., O′Mahony С., Armstrong K., McLoone Ν., Kole P., Woolfson A.D. Hydrogel-forming microneedle arrays exhibit antimicrobial properties: potential for enhanced patient safety // Int. J. Pharm. 2013, Vol. 451, №1-2, P. 76-91.
2. Mukerjee E.V., Collins S.D., Isseroff R.R., Smith R.L. Microneedle array for transdermal biological fluid extraction and in situ analysis // Sensors & Actuators-2004, Vol. 114 - P.267-
3. Wang P.M., Cornwell M., Prausnitz M.R. Minimally Invasive Extraction of Dermal Interstitial Fluid for Glucose Monitoring Using Microneedles // Diabetes Technology & Therapeutics - 2005, Vol. 7, №1 - P. 131-141.
4. Зайцева H.B., Землянова M.A., Праузнитц M.P., Звездин В.Н. «Перспективы использования микроигольных аппликаторов для отбора подкожной интерстициальной жидкости для задач лабораторной диагностики» // International Journal of applied and fundamental research «Medical sciences», №12, 2012, c. 12-14.
5. Park J.H., Yoon Y.K., Choi S.O., Prausnitz M.R., Allen M.G. Tapered conical polymer microneedles fabricated using an integrated lens technique for transdermal drug delivery // IEEE Trans Biomed Eng. - 2007, Vol. 54, №5 - P. 903-913.
6. Kiistala U. Suction blister device for separating viable epidermis from dermis // J. Invest. Dermatol. - 1968. - №50. - P. - 129-137.
1. Способ отбора подкожной интерстициальной жидкости при помощи микроигольного аппликатора, включающий формирование на участке кожи посредством микроигольного аппликатора, содержащего ряд игл, множества микропор, путем прикладывания положительного давления на указанный аппликатор, и извлечение подкожной интерстициальной жидкости через указанные микропоры посредством игл, отличающийся тем, что положительное давление на микроигольный аппликатор оказывают не менее 1 мин, далее производят экспозицию аппликатора на коже в течение 20 мин и после съема аппликатора с кожи подвергают его центрифугированию в режиме 210 об/мин в течение 2 мин, причем в качестве микроигольного аппликатора используют аппликатор площадью поверхности 1 см2 и содержащий 100 полимерных игл высотой 300 мкм, выполненный с возможностью отбора 0,6-1,1 мкл подкожной интерстициальной жидкости.
2. Способ по п. 1, отличающийся тем, что положительное давление на микроигольный аппликатор прилагают вручную, нажимом на него для формирования микропор.
3. Способ по п. 1, отличающийся тем, что при экспозиции аппликатора на коже его фиксируют лейкопластырем.
4. Способ по п. 1, отличающийся тем, что центрифугирование аппликатора производят в пробирке Эппендорфа, в положении фиксации на внутренней стороне крышки последней.
5. Способ по п. 1, отличающийся тем, что полимерные иглы микроигольного аппликатора выполнены из кроссшитых полимеров в соотношении поли(метил)винилэфир-ко-малеиновой кислоты (PMVE/MA) (Sigma) 1980 кДа - 15 г и полиэтиленгликоль (ПЭГ) 10 кДа (Sigma) - 7,5 г в 77 мл дистиллированной воды при реакции полимеризации катализом при температуре +80°C.
6. Способ по п. 1, отличающийся тем, что в качестве микроигольного аппликатора используют одновременно несколько указанных аппликаторов в зависимости от требуемого количества отбираемой подкожной интерстициальной жидкости.
7. Способ по п. 1, отличающийся тем, что участок кожи, на который накладывают микроигольный аппликатор, предварительно обрабатывают антисептиком.