Способ пластики уретры у детей с проксимальными формами гипоспадии с использованием аутологичных кератиноцитов на биодеградирующем матриксе
Иллюстрации
Показать всеИзобретение относится к медицине, хирургии. Выполняют уретропластику у детей с проксимальными формами гипоспадии. Для замещения дефекта уретры используют имплантат из подложки биоматрикса из желатиновой губки с культивированными на одной ее стороне аллогенными мезенхимальными стромальными клетками человека в концентрации не менее 0,1·105 кл./см2, на другой - суспензии аутологичных кератиноцитов в концентрации 2·105 кл./см2. На вентральной поверхности мошонки в области без волосяных фолликулов выполняют U-образный разрез, окаймляющий меатальное отверстие. Дистальные концы разреза соответствуют пено-скротальному углу. Осуществляют мобилизацию мягких тканей вглубь до эректильной ткани собственной уретры без вскрытия белочной оболочки. Устанавливают уретральный катетер 10Ch. Прямоугольный лоскут имплантата укладывают кератиноцитами в сторону катетера, фиксируют узловыми швами. Мягкие ткани ушивают над артифициальной уретрой. На область промежности накладывают давящую повязку на 24 часа. Способ позволяет восстановить дефект уретры, минимизирует риск послеоперационных осложнений за счет применения клеточного имплантата. 10 ил., 3 пр.
Реферат
Изобретение относится к медицине, а именно к урологии и хирургии, и предназначено для пластики уретры у детей с проксимальными формами гипоспадии.
Проксимальные формы гипоспадии характеризуются отсутствием задней стенки мочеиспускательного канала на всем протяжении ствола полового члена и мошонки с вентральным искривлением ствола и расщеплением крайней плоти по дорзальной поверхности. Наружное отверстие уретры при этой патологии располагается в промежности.
Причиной рождения мальчиков с гипоспадией считают точечные мутации генов, гормональные нарушения в организме, развивающиеся в результате воздействия на организм множества экзогенных и эндогенных факторов, приводящих к нарушению формирования наружных половых органов.
В настоящее время известно большое количество методов хирургической коррекции гипоспадии. Поиск новых методов обусловлен неудовлетворенностью урологов результатами лечения.
Так, в современной урологии проблема, связанная с реконструкцией мочевыводящих путей, в частности уретры, является одной из самых сложных. Несмотря на обилие разработанных хирургических методик, на сегодняшний день не существует единого подхода при выборе тактики хирургического лечения протяженных дефектов уретры. Объясняется это достаточно высоким уровнем неудовлетворительных функциональных результатов в ближайшем и отдаленном послеоперационном периоде, а также обилием осложнений, что связано в определенной степени с деликатностью строения анатомических образований при постоянной выраженной функциональной нагрузке, которой подвергается система мочевыведения.
Из уровня техники известен способ лечения гипоспадии, предложенный Norton В. Hodgson (Hodgson-III) (Norton В. Hodgson. A one-stage hypospadias repain // J.Urol, 1970, N 104, p. 281-284). Способ заключается в том, что выполняют окаймляющий разрез вокруг головки полового члена, отступя 3-4 мм от венечной борозды, продолжают его по вентральной поверхности ствола до гипоспадического меатального отверстия уретры окаймлением последнего, отступя 2-3 мм от его края. Глубина разреза достигает фасции Buck. Кожу ствола полового члена мобилизуют до основания. Производят тщательное иссечение фиброзной хорды, расположенной по вентральной поверхности и иногда с переходом на боковую поверхность. Затем производят измерение расстояния от вершины головки до гипоспадического меатального отверстия уретры, соответствующее дефициту уретральной трубки. На дорзальной поверхности мобилизованной кожи выкраивают прямоугольный лоскут на широкой сосудистой ножке с сохранением питающих его сосудов. Сформированный лоскут равен по длине дефициту уретры, а по ширине - длине окружности создаваемой уретры. Прямоугольный лоскут сшивают в трубку на уретральном катетере. На вентральной поверхности головки полового члена вправо и влево от центральной линии деэпидермизируют две поверхности в виде прямоугольных треугольников с вершинами, обращенными к вершине головки полового члена, и катетами, обращенными к центральной линии, получая раневую поверхность в виде равнобедренного треугольника. В проксимальной части прямоугольной кожной раны на дорзальной поверхности мобилизованной кожи ствола полового члена создают отверстие путем разведения тканей, равное окружности ствола полового члена, который перемещают через это отверстие на дорзальную сторону, после чего проксимальный конец артифициальной уретры сшивают с гипоспадическим меатусом по типу "конец в конец". Дистальный конец артифициальной уретры подшивают к вентральной поверхности головки полового члена тремя швами, при этом первый шов накладывают между дорзальным краем артифициального меатуса и вершиной треугольной деэпидермизированной поверхности. Два других шва накладывают между боковыми краями артифициального меатуса и боковыми краями вершины. Края незадействованной в уретропластике кожи препуциального мешка, перемещенного с дорзальной поверхности, подшивают к боковым краям треугольной поверхности. Продольную рану на дорзальной поверхности ствола полового члена ушивают непрерывно до венечной борозды. Края раны вокруг головки полового члена сшивают с краями раны дорзальной поверхности. Дефект кожи на вентральной поверхности ствола полового члена ушивают в продольном направлении.
Недостатками способа является возникновение достаточно большого количества осложнений. Прежде всего, образование мочевых свищей уретры, а также достаточно высокий процент стенозов анастомоза, что обусловлено малым диаметром наружного отверстия естественной уретры и ишемией лоскута, приводящих к констрикции зоны анастомоза. Названные осложнения требуют либо длительного бужирования, либо эндоскопического рассечения или проведения корригирующей операции. Кроме того, осуществление способа приводит к возникновению выраженного косметического недостатка. Вентральная поверхность головки полового члена представлена кожей препуциального мешка, что без сомнения обращает на себя внимание и приводит к психологической травме, особенно в процессе становления половых отношений.
Одной из разновидностей вышеописанной операции является комбинированный способ уретропластики по методу Hodgson-III-Duplay.
Показанием к операции является мошоночная или промежностная форма гипоспадии, при которой меатальное отверстие расположено на мошонке или промежности, а расстояние от гипоспадического меатуса до пено-скротального угла не менее 15-25 мм.
Операция начинается с окаймляющего разреза вокруг головки полового члена, отступя 3-4 мм от венечной борозды. По вентральной поверхности разрез продлевается продольно до пено-скротального угла. Затем производится мобилизация кожи полового члена до перехода на мошонку по вентральной поверхности. По дорзальной и боковым поверхностям мобилизация кожи производится до пеносимфизарного пространства с рассечением lig. suspensorium penis.
Следующим этапом выполняется уретропластика по технологии Hodgson-III (см. выше), а промежуток от гипоспадического меатуса до пено-скротального угла выполняется по методу Duplay. Затем два фрагмента артифициальной уретры сшиваются между собой на уретральном катетере №8 СН по типу «конец в конец» узловыми швами. Раневой дефект ушивается непрерывным обвивным швом. Операция завершается наложением повязки.
Недостатками данного способа является высокая частота формирования свищей уретры, стеноза анастомоза, а также нехватка ткани для дальнейшего укрытия уретры.
Отличие комбинированного метода уретропластики по Duckett-Duplay от вышеописанного заключается в том, что дистальный фрагмент формируемой уретральной трубки создается по технологии Duckett (a не по технологии Hodgson).
Методика Duckett используется для одноэтапной коррекции задней и средней форм гипоспадии в зависимости от запаса пластического материала, а также при тяжелых формах гипоспадии с выраженным дефицитом кожи с целью создания артифициальной уретры в мошоночном и мошоночно-стволовом отделах. Наиболее важным моментом при использовании данной методики является создание проксимального фрагмента уретральной трубки из кожи, лишенной волосяных фолликулов (в данном случае из внутреннего листка крайней плоти), с перспективой дистальной уретропластики местными тканями. Определяющим моментом в данной технологии является размер препуциального мешка, ограничивающий возможности пластики искусственной уретры.
Операция начинается с окаймляющего разреза вокруг головки полового члена на расстоянии 2 мм от нее. После мобилизации кожи полового члена и иссечения фиброзной хорды производят оценку истинного дефицита уретры. Затем выкраивают поперечный эпителиальный лоскут из внутреннего листка крайней плоти. Разрез на внутренней поверхности препуция производится на глубину собственно кожи полового члена. Длина лоскута зависит от величины дефекта уретральной трубки и ограничивается шириной препуциального мешка. Лоскут сшивается в трубку на катетере непрерывным прецизионным внутрикожным швом с использованием атравматических монофиламентных рассасывающихся нитей. Остатки внутреннего и наружного листков крайней плоти расслаиваются в бессосудистой зоне и используются в дальнейшем для закрытия раневого дефекта вентральной поверхности полового члена. Важным этапом данной операции является аккуратная мобилизация артифициальной уретры от наружной эпителиальной пластинки без повреждения сосудистой ножки. Затем мобилизованная уретральная трубка ротируется на вентральную поверхность справа или слева от ствола полового члена в зависимости от расположения сосудистой ножки с целью минимизации перегиба питающих сосудов. «Новая уретра» анастомозируется с гипоспадическим меатусом по типу "конец в конец" узловыми швами. Анастомоз между артифициальной уретрой и головкой полового члена выполняется по методу Hendren. Для этого производится рассечение эпителиального слоя до кавернозных тел, после чего дистальный конец созданной уретры укладывается в образовавшуюся ложбину и сшивается с краями ладьевидной ямки узловыми швами. Иногда мы использовали с этой целью технологию Browne, описанную в 1985 году B. Belman. Для закрытия кавернозных тел полового члена используется ранее мобилизованная кожа, рассеченная по дорзальной поверхности и ротированная на вентральную поверхность.
К сожалению, помимо перечисленных ранее недостатков, к минусам данного вмешательства относится еще и нарушение кровоснабжения уретры сформированной по методике Дакета в связи со сложностью мобилизации сосудов кожи крайней плоти.
Также известен способ пластики уретры у детей с проксимальной формой гипоспадии, включающий одномоментное выпрямление кавернозных тел, восстановление отсутствующего участка уретры при помощи кожного лоскута дорсальной поверхности ствола полового члена и крайней плоти, сшитого в трубку и перемещенного на вентральную поверхность через отверстие в основании лоскута (RU 2143853, 30.03.1999). Данный способ включает также выкраивание дополнительного лоскута из кожи мошонки, который сшивают в трубку для восстановления целостности уретры, формируют анастомоз, и наружное отверстие уретры создают на вершине головки полового члена путем рассечения ткани вглубь при помощи продольных разрезов с последующим укладыванием трубки и сшиванием головки.
Недостатком данного способа является сложность проведения технологических приемов для создания наружного отверстия уретры и, кроме того, большое количество уретральных свищей. Данный способ может быть использован не для всех форм гипоспадии, что ограничивает его возможности. Кроме того, способ имеет низкий косметический эффект.
Также из уровня техники известны различные материалы, которые могут быть использованы для пластики уретры, в частности ксеноперикард, слизистая оболочка щеки и пр. Однако их использование также не приводит к получению стойкого положительного эффекта.
Наиболее близким к предлагаемому нами способу является способ того же назначения, включающий проведение уретропластики с использованием для замещения дефекта уретры ксеноперикарда ((Lara RC, Lucon AM, Агар S. Urethroplasty using a bovine pericardium graft: an experimental study using normal urethras from dogs. Braz. J. Med. Biol. Res. 2004 Mar; 37(3):327-331).
Способ позволяет устранить дефект мочеиспускательного канала на необходимом протяжении. Ксеноперикард отвечает хирургическим критериям пригодности для использования в качестве подложки для тканевого эквивалента уретры, так он обладает:
1) биосовместимостью;
2) механической прочностью, достаточной для проведения хирургических манипуляций;
3) достаточной эластичностью для сворачивания в трубку на катетере;
4) ригидностью для сохранения просвета без катетера.
Однако, несмотря на очевидные достоинства, практика проведения операций по известному способу не дает достаточного количества удовлетворительных клинических результатов, что можно быть связано со следующими недостатками данного материала: в ксеноперикарде отсутствуют естественные поры и, следовательно, процесс интеграции тканевого эквивалента значительно затруднен. А медленные интеграция и ремоделирование материала значительно осложняют процессы адаптации и приживления тканевого эквивалента на основе ксеноперикарда, особенно на ранних сроках. С другой стороны, наличие остаточных клеток в образцах увеличивает вероятность возникновения иммунных реакций на материал при имплантации его пациентам.
По всей видимости, именно вышеуказанные недостатки материала приводят к неудовлетворительным результатам вмешательства в 50% и более процентах случаев.
Более того, практически все известные на настоящий момент клеточные имплантаты обладают одним общим недостатком: так, ткани пациента в области поражения и последующего оперативного вмешательства всегда подвергнуты ишемии из-за недостатка кровоснабжения, что значительно затрудняет процесс регенерации тканей. Однако в состав материала матрицы известных имплантатов не входят элементы, обеспечивающие возможность устранить гипоксию клеток и тканей в зоне ишемии и создать оптимальную микросреду для регенерации ткани.
Задачей настоящего изобретения является создание способа пластики уретры у детей с проксимальными формами гипоспадии, позволяющего восстановить дефект уретры с минимальным количеством ближайших и отдаленных послеоперационных осложнений и с наилучшими косметическими и функциональными результатами.
Технический результат предложенного способа заключается в снижении количества послеоперационных осложнений, улучшении как эстетических (косметических), так и функциональных результатов, что, в свою очередь, приводит к повышению эффективности лечения в целом. Само же снижение количества осложнений и улучшение косметических и функциональных результатов достигается за счет использования новой методики хирургического вмешательства в сочетании с новым материалом для устранения дефектов уретры.
Достижение технического результата обеспечивается тем, что:
- клеточный имплантат содержит подложку биоматрикса, выполненную из желатиновой губки. Такая структура подложки биоматрикса за счет эластичности и пористости позволяет создать оптимальные условия как для культивирования клеток in vitro, обеспечивая достаточный газообмен и снабжение питательными веществами, так и для ускорения процесса регенерации и формирования структуры уретры in vivo за счет быстрого врастания сосудов в структуру подложки биоматрикса, и, как следствие, достаточного уровня питания и тканевого дыхания, восстановления микроциркуляции пораженной ткани. Кератиноциты, входящие в состав эквивалента уретры, прошедшие стадию культивирования in vitro, формируют эпителиальный слой, обращенный в просвет уретры, защищая подлежащие ткани от агрессивного воздействия мочи;
- при осуществлении хирургического вмешательства производят U-образный разрез на вентральной поверхности мошонки с окаймлением гипоспадического меатального отверстия по проксимальному краю, что в последующем позволяет укрыть неоуретру достаточным объемом ткани. Расстояние между дистальными концами разреза (размер базового островка) зависит от расположения волосяных фолликулов, визуализация которых осуществляется под оптическим увеличением (базовый островок не должен содержать волосяных фолликулов). Дистальные края разреза должны строго соответствовать пеноскротальному углу. Мягкотканный лоскут подкожных тканей мобилизуют латеральней до белочной оболочки кавернозных тел таким образом, чтобы мягкие ткани легко сводились над артифициальной уретрой, что обеспечивает герметичность послеоперационной раны и отсутствие косметического дефекта в дальнейшем. Из клеточного имплантата, описанного выше, выкраивают лоскут прямоугольной формы, соответствующий по длине дефициту уретральной трубки, а по ширине - длине окружности формируемой уретры. Устанавливают уретральный катетер 10Ch, размер которого препятствует возникновению стеноза и стриктур уретры в послеоперационном периоде. Выкроенный лоскут с кератиноцитами, обращенными в сторону катетера, укладывают в зону интереса и фиксируют узловыми швами нитью PDS 7/0 по краю базового островка. Мобилизованные подкожные ткани сшивают над артифициальной уретрой непрерывно нитью PDS 7/0. Далее непрерывно сшивают кожу от неомеатального отверстия уретры до проксимального края раны. Уретральный катетер фиксируется к стволу полового члена нитью Пролен 5/0 во избежание его выпадения из просвета мочевого пузыря и нарушения отведения мочи. На область промежности накладывается давящая повязка на 24 часа.
Таким образом, использование предложенного нами клеточного имплантата и разработанных приемов хирургического вмешательства для проведения пластики уретры именно этим имплантатом позволяет обеспечить достижение указанного выше технического результата.
Способ осуществляется следующим образом.
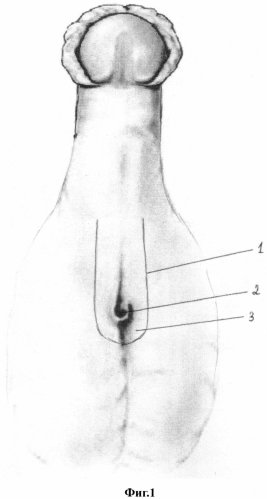
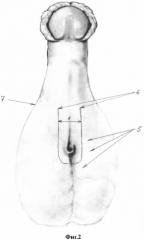
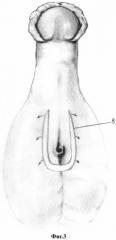
На вентральной поверхности мошонки производят U-образный разрез (1) с окаймлением гипоспадического меатального отверстия (2) по проксимальному краю, формируя так называемый базовый островок (3) (фиг. 1). Расстояние между дистальными концами разреза (4) (фиг. 2) зависит от расположения волосяных фолликулов (5), визуализация которых осуществляется под оптическим увеличением (базовый островок не должен содержать волосяных фолликулов). Вершины (дистальные края) разреза (6) должны строго соответствовать пено-скротальному углу (7). Далее (фиг. 3) выполняют мобилизацию мягких тканей латерально от разреза и вглубь (8) до эректильной ткани собственной уретры. Белочная оболочка спонгиозных тел не вскрывается. Мягкотканный лоскут подкожных тканей мобилизуют латеральней до белочной оболочки кавернозных тел таким образом, чтобы мягкие ткани легко сводились над артифициальной уретрой (фиг. 4). Затем производится тщательный гемостаз с использованием микрохирургического инструмента, не вызывая большой площади ожога. Открывается контейнер, содержащий предложенный нами имплантат (состав и получение описаны ниже), который переносится двумя пинцетами на манипуляционный стол. Из имплантата выкраивают прямоугольный лоскут (9), по длине соответствующий длине уретры, а по ширине равный длине окружности формируемой уретры (фиг. 5). Устанавливается уретральный катетер 10Ch.(10) (фиг. 6) Выкроенный лоскут с кератиноцитами, обращенными в сторону катетера, укладывается в зону интереса и фиксируется узловыми швами (11) нитью PDS 7/0 по краю базового островка (фиг. 7). Мобилизованные подкожные ткани сшиваются над артифициальной уретрой непрерывно (12) нитью PDS 7/0 (фиг. 8). Далее непрерывно сшивается кожа от неомеатального отверстия уретры до проксимального угла раны (13) (фиг. 9).
Клеточный имплантат для восстановления протяженных дефектов уретры конструктивно выполнен в виде живого эквивалента уретры. Он содержит подложку биоматрикса, образующую трехмерный каркас и являющуюся стромой для новой формирующейся ткани. Подложка биоматрикса выполнена из желатиновой губки.
Внутри подложки биоматрикса распределены аллогенные мезенхимальные клетки человека. В качестве аллогенных мезенхимальных клеток человека используют фибробласты или мультипотентные мезенхимальные стромальные клетки жировой ткани (ММСК ЖТ) человека или их смесь с концентрацией клеток не менее чем 0,1·105 кл./см2 имплантата. Сверху подложка биоматрикса покрыта слоем аутологичных эпидермальных кератиноцитов, выделенных из биоптатов кожи, взятых у пациента в ходе операции. Источником для получения ММСК человека служат излишки кожи и жира после пластических операций (блефаропластика, фейслифтинг, абдоминопластика). Эпидермальные и мезенхимальные клетки являются биологически активным компонентом имплантата, инициирующим восстановление уротелия.
На фиг. 10 представлена схема клеточного имплантата (эквивалента уретры), где:
14 - эпидермальный слой (аутологичные кератиноциты);
15 - подложка биоматрикса;
16 - фибробласты.
Клеточный имплантат получают следующим образом.
Для изготовления клеточного имплантата используется коммерческий продукт - желатиновая губка «Spongostan».
Из губки «Spongostan» вырезают квадраты нужного размера и размещают их в чашках Петри нужного размера. Перед посевом клеток губки промывают раствором Хэнкса с гентамицином. Затем на поверхность губок осуществляют посев мезенхимальных клеток (ММСК ЖТ, фибробластов или смесь фибробластов с ММСК ЖТ) в питательной среде и помещают полученную подложку биоматрикса в СО2-инкубатор на 1 сутки. Спустя сутки подложку биоматрикса с клетками при помощи пинцета переворачивают стороной, заполненной клетками, вниз, удаляют всю питательную среду. Затем наносят на свободную поверхность суспензию кератиноцитов в количестве 150 тыс. кл. на 1 см2 губки и заливают полной питательной средой. Культивирование эквивалента уретры проводят в течение недели в СО2-инкубаторе.
Внешний вид эквивалента уретры представляет собой плоскую губку толщиной 0,1-0,2 мм бледно-розового цвета.
Полученный клеточный имплантат упаковывают поштучно в стерильный индивидуальный пакет из многослойной полимерной пленки или одноразовую пластиковую чашку Петри. Пакет или чашку помещают в запаянный пакет из поливинилхлоридной (ПВХ) пленки.
Гарантийный срок хранения клеточного имплантата:
- в условиях криозаморозки (-196°C) - не менее года;
- при комнатной температуре (+22°C) - не менее 14 суток.
Преимущества предложенного способа, возможность реализации заявленного назначения, а также возможность достижения указанного технического результата подтверждаются следующими клиническими примерами:
Клинический пример 1: Больной А., возраст 1,5 года, диагноз промежностная форма гипоспадии. Прооперирован по предложенному способу с использованием аутологичных кератиноцитов на биодеградирующем матриксе. Катетер удален на 10 сутки после операции. На 17 сутки сняты швы. Проходимость уретры удовлетворительная, мочеиспускание не нарушено. На 20 сутки проведена калибровка (оценка проходимости) уретры - проходимость уретры 3,5-4 Fr.
Через год после проведения вмешательства по предложенному способу осложнений не наблюдалось.
Клинический пример 2: Больной М., возраст 1 год, диагноз промежностная форма гипоспадии. Прооперирован по предложенному способу с использованием аутологичных кератиноцитов на биодеградирующем матриксе. Катетер удален на 9 сутки после операции. На 16 сутки сняты швы. Проходимость уретры удовлетворительная, мочеиспускание не нарушено. На 19 сутки проведена калибровка (оценка проходимости) уретры - проходимость уретры 4 Fr.
Через год после проведения вмешательства по предложенному способу осложнений не наблюдалось.
Клинический пример 3: Больной Ж., возраст 1 год, диагноз промежностная форма гипоспадии. Прооперирован методикой Дюплея на промежностном отделе уретры, дефект уретры составил 2 см (от меатального отверстия до пено-скротального угла) Уретральный катетер удален на 10 послеоперационные сутки, отмечалось наличие 3 свищевых отверстий неоуретры. В связи с неудовлетворительным эффектом от первого оперативного вмешательства решено выполнить повторные этапные оперативные вмешательства:
- рассечение неоуретры с заживлением уретральной площадки;
- следующий этап осуществлялся по предложенному способу с использованием аутологичных кератиноцитов на биодеградирующем матриксе. Катетер удален на 10 сутки после операции. На 16 сутки сняты швы. Проходимость уретры удовлетворительная, мочеиспускание не нарушено. На 19 сутки проведена оценка проходимости уретры - проходимость уретры 4 Fr.
Способ пластики уретры у детей с проксимальными формами гипоспадии, включающий проведение уретропластики с использованием для замещения дефекта уретры клеточного имплантата, отличающийся тем, что оперативное вмешательство начинают с выполнения на вентральной поверхности мошонки U-образного разреза с окаймлением гипоспадического меатального отверстия по проксимальному краю; при этом расстояние между дистальными концами разреза выбирают таким образом, чтобы между ними не было волосяных фолликулов, а дистальные края разреза соответствовали пено-скротальному углу; далее осуществляют мобилизацию мягких тканей латерально от разреза и вглубь до эректильной ткани собственной уретры без вскрытия белочной оболочки спонгиозных тел так, чтобы мягкие ткани легко сводились над артифициальной уретрой; производят тщательный гемостаз с использованием микрохирургического инструмента; далее из клеточного имплантата, состоящего из подложки биоматрикса из желатиновой губки с культивированными на одной ее стороне аллогенными мезенхимальными стромальными клетками человека, нанесенными в концентрации не менее 0,1·105 кл./см2, а на другой - суспензии аутологичных кератиноцитов в концентрации 2·105 кл./см2, выкраивают прямоугольный лоскут, по длине соответствующий длине уретры, а по ширине равный длине окружности формируемой уретры; после установки уретрального катетера 10Ch выкроенный лоскут с кератиноцитами, обращенными в сторону катетера, укладывают в зону интереса и фиксируют узловыми швами нитью PDS 7/0; мобилизованные подкожные ткани сшивают над артифициальной уретрой непрерывно нитью PDS 7/0, далее непрерывно сшивают кожу от неомеатального отверстия уретры до проксимального угла раны; уретральный катетер фиксируют к стволу полового члена нитью Пролен 5/0; на область промежности накладывают давящую повязку на 24 часа.