Способ моделирования пролиферативной витреоретинопатии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к офтальмологии, и предназначено для моделирования пролиферативной витреоретинопатии (ПВР). Для этого в оба глаза кролика осуществляют однократное интравитреальное введение 2000 Ε Интерлейкина 1-b в объеме 0.1 мл. Затем последовательно интравитреально однократно вводят тромбоцитарный фактор роста PDGF АА остеосаркомы в объеме 0.1 мл с концентрацией 2000 пкг/мл. Способ обеспечивает получение клинически и цитопатогенетически адекватной модели ПВР с возможностью ее использования для изучения эффективности медикаментозного лечения и профилактики ПВР в эксперименте. 2 пр., 6 ил.
Реферат
Предлагаемое изобретение относится к офтальмологии и предназначено для моделирования пролиферативной витреоретинопатии (ПВР).
Пролиферативная витреоретинопатия (ПВР) является сложным гетерогенным заболеванием, которое характеризуется формированием клеточных мембранных образований на внутренней поверхности сетчатки. Особенностью этих мембран является наличие у них тракционных свойств, приводящих к тракционной отслойке сетчатки с потерей зрительных функций. ПВР, как многофакторный патологический процесс, чаще всего возникает как осложнение при таких клинических состояниях, как регматогенная отслойка сетчатки, травматическая отслойка сетчатки. Развитие ПВР после хирургического лечения отслойки сетчатки вызывает рецидивы заболевания - неприлегание сетчатки.
В основе формирования ПВР лежит пролиферация клеток ретинального пигментного эпителия (РПЭ) и глиальных клеток сетчатки. Лечение ПВР представляет большие трудности, связанные с локализацией процесса преимущественно в заднем отделе глаза. Поэтому для объективного суждения об эффективности лекарственного воздействия при ПВР, необходимо создание адекватной экспериментальной модели.
За последние 25 лет проведены многочисленные исследования по моделированию ПВР.
Известен общепринятый способ моделирования ПВР, в котором главным модельным материалом являются фибробласты из культуры ткани, которые вводят интравитреально. Однако данная модель не является патогенетически ориентированной моделью, отражающей клиническое течение ПВР. Модель демонстрирует образование фиброзных мембран на поверхности сетчатки, однако не отражает ведущую роль в процессах ПВР пролиферации клеток РПЭ, которые не идентифицируются в образованных мембранах (Sugita G, Tano Y, Machemer R, Abrams G, Claflin A, Florentino G. Intravitreal autotransplantation of Fibroblasts. Am J Ophthalmol 1980; 89: 121-30). (Hitchins C.A., Grierson J. Intravitreal injection of fibroblasts. The pathological effects on the ocular tissue of the rabbit following an intravitreal injection of analogus skin fibroblasts. Br J Ophth. 1998.vol. 72, p. 488). В настоящее время известно, что в результате нарушения гематоретинального барьера запускается специфический воспалительный процесс с участием: тромбоцитарного фактора роста PDGF, фактора некроза опухоли бета- TGF-b, эпиретинального фактора роста - EGF, фактора некроза опухоли альфа -TGA-a, и др.; про- и противовоспалительных цитокинов: интерлейкинов - IL-1, IL-6, IL-8, IL-10 и интерферона гамма - INF-v. Взаимодействие этих факторов приводит к процессам миграции, пролиферации и дифференцировки клеток, участвующих в развитии ПВР (Lei H, Rheaume M.A. Kazlauskaa A. Recent developments in our understanding of how platelet-derived growth factor (PDGF) and its receptors contribute to proliferative vitreoretinopathy. Exp Eye Res. 2010; 98(3): 376-381.)
Модели, которые основаны на участии в патогенезе ПВР воспалительных факторов, называют воспалительными.
Известна воспалительная - цитокиновая модель для индуцирования ПВР в эксперименте, которую впервые использовал С.Baudouin с соавт. при моделировании ПВР у крыс путем введения в СТ комплекса ксантин-ксантиноксидазы. Baudouin С, Ettaiche H., Imbert F.: Inhibition of preretinal proliferation by free radical scavengers in an experimental model of tractional retinal detachment.// Exp. Eye Res., 1994, V. 59(6), P. 697-706.
Известно использование естественного гомологичного комплекса цитокинов препарата Суперлимф «ИмБио» (Нижний-Новгород, регистрационное удостоверение Р№000516/01-2001), полученный из крови свиней с активностью IL-1, IL-6, TNF-a, TGF-b, MIF (Хорошилова-Маслова И.П., Бабижаев Μ.Α., Илатовская Л.В., Киселева О.Α., Ганковская Л.В. Протокол способа профилактики пролиферативной витреоретинопатии. Патент на изобретение №2175223. Москва, 2001).
При введении данного комплекса кроликам интравитреально в стекловидном теле имел место воспалительный процесс в увеальном тракте и скопление макрофагов и лимфоцитов на поверхности внутренней пограничной мембраны сетчатки с ее повреждением. Исследование по моделированию ПВР с помощью введения препарата «Суперлимф» было продолжено для оптимизации дозы введения комплекса цитокинов. Была получена модель ПВР с 90% воспроизводимостью за счет введения через плоскую часть цилиарного тела кроликам препарата «Суперлимф» в дозе 0.15 мл 1000 мкм (Кандидатская диссертация Лепарской Н.Л. Роль пролиферативной витреоретинопатии в патогенезе, клинике и лечении травматической отслойки сетчатки (клинико-экспериментальное исследование) Москва. 2005. Стр. 114-121).
Известно для моделирования ПВР введение интравитреально кроликам одного провоспалительного цитокина - человеческого интерлейкина IL-1b в 250 ЕД в 0.1 мл одновременно с 10 механическими повреждениями сетчатки инсулиновой иглой. При этом указано на значение воспаления и травмы, как запускающих факторов развития ПВР (HGF regulation of RPE proliferation in an IL-1b/retinal hole-induced rabbit model of PVR. Gregory I. Liou, Vytautas A. Pakalnis, Suraporn Matragoon and ets. Mol Vis. 2002 Dec 20;8:494-501.
Известен способ моделирования ПВР, который позволил изучить роль тромбоцитов, как основного компонента коагулирующей системы крови в формировании ПВР, при котором модельным материалом служит тромбоцитарная масса (Baudouin Ch, Utache M., Imbert F., Droy-Letaix M., Gustaud D., Lapalus Ph. Inhibition of preretinal proliferation by free radical scavengers in an experimental model of fractional retinal detachment. Experimental Eye Research. 1994. 59. 697-706).
Известен способ моделирования ПВР, при котором в полость глаза вводят тромбоциты активированные АДФ, отличающиеся выраженной экспрессией фибронектина, что способствовало агрегации тромбоцитов и адгезии их на внутренней пограничной мембране сетчатки с ее деструкцией и последующим развитием ПВР (Babizhayev М.А., Seguin M.S., Gueyne J., Evstigneeva R.P., Agryeva E.A., Zheltukhina. L Camosine (b-alanyl-L-histidine) and carcinine (b-alanylhistidine) act as natural antioxidants with hydroxyl radical scavenging and lipid peroxidase activities.//Biochemical journ., 1994, 304, p. 509-516).
Известен способ моделирования ПВР у кроликов, при котором для стандартизации моделирования использовали гетерогенные тромбоциты с активизацией тромбоцитарной массы донора введением тромбина с последующей стимуляцией на центрифуге. При интравитреальном введении активированных тромбоцитов ПВР развивалась в 91.7% случаях. В зависимости от введенной дозы тромбоцитарной массы наблюдался либо глиальный тип пролиферации (введение 0.5 мл) с полным лизисом сетчатки, либо эпителиальный тип пролиферации с частичным лизисом сетчатки и образованием эпиретинальных мембран - 0.3 мл. Данная модель выявила роль пролиферации отдельных структур сетчатки, но была мало пригодной для исследования различных препаратов в целях профилактики пролиферативного процесса. (Кандидатская диссертация Лепарской Н.Л. Роль пролиферативной витреоретинопатии в патогенезе, клинике и лечении травматической отслойки сетчатки (клинико-экспериментальное исследование) Москва. 2005. Стр. 105-114).
Высокая активность аутологичных клеток ретинального пигментного эпителия в процессе развития пролиферативных изменений в сетчатке позволила использовать их в качестве индукторов развития ПВР в пигментно-эпителиально-клеточной модели. У кроликов из энуклеированного глаза с помощью трипсина получали клетки ретинального пигментного эпителия, смешивали их со средой Игла, а затем взвесь, включающую 3.5-9.6×102 клеток, вводили в оставшийся глаз. Через 1-3 месяца при гистологическом исследовании отмечалось формирование клеточных агрегатов на внутренней пограничной мембране (Хорошилова-Маслова И.П., Илатовская Л.В., с соавт. Способ моделирования пролиферативной витреоретинопатии, патент RU 2161335, 2000). Трехкомпонентная модель по данным авторов давала 100% воспроизведение ПВР в срок 1 месяц.
Интравитреально кроликам вводили три компонента: гомологичный ретинальный пигментный эпителий, естественный комплекс цитокинов и плазменный фибронектин (адгезивный белок, усиливающий клеточную агрегацию, который играет информационную роль в процессах фибриллогенеза).
Однако описанные модели значительно отличаются от естественного клинического течения ПВР, поскольку имеет место неадекватная выраженность пролиферативной и воспалительной реакции, отсутствует однотипность морфологических признаков патологического процесса.
Ближайшим аналогом предлагаемого изобретения является способ моделирования ПВР, основанный на однократном введении кроликам интравитреально отработанной дозы провоспалительного цитокина инерлейкина IL-1b. Введение дозы 2000 Ε сопровождается образованием эпиретинальных мембран, модель имеет 100% воспроизводимость. Недостатком этого способа моделирования является длительный процесс формирования ПВР при недостаточной выраженности клинической картины. (Разработка патогенетически обоснованной стандартной экспериментальной модели пролиферативной витреоретинопатии, индуцированной цитокинами. И.П. Хорощилова-Маслова, Н.Л. Лепарская, М.К. Набиева, Л.Д. Андреева. РОЖ. Том 6, №1, 2013. Стр 78-80).
По нашему мнению, модель ПВР должна отражать этапность процесса миграции и пролиферации клеток на внутреннюю пограничную мембрану сетчатки с ее повреждением и образованием пролиферирующими клетками новообразованных мембран с контрактильными свойствами. Подобная модель будет отражать течение процесса в глазу у человека.
Таким образом, остается актуальным создание стандартной модели ПВР, отражающей патогенез ПВР, соответствующей естественному течению процесса в клинических условиях, что явилось задачей изобретения.
Задачей изобретения явилось создание модели ПВР, отражающей патогенетические особенности цитопатогенеза ПВР.
Техническим результатом предлагаемого способа является получение клинически и цитопатогетически адекватной модели ПВР с выраженностью пролиферативной и воспалительной реакции, однотипностью морфологических признаков патологического процесса, этапностью процесса миграции и пролиферации клеток на внутреннюю пограничную мембрану сетчатки с ее повреждением и образованием пролиферирующими клетками новообразованных мембран с контрактильными свойствами.
Технический результат достигается за счет использования модели, соответствующей естественному течению процесса в клинических условиях с помощью интравитреального однократного последовательного введения Интерлейкина 1-b 2000 Ε и тромбоцитарного фактора роста PDGF АА остеосаркомы человека в концентрации 2000 пкг/мл.
Одним из наиболее важных факторов, известных в настоящее время и регулирующих процесс мембранообразования на поверхности сетчатки и активности процесса ПВР, является PDGF (platelet-derived growth factor) - тромбоцитарный фактор роста. Известна роль PDGF в регуляции роста и пролиферации ретинального пигментного эпителия. PDGF экспрессируется клетками ретинального пигментного эпителия, мюллеровыми клетками, глиальными клетками, PDGF был обнаружен в эпиретинальных мембранах (Campochiaro et al. Retinal pigment epithelial cells produce PDGF-like proteins and secrete them into their media. (1989) Exp. Eye Res. 49, 217-227; Mudhar et al., (1993) PDGF and its receptors in the developing rodent retina and optic nerve. Development 118, 539-552; Yoshida et al, (1992) Platelet-derived Growth Factor gene expression in cultured human retinal pigment epithelial cells. Biochem. Biophys. Res. Comm. 189: 66-71).
Известны изоформы PDGF: PDGF-AA, PDGF - AB, PDGF - BB. Исследования показали, что активность развития ПВР имеет зависимость от количественного уровня PDGF - А и PDGF-B. Наибольшее значение в образовании мембран имеет иззоформа PDGF - А. (Vinores S.A., Henderer J.D., and ets. Isoforms of Platelet-derived Growth Factor and its Receptors in Epiretinal membranes: immunolocalization to Retinal Pigmented Epithelial cells. Experimental Eye Res. 1995. 60, 607-619).
На клиническом материале (исследование субретинальной жидкости) было установлено, что при повышении PDGF - АА больше 400 пкг/мл диффузная ПВР развилась в 100% случаев. (Кандид. дис. Кузнецовой И.С. Прогнозирование и ранняя диагностика прогрессирования ПВР после успешного хирургического лечения регматогенной отслойки сетчатки. Москва. 2012. Стр. 152-153)
Таким образом, для оптимизации интерлейкиновой модели ПВР, индуцируемой IL-1b в качестве активатора мы решили использовать PDGF.
В I серии экспериментально-морфологического исследования проведено изучение влияния различных доз PDGF на ткани глаза. В эксперименте использовали 6 кроликов весом 2.5-3.0 кг породы Шиншилла. Животные содержались в виварии ФГУ МНИИ ГБ им. Гельмгольца в условиях соответствующих нормативным документам Россельхознадзора № 1045-73.
Тромбоцитарный фактор роста PDGF АА остеосаркомы человека вводили в различных дозах однократно интравитреально в объеме 0.1 мл: 1 группа - в дозе 2000 пкг/мл, 2 кролика (4 глаза), 2 группа - в дозе 5000 пкг/мл, 2 кролика (4 глаза), 3 группа - в дозе 20000 пкг/мл 2 кролика (4 глаза). Инъекцию проводили инсулиновой иглой под местной анестезией с раствором Алкаина 0.5% (Alcon). Продолжительность эксперимента составила 1 мес. Через 1 мес. животных выводили из эксперимента методом воздушной эмболии.
Результаты I серии экспериментально-морфологического исследования показали, что клинический анализ во всех случаях, проводимый методами прямой и обратной офтальмоскопии в сроки 7, 14, 21 и день забоя, не выявил клиники увеита, изменений со стороны переднего отреза глаза. На глазном дне отмечалась клиника «облысения» пигментного эпителия, депигментация в центральных отделах глазного дна. В группе 3 зоны депигментации были более обширные.
Морфологические исследования проведены по следующей методике: энуклеированные глаза фиксировали в 10% забуференном формалине, затем вскрывали путем рассечения на 3 части. Центральную часть заливали в парафин. Серийные парафиновые срезы окрашивали гематоксилином и эозином, а также пикрофуксином по Ван-Гизону. Для микроскопического исследования использовали микроскопическую систему фирмы Leica.
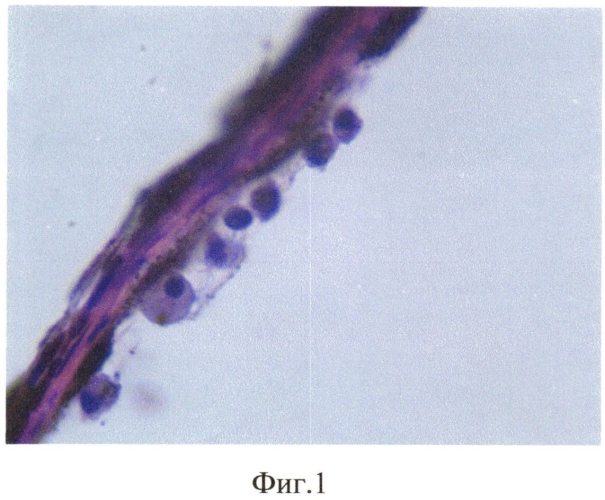
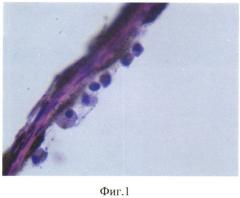
Микроскопическое исследование глаз кроликов 1 группы показало, что передний отрезок всех 4-х глазных яблок был без изменений. Основные изменения локализовались в клетках ретинального пигментного эпителия (РПЭ). Отмечена диссоциация клеток РПЭ, связанная с их активной миграцией. Вышедшие из пласта клетки имели округлую форму, с ядром, переместившимся на периферию. Отмечено исчезновение пигмента и появление отростков в мигрирующих клетках. Наряду с активной миграцией, появились участки оголения в пласте. В наружных слоях хориоидальной зоны - накопления мигрирующих клеток РПЭ. Такие же клетки осели на внутренней поверхности сетчатки и на фибриллах стекловидного тела. Выявлена деструкция наружных сегментов палочек и колбочек с отслойкой сетчатки от РПЭ, уменьшение числа ядерных слоев в наружном зернистом слое сетчатки с резким истончением наружного плексиформного слоя.
Микроскопическое исследование глаз кроликов 2 группы показало, что выявлены те же изменения, что и в 1 группе, локализующиеся в клетках РПЭ. Отмечена диссоциация клеток РПЭ, их миграция, очаги деструкции клеток РПЭ с развитием оголения пласта РПЭ и ограниченными отслойками сетчатки. Благодаря пигментным отложениям в наружных слоях хориоидеи сформировался пигментный пласт. В то же время в глазах 2 группы атрофические изменения в сетчатке были более выражены: число клеточных рядов в ядерных слоях снизилось до 3-5. Плексиформный слой не визуализировался. Выявлен глиоз сетчатки, который характеризовался гиперплазией клеток Мюллера, замещающий зоны атрофичных ганглиозных клеток. В этой группе появились новообразованные сосуды, которые локализовались на поверхности диска зрительного нерва.
Микроскопическое исследование глаз кроликов 3 группы, выявило, что передний отрезок не изменен. Основные изменения сосредоточены в заднем отделе - обширная диссоциация РПЭ, выход его из пласта с формированием участков оголения, мигрирующие клетки в небольшом количестве определялись на внутренней поверхности сетчатки, выраженная деструкция слоя палочек и колбочек с формированием плоской отслойки сетчатки. В сетчатке - атрофия, резкое сокращение числа слоев в зернистых слоях (наружном и внутреннем). Истончение внутреннего плексиформного слоя и отсутствие наружного, атрофия слоя ганглиозных клеток с компенсаторной гиперплазией Мюллеровских клеток.
Таким образом, в I серии экспериментальной работы при введении интравитреально тромбоцитарного фактора роста (PDGF) показан дозозависимый характер изменений. Основной мишенью действия были клетки РПЭ, то есть стимуляция процесса образования активных мигрирующих клеток РПЭ, полученная в эксперименте, может характеризовать развитие ПВР при введении интравитреально PDGF в количестве 2000 пкг/мл. В более высоких дозах введения PDGF (5000 и 20000 пкг/мл) отмечено прогрессирующее изменение клеток РПЭ и нарушение метаболизма наружных слоев сетчатки, где локализуются фоторецепторы. Гибель фоторецепторного слоя при высоких дозах приводит к атрофии сетчатки, где исчезает слой палочек и колбочек, наружный зернистый слой и наружный плексиформный слои резко истончаются, атрофируется слой ганглиозных клеток. Как результат атрофических процессов, происходит компенсаторная гиперплазия опорных клеток сетчатки - клеток Мюллера. То есть в качестве модельной массы обоснованным является выбор дозы 2000 пкг/мл, благодаря которой запускается активация миграции клеток РПЭ.
Таким образом, была отработана доза активатора интерлейкиновой модели - доза PDGF АА 2000 остеосаркомы человека пкг/мл.
Во II серии экспериментальной работы мы использовали отработанные дозы, вводя инравитреально однократно последовательно Интерлейкин 1-b в дозе 2000 Ε в объеме 0.1 мл и тромбоцитарный фактор роста PDGF АА остеосаркомы человека в дозе 2000 пкг/мл в объеме 0.1 мл.
Было использовано 8 кроликов (16 глаз). Инъекцию проводили инсулиновой иглой под местной анестезией с раствором Алкаина 0.5% (Alcon). Продолжительность эксперимента составила 1 мес. Через 1 мес. Животных выводили из эксперимента методом воздушной эмболии.
Клинический анализ во всех случаях, проводимый методами прямой и обратной офтальмоскопией в сроки 7, 14, 21 и день забоя, не выявил клиники увеита, изменений со стороны переднего отреза глаза. На глазном дне отмечалась клиника «облысения» пигментного эпителия, депигментация в центральных отделах глазного дна, на сетчатке отмечалась легкая «тусклость» поверхности сетчатки.
Основным доказательным методом исследования являлась морфологическая идентификация ПВР. Морфологические исследования проведены по выше описанной методике.
Результаты исследования
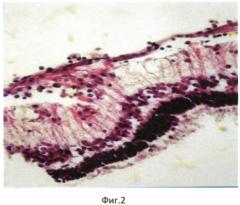
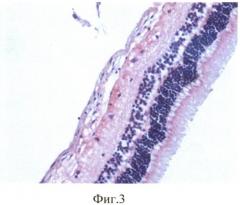
Морфологические исследования во всех случаях (16 глаз) выявили развитие ПВР в виде тонковолокнистой эпиретинальной мембраны (ЭРМ) на внутренней поверхности сетчатки. ЭРМ имела очаговый характер, местами была спаяна с внутренней пограничной мембраной (ВПМ), местами - на значительном протяжении отстояла от нее. Сетчатка в очагах ПВР была складчатой, сохраняла свою обычную слоистую структуру. Обращала внимание весьма слабая выраженность воспалительного процесса: единичные лимфоциты рассеяны в стекловидном теле, вокруг цилиарных отростков. Закономерными были изменения в РПЭ: клетки РПЭ оседали на мембранах стекловидного тела. В результате такой миграции, в пигментном эпителии формировались очаги «облысения» с обнажением Бруховской мембраны. Оседающие на внутреннюю пограничную мембрану клетки РПЭ начинали активно пролиферировать. В пролифератах происходила трансформация клеток РПЭ: они теряли пигмент, изменяли форму, активно синтезировали межклеточный матрикс, в том числе, коллаген (рис. 3). В результате подобной трансформации на внутренней поверхности сетчатки формировалось нежное волокнистое мембранное образование, которое местами было интимно спаяно с сетчаткой, местами - свободно отделялось от нее.
Закономерность полученных изменений позволяет рекомендовать данную модель для использования при изучении эффективности медикаментозного лечения и профилактики ПВР в эксперименте.
Способ осуществляют следующим образом. Кролику проводят местную анестезию, например, с помощью 3-кратной инсталляции с интервалом 3 минуты раствора Алкаина 0.5%. Через плоскую часть цилиарного тела на расстоянии 2.5 мм от лимба инсулиновой иглой 32G выполняют прокол с введением инравитреально Интерлейкина 1-b в дозе 2000 Ε в объеме 0.1 мл, затем - тромбоцитарного фактора роста PDGF АА остеосаркомы человека в дозе 2000 пкг/мл в объеме 0.1 мл.
Пример 1. Кролик №1. Моделирование: в оба глаза 3-кратно инсталлировали с интервалом 3 минуты раствор Алкаина 0.5% (Alcon). Интравитреальную инъекцию проводили в каждый глаз однократно последовательно. Через плоскую часть цилиарного тела на расстоянии 2.5 мм от лимба инсулиновой иглой 32G выполняли прокол с введением инравитреально Интерлейкина 1-b в дозе 2000 Ε в объеме 0.1 мл, затем - тромбоцитарного фактора роста PDGF АА остеосаркомы человека в дозе 2000 пкг/мл в объеме 0.1 мл.
Продолжительность эксперимента составила 1 мес. Через 1 мес кролик забит методом воздушной эмболии. Глаза энуклеировали, подвергали гистологическому исследованию: фиксация в 10% забуференном формалине, обезвоживание в спиртах восходящей крепости. Глаза вскрывали путем рассечения на 3 части. Центральную часть заливали в парафин. Серийные парафиновые срезы окрашивали гематоксилином и эозином, а также пикрофуксином по Ван-Гизону. При гистологическом исследовании отмечено округление клеток РПЭ, оголение мембраны Бруха, их диссоциация и активная миграция в стекловидное тело (фиг. 1), а также пролиферация клеток РПЭ на внутренней пограничной мембране (фиг. 2) с образованием новообразованных эпиретинальных мембран (фиг. 3).
Пример 2. Кролик №5. Моделирование: в оба глаза 3-х кратно инсталлировали с интервалом 3 минуты раствор Алкаина 0.5% (Alcon). Интравитреальную инъекцию проводили в оба глаза однократно последовательно. Через плоскую часть цилиарного тела на расстоянии 2.5 мм от лимба инсулиновой иглой 32G выполняли прокол с введением инравитреально Интерлейкина 1-b в дозе 2000 Ε в объеме 0.1 мл, затем - тромбоцитарного фактора роста PDGF АА остеосаркомы человека в дозе 2000 пкг/мл в объеме 0.1 мл.
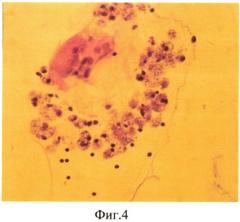
Продолжительность эксперимента составила 1 мес. Через 1 мес кролик забит методом воздушной эмболии. Глаза энуклеировали, подвергали гистологическому исследованию: фиксация в 10% забуференном формалине, обезвоживание в спиртах восходящей крепости. Глаза вскрывали путем рассечения на 3 части. Центральную часть заливали в парафин. Серийные парафиновые срезы окрашивали гематоксилином и эозином, а также пикрофуксином по Ван-Гизону. При гистологическом исследовании отмечена активная диссоциация клеток РЭ в стекловидное тело (фиг. 4). Метаплазия и пролиферация клеток РПЭ на внутренней пограничной мембране (фиг. 5), образование эпиретинальной мембраны на поверхности сетчатки (фиг. 6).
Таким образом, представленные примеры демонстрируют изменения, которые происходят в РПЭ и на поверхности сетчатки с началом образования эпиретинальных мембран, т.е. полученная модель ПВР является клинически и цитопатогенетически адекватной и может быть использована для определения эффективности антипролиферативного действия лекарственных препаратов.
Способ моделирования пролиферативной витреоретинопатии у кроликов, включающий однократное интравитреальное введение 2000 Ε Интерлейкина 1-b в объеме 0.1 мл, отличающийся тем, что последовательно интравитреально однократно вводят тромбоцитарный фактор роста PDGF АА остеосаркомы в объеме 0.1 мл с концентрацией 2000 пкг/мл.