Серосодержащие производные 2,6-диизоборнилфенола
Иллюстрации
Показать всеИзобретение относится к терпенофенолам. Получены новые серосодержащие производные 2,6-диизоборнилфенола формулы I, II и III:
n=0, m=0 (I)
n=1, m=0 (II)
n=1, m=2 (III)
Техническая задача - получение новых серосодержащих изоборнилфенолов. 4 табл.,4 пр.
Реферат
Изобретение относится к органической химии, к серосодержащим производным терпенофенолов.
В настоящее время среди антиоксидантов и стабилизаторов, используемых в промышленности, широкое распространение получили алкилированные фенолы. Прежде всего, это пространственно-затрудненные фенолы, что обусловлено их способностью эффективно ингибировать окислительную деструкцию широкого спектра органических соединений (от полимеров до липидов), возможностью изменять их свойства в широких пределах варьированием заместителей, малая токсичность позволяет применять их для стабилизации продуктов и материалов, контактирующих с человеком [Рогинский В.А. Фенольные антиоксиданты: Реакционная способность и эффективность. М.: Наука, 1988. 247 с.; Сорокина И.В., Крысин А.П., Хлебникова Т.Б., Кобрин B.C., Попова Л.Н. Роль фенольных антиоксидантов в повышении устойчивости органических систем к свободно-радикальному окислению: аналит. обзор, 1997 / СОРАН; ГПНТБ, Новосибирский ин-т орган. химии. Новосибирск, 1997. 68 с. (Сер. «Экология». Вып. 46); Харлампович Г.Д., Чуркин Ю.В. Фенолы. М., «Химия», 1974. 376 с.].
Терпенофенолы являются физиологически активными веществами [Kukovinets O.S., Zainullin R.A., Kislitsyn M.I. Chemistry of Natural Compounds. 2006. 42 (1), 1-15; Cirri M., Mura P., Corvi Mora P. Int. J. Pharm. 2007, 30, 84; Чукичева И.Ю., Буравлев Е.В., Федорова И.В., Борисенков М.Ф., Кучин А.В. Изв. АН. Сер. хим. 2010, 12, 2220-2224]. Показано, что 2,6-диизоборнил-4-метилфенол обладает комплексным влиянием на гемореологию, сосудисто-тромбоцитарный гемостаз и антиоксидантной, нейропротекторной и ретинопротекторной активностью, поэтому данное соединение перспективно при создании лекарственных средств для профилактики и терапии тромбофилических состояний, синдрома повышенной вязкости крови и эндотелиальной дисфункции при сердечно-сосудистых заболеваниях и сахарном диабете [RU №2347561. опубл. 27.02.2009. Бюл. №6; №2351321. опубл. 10.042009. Бюл. №10; №2406488, 20.12.2010; №2406487, 20.12.2010]. Для производных изоборнилфенолов известна противовоспалительная активность [И.Ю. Чукичева, И.В. Федорова, Е.В. Буравлев, А.Е. Лумпов, Ю.Б. Вихарев, Л.В. Аникина, В.В. Гришко, А.В. Кучин. Химия природ, соедин. 402 (2010); E.V. Buravlev, I.Yu. Chukicheva, K.Yu. Suponitsky, Yu.B. Vikharev, V.V. Grishko, A.V. Kutchin, Lett. Org. Chem. 8. 301 (2011)].
Введение функциональных групп в молекулу фенола позволяет расширять спектр применимости фенольных антиоксидантов и увеличивать их эффективность. Структурной основой группы заявляемых соединений является 2,6-диизоборнил-фенол формулы (1), относящийся к классу диалкилированных фенолов. Ближайшими аналогами заявляемых соединений являются производные 3,5-диалкил-4-гидроксибензильного ряда.
Соединения подобного типа - тио(амино)производные 3,5-ди-трет-бутил-4-гидроксибензильного ряда и серосодержащие эфиры 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовой кислоты - используются на практике в качестве серосодержащих антиоксидантов [Л.П. Овчинникова, У.Н. Роцкая, Е.А. Васюнина, О.И. Синицина, Н.В. Кандалинцева, А.Е. Просенко, Г.А. Невинский. Биоорганическая химия. 2009, 35, №3, 417-423; Просенко А.Е., Терах Е.И., Горох Е.А., Никулина В.В., Григорьев И.А. Журнал прикладной химии. 2003, №2 (76), 256-260].
В патенте [Просенко А.Е., Гросс М.А., Кандалинцева Н.В., Толстикова Т.Г., Сорокина И.В. / патент RU 2 447 888] описан (3,5-диметил-4-гидрокси)бензилтиододекан как средство для коррекции цитотоксических эффектов паранеопластических процессов и химиотерапии, обладающее противоопухолевой активностью. В работах [Amorati R., Fumo M.G., Menichetti S., Mugnaini V., Pedulli G.F. Electronic and Hydrogen Bonding Effects on the Chain-Breaking Activity of Sulfur-Containing Phenolic Antioxidants // J. Org. Chem. 2006. Vol. 71. P. 6325-6332; Кемелева Е.А., Васюнина Е.А., Синицина О.И., Хомченко А.С., Гросс М.А., Кандалинцева Н.В., Просенко А.Е., Невинский Г.А. Новые перспективные антиоксиданты на основе 2,6-диметилфенола // Биоорганическая химия. 2008. Т. 34. №4. С. 558-569; Олейник А.С., Куприна Т.С., Певнева Н.Ю., Марков А.Ф., Кандалинцева Н.В., Просенко А.Е., Григорьев И.А. Синтез и антирадикальная активность гидроксиарилпропилтиосульфонатов и сульфонатов натрия // Известия академии наук. Серия химическая. 2007, №6, 1094-1101] представлены соединения класса серосодержащих диалкилфенолов, методы их синтеза и антиоксидантные свойства.
Описания заявляемых соединений и их свойств в источниках информации не обнаружено. Технической задачей, на решение которой направлено предлагаемое изобретение, является получение новых серосодержащих изоборнилфенолов формулы I, II и III.
Для решения поставленной задачи получены новые серосодержащие производные 2,6-диизоборнилфенола формулы I, II и III:
n=0, m=0 (I)
n=1, m=0 (II)
n=1, m=2 (III)
Заявляемые соединения представляют интерес в качестве антиоксидантов, а также как фармакологические субстанции.
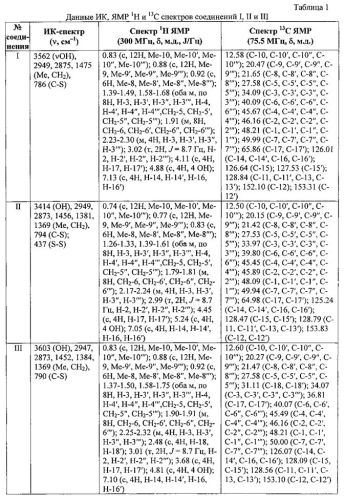
Синтез заявляемых соединений проводили по известным методикам. Структура полученных соединений подтверждена методами ИК- и ЯМР-спектроскопии. ИК спектры записывали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в таблетках с KBr. Спектры ЯМР 1Н и 13С регистрировали на приборе «Bruker Avance II 300» (рабочая частота 300 и 75 МГц) в CDCl3. Соединения формулы I, II и III представляют собой мелкокристаллические порошки. Указанные соединения хорошо растворимы в хлороформе, дихлорметане, этиловом спирте, бензоле, толуоле, диметилсульфоксиде, гексане, нерастворимы в воде.
Для тестирования антиоксидантной и мембранопротекторной активности заявляемых веществ проводили исследования гемолиза эритроцитов в условиях окислительного стресса, индуцируемого пероксидом водорода [Ko, F.N., Hsiao, G., Kuo, Y.H. Protection of oxidative hemolysis bydemethyl diisoeugenol in normal and b-thalassemic red blood cells // Free Radic. Biol. Med. 1997. V. 22. P. 215-222; Lopez-Revuelta A., Sanchez-Gallego J.I., Hermandez-Hernandez A., Sanchez-Yague J., Llanillo M. Membrane cholesterol contents influence the protective effects of quercetin and rutin in erythrocytes damaged by oxidative stress // Chem. Biol. Interact. 2006. V. 161. P. 79-91; Banerjee A., Kunwar A., Mishra В., Priyadarsini K.I. Concentration dependent antioxidant/proxidant activity of curcumin studies from AAPH induced hemolysis of RBCs. Chem. Biol. Interact. 2008. 174 (2), 134-139; Takebayashi J., Chen J., Tai A. A method for evaluation of antioxidant activity based on inhibition of free radical-induced erythrocyte hemolysis. Adv. Protocols in Oxidative Stress, Meth. Mol. Biol. 2010. 594, P. 287-296].
Сущность предлагаемого решения и возможность его осуществления подтверждается примерами, результатами физико-химических и биологических исследований, приведенных в таблицах 1-4.
Пример 1. Бис[(3,5-диизоборнил-4-гидроксифенил)метил]сульфид (соединение I). Соединение получено на основе 2,6-диизоборнил-4-бромометилфенола по известной методике [А.Е. Prosenko, Е.I. Terakh, Е.А. Gorokh, V.V. Nikulina, and I.A. Grigor′ev. Synthesis and Antioxidant Properties of Bis[ω-(3,5-dialkyl-4-hydroxyphenyl)alkyl] Sulfides // Russian Journal of Applied Chemistry. Vol. 76, No. 2, 2003, pp. 248-252].
Выход 83%. Порошок бледно-розового цвета, т.пл. 253-255°C; Rf=0.60 (элюент: петролейный эфир-диэтиловый эфир (10:1)). Спектральные характеристики соединения I приведены в таблице 1.
Пример 2. Бис[(3,5-диизоборнил-4-гидроксифенил)метил]дисульфид (соединение II), синтезирован по известной методике через S-[(3,5-диизоборнил-4-гидроксифенил)метил]изотиурония бромид [Кандалинцева Н.В., Просенко А.Е., Дюбченко О.И., Стоянов Е.С. Синтез галогенидов S-алкилизотиурония по реакции тиомочевины с ω-(4-гидроксиарил)галогеналканами // Журн. орг. химии. 2001. №9 (37). С. 1317-1320; Хомченко А.С. Серосодержащие производные на основе 3-(4-гидрокси(метокси)арил)-1-галогенпропанов и 2,6-диметилфенола: синтез и антиокислительная активность: дис. канд. хим. наук / НГПУ. Новосибирск, 2010. 164 с.]. Выход 87%. Бесцветный порошок, т.пл. 252.3°C с разложением. Rf=0.64 (элюент : петролейный эфир-диэтиловый эфир (10:1)). Спектральные характеристики соединения II приведены в таблице 1.
Пример 3. 1,2-Бис[(3,5-диизоборнил-4-гидроксифенил)метилтио]этан (соединение III) получен на основе 2,6-диизоборнил-4-бромометилфенола по стандартной методике. К 0.2 г (0.5 ммоль) 2,6-диизоборнил-4-бромометилфенола, растворенного в 5 мл ацетона, при перемешивании прибавляли 0.02 мл (0.2 ммоль) (CH2SH)2 и 0.07 мл (0.5 ммоль) Et3N. Процесс вели при кипячении и перемешивании в течение 7 часов. Далее реакционную смесь охлаждали и отгоняли при пониженном давлении. К остатку добавляли петролейный эфир, после чего выпадал осадок белого цвета (C2H5)3N·HBr. Осадок фильтровали и промывали диэтиловым эфиром. Растворитель отгоняли при пониженном давлении. Выход 68%. Бесцветный порошок, т.пл. 241.7-244.1°C. Rf=0.74 (элюент : петролейный эфир-диэтиловый эфир (10:1)). Спектральные характеристики соединения III приведены в таблице 1.
Пример 4. Исследование антиоксидантной и мембранопротекторной активности и токсичности заявляемых соединений.
Для оценки токсичности, антиоксидантной и мембранопротекторной активности соединений использовали 0.5% (v/v) суспензию эритроцитов лабораторных мышей в фосфатно-солевом буфере (PBS, pH 7.4). Исследуемые вещества предварительно растворяли в ацетоне. Токсичность соединений оценивали (in vitro) по их способности индуцировать гемолиз. Растворы соединений вносили в суспензию эритроцитов и инкубировали при 37°C в течение 5 ч в термостатируемом шейкере Biosan ES-20 (Латвия). Контрольные образцы содержали соответствующий объем ацетона. О наличии цитотоксичности судили по степени гемолиза эритроцитов через 1, 3 и 5 ч инкубации.
Мембранопротекторную и антиоксидантную активность определяли по степени ингибирования Н2О2-индуцированного гемолиза, торможения накопления вторичных продуктов ПОЛ и окисления оксигемоглобина в эритроцитах. С этой целью спустя 30 мин после внесения в суспензию эритроцитов растворов исследуемых соединений инициировали гемолиз раствором пероксида водорода (0.006%). Затем реакционную смесь инкубировали в термостатируемом шейкере при медленном перемешивании и 37°C в течение 5 ч. В качестве эталона сравнения использовали ионол. Каждый час из инкубационной среды отбирали аликвоту, центрифугировали 5 мин (1600 g), степень гемолиза определяли по содержанию гемоглобина в супернатанте на спектрофотометре ThermoSpectromic Genesys 20 (США) при λ 524 нм (Takebayashi, 2010). Процент гемолиза рассчитывали по отношению к полному гемолизу образца (Costa, 2009; Wang, 2010). Содержание вторичных продуктов ПОЛ, реагирующих с 2-тиобрабитуровой кислотой (ТБК-АП), определяли спектрофотометрически (Asakawa, 1980). Для оценки накопления продуктов окисления гемоглобина анализировали спектр поглощения в интервале длин волн 540-640 нм. Содержание различных форм гемоглобина (oxyHb, metHb и ferrylHb) рассчитывали с учетом соответствующих коэффициентов экстинкции (Van den Berg, 1992). Каждый эксперимент проводили в 5-6 повторностях. Статистическую обработку данных осуществляли с помощью пакета программ Microsoft Office Excel 2007.
Результаты экспериментов приведены в таблицах 2-4.
В результате эксперимента показано, что все исследованные соединения в концентрации 10 мкМ не обладали выраженной токсичностью по отношению к эритроцитам - уровень гемолиза спустя 5 ч инкубации лишь незначительно превышал спонтанный (табл.2). Оценка мембранопротекторной активности на модели Н2О2-индуцированного гемолиза эритроцитов показала, что к числу высокоактивных соединений можно отнести соединение II, ингибирующее H2O2-индуцированный гемолиз на уровне ионола, несколько меньшей активностью отличалось соединение III (табл. 3). Соединения II и III в концентрации 10 мкМ не только препятствуют гибели клеток, но и ингибируют H2O2-индуцированное окисление мембранных липидов и основного белка эритроцитов - гемоглобина (табл. 4), что свидетельствует о наличии выраженных антиоксидантных свойств у данных соединений.
Новые серосодержащие производные 2,6-диизоборнилфенола формулы I, II и III: n=0, m=0 (I);n=1, m=0(II);n=1, m=2(III).