Способ пластики магистральных сосудов почек в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, сосудистой хирургии. Выполняют закрытие дефекта аутотрансплантатом. При этом в качестве аутотрансплантата используют лоскут слизистой щеки, соразмерный по величине дефекту. Лоскут пришивают «край в край» прерывным узловым швом с краем сосуда. Способ позволяет сократить время закрытия дефекта, снизить число осложнений, связанных с кровопотерей, предотвратить несостоятельность шва и образование стриктур. 8 ил.
Реферат
Изобретение относится к медицине, сосудистой хирургии, может быть использовано для пластики магистральных сосудов у экспериментальных животных.
Известен способ пластики кровеносных сосудов, заключающийся в закрытии дефекта аорты или магистральных артерий трансплантатом из вены пуповины человека, который закрепляют на области дефекта обвивным швом из шелковой или синтетической нити. Однако данный способ имеет следующие недостатки: необходимо полное выделение сосуда в экстремальных условиях, наличие консервированного трансплантата, частое образование аневризм в месте анастомоза или прорезывание швов с последующим кровотечением, что чревато геморрагическим шоком или летальным исходом [1].
Известен способ протезирования ветвей почечной артерии с использованием внутренней подвздошной артерии [2]. Техника операции заключается в следующем. Сосуды почки пересекают с сохранением максимально возможной длины. Накладывают дистальные анастомозы ветвей почечной артерии с ветвями внутренней подвздошной артерии "конец в конец" с одновременным проведением трансартериальной гипотермической перфузии /Т8-12С/. Выполняют проксимальный анастомоз ствола внутренней подвздошной артерии с аортой "конец в бок", сшивают почечную вену.
Недостатками этого способа являются ограниченность использования внутренней подвздошной артерии в связи с сочетанными поражениями почечных артерий и подвздошно-бедренных сегментов, функциональной значимостью в кровоснабжении нижней конечности и органов таза, большая травматичность и удлинение времени операции.
Также известен способ пластики почечной артерии U-образным венозным трансплантатом [3]. Техника заключается в следующем. Выполняют забор большой подкожной вены бедра с притоком, выделяют почечную артерию, осуществляют ее резекцию, инверсионно аутовену анастомозируют с ветвями почечной артерии "конец в конец" после разрушения венозных клапанов, накладывают проксимальный анастомоз ствола большой подкожной вены с аортой "конец в бок".
Однако известный способ имеет значительные ограничения при его осуществлении из-за трудностей в подборе U-образного трансплантата и его вшивании. Кроме того, наличие венозных клапанов, разрушаемых в период подготовки аутотрансплантата для пластики почечной артерии, усложняет выполнение операции и не гарантирует от осложнений в послеоперационном периоде, связанных с недостаточно полным разрушением клапанов и травматизацией интимы.
Наиболее близким по технической сущности является способ пластики сонной артерии, заключающийся в замещении дефекта с помощью аутотрансплантата, выкроенного из височного апоневроза. Однако данный способ имеет недостатки: необходимо дополнительное время для выкраивания лоскута из височного апоневроза, полное выделение сосуда в условиях обильного кровотечения, частое тромбирование сосудистой конструкции по причине контакта тромбоцитов с инородной поверхностью трансплантата, рубцовое сужение сосуда [4].
Новый технический результат - сокращение времени закрытия дефекта, снижение числа осложнений, связанных с кровопотерей, несостоятельностью шва, образованием стриктур, тромбированием сосудов.
Для достижения нового технического результата в способе пластики магистральных сосудов, включающем закрытие дефекта аутотрансплантатом, закрывают дефект лоскутом слизистой щеки, соразмерным по величине дефекту, при этом лоскут сшивают «край в край» прерывным узловым швом с краем сосуда.
Для подтверждения осуществления изобретения при указанном выше техническом результате проведены испытания на 17 беспородных кроликах весом 4500-5200 кг.
Операцию проводили в одно и то же время суток натощак. В качестве вводного и базисного наркоза применяли Золетил 0.2 мл, Ксилавет 0.4 мл внутривенно. Эксперимент проводили на абдоминальном отделе аорты, а именно: заброшенным доступом слева выделяли аорту в нижней ее трети. Остроконечным скальпелем наносили разрез по передней стенке аорты длиной, как и поперечный, так и продольный, диаметром от 1.5 до 2 мм. Заранее приготовленный лоскут слизистой щеки размером, не превышающим площадь дефекта в аорте, накладывали на сосуд.
Лоскут пришивали край в край прерывным узловым швом, после чего кровоток восстанавливался через 15-20 секунд. После остановки аортального кровотечения и тщательного гемостаза рану ушивали послойно наглухо. В ближайшем послеоперационном периоде (до 10 суток) осложнений не наблюдалось. Кормить начинали на вторые сутки.
Животных выводили из эксперимента в различные сроки после пластики кровеносных сосудов. Повторную операцию осуществляли под внутривенным наркозом Золетил 0.2 мл, Ксилавет 0.4 мл. После срединной лапаротомии производили резекцию терминального отдела брюшной аорты, отступали 8-10 мм дистально и проксимально от сосудистой конструкции из лоскута слизистой щеки. Забор материала осуществляли через 1, 2, 4, 6 месяцев от момента сосудистой пластики. Резецированную аорту помещали в раствор формалина с последующей окраской препаратов гематоксилин-эозином, по ван-Гизону, орсеином, серебром.
Результаты представлены на Фиг. 1-8.
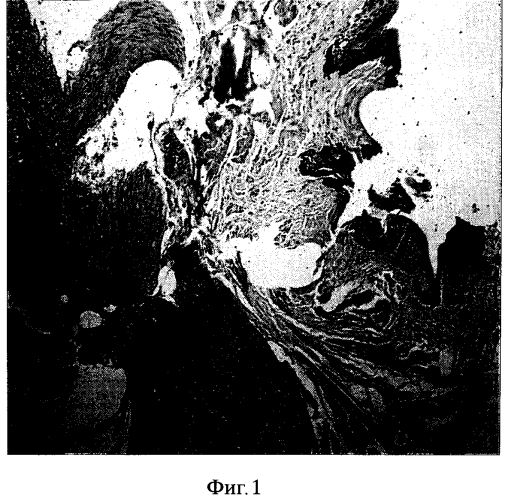
Фиг. 1. Окраска гематоксилином и эозином. Ув. XI50. (2 месяца после операции) В области дефекта стенки аорты определяется подшитый участок слизистой оболочки щеки с подслизистой основой с умеренно выраженным фиброзом и слабой неравномерной лимфоцитарной инфильтрацией. В пласте многослойного плоского неороговевающего эпителия выявляется гиперплазия клеток базального слоя. Морфологические признаки воспалительного процесса отсутствуют.
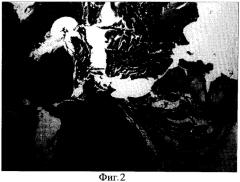
Фиг. 2. Окраска по Ван-Гизону. Ув. XI50. Фрагмент того же участка - определяется зрелая волокнистая соединительная ткань в подслизистой основе щеки, ярко окрашенная в интенсивный малиновый цвет. В зоне оперативного вмешательства в стенке сосуда также обнаруживается фиброз.
Фиг. 3. Окраска гематоксилином и эозином. Ув. XI50. (4 месяца после операции) В зоне оперативного вмешательства определяется созревающая отечная грануляционная ткань, богатая новообразованными сосудами капиллярного типа с неравномерной умеренно выраженной лимфогистиоцитарной и макрофагальной инфильтрацией. В правом нижнем углу препарата обнаруживаются неизмененные гладкомышечные элементы мышечной пластинки слизистой оболочки щеки.
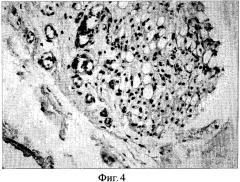
Фиг. 4. Окраска гематоксилином и эозином. Ув. Х400. (6 месяцев после операции) В адвентиции аорты обнаруживается созревающая грануляционная ткань с обилием капилляров, заполненных эритроцитами и отечной нежноволокнистой стромой с наличием лимфогистиоцитарных элементов, плазмоцитов и единичных лейкоцитов. Также заметны признаки регенерации жировой ткани в виде образования липобластов различного размера.
Фиг 5-7. СКТА проводили через 5 месяцев после операции.
СКТА грудной и брюшной аорты выполнено на фоне ручного введения урографина в дозе 4 мл толщиной среза до 1,5 мм. Уровни сканирования: от дуги аорты до подвздошных артерий. Положение: на спине. Скорость введения рассчитать затруднительно, введение выполнено ручным способом.
Аорта в восходящей дуге с четкими и ровными контурами диаметром до 8 мм, расположена типично. Дуга аорты диаметром до 6 мм, нисходящяя часть дуги аорты до 6 мм в диаметре.
Грудная аорта диаметром до 5 мм, прослеживается на всем протяжении до диафрагмы, стенозов и деформации контуров стенки не выявлено.
Брюшная аорта диаметром до 5 мм, прослеживается на всем протяжении без признаков наличия стенозов или аневризматических расширений.
Нижняя полая вена контрастировала хорошо, не расширена, диаметром до 4-6 мм, дефектов наполнения не выявлено, контуры ровные.
Исследование проведено через 6 месяцев после операции.
Фиг. 8. МРА аорты выполнена 29.05.2013 с болюсным контрастным усилением омнисканом в дозе 0,2 ммоль/мл (1,6 мл). Получены три фазы прохождения парамагнетика в режиме 3DFFE толщиной среза до 1,4 мм с интерполяцией. Кроме того, получены Т2 ВИ в сагиттальной проекции толщиной до 3 мм. Исследование выполнено в положении на спине.
На полученных ангиограммах визуализирован нисходящий отдел грудной аорты, брюшная аорта и начальные отделы подвздошных артерий. Грудная аорта диаметром до 4 мм с четкими и ровными контурами без признаков наличия в просвете дефектов, стенотических или аневризматических изменений.
Просвет верхнего отдела брюшной аорты с четкими и ровными контурами диаметром до 3-4 мм, в просвете дефектов усиления, стенозов или аневризматических расширений не выявлено.
Контрастное усиление просвета грудной и верхнего отдела брюшной аорты снижено, имеется артефакт от раннего сбора данных.
Начиная от уровня передней брыжеечной артерии, контрастное усиление удовлетворительное, четко определяются устья почечных артерий, их просветы диаметром 2-3 мм прослеживаются на всем протяжении до почечных синусов с обеих сторон. Нижний отдел брюшной аорты имеет минимальные гемодинамически незначимые дефекты по передней и левой боковой поверхности.
Подвздошные артерии не изменены. Таким образом, преимущество предлагаемого способа пластики артериального сосуда с помощью трансплантата из лоскута слизистой щеки заключается в следующем.
1. Повышается скорость закрытия дефекта.
2. Достигается полная остановка кровотечения из пораженного сосуда в течение 20-30 секунд.
3. Слизистая щеки представляет собой многослойный плоский эпителий. Она устойчива к растяжению и разрыву за счет большого количества соединительных связей и Lamina Propria и эпителием слизистой. Имеет благоприятные иммунологические свойства, резистентность к инфекциям.
6. Постоянная доступность, легкость забора лоскута. При надежном закреплении исключает деформацию сосуда.
Источники информации, принятые во внимание при составлении описания
1. Патент РФ №2099016, опубл. 20.12.1997. «Способ пластики кровеносных сосудов».
2. Kuestner L.М., Stoney R.J. The case for renal revascularization // Cardiovascular Surgery, 1995, vol. 3, N 2, p.141-154.1 Способ протезирования ветвей почечной артерии с использованием внутренней подвздошной артерии.
3. Novick A.C., Straffon R.A. Aortorenal Bypass with a Broached Saphenous Vein Graft for Renal Artery Disease Extending into this Branches // Surgery, 1979, vol. 85, N 2, p. 225-229. Способ пластики почечной артерии U-образным венозным трансплантатом.
4. Патент SU 935084, опубл 15.06.1982.
Способ пластики магистральных сосудов, включающий закрытие дефекта аутотрансплантатом, отличающийся тем, что закрывают дефект лоскутом слизистой щеки, соразмерным по величине дефекту, при этом лоскут сшивают «край в край» прерывным узловым швом с краем сосуда.