Способ профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для химиопрофилактики канцерогенеза печени и пищевода у экспериментальных животных. Способ включает введение диэтилнитрозамина с питьем в дозе 100 мг/л в течение 4 месяцев. В качестве химиопрофилактического средства применяют полисахариды аира болотного в течение 6 месяцев с пищей в дозе 75 мг/кг. Заявленный способ высокоэффективен для профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных. 7 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к экспериментальной медицине, а именно к экспериментальной онкологии, и может быть использовано для профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных. Способ обеспечивает значительное снижение канцерогенного действия диэтилнитрозамина, которое проявляется в снижении частоты возникновения неопластических изменений в ткани печени, пищевода, а также обеспечивает увеличение продолжительности жизни и выживаемости животных за счет снижения уровня перекисного окисления липидов и увеличения активности антиоксидантных ферментов.
Изобретение относится к профилактической медицине, экспериментальной онкологии, фармакологии и может быть использовано при гепатоканцерогенезе с профилактической целью в группах повышенного риска по заболеваемости раком печени и пищевода.
Неуклонный рост заболеваемости злокачественными новообразованиями делает все более актуальной проблему их профилактики, т.е. проблему разработки и применения средств, препятствующих неопластической трансформации клеток и дальнейшему развитию опухолей [Sporn М.В. Suh N., 2000]. Причиной злокачественного роста могут быть канцерогенные нитрозосоединения [N-Nitroso Compounds: Occurrence and Biological Effects and Relevance to Human Cancer - Eds. I.K. O′Nei, R.C. von Borstsel, C.T. Miller, J. Long and H. Bartsch 1988]. В связи с этим возникла необходимость способов профилактики канцерогенного действия нитрозосоединений на организм человека. Известны способы предупреждения возникновения доброкачественных и злокачественных опухолей, индуцируемых канцерогенными нитрозосоединениями, при помощи веществ, влияющих на разные этапы бластомогенного процесса: эндогенное образование канцерогенов, в частности нитрозосоединений, из неканцерогенных предшественников в организме, процессы метаболизма канцерогенов в организме, взаимодействие химических канцерогенов с ДНК, опухолевую трансформацию поврежденных канцерогеном клеток и дальнейшее развитие бластомогенного процесса.
Значительное количество работ посвящено изучению антиканцерогенных свойств естественных антиоксидантов (витамины E, C, P, бета-каратин) и синтетических (бутилгидрокситолуол и др.). Установлено, что в процессе гепатоканцерогенеза происходит интенсификация процессов перекисного окисления, протекающих, в частности, в липидах, и образование свободных радикалов [Туровецкий В.Б., Ситковский М.В. и соавт., 1974]. Доказано, что нарушение равновесия в системе перекисное окисление липидов - антиоксидантная защита, приводящее к накоплению свободных радикалов, является одной из причин запуска злокачественной трансформации и опухолевой прогрессии [Якубовский Р.И., 2000]. Исходя из представлений об участии свободных радикалов в механизме канцерогенеза ряд исследователей пытались использовать антиоксиданты в качестве ингибиторов бластомогенеза [Джиоев Ф.К. 1984; Sporn М.В. Suh N., 2000].
Наиболее близким является способ [Джиоев Ф.К. Влияние селена, фенобарбитала, тетурама и четыреххлористого углерода на канцерогенное действие диэтилнитрозамина и 1,2-диметилгидрозина. // Материалы III-го симп.: «Канцерогенные N-нитрозосоединения-действие, синтез, определение». Таллинн. - 1978. - с. 51-53] химиопрофилактики рака в эксперименте, предупреждая возникновение опухолей и супрессии печеночного канцерогенеза, индуцированного диэтилнитрозамином, дачу которого осуществляли с питьем в дозе 100 мг/л в течение первых 4 месяцев, с профилактической целью использовали селенисто-кислый натрий в дозе 6 ppm/л воды в течение 6 месяцев, который был взят нами за прототип.
Недостатком прототипа является: токсичность селенита натрия в высоких дозах, нецелесообразность его применения в регионах с высоким содержанием селена в воде, почве и пищевых продуктах, сроки введения были сокращены.
Заявляемое изобретение направлено на решение задачи, заключающейся в разработке способа профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных.
Решение этой задачи обеспечивает значительное снижение канцерогенного действия диэтилнитрозамина, что выражается в достоверном снижении частоты возникновения неопластических изменений в тканях печени, множественности новообразований пищевода. Более поздней малигнизации в печени и пищеводе в опытной группе по сравнению с контрольной, увеличение продолжительности жизни и выживаемости животных, снижение уровня перекисного окисления липидов, увеличение активности антиоксидантных ферментов - в том числе каталазы.
Для достижения этого технического результата заявляемое изобретение - способ профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных - имеет следующие существенные признаки: животным ежедневно вводят с кормом антиканцероген-полисахариды аира, осажденные 96% этиловым спиртом, в дозе 75 мг/кг в течение 6 месяцев, а диэтилнитрозамин в дозе 100 мг/л воды - через 3 дня от начала введения полисахаридов аира болотного, в течение 4 месяцев.
Заявляемый способ отличается от прототипа тем, что в качестве антиканцерогена используется препарат из полисахаридов аира, осажденных 96% этиловым спиртом, который ведет к торможению бластомогенного процесса в печени и пищеводе, увеличению продолжительности жизни и выживаемости животных, снижению уровня перекисного окисления липидов, увеличению активности антиоксидантных ферментов. Заявляемый способ является эффективным, экономически выгодным и легко воспроизводимым.
По имеющимся у авторов сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, неизвестна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
По мнению авторов сущность заявляемого изобретения не следует для специалистов явным образом из известного уровня медицины, так как из него не выявляется вышеуказанная возможность получение способа профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных, включающий введение диэтилнитрозамина с питьем и антиканцерогена с кормом, отличающийся тем, что в качестве антиканцерогена вводят полисахариды аира, осажденные 96% этиловым спиртом, в дозе 75 мг/кг в течение 6 месяцев, а диэтилнитрозамин в дозе 100 мг/л воды через 3 дня от начала введения полисахаридов аира болотного, в течение 4 месяцев, что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть многократно использована в медицине с получением результата, заключающегося в эффективном и легко воспроизводимом способе профилактики токсического действия диэтилнитрозамина путем приема препарата из полисахаридов аира болотного, осажденных 96% этиловым спиртом, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Данный способ осуществляется следующим образом. Опухоли печени и пищевода индуцировали добавлением к питьевой воде диэтилнитрозамина (ДЭНА) в концентрации 100 мг/л в течение первых 4 месяцев. Раствор ДЭНА давали контрольной и опытной группам. За 3 дня до начала дачи канцерогена животным опытной группы начинали вводить с кормом ежедневно препарат из полисахаридов аира болотного, осажденных 96% этиловым спиртом, в дозе 75 мг/кг массы тела. По истечении времени эксперимента (6 месяцев) проводили макроскопическое исследование внутренних органов, гистологическое исследование тканей печени и пищевода. Полученные результаты в контрольной и опытной группах сравнивали. Также оценивали интенсивность процессов ПОЛ по накоплению вторичных продуктов липидной пероксидации, основным из которых является малоновый диальдигид (МДА), а также определяли состояние антиоксидантной защиты (АОЗ) по уровню активности фермента каталазы.
Для гистологических исследований образцы тканей (печени и пищевода) фиксировали в 10% формалине, после чего подвергали заливке в парафиновые блоки с последующим приготовлением срезов толщиной 7-8 микрон. Срезы окрашивались гематоксилином и эозином. Изучались под микроскопом.
Интенсивность процессов ПОЛ исследовали по накоплению вторичных продуктов липидной пероксидации, основным из которых является малоновый диальдигид (МДА). [Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Анализ методов определения ПОЛ в сыворотке крови по тесту тиобарбитуровой кислоты. // Вопросы мед. химии. 1981. №1. С 118-122]. Содержание МДА определяли спектрофотометрически в тесте с тиобарбитуровой кислотой с образованием триметинового комплекса с максимумом поглощения при 540 нм по методу Hunter Е.А. (1963), М / Uchiyama, М. Mihara (1978) в модификации Л.И. Андреевой и соавт. [Андреева Л.И., Кожемякина Л.А. Кишкун А.А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой. // Лабораторное дело. 1988. №11. с. 41-43]. Состояние антиоксидантной защиты (АОЗ) изучали по уровню активности ключевого антиоксидантного фермента - каталазы. Активность каталазы крови определяли фотометрически методом по Баху и Зубковой [Королюк М.А., Майорова И.Г. и соавт. Метод определения активности каталазы. // Лабораторное дело. №1. С. 16-19].
Сущность заявляемого способа подтверждается макроскопически и морфологически.
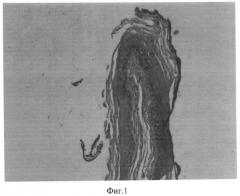
Фиг. 1. Полип пищевода.
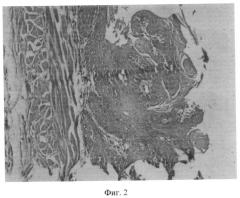
Фиг. 2 Плоскоклеточный рак пищевода с ороговением. Гемотоксилин - эозин. x120
Фиг. 3. Гепатоцеллюлярный рак. Гемотоксилин - эозин. x120
Фиг. 4. Гепатохалангиома. Гемотоксилин - эозин. x120
Пример. Опыты проведены на 55 крысах-самцах линии Вистар массой 170-200 г. животные были разделены на 2 группы: 25 крыс первой группы служили контролем и получали только канцероген; 30 крыс второй опытной группы наряду с канцерогеном получали препарат из полисахаридов аира, осажденных 96% этиловым спиртом, в дозе 75 мг/кг массы тела ежедневно с кормом на протяжении всего эксперимента. Продолжительность опыта составила 24 недели. По окончании эксперимента животных умерщвляли парами фторотана, соблюдая «Правила проведения работ с использованием экспериментальных животных», утвержденные Министерством здравоохранения РФ. Проводили вскрытие и макроскопическое исследование внутренних органов.
При анализе макроскопических изменений в печени и пищеводе крыс основывались на классификации опухолей лабораторных животных, предложенной Международным агентством по изучению рака [Pathology of tumors in laboratory animals. Vol. 1. Tumors of rat. Sekond adetion. Edited by V.S. Turusov and U. Mohr. - Lyon: IARC Scientific Publications №99. - 1990. - 750 р.]. Об эффективности модифицирующего воздействия на канцерогенез судили по изменению количества крыс с неопластическими процессами, среднего латентного периода возникновения новообразований, индекса множественности в опытной группе по сравнению с контролем.
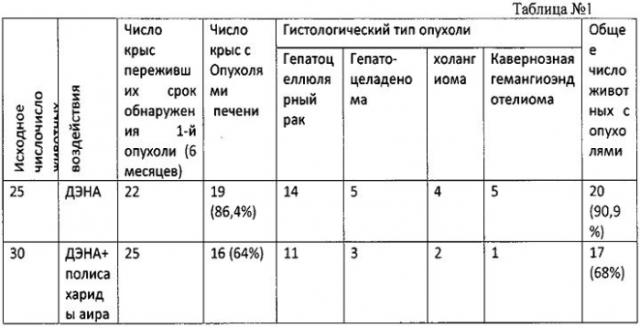
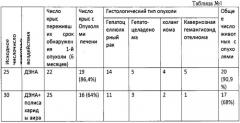
Результаты: в контрольной группе неопластические изменения в ткани печени обнаружены у 86,4% от эффективного числа животных (22 крыс). Первая крыса с предопухолевыми изменениями пала на 12 неделе эксперимента. Микроскопическое изучение ткани печени показало наличие гиперплазии протоков и очагов эозинофильно- и базафильноклеточной гиперплазии гепатоцитов (см. фиг. 4, 5). Злокачественные новообразования впервые были идентифицированы у четырех крыс контрольной группы, павших на 13 неделе опыта: высокодифференцированный гепатоцеллюлярный рак и холангиоцеллюлярный рак, развившийся на фоне цирроза и гиперплазии протоков и гепатоцитов. Суммарно при морфологическом анализе неопластических изменений у 14 крыс контрольной группы идентифицирован высоко-, умеренно- или низкодифференцированный гепатоцеллюлярный рак, у 5 крыс - гепатоцеллюлярная аденома, у 2-холангиоцеллюлярный рак, у 4 холангиома, у 5 кавернозная гемангиоэндотелиома. Вышеописанные процессы развились на фоне диффузных и очаговых гиперплазии гепатоцитов и протоков, а также церротических процессов разной степени выраженности (Табл. 1).
В группе животных, получавших полисахориды аира, неопластические изменения ткани печени обнаружены у 68,% от эффективного числа животных (25 крысы). Микроскопический анализ гистологического материала показал, что в данной группе в 12 случаях наблюдался гепатоцеллюлярный рак, у 3 гепатоцеллюлярная аденома, у 1 холангиокарценома, у 2 холангиома, у 1 кавернозная гемангиоэндотелиома, у 10 животных идентифицированна гиперплазия протоков.
Влияние полисахаридов аира на канцерогенное действие диэтилнитрозамина
(ДЭНА)
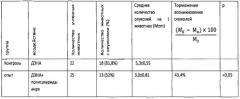
Опухоли пищевода (Табл. 2) развились у 81,8% крыс контрольной группы от эффективного числа животных (22 крысы), индекс множественности составил 5,3±0,55 опухоли на крысу. Во всех случаях опухоли располагались на слизистой оболочке пищевода и имели вид округлых образований диаметром 0,1-0,6 см. Гистологически новообразования классифицированы как папилломы с дисплазией и малигнизацией базальноклеточного типа, высокодифференцированный и низкодифференцированный плоскоклеточный рак. В группе животных, получавших полисахариды аира, новообразования пищевода развились у 52% крыс от эффективного числа животных (25 крыс) при индексе множественности 3,0±0,81, т.е. индекс множественности снижался в 1,8 раза, процент торможения составил - 43,4%.
Влияние полисахаридов аира на возникновение опухолей пищевода, индуцированных у крыс диэтилнитрозамином (ДЭНА)
В условиях проведенного эксперимента применение препарата из полисахаридов аира приводило к достоверному снижению частоты возникновения неопластических изменений в тканях печени, множественности новообразований пищевода, более поздней малигнизации в печени и пищеводе в опытной группе по сравнению с контрольной.
Изучение влияния полисахаридов айрана активность процессов перекисного окисления липидов (ПОЛ) и эффективности антиоксидантной защиты (АОЗ) - путем оценки каталазной активности проводились на 2, 4, 8, 12, и 16 неделях эксперимента. Так Определение показателей пероксидации липидов выявило достоверное повышение содержания малонового диальдегида (фиг 6), с одновременным ослаблением активности ферментов антиоксидантной защиты, наблюдалось снижение активности каталазы на 4 неделе, с последующим компенсаторным ее повышением на более поздних этапах канцерогенеза, как в группе животных получавших ДЭНА (в большей степени), так и в группе получавшей полисахариды аира болотного. (Фиг. 7)
Полученные результаты свидетельствуют о достоверном увеличении активности антиоксидантных ферментов в эритроцитах крыс опытной группы по сравнению с этими показателями у животных из группы «без воздействия». Таким образом, воздействие препарата восстанавливает интенсивность реакций свободно радикального окисления до значений соответствующих здоровому.
Таким образом, на основании полученных данных можно сделать вывод о том, что использование препарата из полисахаридов аира осажденных 96% этиловым спиртом привело к улучшению общего состояния животных, которое проявляется в снижении перекисного окисления липидов и увеличении антиоксидантной активности, уменьшении степени интоксикации. Полученные данные подтверждают высказанное целым рядом исследователей мнение о том, что нарушение баланса ПОЛ-АОЗ является одним из основных механизмов, способствующих прогрессированию злокачественного процесса.
Вследствие этого следует признать патогенетически обоснованным применение препаратов с антиоксидантной активностью при гепатоканцерогенезе [Александров В.А., Беспалов В.Г. Принципы и перспективы химиопрофилактики рака. // Вопросы онкологии. 1991. №4. С. 387-393.; Sporn М.В. Suh N. Chemoprevention of cancer. Carcinogenesis / 2000; 3:525-530]. В условиях проведенного эксперимента применение вышеуказанного препарата приводило к восстановлению нарушенного баланса в системе ПОЛ-АОЗ, перспективно с целью возможного снижения риска развития первичного рака печени и пищевода в группах повышенного риска.
Антиканцерогенная активность полисахаридов аира осажденных 96% этиловым спиртом, обусловлена, прежде всего, антиоксидантными свойствами, обеспечивающими защиту клетки от повреждающего действия свободных радикалов.
Способ химиопрофилактики канцерогенеза печени и пищевода у экспериментальных животных, включающий введение диэтилнитрозамина с питьем в дозе 100 мг/л в течение первых 4 месяцев и химиопрофилактического средства, отличающийся тем, что в качестве химиопрофилактического средства экспериментальным животным в течение 6 месяцев вводят полисахариды аира болотного с пищей в дозе 75 мг/кг.