Фармацевтическая дозированная форма для перорального введения ингибитора семейства bcl-2
Иллюстрации
Показать всеИзобретение относится к фармацевтической дозированной форме, которая включает продукт в виде твердой дисперсии, включающий N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино)-3-((трифторметил)-сульфонил)бензолсульфонамид или его соль, гидрат или сольват, по меньшей мере, один фармацевтически приемлемый полимер и, по меньшей мере, один фармацевтически приемлемый солюбилизатор. Изобретение также направлено на способ приготовления фармацевтической дозированной формы и применение дозированной формы при лечении пролиферативных нарушений. 3 н. и 15 з.п. ф-лы, 8 ил., 6 табл.7 пр.
Реферат
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США 61/185130, поданной 8 июня 2009 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической дозированной форме для перорального введения ингибиторов семейства Bcl-2, способу приготовления дозированной формы и способу лечения пролиферативных нарушений.
Уровень техники
Белки семейства Bcl-2, например, Bcl-2, Bcl-xL и Mcl-1, позволяют клеткам избегать апоптоза. Указанные белки вовлечены в рак и другие пролиферативные заболевания. Они часто апрегулированы в раковых клетках, в которых они блокируют и нейтрализуют проапоптотические белки, позволяя, таким образом, раковым клеткам выживать, несмотря на присутствие апоптоз-индуцирующих сигналов. Следовательно, ингибиторы семейства белков Bcl-2 являются полезными кандидатами для применения в противораковой терапии. Несколько ингибиторов были описаны, например, в WO 2007/040650.
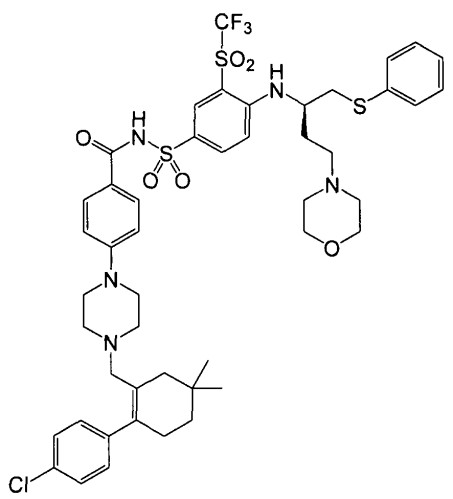
Предпочтительным ингибитором семейства Bcl-2 является N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)-пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенил-сульфанил)метил)пропил)амино)-3-((трифторметил)сульфонил)-бензолсульфонамид (ABT-263), получение которого описано в US 2007/0027135. Молекулярная структура ABT-263 представлена ниже:
К сожалению, кристаллические формы данных соединений характеризуются более или менее выраженной плохой растворимостью в водных жидкостях, что влияет на их скорость растворения и биодоступность. Мерой потенциальной ценности пероральной дозированной формы фармацевтического средства является биодоступность, наблюдаемая после перорального введения дозированной формы. При пероральном введении на биодоступность препарата могут влиять различные факторы. Указанные факторы включают растворимость в воде, адсорбцию препарата в желудочно-кишечном тракте, величину дозы и пресистемный метаболизм. Растворимость в воде является одним из наиболее важных факторов из перечисленных.
В силу ряда причин, таких как соблюдение пациентом режима приема препарата и маскирование вкуса, твердая дозированная лекарственная форма обычно более предпочтительна по сравнению с жидкой дозированной лекарственной формой. Однако в большинстве случаев твердые дозированные лекарственные формы препарата для перорального введения обеспечивают более низкую биодоступность по сравнению с растворами лекарственных средств для перорального введения.
Предпринимались попытки улучшить биодоступность, обеспечиваемую твердыми дозированными формами, посредством формирования твердых растворов лекарственных средств. Твердые растворы являются предпочтительными физическими системами, поскольку их компоненты с легкостью формируют жидкие растворы при контакте с жидкой средой, такой как желудочный сок. Легкость растворения может быть связана, по меньшей мере, частично, с тем фактом, что энергия, требуемая для растворения компонентов твердого раствора, меньше, чем требуется для растворения компонентов кристаллической или микрокристаллической твердой фазы. Впрочем, также важно, что лекарственное соединение, высвобождаемое из твердого раствора, остается солюбилизированным в водных жидкостях желудочно-кишечного тракта; иными словами, лекарственное соединение может осаждаться в желудочно-кишечном тракте, что приводит к низкой биодоступности.
В WO 01/00175 раскрыты механически стабильные фармацевтические дозированные формы, которые являются твердыми растворами активных компонентов в матрице вспомогательного вещества. Матрица содержит гомополимер или сополимер N-винилпирролидона и жидкое или полутвердое поверхностно-активное вещество.
В WO 00/57854 раскрыты механически стабильные фармацевтические дозированные формы для перорального введения, которые содержат, по меньшей мере, одно активное соединение, по меньшей мере, одно термопластичное формуемое, матрицаобразующее вспомогательное вещество, а также более 10% и до 40% по массе поверхностного-активного вещества, которое имеет показатель ГЛБ в пределах 2-18, является жидкостью при 20°C, или имеет температуру каплепадения в пределах от 20°C до 50°C.
В US 2005/0208082 раскрыта солюбилизирующая композиция, включающая смесь витамина Е TPGS и линолевой кислоты. Солюбилизирующая композиция применяется для диспергирования липофильного соединения в водной фазе. Липофильное соединение может быть терапевтически эффективным липофильным соединением, таким как липофильные витамины, кофермент Q10, каротиноиды, альфа-липоевые кислоты или незаменимые жирные кислоты.
В US 2005/0236236 раскрыты фармацевтические композиции для введения гидрофобных лекарственных средств, в особенности стероидов. Фармацевтические композиции включают гидрофобное лекарственное средство, производное витамина Е и сурфактант. В указанной ссылке заявлен синергический эффект между гидрофобным лекарственным средством и производным витамина Е.
Сущность изобретения
Из-за присутствия сульфанильной группы в молекулярной структуре, ABT-263 склонен к окислению до сульфоксидов, которые не обладают терапевтической активностью ABT-263. По этой причине жидкие растворы ABT-263 для перорального введения приготавливали непосредственно перед применением.
Авторы настоящего изобретения установили, что твердая дисперсия ABT-263 и, по меньшей мере, одного фармацевтически приемлемого полимера не только обладает достаточной биодоступностью после перорального введения, но также и приводит к стабильной при хранении, готовой к применению дозированной лекарственной формы. Совершенно неожиданно в твердой дисперсии молекула ABT-263, несмотря на ее по существу некристаллическое аморфное состояние, в значительной степени устойчива к окислению, даже в присутствии незначительного количества антиокислителя или в отсутствии антиокислителя. "По существу некристаллическое аморфное состояние" означает не более 5%, предпочтительно не более 2% кристалличности, согласно определению с помощью рентгеноструктурного анализа, и наиболее предпочтительно отсутствие обнаружимой кристалличности, по данным поляризационной микроскопии.
Изобретение относится к фармацевтической дозированной форме, которая содержит продукт в виде твердой дисперсии, включающей фармацевтически активный компонент, по меньшей мере, один фармацевтически приемлемый полимер и, по меньшей мере, один фармацевтически приемлемый солюбилизатор, где указанный фармацевтически активный компонент является N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)-метил)пропил)амино)-3-((трифторметил)сульфонил)-бензолсульфонамид, его солью, гидратом или сольватом.
Краткое описание фигур
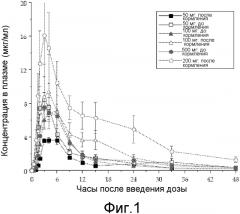
На Фиг.1 показана концентрация ABT-263 в плазме в разные моменты времени при введении в виде дигидрохлорида в лекарственной форме, содержащей Span 20 в качестве солюбилизатора, где лекарственную форму вводили перорально в дозах 50, 100 или 200 мг собакам до или после приема пищи.
На Фиг.2 показана концентрация ABT-263 в плазме в разные моменты времени при введении в виде дигидрохлорида в лекарственной форме, содержащей витамин E-TPGS в качестве солюбилизатора, где лекарственную форму вводили перорально в дозах 50, 100 или 200 мг собакам до или после приема пищи.
На Фиг.3 показана концентрация ABT-263 в плазме в разные моменты времени при введении в виде свободного основания в лекарственной форме, содержащей только витамин E-TPGS (лекарственная форма 13), или в виде дигидрохлорида в лекарственной форме, содержащей витамин E-TPGS плюс пропиленгликоль в качестве пластификатора (лекарственная форма 10), где лекарственную форму вводили перорально в дозе 50 мг собакам после приема пищи.
На Фиг.4 и Фиг.5 показаны результаты ускоренного теста на устойчивость с использованием открытых кювет, где содержание сульфоксидов в различных лекарственных формах ABT-263 определяли в различные моменты времени.
На Фиг.6 и Фиг.7 показаны результаты ускоренного теста на устойчивость с использованием закрытых флаконов, где содержание сульфоксидов в различных лекарственных формах ABT-263 определяли в различные моменты времени.
На Фиг.8 показано высвобождение ABT-263 из таблеток, содержащих различные композиции ABT-263.
Подробное описание
В дозированных формах согласно изобретению активный компонент присутствует в виде твердой дисперсии или в виде твердого раствора. Термин "твердая дисперсия" определяет систему в твердом состоянии (в противоположность жидкому или газообразному состоянию), включающую, по меньшей мере, два компонента, где один компонент равномерно диспергирован в другом компоненте или компонентах. Например, активный компонент или комбинация активных компонентов диспергированы в матрице, состоящей из фармацевтически приемлемого полимера (полимеров) и фармацевтически приемлемых солюбилизаторов. Термин "твердая дисперсия" охватывает системы, в которых мелкие частицы одной фазы, как правило, имеющие диаметр менее 1 мкм, диспергированы в другой фазе. Когда указанная дисперсия компонентов является такой, что система химически и физически однородна или гомогенна, или состоит из одной фазы (как определено в термодинамике), то такую твердую дисперсию называют "твердым раствором" или "стеклообразным раствором". Стеклообразный раствор представляет собой гомогенную, стеклообразную систему, в которой раствор диспергирован в стеклообразном растворителе. Стеклообразные растворы и твердые растворы являются предпочтительными физическими системами. Данные системы не содержат существенных количеств активных компонентов в их кристаллическом или микрокристаллическом состоянии, как подтверждается термическим анализом (ДСК) или рентгеноструктурным анализом (WAXS).
Дозированные формы согласно изобретению отличаются превосходной стабильностью и, в частности, демонстрируют высокую устойчивость к рекристаллизации или разложению активного компонента (компонентов).
Дозированные формы по настоящему изобретению демонстрируют характеристики высвобождения и абсорбции, которые отличаются высоким достигаемым значением AUC (площадь под кривой зависимости концентрации в плазме от времени с 0 до 48 часов или в других указанных временных интервалах), высоким достигаемым значением Cmax (максимальная концентрация в плазме) и низким Tmax (время достижения максимальной концентрации в плазме).
Термин "AUC" означает "площадь под кривой" (от англ. Area Under the Curve) и используется в своем стандартном значении, то есть, как площадь под кривой зависимости концентрации в плазме от времени. "AUC0-48" и "AUC0-24" относятся к площади под кривой зависимости концентрации в плазме от времени в интервале 0-48 часов или 0-24 часа, соответственно.
Дисперсия, сформированная после контакта с водной жидкостью, также может применяться, как есть, например, в виде жидкой дозированной формы для перорального введения или растворов для парентеральной инъекции.
Как правило, продукт в виде твердой дисперсии включает:
• от приблизительно 0,5 до 40% по массе, предпочтительно от приблизительно 1 до 25% по массе, ABT-263,
• от приблизительно 40 до 97,5% по массе, предпочтительно приблизительно от 50 до 94% по массе, указанного, по меньшей мере, одного фармацевтически приемлемого полимера,
• от приблизительно 2 до 20% по массе, предпочтительно приблизительно от 5 до 20% по массе, указанного, по меньшей мере, одного солюбилизатора, и
• от приблизительно 0 до 15% по массе, предпочтительно от приблизительно 0 до 10% по массе, добавок.
Ввиду того, что дозированная форма изобретения может состоять полностью из продукта в виде твердой дисперсии, при включении продукта в виде твердой дисперсии в дозированные формы обычно используются добавки и адъюванты. Как правило, дозированная форма включает, по меньшей мере, 10% по массе, предпочтительно, по меньшей мере, 40% по массе, и наиболее предпочтительно, по меньшей мере, 45% по массе, продукта в виде твердой дисперсии, основанного на полном весе твердой дозированной формы.
Как правило, единичная дозированная форма изобретения содержит эквивалент от приблизительно 50 мг до приблизительно 1000 мг, предпочтительно от приблизительно 75 мг до приблизительно 600 мг, в особенности от приблизительно 100 мг до приблизительно 500 мг ABT-263.
Дозированная форма согласно изобретению включает ABT-263 или комбинацию ABT-263 с одним или более другими ингибиторами семейства Bcl-2. Дозированная форма может включать комбинацию ABT-263 и, по меньшей мере, одного другого активного компонента.
ABT-263 может существовать в виде солей присоединения кислоты, солей присоединения основания или цвиттер-ионов. Соли ABT-263 получают в процессе их выделения или после их очистки. Соли присоединения кислот являются солями, полученными в результате реакции ABT-263 с кислотой. Соответственно, предполагается, что соли, включающие ацетат, адипат, альгинат, бикарбонат, цитрат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, формиат, фумарат, глицерофосфат, глутамат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, лактобионат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, фосфат, пикрат, пропионат, сукцинат, тартрат, тиоцианат, трихлорацетат, трифторацетат, пара-толуолсульфонат и ундеканоат ABT-263, охвачены настоящим изобретением. Соли присоединения оснований соединений являются солями, полученными в результате реакции ABT-263 с бикарбонатом, карбонатом, гидроксидом или фосфатом таких катионов, как литий, натрий, калий, кальций и магний.
В подходящих вариантах осуществления фармацевтически активный компонент выбран из группы, состоящей из свободного основания, натриевой соли и дигидрохлорида ABT-263, или комбинаций перечисленного. В предпочтительном варианте осуществления фармацевтически активный компонент является свободным основанием ABT-263.
Термин "фармацевтически приемлемый солюбилизатор", используемый в настоящей заявке, относится к фармацевтически приемлемому неионному поверхностно-активному веществу. Солюбилизатор может вызывать мгновенное эмульгирование активного компонента, высвобождаемого из дозируемой формы, и/или предотвращать осаждение активного компонента в водных жидкостях желудочно-кишечного тракта. Может использоваться один солюбилизатор, а также комбинации солюбилизаторов. Солюбилизатор может быть выбран из группы, состоящей на неионных солюбилизаторов, анионных солюбилизаторов и их комбинаций. Согласно варианту осуществления изобретения продукт в виде твердой дисперсии включает комбинацию двух или более фармацевтически приемлемых солюбилизаторов.
Согласно одному варианту осуществления изобретения фармацевтически приемлемый неионный солюбилизатор выбран из группы, состоящей из сложных эфиров полиолов и жирных кислот, полиалкоксилированных сложных эфиров полиолов и жирных кислот, полиалкоксилированных эфиров жирных спиртов, производных токоферолов или смесей двух или более из перечисленного, а фармацевтически приемлемый анионный солюбилизатор выбран из группы, состоящей из алкилсульфатов, алкилкарбоксилатов, алкилбензолсульфатов и вторичных алкансульфонатов.
Предпочтительные неионные солюбилизаторы выбраны из сорбитановых эфиров жирных кислот, полиалкоксилированных сложных эфиров жирных кислот, таких как, например, полиалкоксилированные глицериды, полиалкоксилированных сорбитановых эфиров жирных кислот или эфиров жирных кислот и полиалкиленгликолей, полиалкоксилированных эфиров жирных спиртов, производных токоферолов или смесей двух или более из перечисленного. Цепь жирной кислоты в указанных соединениях обычно включает от 8 до 22 атомов углерода. Полиалкиленоксидные блоки включают в среднем от 4 до 50 алкиленоксидных звеньев, предпочтительно этиленоксидных звеньев, в молекуле.
Подходящими сорбитановыми эфирами жирных кислот являются сорбитана монолаурат, сорбитана монопальмитат, сорбитана моностеарат (Span® 60), сорбитана моноолеат (Span® 80), сорбитана тристеарат, сорбитана триолеат, сорбитана моностеарат, сорбитана монолаурат или сорбитана моноолеат.
Примерами подходящих полиалкоксилированных сорбитановых эфиров жирных кислот являются полиоксиэтилен (20) сорбитан монолаурат, полиоксиэтилен (20) сорбитан монопальмитат, полиоксиэтилен (20) сорбитан моностеарат, полиоксиэтилен (20) сорбитан моноолеат (Tween® 80), полиоксиэтилен (20) сорбитан тристеарат (Tween® 65), полиоксиэтилен (20) сорбитан триолеат (Tween® 85), полиоксиэтилен (4) сорбитан моностеарат, полиоксиэтилен (4) сорбитан монолаурат или полиоксиэтилен (4) сорбитан моноолеат.
Подходящие полиалкоксилированные глицериды получают, например, путем алкоксилирования природных или гидрогенизированных глицеридов или переэтерификации природных или гидрогенизированных глицеридов с полиалкиленгликолями. Коммерческими примерами являются полиоксиэтилен глицерин рицинолеат 35, полиоксиэтилен глицерин тригидроксистеарат 40 (Cremophor® RH40, BASF AG) и полиалкоксилированные глицериды, как например, доступные под патентованными наименованиями Gelucire® и Labrafil® (Gattefosse), например, Gelucire® 44/14 (лауроил макрогол-32 глицериды, получаемые путем переэтерификации гидрогенизированного пальмового масла с ПЭГ 1500), Gelucire® 50/13 (стеароил макрогол-32 глицериды, получаемые путем переэтерификации гидрогенизированного пальмового масла с ПЭГ 1500) или Labrafil M1944 CS (олеоил макрогол-6 глицериды, получаемые путем переэтерификации косточкового абрикосового масла с ПЭГ 300).
Подходящим сложным эфиром жирной кислоты и полиалкиленгликолей является, например, ПЭГ 660 гидроксистеариновая кислота (полигликолевый сложный эфир 12-гидроксистеариновой кислоты (70 мол. %) с 30 мол. % этиленгликоля).
Подходящими полиалкоксилированными эфирами жирных спиртов являются, например, ПЭГ (2) стеариловый эфир (Brij® 72), макрогол-6 цетилстеариловый эфир или макрогол-25 цетилстеариловый эфир.
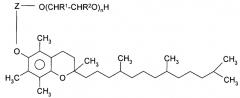
Как правило, производное токоферола соответствует формуле, представленной ниже:
в которой Z является связывающей группой, R1 и R2, независимо друг от друга, являются водородом или C1-C4 алкилом, и n является целым числом от 5 до 100, предпочтительно 10-50. Как правило, Z является остатком алифатической двухосновной кислоты, такой как глутаровая, янтарная или адипиновая кислоты. Предпочтительно, R1 и R2 являются водородом.
Предпочтительным производным токоферола является альфа-токоферил полиэтиленгликоль сукцинат, который обычно сокращенно называют как витамин E-TPGS. Витамин E-TPGS является водорастворимой формой природного витамина Е, которую получают с помощью этерификации d-альфа-токоферилсукцината с полиэтиленгликолем 1000. Витамин E-TPGS поставляется компанией Eastman Chemical Company, Kingsport, TN, USA или Cognis (Dϋsseldorf, Germany) и включен в Фармакопею США и Национальный Формуляр (NF).
Согласно одному предпочтительному варианту осуществления изобретения фармацевтически приемлемый солюбилизатор выбран из группы, состоящей из производных токоферола, содержащих полиалкиленгликолевую группу (таких как α-токоферил полиэтиленгликоль сукцинат), сорбитановых эфиров жирных кислот (таких как сорбитана монолаурат) и полиоксиэтилен-сорбитановых эфиров жирных кислот (таких как полиоксиэтилен сорбитан монолаурат) и комбинаций двух или более из перечисленного. Данный вариант осуществления особенно предпочтителен в том случае, когда активным компонентом является ABT-263 в форме свободного основания.
В другом предпочтительном варианте осуществления дозированная форма включает, по меньшей мере, один фармацевтически приемлемый неионный солюбилизатор и, по меньшей мере, один фармацевтически приемлемый анионный солюбилизатор. Предпочтительно, фармацевтически приемлемый неионный солюбилизатор выбран из группы, состоящей из сорбитановых эфиров жирных кислот, полиоксиэтилен-сорбитановых эфиров жирных кислот и α-токоферил полиэтиленгликоль сукцината (также именуемого в настоящей заявке как витамин E-TPGS или Vit. E-TPGS); и фармацевтически приемлемым анионным солюбилизатором является лаурилсульфат натрия (также именуемый в настоящей заявке как ДСН). Данный вариант осуществления особенно предпочтителен в том случае, когда активным компонентом является ABT-263 в форме соли присоединения кислоты, например, дигидрохлорид ABT-263.
Формированию твердых растворов ABT-263 может способствовать включение нелетучего растворителя для фармацевтически активного компонента в продукт в виде твердой дисперсии. Нелетучий растворитель предпочтительно выбирают из растворителей с высокой растворяющей способностью в отношении ABT-263, которые являются жидкостью при температуре и давлении окружающей среды.
Неограничивающие примеры подходящих растворителей включают жидкие полиэтиленгликоли, например, полиэтиленгликоль 400 (ПЭГ 400); N-метилпирролидон; 1,3-бис(пирролидон-1-ил)-бутан и пропиленгликоль. Предпочтительным растворителем является пропиленгликоль. Количество используемого нелетучего растворителя не должно быть настолько высоким, чтобы неблагоприятно влиять на механические свойства продукта в виде твердой дисперсии, и обычно составляет от 2% до 10% по массе, в расчете на вес продукта в виде твердой дисперсии, например, 3-5% по массе.
Фармацевтически приемлемый полимер может быть выбран из водорастворимых полимеров, вододиспергируемых полимеров или набухающих в воде полимеров или любых смесей перечисленного. Полимеры считаются водорастворимыми, если они образуют прозрачный гомогенный раствор в воде. При растворении при 20°C в водном растворе при концентрации 2% (масс/об), водорастворимый полимер предпочтительно имеет кажущуюся вязкость 1-5000 мПа·с, более предпочтительно 1-700 мПа·с, и наиболее предпочтительно 5-100 мПа·с. Вододиспергируемые полимеры являются такими полимерами, которые при контакте с водой формируют коллоидную дисперсию, а не прозрачный раствор. После контакта с водой или водными растворами набухающие в воде полимеры обычно формируют эластичный гель.
Предпочтительно, фармацевтически приемлемый полимер, применяемый в изобретении, имеет Тс, по меньшей мере, 40°C, предпочтительно, по меньшей мере, +50°C, наиболее предпочтительно от 80°C до 180°C. "Тс" означает температуру стеклования. Методы определения значения Тс органических полимеров описаны в справочнике "Introduction to Physical Polymer Science", 2-е издание, L.H. Sperling, опубликованном John Wiley & Sons, Inc., 1992. Значение Тс может быть вычислено как взвешенная сумма значений Тс для гомополимеров, полученных из каждого из индивидуальных мономеров, i, которые составляют полимер: Тс=Σ Wi Xi, где W является весовым процентом мономера i в органическом полимере, а X является значением Тс для гомополимера, полученного из мономера i. Значения Тс для гомополимеров можно найти в справочнике "Polymer Handbook", 2-е издание, под редакцией J. Brandrup и E.H. Immergut, опубликованном John Wiley & Sons, Inc., 1975.
Различные добавки, содержащиеся в продукте в виде твердой дисперсии, или даже сам активный компонент(ы), могут проявлять пластифицирующий эффект в отношении полимера и, таким образом, понижать Тс полимера так, что конечный продукт в виде твердой дисперсии будет иметь несколько более низкую Тс, чем исходный полимер, используемый для его получения. В большинстве случаев, конечный продукт в виде твердой дисперсии имеет Тс 20°C или выше, предпочтительно 25°C или выше, более предпочтительно 30°C или выше и наиболее предпочтительно 40°C или выше, например, Тс от приблизительно 45°C до приблизительно 60°C.
Например, предпочтительные фармацевтически приемлемые полимеры могут быть выбраны из группы, включающей гомополимеры и сополимеры N-виниллактамов, в особенности гомополимеры и сополимеры N-винилпирролидона, например, поливинилпирролидон (PVP), сополимеры N-винилпирролидона и винилацетата или винилпропионата, сложные эфиры целлюлозы и простые эфиры целлюлозы, в частности метилцеллюлозу и этилцеллюлозу, гидроксиалкилцеллюлозы, в частности гидроксипропилцеллюлозу, гидроксиалкилалкилцеллюлозы, в частности гидроксипропилметилцеллюлозу, фталаты или сукцинаты целлюлозы, в частности фталат ацетат целлюлозы и фталат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы или ацетат сукцинат гидроксипропилметилцеллюлозы; высокомолекулярные полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксиды и пропиленоксида, графт-сополимеры поливинилового спирта и полиэтиленгликоля (выпускаемые под торговым наименованием Kollicoat® IR (BASF AG, Ludwigshafen, Germany)); полиакрилаты и полиметакрилаты, такие как сополимеры метакриловой кислоты/этилакрилата, сополимеры метакриловой кислоты/метилметакрилата, сополимеры бутилметакрилата/2-диметиламиноэтилметакрилата, поли(гидроксиалкилакрилаты), поли(гидроксиалкилметакрилаты), полиакриламиды, полимеры винилацетата, такие как сополимеры винилацетата и кротоновой кислоты, частично гидролизированный поливинилацетат (также называемый частично омыленным "поливиниловым спиртом"), поливиниловый спирт, олиго- и полисахариды, такие как каррагинаны, галактоманнаны и ксантановая камедь или смеси одного или нескольких из перечисленного.
Из перечисленного предпочтительными являются гомополимеры или сополимеры N-винилпирролидона, в особенности сополимер N-винилпирролидона и винилацетата. Наиболее предпочтительным полимером является сополимер N-винилпирролидона (60% от массы сополимера) и винилацетата (40% от массы сополимера).
Другим полимером, который предпочтительно может использоваться, является Kollidon® SR (производства BASF AG, Ludwigshafen, Germany), который включает смесь ПВП и поливинилацетата.
Продукт в виде твердой дисперсии фармацевтически активного компонента может быть получен различными способами.
Предпочтительно, продукт в виде твердой дисперсии получают экструзией из расплава. Соответственно, продукт в виде твердой дисперсии представляет собой формованную из расплава, отвердевшую смесь. Процесс экструзии из расплава включает этапы получения гомогенного расплава из активного компонента или комбинации активных компонентов, фармацевтически приемлемого полимера и солюбилизаторов, и охлаждения расплава до его затвердения. "Плавление" означает переход в жидкое или высокоэластичное состояние, в котором один компонент может быть гомогенно включен в другой. Как правило, один компонент плавится, а другие компоненты растворяются в расплаве, формируя, таким образом, раствор. Плавление обычно включает нагревание выше температуры размягчения фармацевтически приемлемого полимера. Получение расплава может проходить различными путями. Смешивание компонентов может проходить до, во время или после формирования расплава. Например, сначала компоненты могут быть смешаны, а затем расплавлены, или смешаны и расплавлены одновременно. Обычно расплав гомогенизируют, чтобы эффективно диспергировать активные компоненты. Кроме того, может быть удобным сначала расплавить фармацевтически приемлемый полимер, а затем внести и гомогенизировать активные компоненты.
Обычно температура плавления находится в пределах от 70°C до 250°C, предпочтительно от 80°C до 180°C, наиболее предпочтительно от 100°C до 140°C.
Активные компоненты могут применяться также в виде раствора или дисперсии в подходящем растворителе, таком как спирты, алифатические углеводороды или сложные эфиры. Другим растворителем, который может использоваться, является жидкая углекислота. Растворитель удаляют, например, выпаривают, после получения расплава. В альтернативе твердая дисперсия фармацевтически активного компонента также может быть получена с нелетучим растворителем для фармацевтически активного компонента, как указано выше.
В расплав могут быть включены различные добавки, например, регуляторы текучести, такие как коллоидный диоксид кремния; смазывающие вещества, объем образующие вещества (наполнители), разрыхлители, пластификаторы, стабилизаторы, такие как антиоксиданты, светостабилизаторы, поглотители радикалов или стабилизаторы против микробиологической активности.
Плавление и/или смешивание проходят в аппарате, специально предназначенном для этой цели. Наиболее подходящими являются экструдеры или смесители. Подходящие экструдеры включают одношнековые экструдеры, экструдеры со шнеками, находящимися в зацеплении, или другие многошнековые экструдеры, предпочтительно двухшнековые экструдеры, шнеки которых могут вращаться в одном направлении или в противоположных направлениях, и, необязательно, оборудованные смесительными дисками или другими шнековыми элементами для смешивания или диспергирования расплава. Следует понимать, что рабочие температуры также будут определяться в зависимости от типа экструдера или внутренней конфигурации используемого экструдера. Часть энергии, требуемой для плавления, смешивания и растворения компонентов в экструдере, можно обеспечивать путем нагревания элементов. Однако трение и сдвиговая деформация материала в экструдере также могут обеспечивать приложение существенного количества энергии к смеси и способствовать формированию гомогенного расплава компонентов.
Консистенция экструдата, выходящего из экструдера, изменяется от пастообразной до вязкой. Перед тем как экструдат затвердеет, экструдат может быть непосредственно отформован фактически в любую требуемую форму. Формование экструдата может быть удобно выполнено с помощью каландра с двумя противовращающимися роликами с взаимно совпадающими углублениями на их поверхности. Целый ряд форм таблеток может быть получен при использовании роликов с различными формами углублений. Если ролики не имеют углублений на своей поверхности, могут быть получены пленки. В альтернативе экструдат отформован в требуемой форме с помощью литьевого прессования. В альтернативе экструдат подвергают профилированной экструзии и нарезают кусками до (горячая резка) или после затвердевания (холодная резка).
Дополнительно могут быть сформированы пены, если экструдат содержит пропеллент, такой как газ, например, углекислый газ, или летучее соединение, например, низкомолекулярный углеводород, или соединение, который при нагревании разлагается с выделением газа. Пропеллент растворяют в экструдате при условиях относительно высокого давления в экструдере и, когда экструдат выходит из головки экструдера, давление сразу сбрасывается. Таким образом, растворимость пропеллента уменьшается и/или пропеллент испаряется, что приводит к формированию пены.
Необязательно, получаемый в результате продукт в виде твердого раствора промалывают или измельчают с получением гранул. Затем гранулы могут быть заключены в капсулы или могут быть спрессованы. Прессование означает процесс, посредством которого порошковая масса, включающая гранулы, уплотняется под действием высокого давления с получением прессованного изделия с низкой пористостью, например, таблетки. Прессование порошковой массы обычно проводят в таблеточном прессе, более конкретно в стальной форме, помещенной между двумя движущимися штампами.
Предпочтительно твердая дозированная форма содержит, по меньшей мере, одну добавку, выбранную от регуляторов текучести, разрыхлителей, объем образующих и смазывающих веществ.
По меньшей мере, одна добавка, выбранная из регуляторов текучести, разрыхлителей, объем образующих веществ (наполнителей) и смазывающих веществ, предпочтительно используется при прессовании гранул. Разрыхлители способствуют быстрому распаду прессованного изделия в желудке и удерживают высвобожденные гранулы отдельно друг от друга. Подходящими разрыхлителями являются сшитые полимеры, такие как сшитый поливинилпирролидон и натриевая соль сшитой карбоксиметилцеллюлозы. Подходящие объем образующие вещества (также называемые "наполнителями") выбраны из маннита, лактозы, гидрофосфата кальция, микрокристаллической целлюлозы (Avicel®), оксида магния, картофельного или кукурузного крахмала, изомальта, поливинилового спирта.
Подходящие регуляторы текучести выбраны из высокодисперсного силикагеля (Aerosil®) (также именуемого в настоящей заявке как коллоидный диоксид кремния), а также животных или растительных жиров или восков.
Смазывающее вещество предпочтительно используется при прессовании гранул. Подходящие смазывающие вещества выбраны из полиэтиленгликоля (например, с молекулярной массой от 1000 до 6000), стеаратов магния и кальция, стеарилфумарата натрия, талька и т.п.
Могут использоваться другие разнообразные добавки, например красители, такие как азокрасители, органические или неорганические пигменты, такие как оксид алюминия или диоксид титана, или красители природного происхождения; стабилизаторы, такие как антиоксиданты, светостабилизаторы, поглотители радикалов или стабилизаторы против микробиологической активности. Такие добавки известны квалифицированным специалистам в данной области, при этом неограничивающие примеры, например, антиоксидантов, включают витамин Е или его производные (например, витамин E-TPGS), бутилгидрокситолуол (BHT), цистеин и аскорбиновую кислоту или их производные.
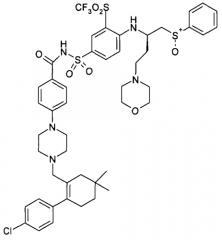
Как указано ранее, молекулы ABT-263 чувствительны к термическому и/или окислительному разложению, которое приводит к образованию различных продуктов разложения, точная структура которых не была полностью установлена. Предполагается, что основными продуктами разложения являются сульфоксиды, образующиеся при окислении сульфанильной группы ABT-263. Предположительная формула сульфоксидного продукта разложения представлена ниже. Квалифицированному специалисту будет очевидно, что атом серы представляет собой центр асимметрии, что приводит к появлению различных диастереомерных форм, которые должны быть включены в термин "сульфоксидные продукты разложения".
Согласно одному варианту осуществления дозированная форма включает менее 1,5% по массе сульфоксидных продуктов разложения активного компонента, более предпочтительно менее 1,2%, и наиболее предпочтительно менее 0,9% по массе сульфоксидных продуктов разложения активного компонента, в расчете на общий вес активного компонента.
Таким образом, следующий аспект изобретения относится к способу приготовления твердой дозированной формы согласно изобретению, в котором: a) получают гомогенный расплав фармацевтически активного компонента, его соли, гидрата или сольвата, по меньшей мере, одного фармацевтически приемлемого полимера и, по меньшей мере, одного солюбилизатора, и b) расплаву позволяют затвердеть с получением продукта в виде твердой дисперсии.
Согласно одному варианту осуществления способ дополнительно включает размол указанного продукта в виде твердой дисперсии и прессование указанного продукта в виде твердой дисперсии с получением таблетки.
Дозированные формы согласно изобретению могут быть предоставлены в виде дозированных форм, состоящих из нескольких слоев, например, слоистых или многослойных таблеток. Они могут быть в открытой или закрытой форме. "Закрытые дозированные формы" являются такими лекарственными формами, в которых один слой полностью окружен, по меньшей мере, одним другим слоем. Многослойные формы обладают преимуществом, которое состоит в том, что могут быть обработаны два активных компонента, несовместимых друг с другом, или что можно регулировать параметры высвобождения активного компонента (компонентов). Например, можно предоставить начальную дозу, включив активный компонент в один из внешних слоев, а поддерживающие дозы - посредством включения активного компонента во внутренний слой (слои). Таблетки многослойного типа могут быть изготовлены путем прессования двух или более слоев гранул. В альтернативе, многослойные дозированные формы могут быть изготовлены с помощью способа, известного как "совместная экструзия". В сущности, данный способ включает получение, по меньшей мере, двух различных ко