Симметричные краунсодержащие диеноны в качестве оптических молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения
Иллюстрации
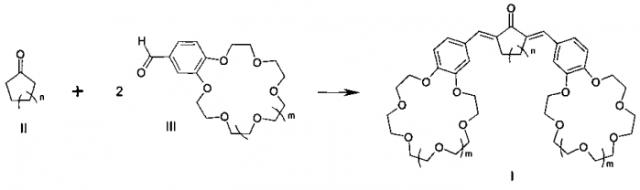
Показать всеИзобретение относится к области химии материалов, а именно к новому типу соединений - симметричным краунсодержащим диенонам общей формулы I, где n=1, 2; m=0, 1, и способу их получения, заключающемуся в том, что циклоалканоны общей формулы II, где n=1, 2; подвергают взаимодействию с формильными производными бензокраун-эфиров общей формулы III, где m=0, 1, и процесс проводят в смеси органического растворителя с водой или в среде органического растворителя. Соединения формулы I и материалы на их основе могут быть использованы в составе оптических хемосенсоров для колориметрического и люминесцентного определения катионов щелочных, щелочноземельных металлов и аммония, например для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках, для мониторинга окружающей среды. 2 н. и 1 з.п. ф-лы, 2 ил., 4 пр.
Реферат
Изобретение относится к органической химии и химии материалов, а именно к новому типу соединений общей формулы I:
где n=1, 2;
m=0, 1.
Полученные соединения и композитные материалы на их основе могут быть использованы в составе оптических хемосенсоров для колориметрического и люминесцентного определения катионов щелочных, щелочноземельных металлов и аммония, например для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках, для мониторинга окружающей среды. Изобретение относится также к способу получения таких соединений.
Указанный тип соединений, их свойства и способ получения в литературе не описаны.
Заявляемый новый тип соединений имеет структуру, не относящуюся ни к одному из известных типов структур. Предложенный тип соединений содержит неизвестное ранее сочетание фрагментов симметричного кросс-сопряженного диенона и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами и в параположениях к этиленовым группам, что предопределяет их спектральные свойства и позволяет отнести эти соединения к новому типу диенонов.
Известны диеноны [Conney А.Н., Zhang К., Wei X., Zheng X., Du Z.-Y. Патент WO 2012021692 Al, 2012; Dibella E.P., Патент US 3389986 A, 1968; Singh N., Pandey J., Yadav A., Chaturvedi V., Bhatnagar S., Gaikwad A.N., Sinha S.K., Kumar A., Shukla P.K., Tripathi R.P., Eur. J. Med. Chem., 2009, 44, 1705. Yu W., Xiu-Mei C, Li-Ling P., Rui M., Cai-Hui Y., Rui Y., Wei L., Wei Y., Rong-Cheng В., Hui W., Synthetic Commun., 2010, 40, 2320], особенностью строения которых является наличие симметричного кросс-сопряженного диенонового фрагмента. Эти диеноны не способны к комплексообразованию с катионами металлов и аммония, поскольку не имеют макрогетероциклического фрагмента.
В литературе описаны симметричные кросс-сопряженные диеноны, в которых диеноновый фрагмент соединен через углерод-азотные связи с двумя остатками азакраун-эфиров, атомы азота которых находятся в сопряжении с бензольными циклами [Дорошенко А.О., Григорович А.В., Посохов Е.А., Пивоваренко В.Г., Демченко А.П., Шейко А.Д. Изв. АН, Сер. хим., 2001, 386; Жмуд Б. В., Голуб А. А., Пивоваренко В. Г. Неорганические материалы, 2004, 40, 1145]. Для них характерны наличие поглощения в области 500-550 нм и способность к комплексообразованию с катионами щелочных и щелочноземельных металлов. Однако константы устойчивости таких комплексов с катионами металлов невысоки из-за слабого участия атомов азота макроциклов в координации катионов металла и из-за конформационной подвижности макроциклов азакраун-эфиров. Это не позволяет использовать диеноны с остатками азакраун-эфиров в качестве эффективных оптических молекулярных сенсоров на катионы металлов и аммония.
Целью настоящего изобретения является новый тип соединений - симметричные крунсодержащие диеноны, в которых атомы кислорода, входящие в состав двух фрагментов краун-эфиров, находятся в сопряжении с бензольными циклами в пара- и метаположениях к этиленовым группам. Задачей изобретения является также разработка способа получения целевых продуктов, доказательство их строения и изучение их комплексообразующих, ионохромных и ионофлуорохромных свойств.
Поставленная цель достигается структурой заявляемого нового типа диенонов общей формулы I и способом их получения, заключающимся в том, что циклоалканоны общей формулы II:
где n имеет указанные выше значения для формулы I;
подвергают взаимодействию с формильными производными бензокраун-эфиров общей формулы III:
где m имеет указанные выше значения для формулы I.
Процесс проводят в смеси органического растворителя с водой или в среде органического растворителя, например спирта, в присутствии оснований, таких как, например, гидроксид натрия, гидроксид калия, гидроксид лития или гидроксид тетрабутиламмония при температурах 0-50°С.
Конденсация указанных циклоалканонов общей формулы II с формильными производными бензокраун-эфиров общей формулы III до настоящего времени не была известна. Согласно предлагаемому способу синтез диенонов общей формулы I осуществляют конденсацией активированных в циклоалканонах I α-метиленовых групп с карбонильными группами двух формильных производных бензокраун-эфиров общей формулы III с образованием двух двойных углерод-углеродных связей.
Строение полученных соединений общей формулы I доказано с помощью спектроскопии ЯМР 1Н и 13С, электронной и ИК-спектроскопии, масс-спектрометрии, а также данными элементного анализа (примеры 1-4). Все эксперименты проводили при красном свете.
Пример 1. (2E,5E)-2,5-бис(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин-15-илметилиден)циклопентанон.
В колбе объемом 3 мл к 65.1 мг (0.22 ммоля) 4'-формилбензо-15-краун-5-эфира приливают 8.4 мг (0.1 ммоля) циклопентанона в 0.2 мл этанола, затем добавляют по каплям при перемешивании 0.3 мл 0.4 М раствора NaOH в смеси этанол - вода (2:1). Реакционную смесь выдерживают в течение 4 ч при комнатной температуре, подкисляют 1 М раствором соляной кислоты до рН=6, разбавляют 5 мл воды, экстрагируют горячим бензолом (4×4 мл). Экстракт упаривают в вакууме, остаток очищают методом колоночной хроматографии на окиси алюминия (Туре Т, 63-200 мкм, Merck), элюируя бензолом, смесью растворителей бензол - этилацетат (10:1), этилацетатом, смесью этилацетат - этанол (50:1). Получают 44 мг (выход 69%) диенона в виде желтых игольчатых кристаллов, т. пл. 178-180°С. Rƒ 0.46 (EtOH - ЕtOAc, 1:10, DC-Alufolien "Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в MeCN-d3, 27°С): 3.13 (с, 4 Н, С(3)Н2, С(4)Н2); 3.66 (м, 8 Н, 4 СН2O); 3.67 (м, 8 Н, 4 СН2O); 3.84 (м, 8 Н, 4 СН2O); 4.16 (м, 8 Н, 4 СН2O); 7.02 (д, 2 H, С(17)Н, J=8.4 Гц); 7.24 (д, 2 Н, С(14)Н, J=1.4 Гц); 7.29 (дд, 2 Н, С(16)Н, J=8.4 Гц, J=1.4 Гц); 7.41 (с, 2 Н, С(1)Н).
Спектр ЯМР 13С (125 МГц, в CD2Cl2, 30°С): 26.91 (С(3)Н2, С(4)Н2); 69.01, 69.38, 69.60, 69.74, 70.52, 70.62, 71.27, 71.30 (16 CH2O); 113.61 (2 С(17)Н); 116.48 (2 С(14)Н); 125.33 (2 С(16)Н); 129.68 (2 С(15)); 133.32 (2 С(1)Н); 136.18 (С(2), С(5)); 149.39 (2 С(17а)); 150.92 (2 С(13а)); 195.95 (С=O).
ИК-спектр (ваз. масло): 1687 см-1 (С=O).
УФ-спектр (С=2×10-5 моль·л-1, ацетонитрил), нм: 394 (ε=44130), 272 (ε=11400), 252 (ε=14300).
Флуоресценция (С=1×10-5 моль·л-1, ацетонитрил): λех 394 нм, λf max 501 нм.
Масс спектр (m/z): 663 [M+Na]+.
Найдено, %: С 65.41; Н 6.83.
С35Н44O11.
Вычислено, %: С 65.61; Н 6.92.
Пример 2. (2E,6E)-2,6-бис(2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин-15-илметилиден)циклогексанон.
В колбе объемом 3 мл к 32.6 мг (0.11 ммоля) 4'-формилбензо-15-краун-5-эфира приливают 4.9 мг (0.05 ммоля) циклогексанона в 0.2 мл этанола, затем добавляют по каплям при перемешивании 0.3 мл 0.4 М раствора NaOH в смеси этанол - вода (2:1). Реакционную смесь выдерживают в течение 24 ч при комнатной температуре, подкисляют 1 М раствором соляной кислоты до рН=6, разбавляют 5 мл воды, экстрагируют горячим бензолом (4×4 мл). Экстракт упаривают в вакууме, остаток очищают методом колоночной хроматографии на окиси алюминия (Туре Т, 63-200 мкм, Merck), элюируя бензолом, смесью растворителей бензол - этилацетат (2:1), этилацетатом, смесью этилацетат - этанол (50:1). Получают 21 мг (выход 64%) диенона в виде желтого порошка, т. пл. 141°С. Rƒ 0.57 (EtOH - EtOAc, 1:10, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в MeCN-d3, 27°С): 1.79 (м, 2 Н, С(4)Н2, J=5.6 Гц); 2.95 (т, 4 Н, С(3)Н2, С(5)Н2, J=5.6 Гц); 3.63 (м, 8 Н, 4 СН2O); 3.67 (м, 8 Н, 4 СН2O); 3.82 (м, 8 Н, 4 СН2O); 4.12 (м, 8 Н, 4 СН2O); 6.98 (д, 2 Н, С(17)Н, J=8.4 Гц); 7.11 (с, 2 Н, С(14)Н); 7.15 (д, 2 Н, С(16)Н, J=8.4 Гц); 7.63 (с, 2 Н, С(1)Н).
Спектр ЯМР 13С (125 МГц, в MeCN-d3, 30°С): 23.74 (С(4)Н2); 29.26 (С(3)Н2, С(5)Н2); 69.46, 69.76, 69.89, 70.00, 70.83, 70.91 (12 СН2O); 71.52 (4 СН2ОАr); 114.06 (2 С(17)Н); 117.00 (2 С(14)Н); 125.36 (2 С(16)Н); 130.04 (2 С(15)); 136.01 (С(2), С(6)); 136.74 (2 С(1)Н); 149.51 (2 С(17а)); 150.66 (2 С(13а)); 190.29 (С=O).
ИК-спектр (ваз. масло): 1660 см-1 (С=O).
УФ-спектр (С=1×10-5 моль·л-1, ацетонитрил), нм: 369 (ε=37840), 254 (ε=25300).
Флуоресценция (С=1×10-5 моль·л-1, ацетонитрил): λех 369 нм, λf mах 414 нм.
Масс спектр (m/z): 677 [M+Na]+.
Найдено, %: С 66.23; Н 7.05.
С36Н46О11.
Вычислено, %: С 66.04; Н 7.08.
Пример 3. (2E,5E)-2,5-бис(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-илметилиден)циклопентанон.
В колбе объемом 3 мл к 37.4 мг (0.11 ммоля) 4'-формилбензо-18-краун-6-эфира приливают 4.2 мг (0.05 ммоля) циклопентанона в 0.2 мл этанола, затем добавляют по каплям при перемешивании 0.3 мл 0.4 М раствора NaOH в смеси этанол - вода (2:1). Реакционную смесь выдерживают в течение 4 ч при комнатной температуре, подкисляют 1 М раствором соляной кислоты до рН=6, разбавляют 5 мл воды и экстрагируют горячим бензолом (4×4 мл). Экстракт упаривают в вакууме, остаток очищают методом колоночной хроматографии на окиси алюминия (Туре Т, 63-200 мкм, Merck), элюируя бензолом, смесью растворителей бензол - этилацетат (1:1), этилацетатом, смесью этилацетат - этанол (50:1). Получают 21 мг (выход 56%) моногидрата диенона в виде желтого порошка, т. пл. 115°С. Rƒ 0.20 (EtOH - ЕtOAc, 1:10, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в MeCN-d3, 27°С): 3.08 (с, 4 Н, С(3)Н2, С(4)Н2); 3.55 (м, 8 Н, 4 СН2O); 3.57 (м, 8 Н, 4 СН2O); 3.60 (м, 8 Н, 4 СН2O); 3.76 (м, 8 Н, 4 СН2O); 4.18 (м, 8 Н, 4 СН2O); 6.99 (д, 2 Н, С(20)Н, J=8.4 Гц); 7.19 (с, 2 Н, С(17)Н); 7.24 (д, 2 Н, С(19)Н, J=8.4 Гц); 7.39 (с, 2 Н, С(1)Н).
Спектр ЯМР 13С (125 МГц, в MeCN-d3, 30°С): 27.16 (С(3)Н2, С(4)Н2); 68.82, 68.94, 69.73, 69.79, 71.03, 71.14, 71.24 (20 СН2O); 113.17 (2 С(20)Н); 115.30 (2 С(17)Н); 125.34 (2 С(19)Н); 129.77 (2 С(18)); 133.46 (2 С(1)Н); 137.03 (С(2), С(5)); 149.12 (2 С(20а)); 150.49 (2 С(16а)); 196.37 (С=O).
ИК-спектр (ваз. масло): 1685 см-1 (С=O).
УФ-спектр (С=1×10-5 моль·л-1, ацетонитрил), нм: 395 (ε=36950), 270 (ε=11900), 255 (ε=13700).
Флуоресценция (С=1×10-5 моль·л-1, ацетонитрил): λех 395 нм, λf mах 495 нм.
Масс спектр (m/z): 751 [М+Na]+, 767 [М+К]+.
Найдено, %: С 62.77; Н 7.49.
C39H52O13 Н2O
Вычислено, %: С 62.72; Н 7.29.
Пример 4. (2E,6E)-2,6-бис(2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин-18-илметилиден)циклогексанон.
В колбе объемом 3 мл к 37.4 мг (0.11 ммоля) 4'-формилбензо-18-краун-6-эфира приливают 4.9 мг (0.05 ммоля) циклогексанона в 0.2 мл этанола, затем добавляют по каплям при перемешивании 0.3 мл 0.4 М раствора NaOH в смеси этанол - вода (2:1). Реакционную смесь выдерживают в течение 24 ч при комнатной температуре, подкисляют 1 М раствором соляной кислоты до рН=6, разбавляют 5 мл воды и экстрагируют горячим бензолом (4×4 мл). Экстракт упаривают в вакууме, остаток очищают методом колоночной хроматографии на окиси алюминия (Туре Т, 63-200 мкм, Merck), элюируя бензолом, смесью растворителей бензол - этилацетат (1:1), этилацетатом, смесью этилацетат - этанол (50:1), смесью этилацетат - этанол (20:1). Получают 15 мг (выход 40%) диенона в виде желтого порошка, т. пл. 130°С. Rƒ 0.3 (EtOH - EtOАс, 1:10, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1Н (500 МГц, в МеСN-d3, 27°С): 1.80 (м, 2 Н, С(4)Н2); 2.96 (м, 4 Н, 2 С(3)Н2, С(5)Н2); 3.57-3.59 (2 м, 16 Н, 8 СН2O); 3.62 (м, 8 Н, 4 СН2O); 3.78 (м, 8 Н, 4 СН2O); 4.19 (м, 8 Н, 4 СН2O); 6.99 (д, 2 Н, С(20)Н, J=8.4 Гц); 7.11 (с, 2 Н, С(17)Н); 7.14 (д, 2 Н, C(19)H, J=8.4 Гц); 7.65 (с, 2 Н, С(1)Н).
Спектр ЯМР 13С (125 МГц, в MeCN-d3, 30°С): 23.73 (С(4)Н2); 29.25 (С(3)Н2, С(5)Н2); 68.87, 68.83, 69.72, 69.78, 71.00, 71.14, 71.24 (20 СН2O); 112.88 (2 С(20)Н); 115.45 (2 С(17)Н); 124.78 (2 С(19)Н); 129.68 (2 С(18)); 135.92 (С(2), С(6)); 136.75 (2 С(1)Н); 148.81 (2 С(20а)); 149.83 (2 С(16а)); 190.21 (С=O).
ИК-спектр (ваз. масло): 1660 см-1 (С=O).
УФ-спектр (С=1×10-5 моль·л-1, ацетонитрил), нм: 370 (ε=14390), 254 (ε=20600).
Флуоресценция (С=1×10-5 моль·л-1, ацетонитрил): λех 370 нм, λf mах 412 нм.
Масс спектр (m/z): 741 [М]+, 765 [М+Na]+, 781 [М+К]+.
Найдено, %: С 64.28; Н 7.43.
С40Н54О13.
Вычислено, %: С 64.67; Н 7.33.
Изучены комплексообразующие, ионохромные и ионофлуорохромные свойства полученных диенонов I из примеров 3 и 4 в ацетонитриле.
Полученные данные, представленные на фиг. 1, 2, убедительно свидетельствуют о том, что новые симметричные краунсодержащие диеноны способны действовать не только как колориметрические молекулярные сенсоры, но и как флуоресцентные сенсоры.
Предварительные результаты исследования симметричных краунсодержащих диенонов общей формулы I показали, что в апротонной среде они способны с хорошим оптическим откликом связывать катионы щелочных, щелочноземельных металлов и аммония, то есть проявляют свойства оптических молекулярных сенсоров. Эти свойства позволяют создать на основе полученных диенонов оптические хемосенсорные материалы.
Таким образом, получен новый тип симметричных диенонов - краунсодержащие диеноны, содержащие неизвестное ранее сочетание фрагментов симметричного кросс-сопряженного диенона и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами в пара- и метаположениях к этиленовым группам, и обнаружена их выраженная способность к связыванию катионов щелочных, щелочноземельных металлов и аммония, характеризующаяся существенными изменениями в спектрах поглощения и испускания. Эти свойства позволяют использовать заявленные соединения в составе оптических хемосенсоров для колориметрического и флуоресцентного определения катионов щелочных, щелочноземельных металлов и аммония, например в составе полимерных пленок и мембран для определения микроколичеств указанных ионов в биологических жидкостях, а также для определения микроколичеств указанных ионов в промышленных водах и стоках, в том числе для мониторинга окружающей среды. Разработан также способ получения заявленных соединений высокой степени чистоты и с хорошими выходами (до 69%).
1. Симметричные краунсодержащие диеноны общей формулы I: где n=1, 2;m=0, 1;отличающиеся тем, что содержат фрагменты симметричного кросс-сопряженного диенона и двух краун-эфиров, атомы кислорода которых находятся в сопряжении с бензольными циклами в пара- и метаположениях к этиленовым группам.
2. Способ получения симметричных краунсодержащих диенонов формулы I по п. 1, отличающийся тем, что он включает взаимодействие циклоалканонов формулы II: в которых n имеет указанные в п. 1 значения,с формильными производными бензокраун-эфиров формулы III: где m имеют указанные в п. 1 значения.
3. Способ по п. 2, отличающийся тем, что процесс проводят в присутствии неорганического основания.