Способ получения замещенных хинонов
Иллюстрации
Показать всеИзобретение относится к способу получения замещенных хинонов путем окисления алкилароматических соединений пероксидом водорода в присутствии катализатора в среде органического растворителя. При этом в качестве катализатора используют кислые алкиламмониевые соли ванадийсодержащих полиоксовольфраматов (Alkm-nHn)[γ-XV2W10O40], где в качестве центрального атома полиоксометаллата X может быть Si или P, предпочтительно, P; в качестве алкиламмонийного катиона полиоксовольфрамата Alk=(CkH2k+1)4N, k=4-6; число протонов n в катионной части полиоксовольфрамата (Alkm-nHn)[γ-XV2W10O40] варьируется от 0 до 2. Предлагаемый способ позволяет получать целевой продукт с высоким выходом при использовании небольших количеств катализатора. 7 з.п. ф-лы, 1 табл., 25 пр.
Реферат
Изобретение относится к области тонкого органического синтеза, а именно к усовершенствованному способу получения замещенных хинонов, в том числе, 2,3,6-триметил-1,4-бензохинона (ТМБХ) и 2-метил-1,4-нафтохинона (МНХ) - ключевых интермедиатов в синтезе витаминов Ε и K, соответственно, широко применяемых в медицинской практике и животноводстве.
Хиноны получают путем окисления доступного сырья - соответствующих алкилароматических соединений (алкилфенолов) экологически чистым и дешевым окислителем - водным пероксидом водорода.
Существуют несколько способов получения алкилзамещенных хинонов из соответствующих алкилфенолов: 1) стехиометрическое окисление неорганическими окислителями (оксидами марганца(IV) и хрома(VI), перманганатом и бихроматом, азотной кислотой и др.); 2) гомогенное каталитическое окисление в присутствии комплексов переходных металлов и 3) гетерогенное каталитическое окисление в присутствии твердофазных катализаторов, содержащих переходные металлы. Поскольку при стехиометрическом окислении используются большие количества дорогих и часто токсичных окислительных агентов, неизбежно возникают проблемы, связанные с утилизацией большого количества токсичных отходов. Поэтому каталитические способы окисления гораздо более приемлемы как с точки зрения экологии, так и с точки зрения экономики.
Наибольший интерес представляют каталитические способы получения хинонов из замещенных фенолов, основанные на использовании экологически безопасных окислителей - молекулярного кислорода и пероксида водорода, которые в качестве единственного побочного продукта дают воду. Хотя стоимость пероксида водорода выше, чем стоимость кислорода, в малотоннажных процессах тонкого органического синтеза использование первого часто оказывается предпочтительным, поскольку стоимость технологического оборудования для окисления пероксидом водорода ниже, чем для окисления кислородом [R.A. Sheldon, J. Dakka. Heterogeneous catalytic oxidations in the manufacture of fine chemicals. Catalysis Today 19 (1994) 215].
При окислении замещенных фенолов кислородом используют два основных типа гомогенных катализаторов: 1) галогениды меди [ЕР 0093540, С07С 50/04, 1983; ЕР 0127888 В1, С07С 46/08, 1987] и 2) фосформолибдованадиевые гетерополикислоты H3+nPMo12-nVnO40 (ΓΠΚ-n, n=2-6) [SU 1719392, С07С 50/04, 1991; PCT/FR 96/01689, С07С 46/08; RU 2022958, С07С 50/12, 1994; WO 2004/014832]. Недостатками каталитических способов, основанных на использовании галогенидов меди, являются высокие (практически стехиометрические) количества катализатора и загрязнение продукта токсичными переходными металлами, а также коррозия аппаратуры. Кроме того, в случае использования хлоридов меди имеет место побочное образование токсичных хлорорганических соединений. В способах, основанных на применении ГПК-n, также используют близкие к стехиометрическим количества катализатора, и продукт загрязняется переходным металлом.
Для окисления замещенных фенолов пероксидом водорода известны системы, основанные на использовании в качестве гомогенного катализатора комплексов кобальта с основаниями Шиффа [DE 2460665 and 2517870, 1975], соединений рутения и железа [Ito S., Aihara K., Matsumoto Μ. Tetr. Lett. Ruthenium-catalyzed oxidation of phenols with hydrogen peroxide. 24 (1983) 5249; Wienhcfer G., Schrcder K., Mcller K., Jungc K., Beller M. Adv. Synth. Catal. 2010, 352, 1615; Moller, K., Wienhcfer, G., Schrcder, K., Join, В., Junge, K., Beller, M. Chem. Eur. J. 2010, 16, 10300], а также гетерополикислот структуры Кеггина (HnXM12O40, X=Si (n=4), Ρ (n=3); Μ=Μο, W) [US 5245059, C07C 50/04, 1993]. В качестве гетерогенных катализаторов могут быть использованы мезопористые титан-силикатные материалы [US 5712402, С07С 50/02, 1998; RU 2164510, 2000; 2196764, 2001]. Недостатками перечисленных выше каталитических систем является, как правило, недостаточно высокий выход целевого продукта и, соответственно, необходимость затрат на очистку от побочных продуктов, а также низкая эффективность использования окислителя (селективность по пероксиду водорода) вследствие побочного процесса его разложения на катализаторе.
Наиболее близким к данному изобретению является способ окисления замещенных фенолов в хиноны пероксидом водорода в присутствии гетерополикислот структуры Кеггина (ΗnΧΜ12O40, X=Si (n=4), Ρ (n=3); Μ=Μο, W) [US 5245059, C07C 50/04, 1993]. Недостатками данного способа являются относительно большое время реакции (3-12 ч), недостаточно высокий выход целевого продукта (максимальный выход ТМБХ - 78% при использовании 60%-ного пероксида водорода и 61% - при использовании 30%-ного Н2О2) и низкая эффективность использования окислителя, а также проведение реакции в инертной атмосфере.
Задачей изобретения является создание экологически безопасного высокоэффективного каталитического способа окисления замещенных фенолов в хиноны с использованием экологически чистого и атомно-эффективного окислителя - пероксида водорода.
Решение задачи должно привести к существенному упрощению и удешевлению технологии существующих процессов получения хинонов, увеличению выхода целевых продуктов и повышению эффективности использования окислителя. Предлагаемый способ исключает образование ядовитых хлорсодержащих побочных продуктов и коррозию аппаратуры.
Технический результат - высокий выход целевого продукта (как на исходный субстрат, так и на окислитель) при использовании небольших количеств катализатора.
Задача достигается тем, что в способе получения замещенных хинонов путем окисления алкилароматических соединений пероксидом водорода в присутствии катализатора в среде органического растворителя в качестве катализатора используют кислые алкиламмониевые соли ванадийсодержащих полиоксовольфраматов (Alkm-nHn)[γ-XV2W10O40], где: в качестве центрального атома полиоксометаллата X может быть Si или Р, предпочтительно, Р; в качестве алкиламмонийного катиона полиоксовольфрамата Alk=(CkH2k+1)4N, k=4-6; число протонов η в катионной части полиоксовольфрамата (Alkm-nHn)[γ-XV2W10O40] варьируется от 0 до 2).
Синтез соединений данного типа описан в [K. Kamata, K. Sugahara, K. Yonehara, R. Ishimoto, N. Mizuno, Chcm. Eur. J. 2011, 17, 7549].
В качестве алкилароматических соединений берут алкилзамещенные фенолы (2,3,6-тиметилфенол, 2,3,5-триметилфенол, 2,6-диметилфенол, 2,6-ди-трет-бутилфенол) и нафтолы (2-метил-1-нафтол).
В качестве окислителя используют водный раствор пероксида водорода с содержанием пероксида не менее 30 мас.%.
Процесс ведут при температуре не ниже 25°С.
В качестве органического растворителя используют ацетонитрил или его смесь со спиртами.
Используют концентрацию субстрата не выше 0,4 М.
Используют мольное отношение пероксид водорода/субстрат не ниже 2/1.
Мольное отношение субстрат/катализатор не ниже 66.
Сущность изобретения иллюстрируется нижеследующими примерами.
Пример 1.
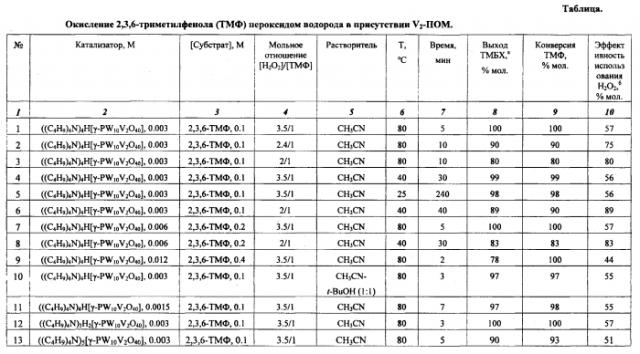
В термостатируемый при 80°С стеклянный реактор, снабженный магнитной мешалкой и конденсором, помещают 14 мг (0,1 ммоль) 2,3,6-триметилфенола (ТМФ), 11 мг (0.003 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] и 1 мл ацетонитрила. Затем при перемешивании добавляют 35 µл (0.35 ммоль) 30%-ной Н2О2 (мольное отношение [H2O2]/[ТМФ]=3.5/1). Смесь перемешивают при 80°С. Через 5 мин конверсия ТМФ и выход 2,3,5-триметил-1,4-бензохинона (ТМБХ) в расчете на исходный ТМФ, определенные методом ГЖХ, составляют 100%. Эффективность использования окислителя (выход в расчете на Н2О2) составляет 57%.
Пример 2.
Процесс проводят, как в примере 1, но вместо мольного отношения [H2O2]/[ТМФ]=3.5/1 используют мольное отношение [H2O2]/[ТМФ]=2.4/1. Через 10 мин конверсия ТМФ - 90%, выход ТМБХ - 90, эффективность использования окислителя - 75%.
Пример 3.
Процесс проводят, как в примере 1, но вместо мольного отношения [H2O2]/[ТМФ]=3.5/1 используют мольное отношение [H2O2]/[ТМФ]=2/1. Через 10 мин конверсия ТМФ - 80%, выход ТМБХ - 80%, эффективность использования окислителя - 80%.
Примеры 2 и 3 демонстрируют, что уменьшение мольного отношение [H2O2]/[ТМФ] при сохранении остальных параметров приводит к уменьшению конверсии субстрата и выхода продукта, увеличению времени реакции, но позволяет увеличить эффективность использования окислителя.
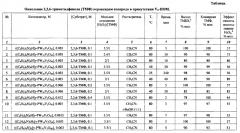
Пример 4.
Процесс проводят, как в примере 1, но при температуре 40°С. Через 30 мин конверсия ТМФ - 99%, выход ТМБХ - 99, эффективность использования окислителя - 56%.
Пример 5.
Процесс проводят, как в примере 1, но при температуре 25°С. Через 240 мин конверсия ТМФ - 98%, выход ТМБХ - 98, эффективность использования окислителя - 56%.
Примеры 4 и 5 демонстрируют, что снижение температуры реакции при мольном отношении [H2O2]/[ТМФ]=3.5/1 приводит к увеличению времени реакции и незначительному снижению конверсии субстрата, выхода продукта и эффективности использования окислителя.
Пример 6.
Процесс проводят, как в примере 3, но при 40°С. Через 40 мин конверсия ТМФ составляет 90%, выход ТМБХ - 89%, эффективность использования H2Ο2 - 89%.
Данный пример показывает, что снижение температуры реакции при мольном отношении [H2O2]/[ТМФ]=2/1 приводит к увеличению времени реакции, но позволяет увеличить конверсию субстрата, выход продукта и эффективность использования окислителя.
Пример 7.
Процесс проводят, как в примере 1, но концентрации всех реагентов увеличивают в 2 раза: вместо 14 мг (1 ммоль) ТМФ, 35 µл (0.35 ммоль) 30%-ной H2O2 и 11 мг (0.003 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] берут 28 мг (0.2 ммоль) ТМФ, 70 μл (0.70 ммоль) 30%-ной Н2О2 и 22 мг (0.006 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] (мольные отношения реагентов не меняются). Через 5 мин конверсия ТМФ - 100%, выход ТМБХ - 100%, эффективность использования окислителя - 57%.
Данный пример показывает, что при 80°С увеличение концентраций реагентов в 2 раза не влияет на параметры процесса.
Пример 8.
Процесс проводят, как в примере 6, но концентрации реагентов увеличивают в 2 раза: вместо 14 мг (1 ммоль) ТМФ, 20 μл (0.20 ммоль) 30%-ной H2Ο2 (мольное отношение [H2O2]/|ТМФ]=2/1) и 11 мг (0.003 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] берут 28 мг (0.2 ммоль) ТМФ, 40 μл (0.40 ммоль) 30%-ной H2O2 и 22 мг (0.006 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40]. Через 30 мин конверсия ТМФ - 83%, выход ТМБХ - 83%, эффективность использования окислителя - 83%.
Данный пример показывает, что увеличение концентраций реагентов при 40°С приводит к некоторому сокращению времени реакции, но при этом уменьшаются конверсия ТМР, выход продукта и эффективность использования окислителя.
Пример 9.
Процесс проводят, как в примере 7, но концентрации реагентов увеличивают еще в 2 раза: вместо 28 мг (0.2 ммоль) ТМФ, 70 μл (0.70 ммоль) 30%-ной Н2О2 и 22 мг (0.006 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] берут 56 мг (0.4 ммоль) ТМФ, 140 μл(1.40 ммоль) 30%-ной Н2О2 и 44 мг (0.012 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] (мольные отношения реагентов не меняются). Через 2 мин конверсия ТМФ - 100%, выход ТМБХ - 78%, эффективность использования окислителя - 44%.
Данный пример демонстрирует, что увеличение концентраций реагентов в 4 раза относительно примера 1 приводит к уменьшению выхода целевого продукта (за счет снижения селективности образования ТМБХ при полной конверсии субстрата).
Пример 10.
Процесс проводят, как в примере 1, но в качестве растворителя вместо ацетонитрила используют смесь ацетонитрил - трет-бутанол в соотношении 1:1. Через 3 мин конверсия ТМФ - 97%, выход ТМБХ - 97%, эффективность использования окислителя - 55%.
Данный пример демонстрирует, что частичная замена ацетонитрила трет-бутанолом приводит к незначительному уменьшению параметров процесса.
Пример 11.
Процесс проводят, как в примере 1, но вместо 11 мг (0.003 ммоль) катализатора ((C4H9)4N)4H[γ-PW10V2O40] его берут в количестве 5.5 мг (0.0015 ммоль). Через 7 мин конверсия ТМФ - 98%, выход ТМБХ - 97%, эффективность использования окислителя - 55%.
Данный пример показывает, что уменьшение количества катализатора в 2 раза (увеличение мольного отношения субстрат/катализатор в 2 раза - с 33 до 66) незначительно влияет на параметры процесса.
Пример 12.
Процесс проводят, как в примере 1, но вместо ((C4H9)4N)4H[γ-PW10V2O40] используют катализатор ((C4H9)4N)4H2[γ-PW10V2O40]. Через 3 мин конверсия ТМФ -100%, выход ТМБХ - 100%, эффективность использования окислителя - 57%.
Данный пример показывает, что замена одного трет-бутиламмонийного катиона на протон в катионной части катализатора ускоряет реакцию и не влияет на другие параметры реакции.
Пример 13.
Процесс проводят, как в примере 1, но вместо катализатора ((C4H9)4N)4H[γ-PW10V2O40] используют катализатор ((C4H9)4N)5[γ-PW10V2O40]. Через 3 мин конверсия ТМФ - 93%, выход ТМБХ - 90%, эффективность использования окислителя - 51%.
Данный пример демонстрирует, что отсутствие в катионной части катализатора протона приводит к ухудшению всех параметров процесса (уменьшению конверсии ТМФ, выхода ТМБХ и эффективности использования окислителя).
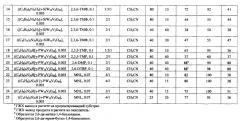
Пример 14.
Процесс проводят, как в примере 1, но вместо катализатора ((C4H9)4N)4H[γ-PW10V2O40] с центральным атомом фосфора берут катализатор ((C4H9)4N)4H2[γ-SiW10V2O40] с центральным атомом кремния. Через 15 мин конверсия ТМФ - 92%, выход ТМБХ - 72%, эффективность использования окислителя - 41%.
Пример 15.
Процесс проводят, как в примере 3, но вместо катализатора ((C4H9)4N)4H[γ-PW10V2O40] берут катализатор ((C4H9)4N)4H2[γ-SiW10V2O40]. Через 15 мин конверсия ТМФ - 55%, выход ТМБХ - 44%, эффективность использования окислителя - 44%.
Пример 16.
Процесс проводят, как в примере 6, но вместо катализатора ((C4H9)4N)4H[γ-PW10V2O40] берут катализатор ((C4H9)4N)4H2[γ-SiW10V2O40]. Через 60 мин конверсия ТМФ - 50%, выход ТМБХ - 38%, эффективность использования окислителя - 38%.
Примеры 12-14 демонстрируют, что катализатор, имеющий центральный атом кремния, является менее эффективным по всем параметрам, чем катализатор с центральным атомом фосфора.
Пример 17.
Процесс проводят, как в примере 16, но вместо катализатора ((C4H9)4N)4H2[γ-SiW10V2O40] используют катализатор ((C6H13)4N)5[γ-SiW10V2O40]. Через 30 мин конверсия ТМФ - 55%, выход ТМБХ - 47%, эффективность использования окислителя - 47%.
Этот пример показывает, что замена в катализаторе тетра-бутиламмонийного катиона (C4H9)4N+ на тетра-гексиламмонийный (С6Н13)4N+ позволяет сократить время реакции и увеличить конверсию ТМФ, выход ТМБХ и эффективность использования окислителя.
Пример 18.
Процесс проводят, как в примере 1, но в качестве субстрата вместо 2,3,6-триметилфенола берут 2,3,5-триметилфенол. Через 10 мин конверсия субстрата достигает 95%, выход целевого ТМБХ - 63%, эффективность использования окислителя - 36%.
Пример 19.
Процесс проводят, как в примере 6, но в качестве субстрата вместо 2,3,6-триметилфенола берут 2,3,5-триметилфенол. Через 60 мин конверсия субстрата достигает 60%, выход ТМБХ - 37%, эффективность использования окислителя - 37%.
Примеры 18-19 показывает, что при использовании в качестве окисляемого субстрата 2,3,5-триметилфенола выход ТМБХ и эффективность использования окислителя ниже, чем в случае изомерного 2,3,6-триметилфенола.
Пример 20.
Процесс проводят, как в примере 6, но в качестве субстрата вместо 2,3,6-триметилфенола берут 2,6-диметилфенол (ДМФ). Через 40 мин конверсия ДМФ достигает 90%, выход 2,6-диметил-1,4-бензохинона - 88%, эффективность использования H2O2 - 88%.
Пример 21.
Процесс проводят, как в примере 6, но в качестве субстрата вместо 2,3,6-триметилфенола берут 2,6-ди-трет-бутил-фенол (ДТБФ). Через 40 мин конверсия ДТБФ - 98%, выход 2,6-ди-трет-бутил-хинона - 88%, эффективность использования H2O2 - 88%.
Примеры 20-21 показывают, что предложенный способ может быть использован для получения алкилзамещенных бензохинонов разного строения.
Пример 22.
Процесс проводят, как в примере 1, но в качестве субстрата берут 11 мг (0.07 ммоль) 2-метил-1-нафтола (МНЛ) и добавляют 28 μл (0.28 ммоль) 30%-ной H2O2 (мольное отношение [H2O2]/[МНЛ]=4/1). Через 10 мин конверсия МНЛ - 100%, выход 2-метил-1,4-нафтохинона (МНХ, менадиона, витамина K3) достигает 82% при эффективности использования окислителя - 38%.
Пример 23.
Процесс проводят, как в примере 22, но при 40°С. Через 15 мин конверсия МНЛ - 100%, выход МНХ - 80%, эффективность использования окислителя - 38%.
Пример 24.
Процесс проводят, как в примере 23, но вместо мольного отношения [H2O2]/[МНЛ]=4/1 берут отношение [H2O2]/[МНЛ]=3/1. Через 15 мин конверсия МНЛ - 100%, выход МНХ - 73%, эффективность использования окислителя - 51%.
Пример 25.
Процесс проводят, как в примере 22, но при 25°С. Через 20 мин конверсия МНЛ - 95%, выход МНХ - 77%, эффективность использования окислителя - 36%.
Примеры 22-25 показывают, что предложенный способ может быть использован для получения 2-метил-1,4-нафтохинона (менадиона или витамина K3).
Обобщенные результаты проведения процесса по примерам 1-25 приведены в таблице.
Приведенные примеры показывают, что предлагаемый настоящим изобретением способ получения хинонов является достаточно дешевым, простым в реализации и экологически чистым и позволяет получить целевой продукт с высоким выходом (как на исходный субстрат, так и на окислитель) при использовании небольших количеств катализатора.
1. Способ получения замещенных хинонов путем окисления алкилароматических соединений пероксидом водорода в присутствии катализатора в среде органического растворителя, отличающийся тем, что в качестве катализатора используют кислые алкиламмониевые соли ванадийсодержащих полиоксовольфраматов (Alkm-nHn)[γ-XV2W10O40], где в качестве центрального атома полиоксометаллата X может быть Si или P, предпочтительно, P; в качестве алкиламмонийного катиона полиоксовольфрамата Alk=(CkH2k+1)4N, k=4-6; число протонов n в катионной части полиоксовольфрамата (Alkm-nHn)[γ-XV2W10O40] варьируется от 0 до 2.
2. Способ по п. 1, отличающийся тем, что в качестве алкилароматических соединений берут алкилзамещенные фенолы (2,3,6-триметилфенол, 2,3,5-триметилфенол, 2,6-диметилфенол, 2,6-ди-трет-бутилфенол) и нафтолы (2-метил-1-нафтол).
3. Способ по п. 1, отличающийся тем, что в качестве окислителя используют водный раствор пероксида водорода с содержанием пероксида не менее 30 мас.%.
4. Способ по п. 1, отличающийся тем, что процесс ведут при температуре не ниже 25°C.
5. Способ по п. 1, отличающийся тем, что в качестве органического растворителя используют ацетонитрил или его смесь со спиртами.
6. Способ по п. 1, отличающийся тем, что используют концентрацию субстрата не выше 0,4 М.
7. Способ по п. 1, отличающийся тем, что используют мольное отношение пероксид водорода/субстрат не ниже 2/1.
8. Способ по п. 1, отличающийся тем, что мольное отношение субстрат/катализатор не ниже 66.