Композиции и способы для лечения болезни гоше
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и касается фармацевтической композиции для лечения болезни Гоше и способа лечения. Композиция содержит велаглюцеразу в эффективном количестве, лимонную кислоту, полисорбат 20, цитрат натрия, сахарозу. Группа изобретений обеспечивает уменьшение иммунного ответа и уменьшение реакций на участке инъекций у пациентов, проходящих лечение болезни Гоше. 3 н. и 34 з.п. ф-лы, 9 пр., 40 табл., 26 фиг.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет на основании заявки на патент США No. 61/229195, поданной 28 июля 2009, заявки на патент США No. 61/303044, поданной 10 февраля 2010, заявки на патент США No. 61/317513, поданной 25 марта 2010, заявки на патент США No. 61/333372, поданной 11 мая 2010 и заявки на патент США No. 61/359338, поданной 28 июня 2010. Содержание вышеперечисленных заявок включено в данную заявку по ссылке во всей полноте.
УРОВЕНЬ ТЕХНИКИ
Болезнь Гоше - аутосомно-рецессивная лизосомное нарушение накопления, которое обусловлена дефицитом лизосомного фермента глюкоцереброзидазы (GCB). GCB гидролизует глюкоцереброзиды - гликолипиды, образующиеся при деградации гликосфинголипидов мембран лейкоцитов и эритроцитов. Недостаток этого фермента приводит у больных болезнью Гоше к аккумуляции глюкоцереброзидов в больших количествах в лизосомах фагоцитов печени, селезенки и костного мозга. Накопление этих молекул приводит к ряду клинических проявлений, включая спленомегалию, гепатомегалию, нарушения скелета, тромбоцитопению и анемию (Beutler et al. Gaucher disease; In: The Metabolic and Molecular Bases of Inherited Disease (McGraw-Hill, Inc, New York, 1995) стр.2625-2639).
Лечение пациентов, страдающих от этого заболевания, заключается в назначении обезболивающих средств для уменьшения скелетных болей, переливании крови и тромбоцитов и, в некоторых случаях, в спленэктомии. Пациентам с эрозиями костей иногда требуется замена суставов.
Для лечения болезни Гоше применяется заместительная ферментативная терапия с GCB. В настоящее время лечение болезни Гоше осуществляется при помощи GCB с углеводным ремоделированием, полученных из человеческой плаценты или клеток яичника китайского хомячка (СНО), трансфектированных конструкцией, экспрессирующей GCB, известных под названиями альглюцераза и имиглюцераза, соответственно.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение основывается, в частности, на открытии того, что при введении субъекту (например, больному болезнью Гоше), велаглюцераза дает меньший иммунный ответ (например, продуцируется меньшее количество антител, например, нейтрализующих), нежели имиглюцераза. Изобретение относится, среди прочего, к композициям и способам для выбора лечения больного болезнью Гоше, выбора субъекта для лечения велаглюцеразой (самой по себе или в комбинации с иными терапевтическими способами), к способам уменьшения реакций на участке инъекций у субъектов, проходящих лечение болезни Гоше, и к способам лечения болезни Гоше. Изобретение также относится, среди прочего, к способам определения продукции антител, в том числе, нейтрализующих, у субъектов, проходящих лечение по поводу болезни Гоше.
В некоторых аспектах, сущность изобретения предоставляет способ лечения субъекта с болезнью Гоше (напр., болезнью Гоше I типа), который включает
проведение заместительной терапии глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso - талиглюцеразой) путем внутривенных инфузии субъекту в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут или 45 минут в лечебных целях.
В некоторых вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) осуществляется более одного раза, каждая дополнительная доза заместительной терапии глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) вводится путем внутривенных инфузии субъекту в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут или 45 минут.
В некоторых вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) осуществляется в дозировке от 15 до 60 ед/кг (напр., от 30 ед/кг до 60 ед/кг, а также 15 ед/кг, 30 ед/кг, 45 ед/кг, либо 60 ед/кг), в дозировке, равной 22,5 ед/кг или ниже, в дозировке от 22,5 до 37,5 ед/кг, в дозировке от 37,5 до 52,5 ед/кг либо в дозировке, равной 52,5 ед/кг или выше. В некоторых вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) осуществляется в дозировке от 2,5 до 60 ед/кг. В некоторых вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) осуществляется через неделю. В иных вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами (напр., велаглюцеразой, имиглюцеразой, uplyso) осуществляется каждую неделю. В некоторых вариантах воплощения, велаглюцеразу вводят три раза в неделю путем внутривенной инфузии, в дозировке 2,5 ед/кг.
В некоторых вариантах воплощения, инфузию одной или большего количества доз (например, доз описанных в настоящем документе), проводят в течение более 60-ти минут.
В некоторых вариантах воплощения, заместительная терапия глюкоцереброзидазными ферментами велаглюцеразой включает:
восстановление лиофилизированной велаглюцеразы фармацевтически приемлемым носителем, например, стерильной водой для инъекций (напр., восстановление флакона на 200 единиц 2,2 мл стерильной воды для инъекций или флакона на 400 единиц 4,3 мл стерильной воды для инъекций) с образованием раствора, напр., без встряхивания флаконов после добавления стерильной воды для инъекций; опционально, проверяя раствор во флаконах (и, например, опционально, проверяя нарушение окраски раствора или наличие не растворившихся частиц, опционально, принимая решение не использовать раствор, если он имеет неправильную окраску или если присутствуют не растворившиеся частицы);
выливание части раствора для получения предустановленной дозировки (напр., дозы, определенной в данном документе: 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг);
разбавление раствора, напр., в 100 мл 0,9%-го раствора хлорида натрия для внутривенного введения, формируя разбавленный раствор; опционально, слегка перемешивая разбавленный раствор, но не встряхивая его; и
введение разбавленного раствора субъекту путем внутривенной инфузии, напр., вводя разбавленный раствор в течение более одного часа со скоростью 1 ед/кг/минута.
В некоторых вариантах воплощения, глюкоцереброзидазные ферменты в рамках заместительной терапии вводят со скоростью переливания 2 ед/кг/минута, 1,5 ед/кг/минута, 1 ед/кг/минута либо 0,5 ед/кг/минута.
В некоторых вариантах воплощения, введение препарата осуществляется в домашних условиях (напр., дома у субъекта, на рабочем месте, в иных неклинических (т.е., внебольничных) условиях). В некоторых вариантах воплощения, введение препарата (напр., инфузия) осуществляется медицинским работником (напр., медсестрой, ассистентом врача). Например, если у субъекта не наблюдались нежелательные явления (НЯ) (напр., связанные с приемом препарата серьезные НЯ или связанные с инфузией НЯ, напр., явление, описанное в данном документе), напр., после одного, двух, трех введений (напр., инфузии) глюкоцереброзидазной ферментной заместительной терапии, то субъекту можно получать дальнейшую терапию внебольнично.
С другой стороны, сущность изобретения включает способ идентификации субъекта с болезнью Гоше, подходящего (напр., являющегося кандидатом) для лечения при помощи глюкоцереброзидазной заместительной ферментной терапии (напр., велаглюцеразой). Способ включает оценивание (напр., измерение, напр., по способу, описанному в данном документе, такому как ИФА (ELISA) или радиоиммунопреципитационный анализ (RIP)) на присутствие антител (напр., нейтрализующих антител) (напр., IgE, IgM, IgG и/или IgA антител) к глюкоцереброзидазной заместительной ферментной терапии (напр., к терапии, вводящейся субъекту) (напр., имиглюцераза или uplyso) в образце от субъекта, напр., и сравнение измеренного уровня антител к терапии с нормой (напр., с отрицательным контролем). К примеру, если уровень антител у субъекта превышает уровень, измеренный для отрицательного контроля (напр., отрицательного контроля по данным ИФА (ELISA)), то субъекта относят к числу субъектов, формирующих антитела к глюкоцереброзидазной заместительной ферментной терапии. Субъекта относят к пригодным для альтернативной терапии болезни Гоше (напр., терапии велаглюцеразой), напр., если измеренная величина превосходит величину стандарта, напр., более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% либо 90%.
В некоторых вариантах воплощения, в качестве образца используется кровь или сыворотка. В некоторых вариантах воплощения, образец модифицируют. К примеру, измерение уровня антител осуществляют путем контактирования образца с аналитическим реактивом, напр., меченым реактивом (напр., меченой глюкоцереброзидазой), и субстрата или клетки, напр., субстрата или клетки, связывающихся с антителом к препарату глюкоцереброзидазной заместительной ферментной терапии. В некоторых вариантах воплощения, измерение уровня антител осуществляют для образца, обогащенного антителами, например, для концентрированного образца крови или сыворотки. В некоторых вариантах воплощения, определение осуществляется по способу, описанному в данном документе.
В некоторых вариантах воплощения, способ включает определение уровня антител, напр., по способу, описанному в данном документе.
С другой стороны, сущность изобретения включает способ выбора субъекта с болезнью Гоше для лечения при помощи глюкоцереброзидазной заместительной ферментной терапии. Опционально, способ включает выбор субъекта для такой терапии на основании того, что согласно анализам, субъект продуцирует антитела (напр., нейтрализующие антитела) к текущей его терапии, назначенной по поводу болезни Гоше. Способ включает оценивание (напр., измерение, напр., по способу, описанному в данном документе, такому как ИФА (ELISA) или радиоиммунопреципитационный анализ (RIP)) или получение оценивания на присутствие антител к глюкоцереброзидазной заместительной ферментной терапии (напр., к терапии, вводящейся субъекту) (напр., имиглюцераза или uplyso) в образце от субъекта, напр., и сравнение измеренного уровня антител к терапии с нормой (напр., с отрицательным контролем). К примеру, если уровень антител у субъекта превышает уровень, измеренный для отрицательного контроля (напр., отрицательного контроля поданным ИФА (ELISA)), то субъекта относят к числу субъектов, формирующих антитела к глюкоцереброзидазной заместительной ферментной терапии. Способы, опционально, включают выбор альтернативной терапии болезни Гоше для субъекта (напр., терапии велаглюцеразой), напр., если измеренная величина превосходит величину стандарта (напр., отрицательного контроля), напр., более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% либо 90%.
В некоторых вариантах воплощения, в качестве образца используется кровь или сыворотка. В некоторых вариантах воплощения, образец модифицируют. К примеру, измерение уровня антител осуществляют путем контактирования образца с аналитическим реактивом, напр., меченым реактивом (напр., меченной глюкоцереброзидазой), и субстрата или клетки, напр., субстрата или клетки, связывающихся с антителом к препарату глюкоцереброзидазной заместительной ферментной терапии. В некоторых вариантах воплощения, измерение уровня антител осуществляют для образца, обогащенного антителами, например, для концентрированного образца крови или сыворотки. В некоторых вариантах воплощения, определение осуществлялось по способу, описанному в данном документе.
В некоторых вариантах воплощения, способ включает определение уровня антител, напр., по способу, описанному в данном документе.
В некоторых вариантах воплощения, субъект положителен по IgE-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, субъект положителен по IgM-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, субъект положителен по IgG- и/или IgA-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
С другой стороны, сущность изобретения включает способ лечения субъекта с болезнью Гоше. Способ включает выбор субъекта для такой терапии на основании тестов о том, что субъект продуцирует антитела (напр., нейтрализующие антитела) к текущей его терапии, назначенной по поводу болезни Гоше, напр., производимых по способу, описанному в данном документе, или на основании того, что субъект находится в группе риска по развитию антител (напр., нейтрализующих антител) к препарату против болезни Гоше (напр., имиглюцеразе или uplyso), и введение велаглюцеразы субъекту.
В некоторых вариантах воплощения, субъект положителен по IgE-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, субъект положителен по IgM-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, субъект положителен по IgG- и/или IgA-антителам к терапии, которую он принимает по поводу болезни Гоше (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 15 до 60 ед/кг (напр., от 30 ед/кг до 60 ед/кг, а также 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг), в дозировке, равной 22,5 ед/кг или ниже, в дозировке от 22,5 до 37,5 ед/кг, в дозировке от 37,5 до 52,5 ед/кг либо в дозировке, равной 52,5 ед/кг или выше. В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 2,5 до 60 ед/кг. В некоторых вариантах воплощения, велаглюцеразу вводят через неделю путем внутривенных инфузии. В иных вариантах воплощения, велаглюцеразу вводят каждую неделю путем внутривенных инфузии. В некоторых вариантах воплощения, велаглюцеразу вводят три раза в неделю путем внутривенной инфузии, в дозировке 2,5 ед/кг.
В некоторых вариантах воплощения, инфузию дозы (напр., дозы, описанной в данном документе), осуществляют в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут либо 45 минут. В предпочтительных вариантах воплощения, инфузию дозы осуществляют в течение более 60 минут.
В некоторых вариантах воплощения, способ включает:
восстановление лиофилизированной велаглюцеразы фармацевтически приемлемым носителем, например, стерильной водой для инъекций (напр., восстановление флакона на 200 единиц 2,2 мл стерильной воды для инъекций или флакона на 400 единиц 4,3 мл стерильной воды для инъекций) с образованием раствора, напр., без встряхивания флаконов после добавления стерильной воды для инъекций; опционально, проверяя раствор во флаконах (и, в т.ч., опционально, проверяя нарушение окраски раствора или наличие не растворившихся частиц, опционально, принимая решение не использовать раствор, если он имеет неправильную окраску или если присутствуют не растворившиеся частицы);
выливание части раствора для получения предустановленной дозировки (напр., дозы, определенной в данном документе: 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг);
разбавление раствора, напр., в 100 мл 0,9%-го раствора хлорида натрия для внутривенного введения, формируя разбавленный раствор; опционально, слегка перемешивая разбавленный раствор, но не встряхивая его; и
введение разбавленного раствора субъекту путем внутривенной инфузии.
В некоторых вариантах воплощения, велаглюцеразу вводят со скоростью переливания 2 ед/кг/минута, 1,5 ед/кг/минута, 1 ед/кг/минута либо 0,5 ед/кг/минута.
В некоторых вариантах воплощения, введение препарата осуществляется в домашних условиях (напр., дома у субъекта, на рабочем месте, в иных неклинических (т.е., внебольничных) условиях). В некоторых вариантах воплощения, введение препарата (напр., инфузия) осуществляется медицинским работником (напр., медсестрой, ассистентом врача). Например, если у субъекта не наблюдались нежелательные явления (НЯ) (напр., связанные с приемом препарата серьезные НЯ или связанные с инфузией НЯ, напр., явление, описанное в данном документе), напр., после одного, двух или трех введений (напр., инфузии) велаглюцеразы, то субъекту можно получать дальнейшую терапию внебольнично.
С другой стороны, сущность изобретения включает способ идентификации субъекта с болезнью Гоше, подходящего (напр., являющегося кандидатом) для лечения при помощи глюкоцереброзидазной заместительной ферментной терапии (напр., велаглюцеразой). Способ включает оценивание (напр., измерение) субъекта на развитие реакции в месте введения (напр., нежелательного явления, связанного с инфузией) (напр., во время инфузии препарата для глюкоцереброзидазной заместительной ферментной терапии или спустя 12 часов) (напр., к терапии, вводящейся субъекту, напр., имиглюцераза или uplyso), напр., и сравнение измеренного уровня реакции с нормой (напр., с отрицательным контролем). К примеру, если у субъекта была измерена величина местной реакции на терапию, превышающую величину для отрицательного контроля (напр., местной реакции после введения субъекту плацебо), то субъекта относят к пригодным для альтернативной терапии болезни Гоше (напр., терапии велаглюцеразой), напр., если измеренная величина местной реакции к терапии, принимаемой субъектом по поводу болезни Гоше, превосходит величину стандарта, напр., более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% либо 90%.
В некоторых вариантах воплощения, способ включает определение уровня местной реакции, напр., по способу, описанному в данном документе.
С другой стороны, сущность изобретения включает способ выбора субъекта с болезнью Гоше для лечения при помощи глюкоцереброзидазной заместительной ферментной терапии. Опционально, способ включает выбор субъекта для такой терапии на основании того, что субъекту необходимо уменьшить местные реакции (напр., уменьшить в сравнении с реакцией, обусловленной введением текущей его терапии, назначенной по поводу болезни Гоше, напр., имиглюцеразы или uplyso). Способ включает оценивание (напр., измерение) или получение оценки субъекта на развитие реакции в месте введения (напр., нежелательного явления, связанного с инфузией) (напр., во время инфузии препарата для глюкоцереброзидазной заместительной ферментной терапии или спустя 12 часов) (напр., к терапии, вводящейся субъекту, напр., имиглюцераза или uplyso), напр., и сравнение измеренного уровня реакции с нормой (напр., с отрицательным контролем). К примеру, если у субъекта была измерена величина местной реакции на текущую терапию по поводу болезни Гоше, превышающую (напр., на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%. 65%, 70%, 75%, 80%, 85% либо 90%) величину для отрицательного контроля (напр., местной реакции после введения субъекту плацебо), то субъекта относят к пригодным для альтернативной терапии болезни Гоше (напр., терапии велаглюцеразой), напр., если измеренная величина местной реакции к терапии, принимаемой субъектом по поводу болезни Гоше, превосходит величину стандарта (напр., отрицательного контроля), напр., более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% либо 90%.
В некоторых вариантах воплощения, способ включает определение уровня антител, напр., по способу, описанному в данном документе.
С другой стороны, сущность изобретения включает способ лечения субъекта с болезнью Гоше. Способ включает выбор субъекта для такой терапии на основании того, что субъекту необходимо уменьшить местные реакции (напр., уменьшить в сравнении с реакцией, обусловленной введением текущей его терапии, назначенной по поводу болезни Гоше, напр., имиглюцеразы или uplyso), напр., по способу описанному в данном документе и введение велаглюцеразы субъекту.
В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 15 до 60 ед/кг (напр., от 30 ед/кг до 60 ед/кг, а также 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг), в дозировке, равной 22,5 ед/кг или ниже, в дозировке от 22,5 до 37,5 ед/кг, в дозировке от 37,5 до 52,5 ед/кг либо в дозировке, равной 52,5 ед/кг или выше. В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 2,5 до 60 ед/кг. В некоторых вариантах воплощения, велаглюцеразу вводят через неделю путем внутривенных инфузии. В иных вариантах воплощения, велаглюцеразу вводят каждую неделю путем внутривенных инфузии. В некоторых вариантах воплощения, велаглюцеразу вводят три раза в неделю путем внутривенной инфузии, в дозировке 2,5 ед/кг.
В некоторых вариантах воплощения, инфузию дозы (напр., дозы, описанной в данном документе), осуществляют в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут либо 45 минут.
В некоторых вариантах воплощения, способ включает:
восстановление лиофилизированной велаглюцеразы фармацевтически приемлемым носителем, например, стерильной водой для инъекций (напр., восстановление флакона на 200 единиц 2,2 мл стерильной воды для инъекций или флакона на 400 единиц 4,3 мл стерильной воды для инъекций) с образованием раствора, напр., без встряхивания флаконов после добавления стерильной воды для инъекций; опционально, проверяя раствор во флаконах (и, в т.ч., опционально, проверяя нарушение окраски раствора или наличие не растворившихся частиц, опционально, принимая решение не использовать раствор, если он имеет неправильную окраску или если присутствуют не растворившиеся частицы);
выливание части раствора для получения предустановленной дозировки (напр., дозы, определенной в данном документе: 15 ед/кг, 30 ед/кг, 45 ед/кг, либо 60 ед/кг);
разбавление раствора, напр., в 100 мл 0,9%-го раствора хлорида натрия для внутривенного введения, формируя разбавленный раствор; опционально, слегка перемешивая разбавленный раствор, но не встряхивая его; и
введение разбавленного раствора субъекту путем внутривенной инфузии.
В некоторых вариантах воплощения, велаглюцеразу вводят со скоростью переливания 2.0 ед/кг/минута, 1,5 ед/кг/минута, 1.0 ед/кг/минута либо 0,5 ед/кг/минута.
В некоторых вариантах воплощения, введение препарата осуществляется в домашних условиях (напр., дома у субъекта, на рабочем месте, в иных неклинических (т.е., внебольничных) условиях). В некоторых вариантах воплощения, введение препарата (напр., инфузия) осуществляется медицинским работником (напр., медсестрой, ассистентом врача). Например, если у субъекта не наблюдались нежелательные явления (НЯ) (напр., связанные с приемом препарата серьезные НЯ или связанные с инфузией НЯ, напр., явление, описанное в данном документе), напр., после одного, двух или трех введений (напр., инфузии) велаглюцеразы, то субъекту можно получать дальнейшую терапию внебольнично.
В некоторых аспектах, сущность изобретения предоставляет способ выбора субъекта с болезнью Гоше (напр., болезнью Гоше I типа) для терапии велаглюцеразой, который включает
идентификацию субъекта с болезнью Гоше, получавшего глюкоцереброзидазную заместительную ферментную терапию (напр., имиглюцеразой или uplyso) и имеющего число тромбоцитов ниже нормы; и
выбор субъекта для терапии велаглюцеразой на основании того, что у субъекта число тромбоцитов ниже нормы.
В некоторых вариантах воплощения, способ включает оценивание (напр., измерение уровня тромбоцитов или получение оценки уровня тромбоцитов в образце, полученном от субъекта, и сравнивание измеренной величины уровня тромбоцитов со стандартом (напр., отрицательным контролем).
В некоторых вариантах воплощения, в качестве образца используется кровь или сыворотка. В некоторых вариантах воплощения, образец модифицируют. В некоторых вариантах воплощения, измерение уровня антител осуществляют для образца, обогащенного тромбоцитами, например, для концентрированного образца крови. В некоторых вариантах воплощения, определение осуществлялось по способу, описанному в данном документе.
В некоторых вариантах воплощения, способ включает определение количества тромбоцитов, напр., по способу, описанному в данном документе.
В некоторых вариантах воплощения, способ далее включает введение велаглюцеразы субъекту, напр., в дозе и по схеме, определенных в данном документе.
В некоторых вариантах воплощения, велаглюцеразу вводят способом внутривенной инфузии в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут либо 45 минут. В некоторых вариантах воплощения, инфузию осуществляют со скоростью 2 ед/кг/минута, 1,5 ед/кг/минута, 1 ед/кг/минута либо 0,5 ед/кг/минута.
В некоторых вариантах воплощения, за норматив числа тромбоцитов принимается 80×103 тромбоцитов/мм3 или ниже. В некоторых вариантах воплощения, норматив основывается на процентном увеличении среднего количества тромбоцитов после 6, 9 или 12 месяцев лечения глюкоцереброзидазной заместительной ферментной терапией. К примеру, субъект с увеличением среднего количества тромбоцитов менее чем на 80%, 75%, 70%, 65%, 60% или 55% после 9 или 12 месяцев терапии в сравнении с начальным уровнем тромбоцитов до начала глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразой, напр., в дозировке 60 ед/кг, напр., при введении через неделю в течение 9 месяцев) идентифицируется для лечения велаглюцеразой. В качестве иного примера, субъект с увеличением среднего количества тромбоцитов менее чем на 40%, 35%, 30% или 25% после 6 месяцев терапии в сравнении с начальным уровнем тромбоцитов до начала глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразой, напр., в дозировке 60 ед/кг, напр., при введении через неделю в течение 6 месяцев) идентифицируется для лечения велаглюцеразой.
В некоторых аспектах, сущность изобретения предоставляет способ лечения субъекта с болезнью Гоше (напр., болезнью Гоше I типа), который включает
выбор субъекта с болезнью Гоше, получавшего глюкоцереброзидазную заместительную ферментную терапию (напр., имиглюцеразой или uplyso) и имеющего число тромбоцитов ниже норматива, напр., субъекта, определяемого по способу, описанному в данном документе; и
введение велаглюцеразы субъекту.
В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 15 до 60 ед/кг (напр., от 30 ед/кг до 60 ед/кг, а также 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг), в дозировке, равной 22,5 ед/кг или ниже, в дозировке от 22,5 до 37,5 ед/кг, в дозировке от 37,5 до 52,5 ед/кг либо в дозировке, равной 52,5 ед/кг или выше. В некоторых вариантах воплощения, велаглюцеразу вводят в дозировке от 2,5 до 60 ед/кг. В некоторых вариантах воплощения, велаглюцеразу вводят через неделю путем внутривенных инфузии. В иных вариантах воплощения, велаглюцеразу вводят каждую неделю путем внутривенных инфузии. В некоторых вариантах воплощения, велаглюцеразу вводят три раза в неделю путем внутривенной инфузии, в дозировке 2,5 ед/кг.
В некоторых вариантах воплощения, инфузию дозы (напр., дозы, описанной в данном документе) осуществляют в течение периода времени менее 2 часов, напр., 90 минут, 80 минут, 70 минут, 60 минут, 50 минут либо 45 минут.
В некоторых вариантах воплощения, способ включает:
восстановление лиофилизированной велаглюцеразы фармацевтически приемлемым носителем, например, стерильной водой для инъекций (напр., восстановление флакона на 200 единиц 2,2 мл стерильной воды для инъекций или флакона на 400 единиц 4,3 мл стерильной воды для инъекций) с образованием раствора, напр., без встряхивания флаконов после добавления стерильной воды для инъекций; опционально, проверяя раствор во флаконах (и, например, опционально, проверяя нарушение окраски раствора или наличие не растворившихся частиц, опционально, принимая решение не использовать раствор, если он имеет неправильную окраску или если присутствуют не растворившиеся частицы);
выливание части раствора для получения предустановленной дозировки (напр., дозы, определенной в данном документе: 15 ед/кг, 30 ед/кг, 45 ед/кг либо 60 ед/кг);
разбавление раствора, напр., в 100 мл 0,9%-го раствора хлорида натрия для внутривенного введения, формируя разбавленный раствор; опционально, слегка перемешивая разбавленный раствор, но не встряхивая его; и
введение разбавленного раствора субъекту путем внутривенной инфузии.
В некоторых вариантах воплощения, велаглюцеразу вводят со скоростью переливания 2 ед/кг/минута, 1,5 ед/кг/минута, 1 ед/кг/минута либо 0,5 ед/кг/минута.
В некоторых вариантах воплощения, введение препарата осуществляется в домашних условиях (напр., дома у субъекта, на рабочем месте, в иных неклинических (т.е., внебольничных) условиях). В некоторых вариантах воплощения, введение препарата (напр., инфузия) осуществляется медицинским работником (напр., медсестрой, ассистентом врача). Например, если у субъекта не наблюдались нежелательные явления (НЯ) (напр., связанные с приемом препарата серьезные НЯ или связанные с инфузией НЯ, напр., явление, описанное в данном документе), напр., после одного, двух, трех введений (напр., инфузии) велаглюцеразы, то субъекту можно получать дальнейшую терапию внебольнично.
С другой стороны, сущность изобретения включает способ оценивания субъекта, например субъекта, уже получающего глюкоцереброзидазную заместительную ферментную терапию (напр., имиглюцеразы, велаглюцеразы или uplyso). Способ включает определение (напр., измерение) или оценивание одного и более (напр., 1, 2, 3, 4, 5, 6 или 7) из следующих параметров субъекта:
концентрация гемоглобина, число тромбоцитов, объем печени (напр., в виде процентного отношения к массе тела), объем селезенки (напр., в виде процентного отношения к массе тела), побочные реакции в месте инфузии, скелетные параметры, присутствие антител (напр., нейтрализующих антител) (напр., IgE, IgM, IgG и/или IgA антител) к глюкоцереброзидазной заместительной ферментной терапии (напр., средняя величина одного и большего количества (напр., 1, 2, 3, 4, 5, 6 или 7) из этих параметров).
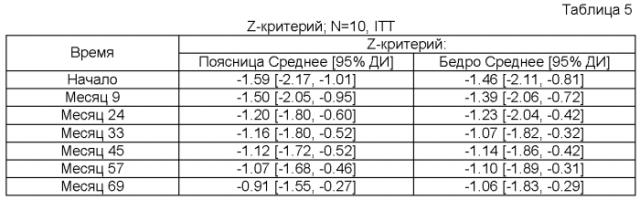
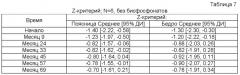
В качестве скелетного параметра может использоваться, напр., минеральная плотность костной ткани (МПКТ) (напр., при измерении изменения (напр., улучшения) Z-критерия). МПКТ может определяться, напр., способом двухэнергетической рентгеновской абсорциометрии (DEXA). К иным скелетным параметрам, которые можно определять, относятся, напр., Т-критерий (напр., для определения нормы, остеопении и остеопороза по классификации ВОЗ), рост субъекта (напр., для педиатрических больных); скелетный возраст субъекта (напр., для педиатрических больных); нагрузка на костный мозг (ВМВ) (напр., для взрослых больных).
Оценивание может проводиться, напр., примерно каждую неделю, примерно каждые две недели, примерно каждые три недели, примерно каждые четыре недели, примерно каждые два месяца, примерно каждые три месяца, примерно каждые четыре месяца, примерно каждые пять месяцев, примерно каждые шесть месяцев, примерно каждые семь месяцев, примерно каждые восемь месяцев, примерно каждые девять месяцев, примерно каждые десять месяцев, примерно каждые одиннадцать месяцев либо примерно каждые двенадцать месяцев во время курса лечения. Оценивание также может проводиться до начала лечения (напр., чтобы определить стартовые величины). Оценивание может включать сравнивание величины параметра субъекта со стандартным (напр., стандарта, описанного в данном документе, напр., отрицательного контроля) и, опционально, определение того, имеется ли разность между величиной параметра, определенной у субъекта, и стандартной величиной. Стандартная величина может быть, напр., величиной параметра, измеренного у субъекта с болезнью Гоше, проходящего лечение иной терапией по поводу болезни Гоше (напр., лечение, описанное в данном документе), или средней величиной для группы таких субъектов (напр., после терапии такой же продолжительности), либо начальной величиной, определенной для субъекта (либо средней начальной величиной, определенной для группы субъектов с болезнью Гоше) до начала терапии (напр., до начала глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразой или велаглюцеразой)). К примеру, скелетный параметр (напр., минеральная плотность костной ткани) может оцениваться на долгосрочные изменения, напр., спустя 1, 2, 3, 4 и более лет применения глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразы, велаглюцеразы или uplyso).
Оценивание может включать определение присутствия:
превосходят ли различия между одной и более величин из: концентрации гемоглобина, уровня тромбоцитов, объема печени, селезенки, скелетных параметров
и нормой (для определенного параметра) 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90%. Альтернативно или в качестве дополнения, оценивание может включать определение наличия местной реакции на инфузию (напр., во время инфузии или спустя 12 часов) и/или наличия антител (напр., нейтрализующих антител) (напр., IgE, IgM, IgG и/или IgA антитела) к глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразе или uplyso).
В некоторых вариантах воплощения, оценивание может производиться для одного и более замеров уровня гемоглобина, числа тромбоцитов и выявления антител (напр., нейтрализующих антител) к глюкоцереброзидазной заместительной ферментной терапии (напр., имиглюцеразе или uplyso). В некоторых вариантах воплощения, оценивание одного или большего количества из этих параметров производится для образца, полученного от субъекта, например, для крови или сыворотки. В некоторых вариантах воплощения, образец модифицируют. К примеру, величины получают путем контактирования образца с аналитическим реактивом и субстратом или клеткой, напр., субстратом или клеткой, связывающимися с антителом к препарату для глюкоцереброзидазной заместительной ферментной терапии. В некоторых вариантах воплощения, величины измеряют для образца, обогащенного, напр., гемоглобином или тромбоцитами, например, для концентрированного образца крови или сыворотки. В некоторых вариантах воплощения, определение осуществлялось по способу, описанному в данном документе.
На основании определения, для субъекта выбирается способ лечения. К примеру, если у субъекта, принимающего терапию по поводу болезни Гоше, например глюкоцереброзидазную заместительную ферментную терапию, напр., имиглюцеразу или uplyso, отмечается один параметр или более, отличающийся от нормы (напр., субъекта, получающего отличную терапию (велаглюцеразу)), может быть сделано решение о переводе субъекта, получающего глюкоцереброзидазную заместительную ферментную терапию, (напр., имиглюцеразу) на иную глюкоцереброзидазную заместительную ферментную терапию (напр., велаглюцеразу). К примеру, если у субъекта, проходящего терапию имиглюцеразой, были обнаружены антитела (напр., нейтрализующие антитела) (напр., IgE, IgM, IgG и/или IgA антитела) к имиглюцеразе, то он может быть переведен на терапию велаглюцеразой. В качестве иного примера, если у субъекта, проходящего терапию имиглюцеразой, обнаруживается местная реакция во время инфузии имиглюцеразы или спустя 12 часов после нее, то он может быть переведен на терапию велаглюцеразой. В качестве иного примера, если среднее количество тромбоцитов у субъекта, проходящего терапию имиглюцеразой, ниже (напр., на 5%, 10%,%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90%) среднего количество тромбоцитов, определенного для группы субъектов, получавших лечение болезни Гоше велаглюцеразой в течение такого же времени и в такой же дозировке и с такой же частотой введения, то субъект может быть переведен на терапию велаглюцеразой.
С другой стороны, сущность изобретения включает способ выбора способа лечения субъекта с болезнью Гоше, который включает
выбор терапии на основании того, что терапия может увеличивать концентрацию гемоглобина и число тромбоцитов и уменьшать объем печени и объем селезенки, уменьшать вероятность (напр., относительно стандарта, напр., стандарта, описанного в данном документе, напр., вероятность для группы субъектов, получающих иное лечение (напр., имиглюцеразу или uplyso) по поводу болезни Гоше) местной реакции от инфузии, изменять скелетные параметры (напр., увеличивать минеральную плотность костной ткани) и/или уменьшать вероятность (напр., относительно стандарта, напр., стандарта, описанного в данном документе, напр., вероятность для группы субъектов, получающих иное лечение (напр., имиглюцеразу или uplyso) по поводу болезни Гоше) формирования антител (напр., нейтрализующих антител) (напр., IgE, IgM, IgG и/или IgA антител) к терапии. Опционально, способ может включать предоставление терапии субъекту, напр., предоставление может включать введение терапии или передачу терапии субъекту. В некоторых вариантах воплощения, препарат для терапии может вводиться в дозе и/или по схеме, определенным в данном документе.
С