Противораковая терапия, направленная против раковых стволовых клеток и форм рака, устойчивых к лечению лекарственными препаратами
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для применения метаарсенита натрия для производства терапевтического агента для лечения устойчивых к таксану и цисплатину форм рака. Для этого в терапевтический агент входит композиция, содержащая метаарсенит натрия и композиция, содержащая паклитаксел, доцетаксел или цисплатин. Также предложены противоопухолевые агенты для лечения устойчивых к таксану и цисплатину форм рака. Группа изобретений позволяет снизить у пациентов количество стволовых и зрелых раковых клеток, устойчивых к действию лекарственных препаратов. 4 н. и 6 з.п. ф-лы, 2 табл., 14 ил., 9 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА АНАЛОГИЧНЫЕ ЗАЯВКИ
[0001] Настоящая заявка включает в себя притязания на преимущество Предварительной заявки №61/241180, поданной в США 10 сентября 2009 года, полный текст которой приводится ниже.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение описывает способы и лекарственные препараты для предотвращения и лечения рака и снижения числа или полного уничтожения раковых клеток; точнее, настоящее изобретение описывает профилактически или терапевтически эффективное количество или режим применения метаарсенита натрия для снижения числа или полного уничтожения раковых стволовых клеток и раковых клеток, устойчивых к лечению лекарственными препаратами.
ТЕХНИЧЕСКАЯ ОСНОВА ИЗОБРЕТЕНИЯ
[0003] Человеческие теломеры - это не кодирующие генов последовательности ДНК на концах хромосом, которые состоят из повторяющихся шестинуклеотидных (гексануклеотидных) последовательностей (TTAGGG)n. При каждом клеточном делении часть теломерной ДНК (30-100 пар оснований) теряется из-за проблемы репликации концов нуклеотидных последовательностей (Blackburn D.H., Nature, V.408, pp.53-56, 2000, и Phatak P. et al., Br. J. Pharmacol., V.152, pp.1003-1011, 2007). Теломеры помогают поддерживать целостность хромосом и предотвращают репликацию дефектных генов. Поскольку в начале жизни хромосомы содержат ограниченное количество теломерной ДНК, клетка может претерпеть лишь ограниченное число делений перед тем, как длина теломер уменьшится до критически низкого значения. Когда в нормальных клетках длина теломер уменьшается до критически низкого значения, они выходят из нормального клеточного цикла и переходят в состояние репликативной старости (Phatak P. et al., Br. J. Pharmacol., V.152, pp.1003-1011, 2007, и Holt S.E. et al., Nature Biotechnol., V.14, pp.1734-1741, 1996), однако на ранних стадиях онкогенеза, при превращении нормальных клеток в злокачественные, длина теломер уменьшается, но затем поддерживается на низком, но стабильном уровне в преобладающем большинстве случаев за счет реактивации фермента теломеразы (Blackburn D.H., Nature, V.408, pp.53-56, 2000; Phatak P. etal., Br. J. Pharmacol., V.152, pp.1003-1011, 2007, и Holt S.E. et al., Nature Biotechnol., V.14, pp.1734-1741, 1996).
Теломераза - это рибонуклеопротеин с активностью обратной транскриптазы, играющий роль матрицы при добавлении новых теломерных повторов и включающий в себя каталитическую субъединицу hTERT (сокр. - human telomerase reverse transcriptase / человеческую теломеразную обратную транскриптазу). Теломераза позволяет раковым клеткам преодолеть фундаментальное ограничение возможности бесконечного деления и делает эти клетки бессмертными. Вследствие этого теломераза и теломеры стали рассматриваться в качестве перспективных целей для способов противоракового лечения (Phatak P. et al.; Br. J. Pharmacol., V.152, pp.1003-1011, 2007, и Chumsri S. et a/., Curr. Opin. Mol. Ther, V.10, pp.323-333, 2008).
[0004] Серьезной проблемой при разработке эффективных и позволяющих достичь окончательного излечения способов лечения рака является то, что раковые образования гетерогенны: они содержат как зрелые клетки, так и клетки, отвечающие за самовозобновление клеточной популяции - так называемые стволовые клетки. Используемые в настоящее время противораковые средства направлены в основном на уничтожение популяции зрелых клеток, однако они не способны полностью уничтожить раковые стволовые клетки. Вследствие этого раковые заболевания часто дают рецидивы, и после этого опухоли состоят из более агрессивных раковых клеток, сходных со стволовыми клетками и устойчивых к лекарственному лечению (Chumsri S. et al., Curr. Opin. Mol. Ther., V.10, pp.323-333, 2008). Следовательно, существует потребность в новых терапевтических средствах и/или режимах лечения, которые были бы способны ингибировать активность теломеразы и/или воздействовать на теломеры для снижения числа или полного уничтожения как зрелых раковых клеток, так и раковых клеток, сходных со стволовыми клетками, включая раковые стволовые клетки, устойчивые к лекарственному лечению, и зрелые раковые клетки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0005] В одном из аспектов настоящего изобретения предлагается способ лечения стойких к лечению форм рака у пациента. Лечение осуществляется с помощью введения пациенту терапевтически эффективного количества метаарсенита натрия (NaAsO2 или KML001), в форме монотерапии или в сочетании с другим противораковым средством или средствами. В некоторых вариантах осуществления настоящего изобретения метаарсенит натрия вводится в единичной дозировке от 0,1 до 20 мг один или несколько раз в день. В некоторых вариантах его осуществления после лечения метаарсенитом натрия пациент может наблюдаться для выявления присутствия популяции стволовых клеток. В некоторых других вариантах его осуществления после лечения метаарсенитом натрия пациент может наблюдаться таким образом в течение срока до четырех лет или более. В некоторых его вариантах осуществления устойчивым к лечению раковым заболеванием является рак предстательной железы, рак легких, лимфома или лейкемия.
[0006] В другом аспекте настоящего изобретения предлагается способ лечения ракового пациента с повышенным сывороточным уровнем IL-6, включающий в себя введение пациенту терапевтически эффективного количества метаарсенита натрия и отслеживание сывороточного уровня IL-6 у пациента после его последнего лечения метаарсенитом натрия. Отслеживание уровня IL-6 у пациента может осуществляться периодически в течение срока до четырех лет и более после завершения его лечения метаарсенитом натрия.
[0007] В другом аспекте настоящего изобретения предлагается способ повышения эффективности противоракового средства у пациента, страдающего формой рака, устойчивой к лекарственному лечению, включающий в себя введение пациенту терапевтически эффективного количества метаарсенита натрия и противоракового средства, к лечению которым у соответствующей формы рака было показано наличие устойчивости.
[0008] В еще одном аспекте настоящего изобретения предлагается способ повышения чувствительности стойких к лечению раковых клеток у пациента к противораковому средству, к которому ранее раковые клетки были устойчивы, включающий в себя введение пациенту терапевтически эффективного количества метаарсенита натрия и соответствующего противоракового средства. Это противораковое средство может вводиться до начала режима лечения метаарсенитом натрия, во время его осуществления или после окончания режима лечения метаарсенитом натрия.
[0009] В еще одном аспекте настоящего изобретения предлагается способ снижения вероятности или полного предотвращения возникновения рецидивов ракового заболевания у пациента. Этот способ включает в себя введение пациенту терапевтически эффективного количества метаарсенита натрия после завершения режима лечения одним или несколькими противораковыми средствами. В некоторых вариантах осуществления настоящего изобретения у пациента отслеживается присутствие популяции раковых стволовых клеток после лечения метаарсенитом натрия. Это отслеживание может осуществляться периодически в течение срока длительностью до четырех лет и более.
[0010] Независимо от конкретной теории или механизма, уменьшение или полное уничтожение популяции раковых стволовых клеток приводит к уменьшению или полному уничтожению популяции раковых клеток, производимых популяцией раковых стволовых клеток, и, таким образом, замедляет или полностью останавливает рост опухоли, уменьшает общий размер опухоли и замедляет или полностью подавляет образование опухоли и/или образование метастазов. Другими словами, уменьшение или полное уничтожение популяции раковых стволовых клеток подавляет образование, рост и повторное образование опухоли и/или метастазов за счет раковых клеток.
[0011] В соответствии с одним из аспектов настоящего изобретения, оно описывает способ лечения рака, включающий в себя введение индивидууму терапевтически эффективного количества метаарсенита натрия, достаточного для уменьшения или полного уничтожения популяции раковых стволовых клеток, устойчивых к лекарственному лечению. В другом варианте осуществления, связанном с этим аспектом изобретения, популяция раковых стволовых клеток является устойчивой к паклитакселу. В еще одном близком варианте осуществления популяция раковых стволовых клеток является устойчивой к доцетакселу.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
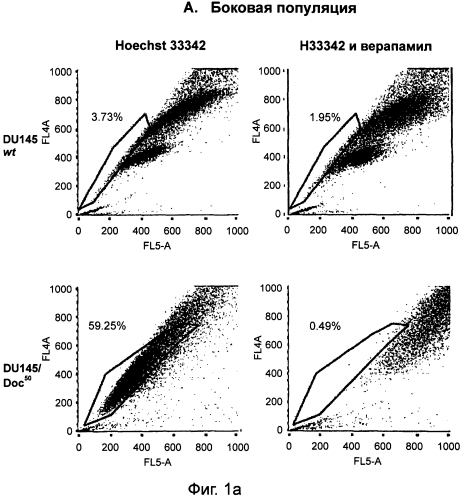
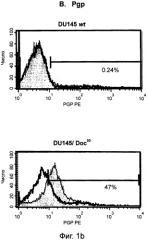
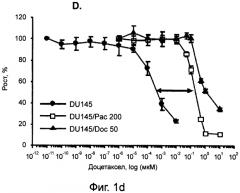
[0012] На фиг.1А показано выявление боковой популяции (SP) в клетках DU145wt и в клетках DU145/Doc50, устойчивых к доцетакселу, с помощью красителя Hoechst 33342. На фиг.1В показана экспрессия Pgp на поверхности клеток у клонов дикого типа и у устойчивых клонов, определенная с помощью проточной цитометрии. Белым обозначены графики для клеток, окрашенных РЕ (фикоэритином) на контрольный изотип, а серым - графики для клеток, положительно окрашивающихся на Рgр. На фиг.1C показаны гистограммы для окрашивания на CD44 (серые графики) в сравнении с окрашиванием на контрольный изотип (белые графики) для клеток линии DU145wt и клеток, устойчивых к таксанам. На фиг.1D показаны графики роста, позволяющие сравнить клетки линии DU145wt и клетки, устойчивые к паклитакселу и к доцетакселу, после их обработки доцетакселом в МТТ-тесте. На фиг.1Е показаны графики роста, позволяющие сравнить клетки линии DU145wt и клетки, устойчивые к паклитакселу и к доцетакселу, после их обработки KML001 в МТТ-тесте.
[0013] На фиг.2А показана боковая популяция клеток из линии DU145wt, окрашенной красителем DCV. На фиг.2В показана боковая популяция клеток из линии DU145wt, обработанной фумитреморгином С (FTC), ингибитором BCRP/ABCG2. На фиг.2С показана боковая популяция клеток из линии DU145wt, обработанной верапамилом, ингибитором Pgp/ABCB1.
[0014] на фиг.3А показаны клетки линии DU145wt, обработанной обычной (контрольной) средой. На фиг.3В показаны клетки линии DU145wt, предварительно обработанной средой, содержащей KML001 в концентрации, равной IC100 (13 мкМ), в течение 72 ч.
[0015] На фиг.4А показаны результаты пролиферационного МТТ-теста для клеток линии DU145/Pac200, обработанной KML001. На фиг.4В показаны результаты пролиферационного МТТ-теста для клеток линии DU145/Pac200, обработанной GRN163L.
[0016] На фиг.5А показана боковая популяция клеток линии DU145/Pac200, обработанной только красителем DCV. На фиг.5В показана боковая популяция клеток линии DU145/Pac200, обработанной красителем DCV и фумитреморгином С (FTC). На фиг.5С показана боковая популяция клеток линии DU145/Pac200, обработанной красителем DCV и верапамилом. На фиг.5D показаны результаты теста на боковую популяцию для клеток линии DU145/Pac200, обработанной KML001 в концентрации, равной IC100. На фиг.5Е показаны результаты теста на боковую популяцию для клеток линии DU145/Pac200, обработанной GRN163L в концентрации, равной IC100.
[0017] На фиг.6А и фиг.6В показан рост клеток рака предстательной железы (DU145 и DU145/Pac200, соответственно) в тесте на клоногенные клетки, выраженный как среднее число колоний, образованных необработанными клеточными линиями и клеточными линиями, обработанными KML001.
[0018] На фиг.7 показаны графики роста, полученные в стандартном МТТ-тесте с пятидневной обработкой KML001. Они позволяют сравнить данные для фракции нерассортированных клеток, фракции SP- и фракции SP+, полученных из клеточной линии рака предстательной железы DU145/Pac200.
[0019] На фиг.8А и фиг.8В показана экспрессия гена hTERT, измеренная с помощью количественной RT-PCR. А. Уровень транскрипта мРНК теломеразы в отсортированных фракциях SP- и SP+ клеточной линии DU145/Pac200 характеризуется сходными уровнями экспрессии. В. Снижение уровня экспрессии hTERT после 72 ч обработки KML001 в концентрациях, равных IC50 и IC100, определенное с помощью стандартного МТТ-теста.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] Настоящее изобретение описывает способы предотвращения, лечения и/контроля развития рака у млекопитающих, в особенности у людей. Эти способы включают в себя введение нуждающемуся в этом индивидууму терапевтически эффективного количества метаарсенита натрия, снижающего или полностью уничтожающего популяцию раковых стволовых клеток, а также зрелых раковых клеток, устойчивых к лекарственному лечению, и раковых стволовых клеток, устойчивых к лекарственному лечению.
[0021] Это изобретение частично основано на результатах экспериментов, в соответствии с которыми метаарсенит натрия (KML001), лекарственный препарат, проходящий клинические испытания фазы I/II при лечении рака предстательной железы, может воздействовать как на каталитическую субъединицу теломеразы, так и на теломеры, и подавляет рост популяций зрелых клеток и стволовых клеток клеточных линий рака предстательной железы, не подвергавшихся химиотерапевтическому лечению и устойчивых к химиотерапевтическому лечению.
ОПРЕДЕЛЕНИЯ
[0022] При его использовании в этой заявке, термином "раковая(ые) стволовая(ые) клетка(и)" обозначается клетка, которая может быть клеткой-предшественником высокопролиферативных раковых клеток. Раковая стволовая клетка обладает способностью воссоздавать опухоль, подтвержденной ее способностью образовывать опухоли у млекопитающих с ослабленным иммунитетом, например, у мышей, и обычно образовывать опухоли при последующих последовательных трансплантациях у млекопитающих с ослабленным иммунитетом, например, у мышей. Раковые стволовые клетки также обычно медленно растут по сравнению с основной массой опухоли; это означает, что раковые стволовые клетки являются, как правило, латентными. В некоторых (но не во всех) случаях раковые стволовые клетки могут составлять приблизительно от 0,1% до 20% от всей опухоли.
[0023] При его использовании в этой заявке, термином "противораковое средство" обозначается любой способ лечения рака, включая лекарственное лечение, иммунотерапию, таргетную терапию, гормональную терапию, химиотерапию, в том числе с использованием алкилирующих соединений, антиметаболитов, антрациклинов, растительных алкалоидов, ингибиторов топоизомеразы, ингибиторов киназы и других противоопухолевых средств, хирургию и радиационную терапию.
[0024] При его использовании в этой заявке, термином "терапевтически эффективное количество" обозначается количество метаарсенита натрия, достаточное для предотвращения развития, возникновения или рецидива рака или раковых стволовых клеток или одного или нескольких симптомов рака, для улучшения или усиления профилактического эффекта или эффектов другого лечения, снижения степени тяжести и длительности ракового заболевания, ослабления одного или нескольких симптомов ракового заболевания, предотвращения его перехода в более продвинутую стадию, для регрессии рака и/или для улучшения или усиления терапевтического эффекта или эффектов другого лечения. В некоторых вариантах осуществления настоящего изобретения терапевтически эффективным количеством метаарсенита натрия является его количество, эффективное после его введения для достижения одного, двух, трех или более из указанных далее результатов: (1) уменьшения или полного уничтожения популяции раковых стволовых клеток; (2) уменьшения или полного уничтожения популяции раковых клеток; (3) замедления роста опухоли или новообразования; (4) нарушения формирования опухоли; (5) полного уничтожения, удаления или контроля развития первичного, местно-распространенного и/или метастатического рака; (6) снижения смертности; (7) повышения длительности или частоты выживаемости без заболевания, рецидивов или прогрессии и/или общей выживаемости; (8) повышения частоты отклика на лечение, длительности отклика или числа пациентов, у которых удается достичь отклика на лечение или ремиссии; (9) поддержания размера опухоли и предотвращения ее увеличения или поддержания ее увеличения на уровне менее 10% или менее 5% или менее 4% или менее 2%; (10) повышения числа пациентов, у которых удается достичь ремиссии; (11) увеличение периода или продолжительности ремиссии;
(12) снижения частоты рецидивирования ракового заболевания; (13) увеличения длительности промежутков времени между рецидивами ракового заболевания; (14) ослабления связанных с раком симптомов и/или улучшения качества жизни, и (15) снижения устойчивости раковых клеток к лекарственным препаратам.
[0025] При его использовании в этой заявке, термином "терапевтически эффективный режим лечения" обозначается режим, определяющий дозировку, время, частоту и длительность применения метаарсенита натрия для лечения и/или контроля ракового заболевания или его симптомов. В конкретном варианте осуществления режим лечения позволяет достигнуть одного или нескольких из следующих результатов: (1) уменьшения или полного уничтожения популяции раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению; (2) уменьшения или полного уничтожения популяции раковых клеток; (3) замедления роста опухоли или новообразования; (4) нарушения формирования опухоли; (5) полного уничтожения, удаления или контроля развития первичного, местно-распространенного и/или метастатического рака; (6) снижения смертности; (7) повышения длительности или частоты выживаемости без заболевания, рецидивов или прогрессии и/или общей выживаемости; (8) повышения частоты отклика на лечение, длительности отклика или числа пациентов, у которых удается достичь отклика на лечение или ремиссии; (9) снижения частоты госпитализации; (10) снижения длительности госпитализации; (11) поддержания размера опухоли и предотвращения ее увеличения или поддержания ее увеличения на уровне менее 10%, предпочтительно менее 5%, предпочтительно менее 4%, предпочтительно менее 2%; (12) увеличения числа пациентов, у которых удается достичь ремиссии; (13) увеличения чувствительности раковых клеток пациента, устойчивых к лекарственному лечению, в том числе раковых стволовых клеток, к лекарственному препарату или препаратам, к лечению которыми они устойчивы.
[0026] При их использовании в этой заявке, термины "индивидуум" («субьект») и "пациент" являются синонимами. При его использовании в этой заявке, термином "индивидуум" могут обозначаться животные, преимущественно млекопитающие, в частности, не относящиеся к приматам (например, коровы, свиньи, лошади, кошки, собаки, крысы и т.д.) и приматы (например, обезьяны и люди), наиболее предпочтительно - люди. В некоторых вариантах осуществления настоящего изобретения индивидуумом может являться млекопитающее, не являющееся человеком, например, сельскохозяйственное животное (в частности, лошадь, свинья или корова) или домашнее животное (в частности, собака или кошка). В другом варианте осуществления индивидуумом является человек пожилого возраста. В другом варианте осуществления индивидуумом является взрослый человек. В другом варианте осуществления индивидуумом является ребенок (человек). В еще одном его воплощении индивидуумом является младенец (человек).
[0027] При его использовании в этой заявке, термином "ремиссия" обозначается состояние здоровья индивидуума, характеризующееся отсутствием обнаружимого ракового заболевания и возможностью возобновления активности этого ракового заболевания в будущем.
[0028] Раковые стволовые клетки образуют уникальную субпопуляцию (часто приблизительно 0,1-10%, но иногда до 0,1-20% и более) в составе опухоли, которая, относительно остающихся ~90% опухоли (т.е. ее основной массы), является более туморогенной, относительно более медленно растущей или латентной и часто относительно более устойчивой к химиотерапевтическим средствам, чем основная масса опухоли. С учетом того, что стандартные способы и режимы лечения были, в значительной степени, разработаны для уничтожения быстро делящихся клеток (т.е. раковых клеток, составляющих основную массу опухоли), раковые стволовые клетки, которые зачастую растут более медленно, могут быть относительно более устойчивы, чем быстро растущая основная масса опухоли, к стандартным способам и режимам лечения. Раковые стволовые клетки могут обладать и другими особенностями, делающими их относительно более устойчивыми к химиотерапевтическим средствам, например, множественной лекарственной устойчивостью и антиапоптотическими механизмами. Вышеупомянутые особенности являются ключевой причиной неспособности стандартных онкологических режимов лечения обеспечить долгосрочный благоприятный эффект у большинства пациентов с продвинутыми стадиями раковых заболеваний, ибо они неспособны адекватно воздействовать на раковые стволовые клетки и уничтожать их. В некоторых случаях раковая стволовая клетка является клеткой-основательницей опухоли (т.е. является клеткой-предшественницей всех раковых клеток, составляющих основную массу опухоли).
[0029] Раковые стволовые клетки были выявлены для большого числа типов раковых заболеваний. Например, Bonnet et al., используя проточную цитометрию, смогли выделить лейкозные клетки, обладающие специфическим фенотипом, CD34+CD38-, и затем показать, что именно эти клетки (составляющие менее 1% от всех лейкозных клеток), а не остающиеся 99+% лейкозных клеток, способны вызывать лейкоз, подобный исходному, при их введении иммунодефицитным мышам (см., например, "Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell"/"Человеческий острый миелолейкоз организован в форме иерархии, в основании которой лежит примитивная гематопоэтическая клетка"), Nat. Med., V.3, pp.730-737, 1997). Это означает, что эти раковые стволовые клетки, доля которых составляет менее 1 на 10000 лейкозных клеток, даже при их столь низком содержании в популяции, способны инициировать и серийно передавать человеческий лейкоз мышам с тяжелым комбинированным иммунодефицитом и диабетом, не сопровождающимся ожирением (NOD/SCID), и этот лейкоз характеризуется тем же гистологическим фенотипом, как и исходная опухоль.
[0030] Сох et al. выявили небольшие субфракции клеток человеческого острого лимфобластного лейкоза (ALL), обладающие фенотипами CD34+/CD10- и CD34+/CD19-, и смогли привить опухоли ALL мышам с нарушенным иммунитетом - т.е. эти клетки являлись раковыми стволовыми клетками. Напротив, при использовании основной массы клеток ALL прививания опухолей у мышей не наблюдалось, несмотря на то, что в некоторых случаях им вводили в 10 раз большее количество клеток (см. Сох et al., "Characterization of acute lymphoblastic leukemia progenitor cells/"Определение характеристик клеток-предшественниц острого лимфобластного лейкоза", Blood, V.104(19), рр / 2919-2925, 2004).
[0031] Было установлено, что множественная миелома содержит небольшие субпопуляции клеток с фенотипом CD138-, которые, относительно большой основной популяции миеломных клеток с фенотипом CD138+, обладали более высоким клоногенным и туморогенным потенциалом (см. Matsui et al., "Characterization of clonogenic multiple myeloma cells"/"Определение характеристик кпоногенных клеток множественной миеломы", Blood, V.103(6), р.2332). Авторы этой работы пришли к выводу, что субпопуляция CD138-клеток множественной миеломы является популяцией раковых стволовых клеток.
[0032] Kondo et al. выделили небольшую популяцию клеток из глиомной клеточной линии С6, которые были идентифицированы как раковые стволовые клетки благодаря их способности прививать и поддерживать глиомы у мышей с нарушенным иммунитетом (см. Kondo et al., "Persistence of a small population of cancer stem-like cells in the С6 glioma cell line", Proc. Natl. Acad. Sci. USA, V.101, pp.781-786, 2004). В этом исследовании Kondo et al. установили, что раковые клеточные линии содержат популяцию раковых стволовых клеток, придающую этим линиям способность к прививанию опухолей у иммунодефицитных мышей.
[0033] Было показано, что раковые образования молочных желез содержат небольшую популяцию клеток, обладающих характеристиками стволовых клеток, несущих поверхностные маркеры CD44+ CD24low (см. AI-Hajj et al., "Prospective identification of tumorigenic breast cancer cells"/"Предположительная идентификация туморогенных клеток рака молочных желез", Proc. Natl. Acad. Sci. USA, V.100, pp.3983-3988, 2003). Всего 200 подобных клеток, составляющих 1-10% от общей популяции опухолевых клеток, способны вызывать развитие опухолей у мышей NOD/SCID. Напротив, имплантация 20 000 клеток, не обладающих таким фенотипом (т.е. относящихся к основной массе опухоли) была неспособна приводить к повторному росту опухоли.
[0034] Было установлено, что субпопуляция клеток, полученных из опухолей предстательной железы человека, способна к самовозобновлению и к восстановлению фенотипа той опухоли предстательной железы, из которой они были получены, т.е. они являются популяцией стволовых клеток рака предстательной железы (см. Collins et al., "Prospective Identification of Tumorigenic Prostate Cancer Stem Cells"/"Предположительная идентификация туморогенных стволовых клеток рака предстательной железы", Cancer Res., V.65(23), pp.10946-10951, 2005).
[0035] Fang et al. изолировали из меланомы субпопуляцию клеток, обладающих свойствами раковых стволовых клеток. В частности, эта субпопуляция клеток способна дифференцироваться и самовозобновляться. В культуре клетки из этой субпопуляции росли в виде сфер, тогда как клетки из более дифференцированной фракции из меланомных очагов демонстрировали более высокую способность к распластыванию. Более того, субпопуляция, содержащая сфероподобные клетки, обладала более высокой туморогенностью, чем распластывающиеся клетки, при ее прививании мышам (см. Fang et al., "A Tumorigenic Subpopulation with Stem Cell Properties in Melanomas"/"Туморогенная субпопуляция в меланомах, обладающая свойствами стволовых клеток", Cancer Res., V.65(20), pp.9328-9337, 2005).
[0036] Singh et al. идентифицировали стволовые клетки опухолей мозга. После их выделения и трансплантации безтимусным мышам раковые стволовые клетки с фенотипом CD133+, в отличие от клеток основной массы опухоли с фенотипом CD133-, образуют опухоли, которые могут быть последовательно трансплантированы (см. Singh et al., "Identification of human brain tumor initiating cells"/"Идентификация клеток, инициирующих опухоли головного мозга человека", Nature, V.432, pp.396-401, 2004; Singh et al., "Cancer stem cells in nervous system tumors"/"Раковые стволовые клетки в опухолях нервной системы", Oncogene, V.23, pp.7267-7273, 2004; Singh et al., "Identification of a cancer stem cell in human brain tumors"/"Идентификация раковых стволовых клеток в опухолях головного мозга человека", Cancer Res., V.63 pp.5821-5828, 2003).
[0037] Поскольку стандартные способы лечения рака направлены на уничтожение быстро делящихся клеток (т.е. клеток, образующих основную массу опухоли), эти способы лечения, как предполагается, являются относительно неэффективными против раковых стволовых клеток. В действительности было показано, что раковые стволовые клетки, включая лейкемические стволовые клетки, действительно являются относительно устойчивыми к стандартным химиотерапевтическим способам лечения (например, с использованием Ara-C и даунорубицина), а также к новым способам таргетной терапии (например, с использованием Gleevec® и Velcade®). Примеры раковых стволовых клеток из различных опухолей, являющихся устойчивыми к химиотерапии, и механизмы этой устойчивости описаны в приводимой ниже таблице.
| Тип РСК | Устойчивость | Механизм устойчивости | Источник |
| AML | Ara-C | Латентные клетки | Guzman, Blood, '01 |
| AML | Даунорубицин | Выведение лекарства | Costello, Cancer Res., '00 |
| Антиапоптотический | |||
| механизм | |||
| AML | Даунорубицин, | Выведение лекарства | Wulf, Blood, '01 |
| митоксантрон | |||
| AML | Латентные клетки | Guau, Blood, '03 | |
| AML, MDS | Антиапоптотический механизм | Suarez, Clin. Cancer Res., '04 | |
| CML | Латентные клетки | Holyoake, Blood, '99 | |
| CML | Gleevec® | Латентные клетки | Graham, Blood, '02 |
| Миелома | Velcade® | Matsui, ASH, '04 |
[0038] Например, лейкемические стволовые клетки являются относительно медленнорастущими или латентными, экспрессируют гены множественной лекарственной устойчивости и используют другие антиапоптотические механизмы - и именно эти особенности способствуют их устойчивости к воздействию химиотерапевтических средств (см. Jordan et al., "Targeting the most critical cells: approaching leukemia therapy as a problem in stem cell biology"/"Targeting воздействие на наиболее критичные клетки: подход к лечению лейкемии как к проблеме, относящейся к биологии стволовых клеток", Nat. Clin. Pract. Oncol., V.2, pp.224-225, 2005). Более того, благодаря своей устойчивости к воздействию химиотерапевтических средств, раковые стволовые клетки могут приводить к неудачному исходу лечения и могут сохраняться в организме пациента после достижения клинической ремиссии, и эти остающиеся раковые стволовые клетки могут, таким образом, приводить в будущем к возникновению рецидивов (см. Behbood etal., "Will cancer stem cells provide new therapeutic targets?"/"Станут ли раковые стволовые клетки новыми мишенями для лечения?", Carcinogenesis, V.26(4), pp.703-711, 2004). По этой причине, как ожидается, целевое воздействие на раковые стволовые клетки может способствовать улучшению долгосрочных исходов у раковых пациентов. Соответственно, для достижения этой цели необходимы новые терапевтические средства и/или режимы лечения, предназначенные для целенаправленного воздействия на раковые стволовые клетки.
[0039] Настоящее изобретение позволяет достигнуть этой цели с помощью введения нуждающемуся в этом индивидууму терапевтически эффективного количества или применения терапевтически эффективного режима введения метаарсенита натрия.
[0040] Рак или опухолевое заболевание, включающее в себя, в частности, новообразования, опухоли, метастазы, лейкемии, или любое заболевание или нарушение, характеризующееся неконтролируемым ростом клеток, может быть предотвращено, излечено или контролируемо с помощью введения нуждающемуся в этом индивидууму профилактически или терапевтически эффективного количества или применения терапевтически эффективного режима введения метаарсенита натрия.
[0041] Настоящее изобретение описывает способ предотвращения, лечения и/контроля развития рака путем уменьшения числа или полного уничтожения зрелых раковых клеток, а также раковых стволовых клеток и, в особенности, раковых стволовых клеток, устойчивых к лекарственному лечению; этот способ включает в себя введение нуждающемуся в этом индивидууму профилактически или терапевтически эффективного количества или применения терапевтически эффективного режима введения метаарсенита натрия. В некоторых вариантах осуществления настоящего изобретения это количество или режим введения метаарсенита натрия приводят по меньшей мере к ~5% уменьшению популяции раковых стволовых клеток, в том числе раковых стволовых клеток, устойчивых к лекарственному лечению. В некоторых вариантах осуществления настоящего изобретения уменьшение популяции раковых стволовых клеток отслеживается периодически, например, в течение четырех и более лет после окончания лечения метаарсенитом натрия. Соответственно, в определенном варианте осуществления настоящее изобретение предоставляет способ предотвращения рецидивов ракового заболевания, его лечения и/или контроля его развития у индивидуума; этот способ включает в себя: (а) введение нуждающемуся в этом индивидууму одной или нескольких доз эффективного количества метаарсенита натрия; (b) отслеживание популяции раковых стволовых клеток перед, во время и/или после введения определенного числа доз и перед введением следующей дозы; и (с) выявление по меньшей мере 5% уменьшения популяции раковых стволовых клеток, в том числе раковых стволовых клеток, устойчивых к лекарственному лечению, достигаемого у индивидуума с помощью повторения, при необходимости, шага (а). Если, во время отслеживания популяции раковых стволовых клеток у пациента, станет очевидно, что популяция раковых стволовых клеток увеличилась, лечащий врач может вновь ввести пациенту метаарсенит натрия (в форме монотерапии или в сочетании с другим противораковым средством), в той же самой или иной дозировке и/или дозовом режиме.
[0042] Метаарсенит натрия может вводиться пациенту в любой форме, в том числе парентерально (например, внутривенно), внутрибрюшинно или орально. Его дневная дозировка может вводиться в виде одной или нескольких доз в течение дня. Режим лечения метаарсенитом натрия может включать в себя введение его дневной дозировки на протяжении одного или нескольких дней, например, от одного до десяти последовательных дней или любого числа дней от одного до десяти, например, от одного до пяти, четырех, трех или двух последовательных дней. Альтернативно, дозовый режим может включать в себя введение дозировок метаарсенита натрия в течение нескольких дней, например, от одной недели до одного месяца, непоследовательным образом, т.е., например, через день или на каждый третий или четвертый день или, например, после трех последовательных дней лечения может следовать перерыв в несколько последовательных дней, например, тоже в три дня, а затем эта схема может повторяться или, при необходимости, модифицироваться. Опытный врач (специалист) может легко определить наиболее эффективный способ введения и дозировку метаарсенита натрия, необходимую для достижения наилучшего результата для пациента, на основании состояния здоровья пациента, его возраста, массы тела, переносимости лекарства и т.д.
[0043] В определенных вариантах осуществления настоящего изобретения количество или режим применения метаарсенита натрия приводят по меньшей мере к 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99% уменьшению популяции раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению. Например, в некоторых вариантах осуществления количество или режим применения метаарсенита натрия могут приводить по меньшей мере к ~5%-99%, 5%-80%, 5%-40%, 10%-99%, 10%-80%, 10-60%, 10%-40%, 20%-99%, 20%-80%, 20%-60%, 20%-40%, 50%-98%, 50%-80% или 60%-99% уменьшению популяции раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению.
[0044] В других вариантах осуществления настоящего изобретения количество или режим применения метаарсенита натрия могут приводить по меньшей мере к 1,1-, 1,2-, 1,5-, 2-, 3-, 4-, 5-, 10-, 25-, 50-, 75-, 100-, 200- или 1000-кратному уменьшению популяции раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению. В некоторых вариантах его осуществления уменьшение популяции раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению, может достигаться после двух недель, месяца, двух месяцев, трех месяцев, четырех месяцев, шести месяцев, девяти месяцев, 1 года, 2 лет, 3 лет или 4 лет применения режима лечения. Способы определения популяции раковых стволовых клеток и определения изменений количества раковых стволовых клеток описаны ниже. Если в период мониторинга будет зафиксировано увеличение числа раковых стволовых клеток, пациенту может быть назначен другой режим лечения метаарсенитом натрия (такой же или отличающийся от предыдущего режима лечения) и/или другого противоракового средства или средств.
[0045] В некоторых вариантах осуществления настоящего изобретения количество или режим применения метаарсенита натрия могут приводить к уменьшению популяции раковых клеток, а также раковых стволовых клеток, включая раковые стволовые клетки, устойчивые к лекарственному лечению. В некоторых вариантах его осуществления уменьшение популяции раковых клеток или уменьшение популяций раковых клеток и раковых стволовых клеток периодически отслеживаются. Соответственно, в одном из вариантов осуществления настоящее изобретение предоставляет способ предотвращения, лечения и/или контроля развития ракового заболевания у индивидуума, который включает в себя: (а) введение нуждающемуся в этом индивидууму одной или нескольких доз эффективного количества метаарсенита натрия; (b) отслеживание популяции раковых стволовых клеток перед, во время и/или после введения определенного числа доз и перед введением следующей дозы; и (с) выявление по меньшей мере 5% уменьшения популяции раковых стволовых клеток, в том числе раковых стволовых клеток, устойчивых к лекарственному лечению, и популяции раковых клеток, достигаемых у индивидуума с помощью повторения, при необходимости, шага (а).
[0046] В определенных вариантах осуществления настоящего изобретения количество или режим применения метаарсенита натрия приводят по меньшей мере к ~5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% или 99% уменьшению популяции раковых клеток. Например, в некоторых вариантах его осуществления количество или режим применения метаарсенита натрия могут приводить по меньшей мере к ~2%-98%, 5%-80%, 5%-40%, 10%-99%, 10%-80%, 10%-60%, 10%-40%, 20%-99%, 20%-80%, 20%-60%, 20%-40%, 50%-98%, 50%-80% или 60%-99% уменьшению популяции раковы