Устройства, способы и наборы для иммунохроматографии
Иллюстрации
Показать всеГруппа изобретений относится к устройствам и способам анализа с использованием специфического связывания и предназначена для определения наличия или количества аналита в пробном образце. Иммунохроматографическое устройство содержит мембрану, несущую захватывающее антитело, связанное с ней, в тестовой зоне, и структуру с конъюгатами, соединенную по текучей среде с мембраной в проксимальном конце. Данная структура содержит детектирующее антитело, имеющее конъюгированный с ним репортерный фрагмент. Каждое из указанных захватывающего и детектирующего антител представляет собой моноклональное антитело, производимое гибридомными клетками, депонированными под номером доступа DSM АСС3092 (моноклональное антитело LG96) или DSM АСС3093 (моноклональное антитело MG97). Аналит представляет собой белок Z-ААТ, присутствующий в образце от носителя гена PiZ. Использование группы изобретений позволяет повысить эффективность определения наличия аналита, в частности белка Z-ААТ. 8 н. и 17 з.п. ф-лы, 33 ил., 1 табл., 5 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
Испрашивается приоритет по предварительной заявке США № 61/386214, поданной 24 сентября 2010 г. и предварительной заявке США № 61/482867, поданной 5 мая 2011 г., обе они включены в настоящее описание во всей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к устройствам и способам анализа с использованием специфического связывания, в частности иммунохроматографическим устройствам и способам анализа.
УРОВЕНЬ ТЕХНИКИ
В способах проточного анализа для определения наличия и/или концентрации аналитов, которые могут присутствовать в пробном образце, обычно применяют различные аналитические методы и устройства. Тесты с латеральными потоками, также известные как иммунохроматографические способы анализа с латеральными потоками или способы анализа с латеральными потоками (LFA), обычно применяют, например, в устройствах для медицинской диагностики по месту лечения (POC). Отдельные схемы анализа приспосабливают к конкретному применению.
Дефицит альфа-1-антитрипсина (AATD) представляет собой наследственное заболевание, которые можно диагностировать посредством генетического обследования. При этом AATD гиподиагностируют и только 10-15% выявляют. У не выявленных пациентов иногда неверно диагностируют соответственно "обычное" хроническое обструктивное заболевание легких (COPD) и астму.
Сохраняется необходимость в эффективном способе анализа с латеральными потоками для определения наличия аналита, в частности белка Z-AAT.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение предлагает иммунохроматографическое устройство, содержащее мембрану, несущую захватывающее антитело, связанное с ней, в тестовой зоне. Данное захватывающее антитело способно к связыванию с аналитом. Аналит может представлять собой белок Z-AAT, присутствующий в образце от носителя гена PiZ.
В некоторых аспектах настоящее изобретение предлагает устройство для иммуноанализа, содержащее: мембрану, несущую область захвата белка Z-AAT, определяемую посредством захватывающего антитела, иммобилизованного в ней, причем данное захватывающее антитело представляет собой антитело к белку Z-AAT.
В других аспектах настоящее изобретение предлагает устройство для иммуноанализа для определения наличия или количества белка Z-AAT в текучем образце. Данное устройство содержит:
область нанесения образца;
микропористую мембрану, несущую область захвата белка Z-AAT, определяемую посредством захватывающего антитела, иммобилизованного в ней, причем данное захватывающее антитело представляет собой LG96 или его антигенсвязывающий фрагмент;
путь потока от области нанесения образца до области захвата белка Z-AAT, причем наличие или количество белка Z-AAT в текучем образце можно определять по образованию комплекса между захватывающим антителом и белком Z-AAT, который может присутствовать в текучем образце; и
структуру с конъюгатами, расположенную в пути потока, причем данная структура с конъюгатами содержит детектирующий реагент, специфичный к белку Z-AAT, причем данный детектирующий реагент является подвижным или мобилизуемым, причем данный детектирующий реагент представляет собой конъюгированное с золотом LG96 или его конъюгированный с золотом антигенсвязывающий фрагмент.
В одном аспекте предлагается способ обнаружения белка Z-AAT у субъекта. Данный способ включает в себя:
нанесение биологического образца от данного субъекта на устройство для иммуноанализа настоящего изобретения; и
обнаружение комплекса, образованного между захватывающим антителом и белком Z-AAT, который может присутствовать в текучем образце, причем обнаружение данного комплекса указывает на наличие белка Z-AAT в данном образце.
В другом аспекте настоящее изобретение предлагает способ определения носителя гена PiZ. Данный способ включает в себя подвергание образца от субъекта иммунохроматографии с применением устройства в соответствии с настоящим изобретением; и определение связывания аналита с захватывающим антителом, причем связывание аналита с захватывающим антителом указывает на то, что данный субъект является носителем PiZ.
В некоторых аспектах настоящее изобретение предлагает способ диагностирования состояния или заболевания, связанного с дефицитом AAT. Данный способ включает в себя подвергание образца от субъекта иммунохроматографии с применением устройства в соответствии с настоящим изобретением; и определение связывания аналита с захватывающим антителом, причем связывание аналита с захватывающим антителом указывает на то, что данный субъект имеет данное состояние или заболевание.
В других аспектах настоящее изобретение предлагает способ определения предрасположенности субъекта к развитию состояния или заболевания, связанного с дефицитом AAT. Данный способ включает в себя подвергание образца от субъекта иммунохроматографии с применением устройства в соответствии с настоящим изобретением; и определение связывания аналита с захватывающим антителом, причем связывание аналита с захватывающим антителом является признаком предрасположенности субъекта к развитию состояния или заболевания.
В одном аспекте настоящее изобретение предлагает способ определения наличия белка Z-AAT в биологическом образце. Данный способ включает в себя: помещение биологического образца и первого антитела в смешанном состоянии на мембрану, несущую второе антитело, связанное с ней, в тестовой зоне, причем как первое, так и второе антитело способны к связыванию с белком Z-AAT; причем захват второго антитела в тестовой зоне указывает на наличие белка Z-AAT в данном образце.
В других аспектах настоящее изобретение предлагает набор, содержащий устройство в соответствии с настоящим изобретением; и детектирующий реагент.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
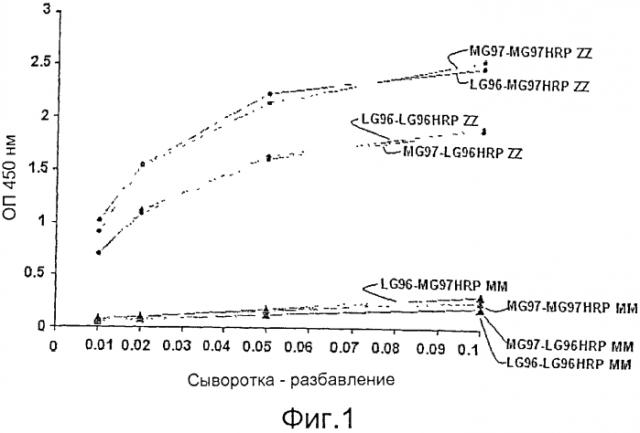
Фиг.1 показывает результаты тестирования совместимых пар, сэндвичный ELISA с моноклональными антителами LG96 и MG97. Частично очищенные моноклональное антитела LG96 и MG97 применяли или в качестве захватывающих антител, или в качестве детектирующих антител, меченых с помощью пероксидазы хрена (LG96HRP или MG97HRP соответственно). Смешанную сыворотку ZZ или MM последовательно разбавили буфером для образца и использовали в качестве раствора антигена. Совместимые пары LG96-LG96HRP, LG96-MG97HRP, MG97-LG96HRP и MG97-MG97HRP демонстрируют специфическое связывание с сывороткой PiZZ, но не с сывороткой PiMM.
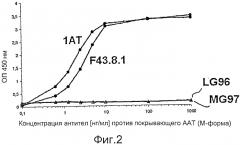
Фиг.2 показывает результаты тестирования перекрестной реактивности моноклональных антител LG96 и MG97 с покрывающим AAT (M-форма). M-специфичные антитела F43.8.1 и 1AT играют роль положительного контроля и демонстрируют очень сильное специфическое связывание с покрывающим AAT (M-форма). Напротив, антитела LG96 и MG97 демонстрируют отсутствие связывания с покрывающей M-формой AAT.
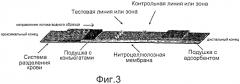
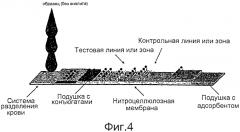
Фиг.3 иллюстрирует схему устройства для анализа с латеральными потоками (LFA) для иммунохроматографии в соответствии с одним вариантом осуществления настоящего изобретения.
Фиг.4 иллюстрирует схему с фиг.3, причем образец не содержит целевой аналит.
Фиг.5 представляет собой изображение устройства для LFA, причем иммунохроматографические компоненты изображены заключенными в корпус, изготовленный, например, из пластмассы. Тестовая линия или зона не показана, что указывает на то, что результаты теста на наличие аналита в образце отрицательны. Контрольная линия или зона положительна, что указывает на то, что устройство работает правильно.
Фиг.6 иллюстрирует схему с фиг.3, причем образец содержит целевой аналит.
Фиг.7 представляет собой изображение устройства для LFA, причем иммунохроматографический компоненты изображены заключенными в корпус, как на фиг.5. Тестовая линия или зона показана присутствующей, что указывает на то, что результаты теста на наличие аналита в образце положительны. Контрольная линия или зона также положительна, что указывает на то, что устройство работает правильно.
Фиг.8 иллюстрирует принцип LFA в соответствии с одним вариантом осуществления настоящего изобретения, причем образец представляет собой кровь от индивидуума типа ZZ. Захватывающее антитело LG96; детектирующее антитело MG97, конъюгированное с HRP; контрольное антитело: Ig.
Фиг.9 иллюстрирует принцип LFA в соответствии с другим вариантом осуществления настоящего изобретения, причем образец представляет собой кровь от индивидуума типа MM. Захватывающее антитело LG96; детектирующее антитело MG97, конъюгированное с HRP; контрольное антитело: Ig.
Фиг.10 иллюстрирует принцип LFA в соответствии с другими вариантами осуществления настоящего изобретения, причем образец представляет собой кровь от индивидуума типа MZ. Захватывающее антитело LG96; детектирующее антитело MG97, конъюгированное с FIRP; контрольное антитело: Ig.
Фиг.11 показывает кривые результатов связывания LG96-MG97HRP с сывороткой ZZ и MM.
Фиг.12 показывает результаты специфического связывания LG96-MG97HRP с сывороткой ZZ. Связывание с сывороткой MM отсутствует.
Фиг.13 показывает результаты скрининга реальных образцов (разведение 1:20) в контрольных тестах.
Фиг.14 показывает определение концентрации Z-AAT в различных коммерчески доступных и собственных образцах сыворотки/плазмы с применением PiZZ-ELISA.
Фиг.15A-15D показывают тестирование образцов сыворотки #1-6 со всеми возможными комбинациями антител, причем антитело, указанное первым, является захватывающим антителом, иммобилизованным на нитроцеллюлозе, а антитело, указанное после косой черты, является детектирующим антителом, соединенным с частицами золота.
Фиг.16 показывает вид сбоку одного варианта осуществления устройства настоящего изобретения.
Фиг.17 представляет собой продольное сечение устройства, показанного на фиг.16.
Фиг.18 представляет собой увеличенное изображение загрузочной области устройства, показанного на фиг.16.
Фиг.19 представляет собой увеличенное представление реакционной области: (A) устройства, показанного на фиг.16; и (B) другого варианта осуществления устройства, в котором устройство содержит отдельный картридж.
Фиг.20 показывает вид сбоку колпачка и режущей части устройства, показанного на фиг.16.
Фиг.21 представляет собой продольное сечение одного варианта осуществления устройства настоящего изобретения.
Фиг.22 представляет собой другой вариант осуществления устройства настоящего изобретения.
Фиг.23 представляет собой устройство настоящего изобретения в соответствии с некоторыми вариантами осуществления.
Фиг.24 представляет собой устройство настоящего изобретения в соответствии с другими вариантами осуществления.
Фиг.25 представляет собой устройство настоящего изобретения в соответствии с некоторыми другими вариантами осуществления.
Фиг.26 показывает результаты трех отдельных скринингов ZZ(+) образцов сыворотки с применением одного варианта осуществления устройства настоящего изобретения.
Фиг.27 показывает тестирование капиллярной крови в сравнении с образцами сыворотки (сравнение 20 мкл капиллярной крови и образца сыворотки от одного и того же донора). Тестовые сигналы измеряли через 15 минут с применением оптического считывателя (QuickSens Omega 100 reader). Количества в мг/дл указывают на уровень AAT в сыворотке, определяемый нефелометрически.
Фиг.28 показывает воздействие различных антикоагулянтов на результаты теста. Контроль: сыворотка ММ. Тестируемые образцы: плазма ZZ-ЭДТА, плазма ZZ-цитрат и ZZ-гепарин плазма. Тестовые сигналы измеряли оптическим считывателем через 15 минут после начала теста. Количества в мг/дл указывают на уровень AAT в сыворотке, определяемый нефелометрически.
Фиг.29 показывает тестируемые образцы сыворотки от: (A) MM донора; (B) ZZ донора; и (C) SZ донора (использовали образцы сыворотки по 20 мкл, и результаты показаны после различных промежутков времени). "Vol." представляет собой интенсивность сигнала тестовой линии (T), измеренную посредством оптического считывателя. Контрольная линия обозначена "C".
Фиг.30 показывает сводку тестирования по n-65 тестам с сывороткой и цельной кровью. 0=образцы PiMM; 1=образцы PiMZ, PiSZ и PiZZ. Тестовые сигналы измеряли после 15-20 минут с применением оптического считывателя.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение предлагает иммунохроматографическое устройство, содержащее мембрану, несущую захватывающее антитело, связанное с ней, в тестовой зоне. Данное захватывающее антитело способно к связыванию с аналитом. В предпочтительном варианте осуществления аналит представляет собой белок Z-AAT. Данное устройство можно применять, для того чтобы определять наличие аналита в образце.
Термин "белок Z-AAT", как применяется в настоящем описании, относится к полимеру(ам) из аминокислот Z-AAT и не предназначен для обозначения определенной длинны данного белка; следовательно, его фрагменты включены в определение "белка Z-AAT". Данный термин также включает формы, варианты и аналоги белка Z-AAT, включая мономеры, димеры, мультимеры и т.д., а также посттрансляционные модификации данного белка, например гликозилирования, ацетилирования, фосфорилирования и тому подобные. Таким образом, в некоторых вариантах осуществления термин "белок Z-AAT" может быть синонимом термина "полипептид Z-AAT" или может относиться к комплексу из двух или более Z-AAT полипептидов (например, димерному, мультимерному, агрегированному).
Образец
Образец, обычно, относится к материалу, который может содержать или не содержать аналит. Образец можно использовать непосредственно как он получен из источника или после предварительной обработки для модификации или изменения характеристик образца. Источником образца может быть любой биологический источник, такой как физиологическая жидкость, включая, но без ограничения, кровь, интерстициальную жидкость, слюну, внутриглазную жидкость, цереброспинальную жидкость, пот, мочу, молоко, асцитную жидкость, хрипы, синовиальную жидкость, перитонеальную жидкость, вагинальную жидкость, амниотическую жидкость или тому подобное. Предпочтительно, образец представляет собой водный образец.
В некоторых вариантах осуществления образец представляет собой неразбавленный образец, т.е. образец получают из биологического источника и наносят непосредственно на устройство без какого-либо предварительного разбавления образца. В других вариантах осуществления образец предварительно обрабатывают перед использованием, как например получают плазму из крови, разбавляют вязкие жидкости и тому подобное. Предварительная обработка образца может включать в себя фильтрацию, осаждение, разбавление, перегонку, концентрирование, инактивацию мешающих компонентов и добавление реагентов. В одном варианте осуществления в качестве источника образца можно применять твердый материал, исследуемый на содержание аналита, предпочтительно посредством модификации твердого материала в форму жидкой или полужидкой композиции.
В одном варианте осуществления образец представляет собой цельную кровь, плазму или сыворотку. В другом варианте осуществления образец представляет собой капиллярную кровь.
Мембрана
Устройство настоящего изобретения обеспечивает мембранный иммунохроматографический анализ для определения наличия или количества аналита в образце. В предпочтительных вариантах осуществления аналит представляет собой белок Z-AAT. Например, в одном варианте осуществления аналит представляет собой белок Z-AAT, причем наличие аналита в образце крови, полученном от млекопитающего (например, человека), указывает на то, что данное млекопитающее является носителем гена PiZ.
Мембрану можно изготавливать из любого из множества материалов, через которые образец способен проходить. Например, материалы, применяемые для того, чтобы сформировать мембрану, могут включать, но без ограничения, натуральные, синтетические или встречающиеся в природе материалы, которые подвергают синтетической модификации, такие как полисахариды (например, целлюлозные материалы, такие как бумага, и производные целлюлозы, такие как ацетат целлюлозы и нитроцеллюлоза); полиэфирсульфон; нейлоновые мембраны; кремнезем; неорганические материалы, такие как деактивированный оксид алюминия, диатомитовая земля, MgSO4 или другой неорганический мелкоизмельченный материал, равномерно распределенный в пористой полимерной матрице, с полимерами, такими как винилхлорид, сополимер винилхлорида и пропилена и сополимер винилхлорида и винилацетата; ткань, как натуральная (например, хлопок), так и синтетическая (например, нейлон или искусственный шелк); пористые гели, такие как силикагель, агароза, декстран и желатин; полимерные пленки, такие как полиакриламид; и тому подобное.
В одном варианте осуществления мембрану формируют из нитроцеллюлозных и/или полиэфирсульфоновых материалов. Нитроцеллюлоза может представлять собой азотнокислые эфиры целлюлозы, которые могут представлять собой одну нитроцеллюлозу или смешанные сложные эфиры азотной кислоты и других кислот, таких как алифатические карбоновые кислоты с одним или несколькими атомами углерода.
В некоторых вариантах осуществления мембрана содержит нитроцеллюлозу. Нитроцеллюлоза может обладать способностью связывать белки без необходимости в предварительной сенсибилизации. Некоторые реагенты, такие как антитела, можно наносить непосредственно на нитроцеллюлозу и иммобилизовывать на ней. Химическая обработка, которая может помешать основной специфической связывающей активности реагента, требуется небольшая или не требуется. Неиспользованные участки связывания на нитроцеллюлозе можно затем блокировать с помощью простых материалов, таких как поливиниловый спирт. Кроме того, нитроцеллюлоза с различными размерами пор легко доступна, и это облегчает выбор материала мембраны, подходящего для конкретных требований, таких как скорость потока образца и т.д.
В одном варианте осуществления мембрана содержит одну тестовую зону, или линию, или участок, несущий захватывающее антитело, связанное с ним.
В других вариантах осуществления мембрана содержит несколько тестовых зон, расположенных, например, последовательно, на мембране, через которые водный образец может поступательно проходить. В одном варианте осуществления несколько тестовых зон можно применять для получения количественного измерения аналита, или, в другом варианте осуществления, можно нагружать индивидуально различными специфическими захватывающими антителами для получения теста на несколько аналитов.
В других вариантах осуществления мембрана содержит контрольную зону, для того чтобы обеспечивать определение того, что устройство работает. Предпочтительно, контрольная зона расположена по направлению потока от тестовой зоны (тестовых зон), в которых определяют искомый результат теста. Индикатор положительного контроля, следовательно, предоставляет информацию о том, что образец по меньшей мере прошел требуемое расстояние по мембране.
Например, контрольную зону можно нагружать антителом или другой молекулой/реагентом, который будет связываться с детектирующим реагентом, для того чтобы подтверждать, что образец продвинулся по мембране достаточно. Например, если детектирующий реагент представляет собой меченое антитело, полученное из мышиной гибридомы, то контрольная зона может содержать "антимышиное" антитело (например, антимышиный IgG). В другом варианте осуществления контрольная зона может содержать безводный реагент, который, при увлажнении, изменяет цвет или окрашивается, например безводный сульфат меди, который становится синим при увлажнении водным образцом. В качестве еще одного варианта осуществления контрольная зона может содержать иммобилизованный аналит (например, белок Z-AAT), который будет реагировать с избытком детектирующего реагента.
В одном варианте осуществления мембрана содержит контрольную зону, несущую контрольное антитело, связанное с ней, причем контрольное антитело способно к связыванию с детектирующим реагентом. В некоторых вариантах осуществления контрольное антитело представляет собой антимышиный IgG.
Захватывающее антитело
В предпочтительных вариантах осуществления захватывающее антитело, которое связано с мембраной в тестовой зоне, представляет собой антитело или его антигенсвязывающий фрагмент, которые специфичны к белку Z-AAT.
Антитело в различных вариантах осуществления проявляет по существу малую перекрестную реактивность к сывороткам PiMM или очищенному AAT дикого типа или не проявляет ее.
В одном варианте осуществления антитело или его антигенсвязывающий фрагмент представляют собой моноклональное антитело или его антигенсвязывающий фрагмент.
Термины "поликлональное" и "моноклональное" относятся к степени гомогенности препарата антитела, и не предназначены для ограничения конкретных способов получения. Термин "моноклональное антитело" или "композиция моноклонального антитела", как применяется в настоящем описании, относится к популяции молекул антитела, которая содержит антигенсвязывающий участок только одного вида, способный к иммунной реакции с конкретным эпитопом.
Фрагменты антител включают, но без ограничения, одноцепочечные, химерные, гуманизированные, приматизированные или венированные антитела также рассматриваются. Например, фрагменты антитела, способные к специфическому связыванию с белком Z-AAT, могут включать, но без ограничения, Fab', Fab, F(ab')2, однодоменные антитела (DAB), Fv, scFv (одноцепочечные Fv), линейные антитела, диатела, камелизированные антитела и тому подобное. Способы получения и применения различных основанных на антителах конструкций и фрагментов хорошо известны в данной области техники. Такие фрагменты можно получать посредством ферментативного расщепления или посредством рекомбинантных методов. Например, расщепление папаином или пепсином может давать, соответственно, фрагменты Fab или F(ab')2. Другие протеазы с нужной субстратной специфичностью также можно применять для получения фрагментов Fab или F(ab')2. Антитела также можно получать во множестве процессированных форм с применением генов антител, в которые вводят один или несколько стоп-кодонов по направлению против хода транскрипции от естественного терминирующего участка. Например, можно разработать химерный ген, кодирующий часть тяжелой цепи F(ab')2, включающий последовательности ДНК, кодирующие домен CH1 и шарнирный участок тяжелой цепи.
Одноцепочечные антитела и химерные, гуманизированные, или приматизированные (с привитыми определяющими комплементарность областями (CDR-привитые)), или венированные антитела, а также химерные, CDR-привитые или венированные одноцепочечные антитела, содержащие участки, происходящие из различных видов, и тому подобные также охвачены настоящим изобретением. Различные участки данных антител можно объединять вместе химически посредством обычных методов или можно получать в виде непрерывного белка с применением методов генной инженерии.
В одном варианте осуществления захватывающее антитело представляет собой моноклональное антитело LG96, MG97 или их антигенсвязывающий фрагмент. В одном варианте осуществления захватывающее антитело представляет собой моноклональное антитело MG97, и детектирующее антитело представляет собой моноклональное антитело LG96. В одном варианте осуществления захватывающее антитело представляет собой моноклональное антитело LG96, и детектирующее антитело представляет собой моноклональное антитело LG96.
Клетки типичного образца гибридомных клеточных линий, производящие моноклональное антитела LG96 и MG97, депонированы 14 сентября 2010 года в "Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH", Mascheroder Weg 1b, 38124 Брауншвейг, Германия в соответствии с Будапештским договором под номерами доступа DSM ACC3092 и DSM ACC3093 соответственно.
Средний специалист в данной области техники может определить последовательности нуклеиновой кислоты моноклональных антител с применением ряда способов, известных в данной области техники. Нуклеиновые кислоты, кодирующие моноклональное антитело, можно клонировать, для того чтобы получить "рекомбинантное" моноклональное антитело. Можно использовать любой метод рекомбинантного клонирования, включая применение полимеразной цепной реакции (ПЦР), для того чтобы запустить синтез кодирующих антитело последовательностей нуклеиновой кислоты. Таким образом, способы получения моноклонального антитела включают способы, включающие в себя получение по меньшей мере первой подходящей молекулы или сегмента нуклеиновой кислоты, кодирующей анти-Z-AAT антитело, от подходящей производящей анти-Z-AAT антитело клетки, предпочтительно гибридомы; и экспрессию молекулы или сегмента нуклеиновой кислоты в рекомбинантной клетке-хозяине, для того чтобы получить рекомбинантное анти-Z-AAT моноклональное антитело.
В данной области техники известны другие рекомбинантные методы, такие как, например, способы, основанные на фагмидных библиотеках. Например, способ может включать в себя: (a) иммунизирование животного посредством введения животному по меньшей мере одной дозы и, необязательно, более чем одной дозы композиции, содержащей иммуногенно эффективное количество иммуногенного белка Z-AAT, предпочтительно композиции, содержащей активированные эндотелиальные клетки; (b) получение комбинаторной иммуноглобулиновой фагмидной библиотеки, экспрессирующей РНК, выделенную из производящих антитела клеток, предпочтительно из селезенки иммунизированного животного; (c) выбор из фагмидной библиотеки по меньшей мере первого клона, экспрессирующего по меньшей мере первое анти-Z-AAT антитело, необязательно такое, которое по существу перекрестно реагирует или конкурирует с моноклональным антителом LG96 или MG97; (d) получение нуклеиновых кислот, кодирующих анти-Z-AAT антитело, из по меньшей мере первого выбранного клона и экспрессирование нуклеиновых кислот в рекомбинантной клетке-хозяине, для того чтобы получить по меньшей мере первое анти-Z-AAT антитело; и (e) получение по меньшей мере первого анти-Z-AAT антитела, экспрессируемого нуклеиновыми кислотами, полученными из по меньшей мере первого выбранного клона.
В некоторых вариантах осуществления захватывающее антитело, которое связано с мембраной в тестовой зоне, представляет собой антитело или его антигенсвязывающий фрагмент, который специфичен к белку Z-AAT, причем антитело или антигенсвязывающий фрагмент содержит одну или несколько определяющих комплементарность областей (CDR) из моноклонального антитела LG96, MG97 или из обоих.
В другом варианте осуществления антитело или антигенсвязывающий фрагмент обладает такой же или схожей эпитопной специфичностью, что и моноклональное антитело LG96 или MG97. Антитела или антигенсвязывающие фрагменты с эпитопной специфичностью такой же или схожей со специфичностью моноклонального антитела LG96 или MG97 можно идентифицировать с помощью множества способов, известных в данной области техники. Например, антитело с такой же или схожей эпитопной специфичностью можно идентифицировать исходя из способности конкурировать с моноклональным антителом за связывание с полипептидом Z-AAT. В другом примере связывание, например, LG96 mAb, и связывание антитела с такой же или схожей эпитопной специфичностью к полипептиду Z-AAT можно ингибировать одним пептидом (например, природным пептидом, синтетическим пептидом).
Не ограничивая себя одной конкретной теорией, можно полагать, что проблема с высокими концентрациями аналита в образце для тестирования может представлять собой так называемый "хук-эффект", который известен среднему специалисту в данной области техники как уменьшение детектируемого сигнала при очень высоких концентрациях аналита. Обычно при гетерогенной схеме сэндвичного анализа растворимое меченое антитело (например, детектирующий реагент) и антитело в твердой фазе (например, захватывающее антитело) присутствуют в избытке по отношению к определяемому аналиту, так что сэндвичные комплексы могут быть образованы, а также обнаружены, по существу полностью. Однако, при наличии высокой концентрации аналита, ограниченное количество антител встречается с очень большим количеством молекул аналита, который может присутствовать в образце. В крайнем случае имеет место дефицит антитела в твердой фазе, так что аналит связывается только частично и, кроме того, долю аналита, связанного с твердой фазой, нельзя полностью обнаружить, поскольку меченое антитело захвачено избытком аналита с образованием комплексов растворимое детектирующее антитело - аналит. Это может приводить к уменьшению измеренного сигнала, что может приводить к ложноотрицательному результату теста.
В некоторых вариантах осуществления образец представляет собой предварительно разбавленный образец, который затем подвергают иммунохроматографии.
В других вариантах осуществления мембрана содержит одну или несколько зон захвата, расположенных (например, последовательно) на мембране, каждая в проксимальном положении относительно тестовой зоны (тестовых зон), через которые водный образец может поступательно проходить до достижения тестовой зоны (тестовых зон). В некоторых вариантах осуществления одна или несколько зон захвата содержат иммобилизованное/связанное с ними моноклональное антитело LG96 или MG97. Одна или несколько зон захвата могут обеспечивать предупреждение, уменьшение или устранение хук-эффекта в способах анализа образцов, потенциально подверженных такому эффекту.
Структура с конъюгатами
В одном варианте осуществления устройство дополнительно содержит структуру с конъюгатами, несущую детектирующий реагент, такой как детектирующее антитело, меченое репортерным фрагментом. В некоторых вариантах осуществления структура с конъюгатами приведена в контакт с мембраной, причем, когда жидкость приходит в контакт со структурой с конъюгатами, детектирующий реагент регидратируется и переносится по мембране.
В других вариантах осуществления структура с конъюгатами соединена по текучей среде с мембраной в проксимальном конце мембраны.
В другом варианте осуществления структура с конъюгатами представляет собой подушку с конъюгатами, которая частично перекрывает мембрану в проксимальном конце мембраны.
Например, в некоторых вариантах осуществления структуру с конъюгатами изготавливают из впитывающего влагу пористого или волокнистого материала, способного быстро абсорбировать жидкость. Пористость материала может быть однонаправленной (например, с порами или волокнами, расположенными полностью или преимущественно параллельно оси структуры) или многонаправленной (например, всенаправленной, так что элемент обладает аморфной губкоподобной структурой). Можно использовать пористый полимерный материал, такой как полипропилен, полиэтилен, поливинилиденфторид, этиленвинилацетат, акрилонитрил и политетрафторэтилен. Полезно предварительно обработать данный материал поверхностно-активным веществом во время производства, поскольку это может уменьшить присущую материалу гидрофобность и, следовательно, усилить его способность принимать и доставлять влажный образец быстро и эффективно. Пористую структуру также можно изготавливать из бумаги или других целлюлозных материалов, таких как нитроцеллюлоза. В некоторых вариантах осуществления можно использовать материалы, которые в настоящее время применяют в наконечниках так называемых волоконных пишущих узлов, и таким материалам можно придавать форму или экструдировать с получением множества длин и поперечных сечений, соответствующих контексту настоящего изобретения. Предпочтительно, материал, содержащий пористую структуру с конъюгатами, выбирают так, чтобы данный пористый материал мог насыщаться водной жидкостью в течение секунд. Предпочтительно, материал остается прочным при увлажнении.
В других вариантах осуществления структура с конъюгатами представляет собой лак или глазурь, на которые нанесен слой детектирующего реагента. В одном варианте осуществления часть мембраны несет структуру с конъюгатами. Специалисту в данной области техники ясно, что, на практике, лак/глазурь не может образовывать настоящий поверхностный слой, и лакирующий/глазурующий материал может проникать до некоторой степени внутрь толщины мембраны. Нанесенный детектирующий реагент также может проникать внутрь мембраны. В соответствии с такими вариантами осуществления водный образец может течь вдоль длины мембраны и при этом растворять лак/глазурь и мобилизовать детектирующий реагент и переносить детектирующий реагент вдоль мембраны.
Детектирующий реагент
В предпочтительных вариантах осуществления детектирующий реагент представляет собой детектирующее антитело, меченое репортерным фрагментом.
В одном варианте осуществления детектирующее антитело представляет собой антитело или его антигенсвязывающий фрагмент, которые специфичны к белку Z-AAT. Антитело в различных вариантах осуществления проявляет по существу малую перекрестную реактивность к сывороткам PiMM или очищенному AAT дикого типа или не проявляет ее.
В другом варианте осуществления детектирующее антитело представляет собой моноклональное антитело LG96, MG97 или его антигенсвязывающий фрагмент.
В других вариантах осуществления детектирующее антитело представляет собой моноклональное антитело MG97, причем захватывающее антитело представляет собой моноклональное антитело LG96. В некоторых вариантах осуществления детектирующее антитело представляет собой моноклональное антитело LG96, причем захватывающее антитело представляет собой моноклональное антитело MG97. В некоторых вариантах осуществления захватывающее антитело представляет собой моноклональное антитело LG96, и детектирующее антитело представляет собой моноклональное антитело LG96.
Репортерный фрагмент может быть любым из широкого диапазона материалов/репортерных систем, известных в данной области техники. В некоторых вариантах осуществления репортерный фрагмент содержит первый член пары лиганд-рецептор, включая, но без ограничения, фермент (например, пероксидазу хрена (HRP), щелочную фрсфатазу, люциферазу, β-галактозидазу, глюкозооксидазу, лизоцим, малатдегидрогеназу, глюкозо-6-фосфатдегидрогеназу); золь металла, золь селена, углеродный золь и тому подобное; окрашенные или способные окрашиваться частицы (например, окрашенные или способные окрашиваться частицы латекса); частицы коллоидного металла (например, коллоидное золото, коллоидное серебро, коллоидная платина, коллоидный селен). Примеры известных в данной области техники способов обнаружения репортера включают, но без ограничения, способы обнаружения посредством визуального осмотра, спектрофотометрии в ультрафиолетовом (УФ) и видимом диапазоне, флуорометрии и радиационных счетчиков.
Репортерный фрагмент может быть ковалентно или нековалентно связан/соединен с детектирующим антителом. Связывание/соединение можно осуществлять любым способом, известным в данной области техники. Например, реагенты, применяемые при связывании/соединении, включают, но без ограничения, глутаральдегид, п-толуолдиизоцианат, различные карбодиимидные реагенты, п-бензохинон м-периодат, N,N1-o-фенилендималеимид, рекомбинантные способы и тому подобное.
Система разделения крови
В других вариантах осуществления устройство дополнительно содержит систему разделения крови для приема образца, причем данная система разделения крови соединена по текучей среде со структурой с конъюгатами. В одном варианте осуществления система разделения крови представляет собой система разделения крови, которая частично перекрывает подушку с конъюгатами.
В некоторых вариантах осуществления образец не следует наносить непосредственно на структуру с конъюгатами или мембранную часть устройства. В предпочтительном варианте осуществления образец наносят на систему разделения крови (например, абсорбирующий материал/подушку), которая соединена по текучей среде со структурой с конъюгатами. Например, система разделения крови может функционировать в качестве фильтра, например для удаления кровяных клеток из образца. Фильтрованный образец затем может достигать структуры с конъюг