Легковыделяемые биспецифические антитела с природным иммуноглобулиновым форматом
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ получения антигенсвязывающего белка, который является гетеродимерным в отношении связывания белка А. Культивируют клетки, содержащие первую нуклеиновую кислоту, кодирующую первую тяжелую цепь иммуноглобулина, содержащую первый вариабельный домен, который распознает первый эпитоп и вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь иммуноглобулина, содержащую второй вариабельный домен, который распознает второй эпитоп, где вторая область СН3 содержит модификацию, которая снижает или предотвращает связывание второй области СН3 с белком А по сравнению с первой областью СН3, а также третью нуклеиновую кислоту, кодирующую легкую цепь иммуноглобулина, которая образует пару с первой и второй тяжелыми цепями иммуноглобулина. Изобретение решает проблему загрязнения побочными продуктами биспецифических антигенсвязывающих белков А. 18 з.п. ф-лы, 10 ил., 3 табл., 12 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к антигенсвязывающим белкам или антителам с гетеродимерами тяжелых цепей, т.е. антителам с двумя тяжелыми цепями иммуноглобулинов, которые отличаются по меньшей мере одной аминокислотой, что позволяет проводить выделение антигенсвязывающего белка на основе различной аффинности к аффинному реагенту тяжелой цепи иммуноглобулина и модифицированной или мутированной тяжелой цепи иммуноглобулина. Изобретение также относится к антигенсвязывающим белкам (в том числе, к биспецифическим антителам), которые имеют участки СН2 и СН3 IgG с различными аффинностями к белку А, что обеспечивает их быстрое выделение за счет различного связывания участков IgG с белком А.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Антитела представляют собой многофункциональные молекулы, обладающие уникальной специфичностью связывания мишеневого антигена, а также способностью к взаимодействию с иммунной системой посредством механизмов, которые являются антиген-независимыми. Многие биологические лекарственные средства, используемые в настоящее время для лечения рака, представляют собой моноклональные антитела, направленные против антигенов, которые, как правило, сверхэкспрессированы на мишеневой злокачественной клетке. Если такие антитела связывают опухолевые клетки, то они могут запускать механизм антитело-зависимой клеточной цитотоксичности (ADCC) или комплемент-зависимой цитотоксичности (CDC). К сожалению, злокачественные клетки часто обладают механизмами, которые подавляют эти нормальные иммунные ответы.
В последние годы значительные усилия были направлены на создание терапевтических средств, аналогичных антителам, которые обладают более чем одной антиген-связывающей специфичностью, например, биспецифических антител. В случае способов лечения злокачественной опухоли, полиспецифический характер может обеспечить возможность применения, например, одной связывающей специфичности для нацеливания молекулы к антигену опухолевой клетки, а другой связывающей специфичности для индукции ответа, который в норме отсутствует в иммунной системе. Биспецифические антитела также могут быть использованы в качестве лигандов-заменителей для двухкомпонентных гетеродимерных рецепторных систем, которые в норме активируются их природным лигандом, который связывает и объединяет оба компонента.
В данной области разработаны различные форматы для направления терапевтического потенциала, обусловленного молекулами с многочисленными связывающими специфичностями. Желательно, такие молекулы должны представлять собой удобные в работе белки, которые легко получать и очищать, и которые обладают подходящими свойствами in vivo, например, фармакокинетикой, подходящей для намеченной мишени, минимальной иммуногенностью и, если необходимо, эффекторными функциями обычных антител.
Самый прямой способ получения биспецифического антитела (экспрессия двух различных антител в одной клетке) приводит к получению нескольких видов, поскольку соответствующие тяжелые цепи образуют и гомо- и гетеродимеры, а нужны только гетеродимеры. Также, легкие и тяжелые цепи могут образовать пару несоответствующим образом. Ниже описаны некоторые примеры форматов, которые пытаются разрешить эти проблемы различными способами.
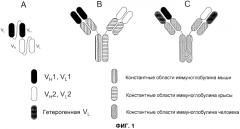
Один из форматов, используемый для биспецифичных молекул-активаторов Т-клеток (BiTE) (см., например. Wolf, E. et al. (2005) Drug Discovery Today 10:1237-1244)), основан на элементах одноцепочечного вариабельного фрагмента (scFv). scFv состоит из вариабельных областей легкой и тяжелой цепи антител, соединенных посредством гибкого линкера, который, как правило, может сворачиваться соответствующим образом и благодаря этому области могут связывать "свой" антиген. BiTE последовательно соединяет две различные специфичности scFv на одной цепи (см. фиг.1А). Подобная конфигурация предотвращает получение молекул с двумя копиями вариабельной области одной и той же тяжелой цепи. Кроме того, конструируют конфигурацию линкера для обеспечения правильного объединения соответствующих легких и тяжелых цепей.
Формат BiTE имеет некоторые недостатки. Во-первых, общеизвестно, что молекулы scFv склонны к агрегации. И хотя иммуногенность линкеров scFv по общему мнению является низкой, нельзя исключить возможность продукции антител против BiTE. Отсутствие участка Fc в формате BiTE также делает его время полужизни в сыворотке очень короткой, и это влечет за собой сложности вследствие частых повторных введений или вследствие непрерывной инфузии посредством помпы. В конечном итоге, отсутствие Fc также подразумевает отсутствие эффекторных функций, опосредованных Fc, которые могут являться эффективными в некоторых условиях.
Второй формат (фиг.1В) представляет собой гибрид моноклонального антитела мыши и крысы, и основывается на модификации общепринятой аффинной хроматографии с белком А (см., например, Lindhofer, H. et al. (1995) J. Immunol. 155:219-225)). В данном формате, антитело IgG2a мыши и IgG2b крысы продуцируются вместе в одной клетке (например, либо в виде квадромы, полученной слиянием двух гибридом, либо в сконструированных клетках СНО). Так как легкие цепи каждого антитела связываются преимущественно тяжелыми цепями родственных видов, то можно получить только три отдельных вида антител: два исходных антитела, и гетеродимер двух антител, содержащий одну пару тяжелой/легкой цепи каждого, связанную посредством их участков Fc. Требуемый гетеродимер можно легко очищать из смеси, так как его свойства связывания с белком А отличаются от свойств связывания исходных антител: IgG2b крысы не связывается с белком А, в то время как IgG2a мыши связывается. Таким образом, гетеродимер мышь-крыса связывается с белком А, но элюируется при более высоком значении рН, чем гомодимер IgG2a мыши, и это делает возможным селективную очистку биспецифического антитела. Как и в случае с форматом BiTE, этот гибридный формат обладает двумя моновалентными антигенсвязывающими участками.
Недостатком гибрида мышь/крыса в том, что он не является человеческим, это, вероятно, вызовет иммунный ответ у пациента, что может иметь побочные эффекты (например, реакции «НАМА» или «HARA»), и/или нейтрализовать эффект терапии.
На современном уровне техники обсуждали третий формат, обозначаемый как «выступы-во-впадины» (фиг.1C), как возможно эффективный для получения биспецифических антител (патент США №7183076). В этой стратегии, конструируют участки Fc из двух антител для создания одного выступающего «выступа», и другой комплементарной «впадины». Утверждают, что будучи полученными в одной и той же клетке, тяжелые цепи преимущественно образуют гетеродимеры, а не гомодимеры, посредством объединения сконструированных «выступов» с конструированными «впадинами». Проблемы правильного спаривания легкой и тяжелой цепи решают посредством выбора антител, которые обладают различными специфичностями, но используют одинаковые легкие цепи.
Недостаток этого формата состоит в том, что стратегия «выступы-во-впадины» может приводить к продукции значительного количества гомодимеров, что, таким образом, влечет за собой дополнительные стадии очистки. Эта проблема осложняется тем фактом, что контаминирующие виды по многим своим свойствам очень похожи на желаемые виды. Сконструированные формы могут также являться иммуногенными, так как мутации, вводимые для создания «выступов» и «впадин», привносят чужеродные последовательности.
Сохраняется необходимость в формате биспецифического антитела, в частности для терапевтического применения, который минимизирует некоторые или все недостатки, перечисленные выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 проиллюстрировано три формата биспецифического антитела: (А) биспецифический активатор Т-клеток (BiTE); (В) гибрид мышь-крыса; и (С) "выступы-во-впадины" с общей легкой цепью.
На фиг.2 проиллюстрирована модификация FcAAdp: (A) выравнивание Fc-областей IgC1 человека (SEQ ID NO:1) и IgG3 (SEQ ID NO:3), демонстрирующее модификацию FcAAdp, окаймленную рамкой; (В) схематическое изображение биспецифического антитела FcAAdp.
На фиг.3 проиллюстрировано выравнивание доменов СН3 IgG1 человека (с использованием нумерации экзонов IMGT и нумерацию EU), IgG2, и IgG4, с дипептидной модификацией AAdp и без дипептидной модификации AAdp, а также IgG3.
На фиг.4 показана регистрация результатов выделения биспецифического антитела на колонке с белком А, которые показывают профиль элюции с использованием ступенчатого градиента.
На фиг.5 представлен профиль связывания IL4-Ra и IL-6Ra в BIACORE™ для фракций, элюированных с колонки при хроматографическом разделения, показанном на фиг.4. Антитела во фракциях захватывали иммобилизованными антителами против Fc и затем растворимые IL-4Ra или IL-6Ra исследовали на связывание с захваченными антителами.
На фиг.6 показан фармакокинетический профиль биспецифического антитела FcΔAdp (IL-6RΔ/IL-4R), гомодимера FcΔAdp (IL-6RΔ/IL-6RΔ), антитела IgG1 с последовательностью СН3 дикого типа (IL-4R/IL-4R) и контрольного моноспецифического антитела.
На фиг.7 проиллюстрирована эффективность биспецифического антитела CD20×CD3ΔAdp в анализе цитолиза клеток Raji.
На фиг.8 проиллюстрирован неспецифический цитолиз клеток (293) с биспецифическим антителом CD20×CD3ΔAdp.
На фиг.9 показаны результаты экспериментов по экспрессии, с использованием различных гетеродимеров mFc. Панель А: анализ Вестерн-блоттинг зависящего от рН разделения гетеродимерного mIgG2a/mIgG2aPTTTK от гомодимерного mIgG2a и гомодимерного IgG2aPTTTK; панель В: анализ Вестерн-блоттинг зависящего от рН разделения гетеродимерного mIgG2a/mIgG2aTTTK от гомодимерного mIgG2a и гомодимерного IgG2aTTTK; IP=исходная фракция; FT=фракция, пропущенная через колонку; W2=вторая промывка (1× PBS рН 7,2); E1 = первая элюция (20 мМ Na цитрат, 1М NaCl рН 5,5); Е2 = вторая элюция (20 мМ Na цитрат, 1М NaCl; 57% рН 5,5+43% рН 2,6); Е3 = третья элюция (20 мМ Na цитрат, 1М NaCI рН 2,6).
На фиг.10 проиллюстрировано предпочтительное образование гетеродимеров мутантов IgG2a над образованием гетеродимеров смешанных изотипов (например, mIgG2a и mIgG1), с использованием соотношения 4:1 для конструкта IFNAR1:IFNAR2. Дорожка 1: IFNAR1-IgG2a:IFNAR2-IgG1; дорожка 2: INFAR1-IgG2a:IFNAR2-IgG2aTTT; дорожка 3: IFNAR1-IgG2a:IFNAR2-IgG2aTTTK; дорожка 4: IFNAR1-IgG2a:IFNAR2-IgG2aPTTTK; дорожка 5: IFNAR1-IgG2a:IFNAR2-IgG2aRF.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение по меньшей мере отчасти основано на использовании в биспецифическом антигенсвязывающем белке двух последовательностей константного домена СН3 тяжелой цепи иммуноглобулина, которые отличаются по меньшей мере одной аминокислотой. Отличие по меньшей мере в одной аминокислоте приводит к повышенной эффективности при выделении белка, так как отличие приводит к различной способности последовательностей домена СН3 связываться с аффинным средством.
В одном из аспектов, разработан антигенсвязывающий белок, содержащий первый и второй полипептид, первый полипептид содержит, от N-конца до С-конца, первую антигенсвязывающую область, которая селективно связывает первый антиген, за которым следует константная область, которая содержит первую область СН3 IgG человека, выбранного из IgG1 (SEQ ID NO:1), IgG2 (SEQ ID NO:3), IgG4 (SEQ ID NO:5), и их комбинацию; и, второй полипептид, содержащий, от N-конца до С-конца, вторую антигенсвязывающую область, которая селективно связывает второй антиген, с последующей константной областью, которая содержит вторую область СН3 IgG человека, выбранную из IgG1, IgG2, IgG4, и их комбинацию, где вторая область СН3 содержит модификацию, которая снижает или устраняет связывание второго домена СН3 с белком А.
В одном из вариантов осуществления вторая область СН3 содержит модификацию 95R (при нумерации экзонов IMGT; 435R при нумерации EU). В другом варианте осуществления вторая область СН3 дополнительно содержит модификацию 96F (IMGT; 436F при EU). В конкретных вариантах осуществления, вторая область СН3 выбрана из SEQ ID NO:2, SEQ ID NO:4 и SEQ ID NO:6.
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG1 человека (SEQ ID NO:2) и дополнительно содержит модификацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L358M, N384S, K392N, V397M и V422I при EU).
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG2 человека (SEQ ID NO:4) и дополнительно содержит модификацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT; N384S, K392N и V422I при EU).
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG4 человека (SEQ ID NO:6), и дополнительно содержит модификацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I при EU).
В одном из вариантов осуществления домен СН3 происходит из химерного домена, который содержит последовательности из двух или более IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека.
В одном из вариантов осуществления домен СН3 происходит из IgG1 человека, IgG2 человека или IgG4 человека, и антигенсвязывающий белок дополнительно содержит домен СН1 и СН2, где домен СН1 и домен СН2 независимо выбраны из группы, состоящей из домена СН1 или СН2 IgG1 человека, домена СН1 или СН2 IgG2 человека, химерного IgG1/IgG2 человек/человек или химерного IgG1/IgG3 человек/человек или химерного домена IgG2/IgG3 человек/человек или химерного IgG1/IgG4 человек/человек или химерного IgG3/IgG4 или химерного домена IgG2/IgG4. В конкретном варианте осуществления химерные домены IgG1/IgG2, IgG1/IgG3, IgG2/IgG3, IgG1/IgG4, IgG3/IgG4 и IgG2/IgG4 являются неиммунсгонными или по существу неиммуногенными для человека.
В одном из вариантов осуществления антигенсвязывающий белок дополнительно содержит легкую цепь иммуноглобулина. В одном из вариантов осуществления легкая цепь иммуноглобулина выбрана из легкой цепи лямбда и каппа человека.
В одном из вариантов осуществления каждая первая и вторая антигенсвязывающие области содержат по меньшей мере один CDR, в другом варианте осуществления по меньшей мере два CDR, в другом варианте осуществления каждая содержит три CDR. В конкретном варианте осуществления CDR происходят из тяжелой цепи иммуноглобулина. В другом конкретном варианте осуществления тяжелая цепь представляет собой тяжелую цепь иммуноглобулина человека.
В одном из вариантов осуществления первая антигенсвязывающая область содержит первый вариабельный домен тяжелой цепи иммуноглобулина, а вторая антигенсвязывающая область содержит второй вариабельный домен тяжелой цепи иммуноглобулина.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина независимо выбирают из домена иммуноглобулина мыши, крысы, хомяка, кролика, макака, человекообразной обезьяны и человека.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина независимо содержат CDR человека, CDR мыши, CDR крысы, CDR кролика, CDR макака, CDR человекообразной обезьяны и гуманизированные CDR. В одном из вариантов осуществления CDR происходит из человека и является соматически мутированным.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина содержат каркасную область человека (FR). В одном из вариантов осуществления FR человека представляет собой соматически мутированный FR человека.
В одном из вариантов осуществления первую и/или вторую антигенсвязывающие области получают скринингом фаговой библиотеки, содержащей вариабельные области антитела, по реактивности по отношению к представляющему интерес антигену. В другом варианте осуществления первую и/или вторую антигенсвязывающие области получают иммунизацией животного, не являющегося человеком, такого как мышь, крыса, кролик, макака или человекообразная обезьяна, представляющим интерес антигеном и идентификацией последовательности нуклеиновой кислоты вариабельной области антитела, кодирующей вариабельную область, специфичную для представляющего интерес антигена. В конкретном варианте осуществления животное, не являющееся человеком, содержит один или несколько генов вариабельной области иммуноглобулина человека. В другом конкретном варианте осуществления один или несколько генов вариабельной области иммуноглобулина человека представлены в животном, не являющемся человеком, внехромосомно, в виде перестановки в локусе эндогенного иммуноглобулина, или в виде трансгена, случайным образом интегрированного в геном животного, не являющегося человеком. В одном из вариантов осуществления первую и/или вторую антигенсвязывающие области получают из гибридомы или квадромы, в другом варианте осуществления посредством скрининга иммунных клеток иммунизированного животного, не являющегося человеком, используя сортировку клеток.
В одном из вариантов осуществления антигенсвязывающий белок представляет собой биспецифическое антитело. В одном из вариантов осуществления биспецифическое антитело полностью является биспецифическим антителом человека и независимо обладает аффинностью для каждого эпитопа в микромолярном, наномолярном или пикомолярном диапазоне.
В одном из вариантов осуществления антигенсвязывающий белок является неиммуногенным или по существу неиммуногенным для человека. В конкретном варианте осуществления антигенсвязывающий белок не содержит неприродный эпитоп для Т-клетки человека. В одном из вариантов осуществления модификация области СН3 является неиммуногенной или по существу неиммуногенной для человека. В конкретном варианте осуществления модификация области СН3 не приводит в результате к образованию неприродного эпитопа для Т-клетки человека.
В одном из вариантов осуществления антигенсвязывающий белок содержит тяжелую цепь, где тяжелая цепь является неиммуногенной или по существу неиммуногенной для человека. В одном из вариантов осуществления тяжелая цепь имеет аминокислотную последовательность, которая не содержит неприродный эпитоп для Т-клетки. В одном из вариантов осуществления тяжелая цепь содержит аминокислотную последовательность, протеолиз которой не может привести к образованию аминокислотной последовательности из приблизительно 9 аминокислот, которые являются иммуногенными для человека. В конкретном варианте осуществления человек представляет собой человека, который подвергся действию антигенсвязывающего белка. В одном из вариантов осуществления тяжелая цепь содержит аминокислотную последовательность, протеолиз которой не может привести к образованию аминокислотной последовательности, состоящей из приблизительно 13-17 аминокислот, которые являются иммуногенными для человека. В конкретном варианте осуществления человек представляет собой человека, который подвергся действию антигенсвязывающего белка.
В одном из аспектов, представлен биспецифический связывающий белок, содержащий модификации в СН2 и/или СН3, как описано в настоящем документе, где биспецифический связывающий белок содержит первую связывающую молекулу, которая специфически распознает антиген на В-клетке, и вторую связывающую молекулу, которая специфично распознает антиген на Т-клетке.
В одном из вариантов осуществления связывающий белок представляет собой биспецифическое антитело. В конкретном варианте осуществления биспецифическое антитело содержит тяжелую цепь IgG1 человека и тяжелую цепь IgG1ΔAdp человека. В одном из вариантов осуществления первая связывающая молекула представляет собой вариабельный домен тяжелой цепи человека, который специфично распознает CD20. В одном из вариантов осуществления вторая связывающая молекула представляет собой вариабельный домен тяжелой цепи иммуноглобулина человека, который специфично распознает CD3. В одном из вариантов осуществления биспецифическое антитело демонстрирует, в анализе цитолиза Raji, ЕС50 приблизительно равное 2,8-3,2×10-12 M или приблизительно равное 2,8-3,0×10-12 M, и демонстрирует не более, чем приблизительно 1-10%, или 1-5% неспецифического цитолиза в анализе неспецифического клеточного цитолиза, где "фоновая" клетка не содержит эпитоп CD20. В конкретном варианте осуществления "фоновая" клетка представляет собой клетку 293. В другом конкретном варианте осуществления неспецифический клеточный цитолиз в анализе измеряют в концентрации биспецифического антитела от приблизительно 10-8 М до приблизительно 10-14 М.
В одном из аспектов, был создан способ для получения биспецифического антитела, где способ предусматривает: получение последовательности нуклеиновой кислоты, кодирующей первую тяжелую цепь иммуноглобулина, содержащую первый вариабельный домен, который распознает первый эпитоп, где первая тяжелая цепь иммуноглобулина содержит константный домен изотипов IgG1, IgG2 или IgG4, или химерный константный домен этих изотипов; получение второй последовательности нуклеиновой кислоты, кодирующей вторую тяжелую цепь иммуноглобулина, содержащую второй вариабельный домен, который распознает второй эпитоп, где вторая тяжелая цепь иммуноглобулина содержит константный домен изотипов IgG1, IgG2 или IgG4 или химерный константный домен этих изотипов, который содержит модификацию в его домене СН3, которая устраняет или снижает связывание с белком А; получение третьей последовательности нуклеиновой кислоты, кодирующей легкую цепь иммуноглобулина, которая образует пару с первой и второй тяжелой цепью иммуноглобулина; введение первой, второй и третьей последовательности нуклеиновой кислоты в клетку млекопитающего/что позволяет клетке экспрессировать иммуноглобулин, и выделение иммуноглобулина с использованием белка А.
В одном из вариантов осуществления клетка выбрана из СНО, COS, 293, HeLa и клетки сетчатки, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
В одном из аспектов, представлен биспецифический антигенсвязывающий белок, который содержит первую специфичность, которая связывает антиген и вторую специфичность, которая активирует рецептор, где биспецифический антигенсвязывающий белок содержит первый полипептид, содержащий первый домен СН3 IgG1, IgG2 или IgG4, который содержит связывающую белок А детерминанту, и второй полипептид, содержащий второй домен СН3 IgG1, IgG3 или IgG4, который лишен связывающей белок А детерминанты.
В одном из вариантов осуществления вторая специфичность, которая активирует рецептор, связывает рецептор с Ко, которая представлена в молярном, миллимолярном, микромолярном, наномолярном или пикомолярном диапазоне.
В одном из вариантов осуществления вторая специфичность связывает рецептор, выбранный из рецептора, связывающего G-белок, рецептора тирозинкиназы, интегрина и Toll-подобного рецептора.
В одном из вариантов осуществления вторая специфичность связывается с рецептором и вызывает изменение рецептора или субъединицы или белка, физически связанного с ним для осуществления фосфорилирования серина, треонина или тирозина; обуславливает циклитизацию нуклеотида (например, цАМФ, цАДФ или цГМФ); обуславливает продукцию фосфатидилинозитола или его производных (например, IP3 или PIP3); обуславливает продукцию липидного вторичного мессенджера (например, диацилглицерола, церамида, лизофосфатидной кислоты, эйкозаноида); обуславливает дефосфорилирование (например, фосфатазную активность); обуславливает фосфорилирование липида для образования вторичного мессенджера; обуславливает гидролиз вторичного мессенджера; обуславливает протеолиз; обуславливает окислительно-восстановительный путь передачи сигнала; обуславливает перемещение белка в клеточные органеллы (например, в ядро); обуславливает агрегацию рецептора (самого с собой) для образования гомо- или (с другими рецепторами) гетеромультимеров; или обуславливает открытие или закрытие трансмембранного канала.
В одном из аспектов, предоставлен способ получения биспецифического антитела, включающий: выделение представляющего интерес биспецифического антитела из квадромы, где представляющее интерес биспецифическое антитело содержит первую тяжелую цепь, которая представляет собой изотип IgG1, IgG2 или IgG4, вторую тяжелую цепь, которая представляет собой изотип IgG1, IgG2 или IgG4, обладающий константным доменом/ который содержит модификацию в своем домене СН3, который устраняет или снижает связывание с белком А, где представляющее интерес биспецифическое антитело выделяют, используя белок А.
В одном из аспектов, предоставлен способ получения биспецифического антитела, включающий стадию выделения из разрушенной клетки или смеси антител биспецифического антитела, имеющего селективно модифицированные домены СН3 IgG1, IgG2 или IgG4, где селективно модифицированный домен СН3 является неиммуногенным или по существу неиммуногенным для человека, и где модификация приводит к получению биспецифического антитела с гетеродимерной тяжелой цепью, мономеры которых обладают различной аффинностью к белку А и биспецифическое антитело выделяют из разрушенной клетки или смеси, используя белок А.
В одном из вариантов осуществления биспецифическое антитело выделяют, используя аффинную подложку с белком А, где биспецифическое антитело элюируется при рН от приблизительно 3,9 до приблизительно 4,4, от приблизительно 4,0 до приблизительно 4,3, от приблизительно 4,1 до приблизительно 4,2 или приблизительно рН 4,2. В одном из вариантов осуществления биспецифическое антитело элюируется при рН приблизительно 4, 4,1, 4,2, 4,3, 4,4 или 4,5.
В одном из вариантов осуществления биспецифическое антитело выделяют, используя аффинную подложку с белком А и градиент рН или стадию, где градиент рН или стадия включает ионный модификатор. В конкретном варианте осуществления ионный модификатор представлен в молярной концентрации от приблизительно 0,5 до приблизительно 1,0. В конкретном варианте осуществления ионный модификатор представляет собой соль. В одном из вариантов осуществления ионный модификатор выбран из группы, состоящей из бериллия, лития, натрия и калиевых солей ацетата; натрия и калия бикарбонатов; лития, натрия, калия и цезия карбонатов; лития, натрия, калия, цезия и хлорида магния;
натрия и калия фторидов; натрия, калия и кальция нитратов/натрия и калия фосфатов; и кальция и сульфата магния. В конкретном варианте осуществления ионный модификатор представляет собой галоидную соль щелочного металла или щелочноземельного металла. В конкретном варианте осуществления ионный модификатор представляет собой хлорид натрия.
В одном из аспектов, связывающий белок, содержащий Fc, где Fc содержит первый домен СН3, который модифицирован как описано в настоящем документе и второй СН3, который не модифицируют, с тем, чтобы создать гетеродимерный Fc, где избирательная модификация приводит к тому, что связывающий белок элюируется из аффинного материала с белком А при единицах рН, равных 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,3 или 1,4, более высоких, чем единицы рН для соответствующего связывающего белка, который не имел избирательной модификации.
В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при рН приблизительно 4,2, тогда как немодифицированный связывающий белок элюируется при рН приблизительно 3. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН приблизительно равном 4,5, тогда как немодифицированный связывающий белок элюируется при значении рН, приблизительно равном 3,5. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН, приблизительно равном 4, тогда как немодифицированный связывающий белок элюируется при значении рН, приблизительно равном 2,8-3,5, 2,8-3,2 или 2,8-3. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН, приблизительно равном 4,2, тогда как немодифицированный связывающий белок элюируется при значении рН приблизительно равном 2,8. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН приблизительно равном 4,4, тогда как немодифицированный связывающий белок элюируется при значении рН приблизительно равном 3,6. В этих вариантах осуществления, «немодифицированный» относится к отсутствию модификации в 435 (нумерация EU), или отсутствию модификации в 435 и 436 (нумерация EU), в обоих доменах СН3.
Любые варианты осуществления и аспекты, описываемые в настоящем документе можно использовать в комбинации друг с другом, если не указано иначе или не очевидно из контекста. Другие варианты осуществления будут очевидны специалистам в данной области из обзора последующего описания.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение не ограничено конкретными способами и описанными экспериментальными условиями, по существу способы и условия могут изменяться. Также следует понимать, что используемая в настоящем документе терминология представлена только для описания конкретных вариантов осуществления, и не предназначена для ограничения, так как объем настоящего изобретения определен пунктами формулы изобретения.
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области, к которому относится настоящее изобретение. Несмотря на то, что в практическом осуществлении или анализе по настоящему изобретению можно использовать любые способы и материалы, похожие или эквивалентные способам и материалам, описываемым в настоящем документе, конкретные способы и материалы описаны в документе. Все указанные публикации включены, таким образом, в качестве ссылки.
Как используется в настоящем документе термин «антитело» включает молекулы иммуноглобулинов, состоящие из четырех полипептидных цепей, двух тяжелых цепей (Н) и двух легких цепей (L), связанных дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращено в настоящем документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращено в настоящем документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен CL. Области VH и VL можно дополнительно подразделять на области гипервариабельности, обозначаемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более консервативными, обозначаемые каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенные от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращены как HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращены как LCDR1, LCDR2 и LCDR3. Термин «высокая аффинность» антитела относится к таким антителам, которые обладают аффинностью связывания со своей мишенью по меньшей мере равной 10-9 М, по меньшей мере 10-10 М; по меньшей мере 10-11 М; или по меньшей мере 10-12 М, как измерено поверхностным плазменным резонансом, например, BIACORE™ или аффинной ELISA в растворе.
Выражение «антигенсвязывающий белок» включает белок, имеющий по меньшей мере один CDR и способный к избирательному распознаванию антигена, т.е. белок, который является способным к связыванию антигена с KD, которая представлена по меньшей мере в микромолярном диапазоне. Для терапевтических антигенсвязывающих белков (например, терапевтических антител) обычно требуется KD, которая представлена в наномолярном или пикомолярном диапазоне. Выражение «антигенсвязывающий белок» также включает белок, содержащий первый и второй домен СН3, как описано в настоящем документе и первый белок или распознающий лиганд домен и второй белок или распознающий лиганд домен, где первый белок или распознающий лиганд домен и второй белок или распознающий лиганд домен, каждый независимо распознает один и тот же белок или лиганд или вместе распознают один и тот же белок или лиганд, или каждый независимо распознает различные белок или лиганд. Одним из примеров такого белка является иммуноадгезин, содержащий слитый белок - (гетеро- или гомо-) димер, где полипептиды димера представляют собой слитые полипептиды, которые содержат рецепторный компонент или лигандный компонент, где лигандный компонент включает аминокислотную последовательность, связывающую рецептор.
Выражение «биспецифическое антитело» включает антитело, способное селективно связывать два или более эпитопа. Биспецифические антитела, как правило, включают две различные тяжелые цепи, где каждая тяжелая цепь специфически связывает разные эпитопы или на различных молекулах (например, антигенах) или на одной и той же молекуле (например, на одном и том же антигене). Если биспецифическое антитело способно селективно связывать два различных эпитопа (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи для первого эпитопа как правило будет по меньшей мере от одного до двух или трех или четырех порядков ниже, чем аффинность первой тяжелой цепи для второго эпитопа и наоборот. Эпитопы, распознаваемые биспецифическим антителом могут представлять собой одну и ту же или различную мишень (например, на одном и том же или различном белке). Биспецифические антитела можно получать, например, комбинированием тяжелых цепей, которые распознают различные эпитопы на одном и том же антигене. Например, последовательности нуклеиновой кислоты, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного и того же антигена могут быть слиты с последовательностями нуклеиновой кислоты, кодирующими различные константные области тяжелой цепи, и такие последовательности можно экспрессировать в клетке, которая экспрессирует легкую цепь иммуно глобулин а. Типичное биспецифическое антитело имеет две тяжелые цепи, где каждая имеет три CDR тяжелой цепи, с последующим (от N-конца до С-конца) доменом СН1, шарнирной областью, доменом СН2 и доменом СН3, и легкой цепью иммуноглобулина, которая или не наделена антигенсвязывающей специфичностью, но может объединяться с каждой из тяжелой цепей, или может объединяться с каждой из тяжелых цепей и может связывать один или несколько эпитопов, ограниченных антигенсвязывающими областями тяжелой цепи, или может объединяться с каждой из тяжелых цепей и способствует связыванию или одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин «клетка» включает любую клетку, которая является подходящей для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают клетки прокариот и эукариот (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы Е. coil, Bacillus spp., Streptomyces spp., и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, 5. cerevlslae, S. pombe, P. pastoris, P. mekhanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, клетки насекомых, инфицированные бакуловирусом, Trichoplusia ni, и т.д.), не относящиеся к человеку животные клетки, клетки человека, или слияния клеток, такие как, например, гибридомы или квадромы. В некоторых вариантах осуществления клетка представляет собой клетку человека, макака, человекообразной обезьяны, хомяка, крысы или мыши. В некоторых вариантах осуществления клетка является эукариотической и выбрана из следующих клеток: СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетки сетчатой оболочки глаза, Vero, CV1, почек (например, НЕК293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, BHK21), Jurkat, Daudi, A431 (эпидермальная), CV-1, U937, 3Т3, клеток L, клеток С127, SP2/0, NS-0, ММТ 060562, клеток Сертоли, клеток BRL 3А, клеток НТ1080, миеломной клетки, опухолевой клетки и клеточной линии, полученной из указанных выше клеток. В некоторых вариантах осуществления клетка включает один или несколько вирусных генов, например, клетка сетчатой оболочки глаза, которая экспрессирует вирусный ген (например, клетки PER.C6™).
Выражение «определяющая комплементарность область» или термин «CDR» включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулина организма, которые, как правило, (т.е., у животных дикого типа) присутствует между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы имуноглобулина (например, антитела или рецептора Т-клетки). CDR может кодироваться, например, последовательностью зародышевой линии или перестроенной или неперестроенной по