Векторы
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии. Предложен вектор переноса для встраивания гена в генетический локус последовательности бакуловируса, содержащий кассету экспрессии, содержащую эукариотический промотор, функционально связанный с указанным геном, удаляемую кассету двойной селекции, которая фланкирована последовательностями рекомбинации LoxP, причем указанные последовательности LoxP модифицированы, чтобы обеспечить прохождение только одного цикла рекомбинации, содержащую экспрессируемую последовательность, кодирующую первый селектируемый маркер, экспрессируемую последовательность, кодирующую второй селектируемый маркер, последовательности, фланкирующие указанные кассету экспрессии и кассету двойной селекции, причем указанные последовательности в существенной степени соответствуют последовательностям указанного генетического локуса в последовательности бакуловируса, что обеспечивает гомологическую рекомбинацию между указанным вектором переноса и указанным бакуловирусом. Также предложены способ получения рекомбинантной бакмиды, способ получения рекомбинантного бакуловируса, рекомбинантная бакмида, рекомбинантный бакуловирус, клетка и способ получения белка. Изобретение позволяет увеличить эффективность экспрессии рекомбинантных белков. 7 н. и 12 з.п. ф-лы, 8 ил., 1 табл., 4 пр.
Реферат
Настоящее изобретение относится к вектору переноса, применяемому для встраивания гена в генетический локус последовательности бакуловируса. Также настоящее изобретение относится к способам применения вектора переноса и получаемым бакмидам и бакуловирусам.
Систему экспрессии на основе бакуловируса применяли для экспрессии тысяч белков в клетках эукариот в целях структурных и биохимических исследований (14). Помимо того, что система на основе бакуловируса позволяет осуществлять экспрессию отдельных рекомбинантных белков, ее также применяли для совместной экспрессии нескольких белов, которые образуют комплексы (15-22). Это важно, поскольку скрининг всего генома для поиска взаимодействующих молекул показывает, что многие жизненно-важные функции живых клеток обусловлены комплексами белков из нескольких субъединиц (23). Для достижения совместной экспрессии белков с помощью системы на основе бакуловируса применяли две основные стратегии. Наиболее распространенный подход - это совместное инфицирование клетки двумя или более вирусами, каждый из которых экспрессирует один рекомбинантный белок (19, 24, 25). Однако, часто выход комплексов белков при гаком подходе варьирует в значительной степени, а совместное инфицирование одних и тех же клеток двумя разными бакуловирусами не подчиняется закону распределения Пуассона (26). Таким образом, хотя способ совместного инициирования технически прост, практически он ограничен получением только относительно простых комплексов для приложений, которые не требуют большого количества очищенного белка.
Для приложений, таких как структурные исследования и крупные испытания вакцин, для которых требуются большие количества белков, и для более сложных комплексов. образуемых множеством субъединиц, применяли альтернативный подход совместной экспрессии белков с нескольких одинаковых кассет экспрессии, которые встраивают в локус полиэдрина или Р10 (15-18, 22, 27). Этот подход имеет то преимущество, что каждая клетка в культуре, инфицированная рекомбинантным вирусом, воспроизводимо экспрессирует все белки, необходимые для образования белкового комплекса. При сравнении подходов совместного инфицирования и применения только одного бакуловируса, второй подход продемонстрировал значительно больший выход рекомбинантного комплекса (28). Однако экспрессия нескольких белков с применением одного рекомбинантного вируса не лишена недостатков. Хотя палочковидный бакуловирус, является довольно устойчивым к вставкам в его геном, гены трансфецируют в вирус посредством гомологичной рекомбинации, и вектор переноса должен иметь такой размер, чтобы с ним было легко работать в клетках Е.coli. Соответственно, существует ограничение по числу генов, которые можно встраивать в вектор переноса. На практике это означает, что редко можно экспрессировать более четырех белков из одного локуса. Кроме того, бакуловирус содержит последовательности и экспрессирует белки, которые запускают гомологичную рекомбинацию (29-32). Соответственно, вирусы, которые содержат большое количество повторов, склонны к перестройке и рекомбинации (21, 33, 34).
Подход совместной экспрессии с применением одного бакуловируса модифицировали посредством встраивания сайта loxP в локус chiA/cathepsin бакмиды, который уже содержит мишень Tn7 в локусе полиэдрина (20). Это позволяет осуществить встраивание множества экспрессионных кассет в каждый из этих локусов посредством рекомбинации в Е.coli. Как можно было ожидать исходя из того, что указанная система основана на повторяющейся дупликации кассеты экспрессии, которую модифицировали в целях экспрессии разных генов, существуют данные, что вставки в этой системе в определенной степени генетически нестабильны (21).
Недавно, для изучения бакуловируса появились новые возможности благодаря применению системы рекомбинации ЕТ, которая позволила производить селективное выключение вирусных генов (35-49). Однако потенциал данного метода для конструирования и облегчения экспрессии белков в генетических локусах помимо локуса р10 и полиэдрина не изучали.
Настоящее изобретение относится к способу эффективной экспрессии множества рекомбинантных белков (т.е., белков; не происходящих от бакуловируса) с генома одного бакуловируса. Данный способ позволяет эффективно вводить кассеты экспрессии отдельных белков в разные локусы в геноме вируса при помощи системы рекомбинации RT. Кроме того, данный способ дает возможность экспрессии комплексов с множеством субъединиц.
Экспрессия отдельных белков с применением бакуловируса в качестве системы экспрессии сейчас общепринята. Основная методология данной системы экспрессии очень мало изменилась с тех пор, как она была получена впервые. Поскольку геном бакуловируса состоит из 133 кб двухцепочечной ДНК, он слишком велик для того, чтобы работать с ним напрямую. Соответственно, гены, кодирующие чужеродные белки, с использованием клеток Е.coli клонируют в векторы, содержащие кассету экспрессии из вируса насекомых AcMNPV, которые затем вводят с вирусной ДНК в клетки насекомых, где белки вируса и клетки опосредуют гомологичную рекомбинацию, которая приводит к продукции инфекционного (применительно к клеткам насекомых) вируса, экспрессирующего чужеродный белок. Были получены различные варианты указанной системы, включая геномы вирусов, которые способны реплицироваться только в случае происхождения рекомбинации (1, 2), и проведение рекомбинации в Е.coli при помощи бакмиды, основанной на применении транспозона Tn7 (3) для ускорения отбора рекомбинантного вируса. Экспрессию комплекса из нескольких белков в клетках насекомых также осуществляли при помощи экспрессирующей системы бакуловируса, которая кратко описана выше. Изначально для совместного инфицирования восприимчивых клеток применяли несколько вирусов, каждый из которых экспрессировал отдельный белок, и комплекс белков очищали после экспрессии. Однако этот способ в лучшем случае неэффективен и не достаточно воспроизводим для промышленного масштаба. В качестве альтернативы создали векторы, которые включают несколько единиц экспрессии, но способны к рекомбинации с единственным генетическим локусом вируса (4-6). Эти векторы имели то преимущество, что они давали возможность получения всех субъединиц рекомбинантных белков в каждой инфицированной клетке и давали значительно более высокий выход комплекса рекомбимантных белков. Кроме того, поскольку все белки экспрессирует только один вирус, воспроизводимость результата инфекций была гораздо выше. Такие векторы имеют два недостатка. Во-первых, поскольку векторы содержат повторы, и бакуловирус экспрессирует белки, которые запускают гомологичную рекомбинацию, экспрессия, особенно с конструкций, содержащих три или четыре единицы экспрессии, не всегда достаточно генетически стабильна при большом количестве пересевов вирусов (которые необходимы при увеличении объема для промышленной экспрессии белков с применением бакуловирусов). Во-вторых, есть практическое ограничение по размеру вставки, которую легко можно сохранять и с которой можно работать в Е.coli, что ограничивает количество белков, которые можно экспрессировать с таких векторов. Другой подход, который был предложен для производства нескольких белков, состоит во встраивании чужеродного белка (белков) в один генетический локус в бакуловирусе, последующей селекции вируса, экспрессирующего этот белок, и применение генома этого вируса для рекомбинации во втором генетическом локусе для экспрессии других белков (7). Однако из-за необходимости высокой степени технической подготовки и большого времени, которых требует этот подход (16 дней для первого локуса и 25 дней для каждого последующего локуса), этот подход применяли очень редко. Последние разработки включали модификацию ВАС на основе системы транспозона Tn7 посредством встраивания сайта LoxP во второй генетический локус в бакуловирусе, чтобы также сделать возможным встраивание дополнительных генов в этот локус в Е.coli (8). Однако этот способ все еще не лишен проблем, связанных с тем, что наличие повторов вследствие дупликации промоторов в бактериальных векторах означает, что конструкция будет генетически нестабильна при множественных пересевах вируса, и векторы переноса будут быстро достигать размера, максимально допустимого для манипуляции в Е.coli.
Способ, предложенный в настоящем изобретении, позволяет преодолеть по меньшей мере некоторые из проблем, присущих ранее существующим способам, такие как генетическая нестабильность и потребность в множественных циклах рекомбинации.
Согласно первому аспекту настоящего изобретения предложен вектор переноса для встраивания гена в генетический локус последовательности бакуловируса, содержащий:
кассету экспрессии, содержащую эукариотический промотор, функционально связанный с геном; кассету двойной селекции, содержащую:
(i) экспрессируемую последовательность, кодирующую первый селектируемый маркер; и
(ii) экспрессируемую последовательность, кодирующую второй селектируемый маркер; и
последовательности, фланкирующие указанные кассету экспрессии и кассету двойной селекции, причем указанные последовательности в существенной степени соответствуют последовательностям генетического локуса в последовательности бакуловируса.
Вектор переноса, предложенный в настоящем изобретении, можно применял, для эффективного встраивания гена в генетический локус последовательности бакуловируса и для отбора последовательностей бакуловируса, которые содержат указанный ген. В частности, было показано, что применение кассеты двойной селекции значительно увеличивает число идентифицированных положительных клонов (т.е., последовательностей бакуловируса, содержащих встроенный ген) по сравнению с отбором при помощи одиночного селектируемого маркера. Это дает значительные преимущества по сравнению с применением одиночного селектируемого маркера. Трансформируется только небольшое количество бакуловирусов, и, следовательно, маркер экспрессируется только на очень низком уровне. Например, когда маркером является устойчивость к антибиотику, можно применять только очень низкую концентрацию антибиотика. Это приводит к селекции вариантов бактерий, которые являются устойчивыми к используемому антибиотику. Следовательно, некоторые бактерии, растущие на чашках, могут не содержать модификацию. Применение двух способов положительной селекции позволяет преодолеть вероятность таких ложно-положительных результатов отбора.
Вектором переноса, предложенным в соответствии с настоящим изобретении, может быть любой подходящий вектор, при условии, что он способен к рекомбинации с последовательностью бакуловируса путем гомологичной рекомбинации и обеспечивать встраивание гена в последовательность бакуловируса. Подходящие векторы переноса хорошо известны специалистам в данной области техники. Основные свойства вектора переноса обсуждаются ниже.
Ген, который нужно вставить в последовательность бакуловируса, может представлять собой любой гетерологичный ген (т.е., ген, не происходящий от бакуловируса). Предпочтительно, указанный гетерологичный ген кодирует субъединицу белкового комплекса. Указанный гетерологичный ген может кодировать белок вируса, компонент рецептора или комплекса шаперонов. Особенно предпочтительно, чтобы гетерологичный ген кодировал белок вируса, который вместе с другими белками вируса может образовывать вирусоподобную частицу (ВПЧ).
Генетическим локусом, в который встраивают ген в последовательности бакуловируса, может быть любой подходящий локус, который дает возможность экспрессировать такой встроенный ген, а также не нарушает способность последовательности бакуловируса к репликации. Также применяемый локус не должен влиять на способность бакуловируса к инфицированию клеток, т.е., к репликации или распространению из клетки в клетку. Такие локусы включают локусы полиэдрина и р10. Другие дополнительные подходящие локусы, обнаруженные авторами настоящего изобретения, включают ctx, egt, 39k, orf51, gp37, iap2 и odv-e56.
Последовательностью бакуловируса может быть любая подходящая последовательность бакуловируса, которая может реплицироваться в клетке насекомого и прокариотической клетке, такой как Е.coli. В частности, можно применять любой геном бакуловируса, который содержит репликой ВАС. Подходящие последовательности бакуловируса включают бакмиду AcMNPV.
Термин «кассета экспрессии» относится к комбинации элементов, необходимых для экспрессии гена. Соответственно, кассета экспрессии включает подходящий промотор, который делает возможной экспрессию кодируемого гена в клетках эукариот (например, клетках насекомых), и подходящую последовательность сигнала полиаденилирования, фланкирующую указанную последовательность гена. Кассеты экспрессии для экспрессии генов в клетках эукариот хорошо известны специалистам в данной области техники.
Промоторы, которые особо предпочтительны, включают вирусные поздние промоторы бакуловируса (например, р35) или вирусные очень поздние промоторы (например, промоторы полиэдрина и р10). Подходящие последовательности сигнала полиаденилирования включают последовательность полиаденилирования триптофангидроксилазы (Тпг) или последовательности полиаденилирования из генов бакуловируса.
Кассета экспрессии согласно настоящему изобретению может содержать более одного гена (например, 2, 3 или 4 гена), что приводит к экспрессии более чем одного гена. Однако обычно предпочтительно, чтобы кассета экспрессии содержала единственный ген.
Было показано, что кассета двойной селекции улучшает идентификацию и выделение клонов, которые успешно включили ген. Кассета двойной селекции содержит 2 различных селектируемых маркера. Также указанная кассета содержит любые элементы, необходимые для экспрессии маркеров в клетке бактерии, такие как один или более бактериальных промоторов. Этап отбора последовательностей, которые содержат ген, включает отбор последовательностей, содержащих оба селектируемых маркера. Данный этап отбора проводят в клетках бактерий, например, Е.coli. Селектируемыми маркерами могут быть любые маркеры, которые позволяют отбирать клетки, содержащие кассету. Например, маркеры могут быть визуальными, такие как маркер, вызывающий изменение внешнего вида или окраски колонии клеток. В качестве альтернативы, маркер может придавать устойчивость, например, к антибиотику. Два указанных селектируемых маркера могут быть маркерами одного типа, например, представлять собой устойчивость к двум разным антибиотикам, или маркерами разного типа, например, представлять собой устойчивость к антибиотику и визуальный маркер. Первый селектируемый маркер предпочтительно представляет собой визуальный маркер, такой как фрагмент LacZalpha, придающий синюю окраску клеткам, экспрессирующим фрагмент LacZalpha, в присутствии IPTG (изопропилтиогалактозида) и X-gal. Второй селектируемый маркер предпочтительно представляет собой любой маркер, придающий устойчивость к антибиотику, такую как устойчивость к хлорамфениколу, тетрациклину, нуромицину, ампициллину, пенициллину, апрамицину, канамицину или флеомицину. Особенно предпочтительно, чтобы второй маркер придавал устойчивость к флеомицину.
Согласно предпочтительному варианту реализации указанная кассета двойной селекции фланкирована последовательностями рекомбинации LoxP. Последовательности рекомбинации LoxP соединяются вместе в присутствии рекомбиназы Cre, что приводит к делеции последовательности, которая находится между ними. Соответственно, кассету двойной селекции можно удалить, что позволяет применять одни и те же селектируемые маркеры при введении любых дополнительных генов в последовательность бакуловируса. Предпочтительно модифицировать сайты LoxP так, чтобы между сайтами мог происходить только один цикл рекомбинации. Подходящие модифицированные сайты LoxP хороню известны специалистам в данной области техники, например, модифицированные сайты Lox66 и Lox71.
Последовательности, фланкирующие кассету экспрессии и кассету двойной селекции согласно настоящему изобретению, в существенной степени соответствуют последовательностям указанного генетического локуса, что дает возможность осуществления гомологичной рекомбинации между вектором переноса и последовательностью бакуловируса. Каждая фланкирующая последовательность предпочтительно должна иметь длину по меньшей мере 20 пар оснований (по), более предпочтительно длину по меньшей мере 30 по, и еще более предпочтительно, длину по меньшей мере 50 по, и должна содержать последовательность, позволяющую осуществлять специфичную рекомбинацию с последовательностью указанного генетического локуса.
Согласно второму аспекту настоящего изобретения предложен способ получения рекомбинантной бакмиды, включающий:
объединение бакмиды и вектора переноса, соответствующего первому аспекту настоящего изобретения, для обеспечения возможности гомологичной рекомбинации; и
селекцию рекомбинантной бакмиды, которая содержит кассету двойной селекции.
Отбор рекомбинантной бакмиды можно проводить при помощи стандартных методик в зависимости от кассеты двойной селекции. Способ получения рекомбинантной бакмиды может дополнительно включать детектирование наличия гена в бакмиде или продукта его экспрессии. Можно применять подходящие методики скрининга в зависимости от конкретного гена.
Кроме того, когда кассета селекции фланкирована последовательностями рекомбинации LoxP, способ предпочтительно дополнительно включает также индукцию рекомбинации между сайтами LoxP, например, посредством воздействия на бакмиду рекомбиназой Cre, для удаления кассеты двойной селекции. Предпочтительно, чтобы рекомбиназа Cre была под контролем индуцируемого промотора, такого как промотор арабинозы. Преимущество удаления кассеты двойной селекции состоит в том, что с бакмидой можно рекомбинировать дополнительный вектор переноса, причем указанный дополнительный вектор переноса может содержать ту же кассету двойной селекции. Отбор дополнительно рекомбинированной бакмиды можно проводить при помощи тех же методик, которые применяют после первого цикла рекомбинации.
Обычно способ получения рекомбинантной бакмиды реализуют в прокариотической клетке, поскольку системой на основе клетки прокариот можно легче и быстрее манипулировать. Предпочтительно, чтобы система на основе клетки прокариот обеспечивала возможность гомологичной рекомбинации. Такие системы включают систему рекомбинации лямбда ред, которая описана в заявке на Европейский патент ЕР-А-1291420. Предпочтительно, чтобы способ получения рекомбинантной бакмиды был реализован в E.coli. Особенно предпочтительно, чтобы способ был реализован с применением клеток E.coli линии EL350, которые содержат и интегрированный профаг лямбда, экспрессирующий exo, bet и gam под контролем регулируемого температурой промотора lambdaPL, и рекомбиназу Cre под контролем промотора, индуцируемого арабинозы.
Способ получения рекомбинантной бакмиды можно повторять несколько раз так, чтобы бакмида могла содержать несколько гетерологичных генов, т.е., 1, 2, 3, 4, 5, 6, 7, 8 или более гетерологичных генов. При попытках применения разных промоторов для экспрессии каждого встроенного гена, и если каждый ген встроен в отличный генетический локус, можно сократить или избежать повторов в бакмиде и тем самым гарантировать хорошую генетическую стабильность бакмиды. Также предпочтительно, чтобы между встроенными гетерологичными генами был расположен по меньшей мере один незаменимый ген. Такое расположение гарантирует, что если между любыми из встроенных последовательностей произойдет гомологичная рекомбинация, незаменимый ген будет удален, и образуется нежизнеспособная бакмида.
Согласно третьему аспекту настоящего изобретения предложена рекомбинантная бакмида, полученная посредством способа, соответствующего второму аспекту настоящего изобретения. Указанная бакмида содержит встроенный ген, а также может содержать остатки последовательностей LoxP. Эти остатки можно применять в качестве маркеров для идентификации бакмид. Предпочтительно, чтобы бакмида содержала по меньшей мере 5, 6, 7, 8 или 9 гетерологичных генов.
Согласно четвертому аспекту настоящего изобретения также предложен способ получения рекомбинантного бакуловируса, включающий культивирование эукариотических клеток, содержащих рекомбинантную бакмиду, полученную посредством способа, соответствующего второму аспекту настоящего изобретения при условиях, в которых образуется бакуловирус.
Предпочтительно, эукариотические клетки представляют собой клетки насекомых, более предпочтительно, их получают из насекомых Spodoptera frugiperda или Trichoplusia ni, например, клетки насекомых Sf21, Sf9 или TN 5B-1-4. Бакуловирус можно выделить при помощи стандартных методик и можно протестировать экспрессию встроенных гетерологичных генов.
Согласно пятому аспекту настоящего изобретения также предложен рекомбинантный бакуловирус, полученный посредством способа, соответствующего четвертому аспекту настоящего изобретения.
Согласно шестому аспекту настоящего изобретения также предложена рекомбинантная бакмида или рекомбинантный бакуловирус, которые экспрессируют совокупность гетерологичных белков, отличающиеся тем, что каждый белок экспрессируется с отдельного генетического локуса указанных бакмиды или бакуловируса. Также предпочтительно, чтобы между каждым генетическим локусом, экспрессирующим гетерологичный белок, был расположен по меньшей мере один незаменимый ген. Такое расположение гарантирует, что если между генетическими локусами, экспрессирующими гетерологичный ген, произойдет гомологичная рекомбинация, указанный незаменимый ген будет удален, и образуется нежизнеспособная бакмида или бакуловирус. Предпочтительно, чтобы указанные бакмида или бакуловирус экпрессировали по меньшей мере 3, более предпочтительно по меньшей мере 5, а наиболее предпочтительно по меньшей мере 8 белков. Указанные белки являются гетерологичными, т.е, их не кодируют существующие в природе бакуловирусы. Также предпочтительно, чтобы кодируемые гетерологичные белки были субъединицами белкового комплекса, такого как ВПЧ, комплекс рецептора или комплекс шаперонов.
Также предпочтительно, чтобы отдельные генетические локусы рекомбинантной бакмиды или бакуловируса были выбраны из: ctx, egt, 39k, orf51, gp37, iap2, odv-e56 и p10. Положение таких локусов специально описано применительно к бакуловирусу AcMNPV в Таблице 1. Специалисты в данной области техники могут легко определить положение локусов у других штаммов бакуловирусов и бакмид на основании этой информации.
| Таблица 1 | |
| Генетические локусы, указанные выше, определены ниже применительно к эталонной последовательности доступа для AcMNPV (номер доступа NC001623). | |
| Локус | Граничные точки |
| ctx | 2028-2296 |
| egt | 11310-13091 |
| 39k | 29196-30070 |
| orf51 | 43154-44337 |
| gp37 | 52192-52327 |
| iap2 | 60983-61823 |
| р35 | 116282-117460 |
| plO | 118767-119135 |
| odv-e56 | 128947-130166 |
Согласно седьмому аспекту настоящего изобретения также предложены рекомбинантная бакмида или рекомбинантный бакуловирус, в которых кассету экспрессии, кодирующая гетерологичный белок, встраивают в один или более из следующих генетических локусов: ctx, egt, 39k, orf51, gp37, iap2 и odv-e56.
Было показано, что указанные генетические локусы специфичным образом способствуют высокому уровню экспрессии гетерологичного белка, не нарушая ключевых функций бакмиды или бакуловируса.
Предпочтительно, чтобы рекомбинантная бакмида или рекомбинантный бакуловирус кодировали совокупность белков, и каждая кассета экспрессии была встроена в отдельный генетический локус. Также предпочтительно, чтобы рекомбинантная бакмида или рекомбинантный бакуловирус кодировали по меньшей мере 3, более предпочтительно но меньшей мере 5, а наиболее предпочтительно по меньшей мере 8 белков. Также предпочтительно, чтобы кодируемые гетерологичные белки были субъединицами белкового комплекса, такого как ВПЧ, комплекс рецептора или комплекс шаперонов.
Согласно восьмому аспекту настоящего изобретения также предложен вектор переноса для встраивания гена в генетический локус последовательности бакуловируса, содержащий:
кассету экспрессии, содержащую эукариотический промотор, функционально связанный с геном; и
последовательности, фланкирующие кассету экспрессии, причем указные последовательности в значительной степени соответствуют последовательностям генетического локуса в последовательности бакуловируса, при этом указанный генетический локус выбирают из числа: ctx, egt, 39k, orf51, gp37, iap2 и odv-e56.
Как указано выше, было показано, что при вставке гена в перечисленные генетические локусы можно получить высокий уровень экспрессии гена без нарушения ключевых функций последовательности бакуловируса.
Согласно девятому аспекту настоящего изобретения также предложен способ получения рекомбинантной бакмиды, включающий:
объединение бакмиды и вектора переноса, соответствующего восьмому аспекту настоящего изобретения, для обеспечения прохождения гомологичной рекомбинации; и
селекцию рекомбинантной бакмиды, содержащей кассету экспрессии.
Способы получения такой рекомбинантной бакмиды и отбора такой бакмиды хорошо известны специалистам в данной области техники. Согласно настоящему изобретению также предложена рекомбинантная бакмида, полученная указанным способом.
Согласно десятому аспекту настоящего изобретения также предложен способ получения рекомбинантного бакуловируса, включающий получение рекомбинантной бакмиды посредством способа, предложенного в настоящем изобретении, и культивирование эукариотической клетки, содержащей указанную бакмиду с получением бакуловируса.
Способы получения такого рекомбинантного бакуловируса хороню известны специалистам в данной области техники. Согласно настоящему изобретению также предложена рекомбинантный бакуловирус, полученный указанным способом.
Согласно настоящему изобретению также предложена клетка, содержащая вектор переноса, бакмиду или бакуловирус, соответствующие любому из аспектов настоящего изобретения. Согласно настоящему изобретению также предложен способ получения одного или более белков, включающий культивирование рекомбинантной бакмиды или бакуловируса, соответствующих любому из аспектов настоящего изобретения, при подходящих условиях. Указанные один или более белков кодируются одним или более генами и могут объединяться, образуя белковый комплекс, такой как ВПЧ, комплекс рецептора или комплекс шаперонов. Один или более белок можно изолировать при помощи стандартных методик, хорошо известных специалистам в данной области техники.
Ниже настоящее изобретение в качестве примера описано применительно к следующим фигурам.
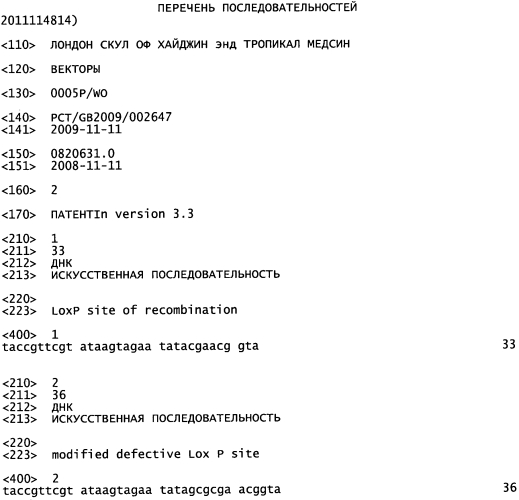
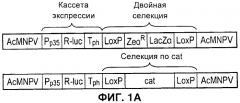
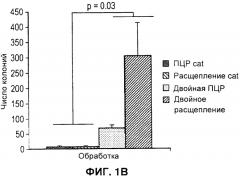
На Фигуре 1 показан улучшенный отбор рекомбинантов, полученных при клонировании ЕТ. А) Схема ДНК, применяемой для рекомбинации гена cat (хлорамфениколацетилтрансферазы) и двойных рекомбинаций. Обе конструкции содержат одинаковые фланкирующие последовательности бакуловируса (AcMNPV), кассету экспрессии люциферазы Renilla (Pp35-Rluc-Tph) и сайты loxP (LoxP). Двойной селектируемый маркер также содержит ген устойчивости к зеоцину (ZeoR) и фрагмент LacZa. В конструкции, устойчивой к хлорамфениколу, его заменяют на ген cat. В) Количество положительных колоний бактерий после рекомбинации ЕТ. ДНК, применяемую для рекомбинации, получали либо посредством ПЦР (полимеразной цепной реакции), либо путем расщепления рестрикционной эндонуклеазы, как указано. С) Правильность встраивания кассеты экспрессии Rluc подтверждали посредством ПЦР с применением одного праймера в Т-ДНК и одного фланкирования целевого локуса в ДНК бакуловируса. Надлежащий продукт ПЦР (показан стрелкой) можно получить только после надлежащей интеграции. Показаны результаты 12 независимых рекомбинаций (1-12), отсутствие образца контроля ПЦР (13), образец немодифицированной бакмиды (14) и образец Т-ДНК (15). Дорожка М - это маркер ДНК. D) Активность люциферазы Renilla (относительные световые единицы) через 48 часов после инфицирования в лизате клеток, инфицированных пересевом 2 рекомбинантных бакмид 1-12 с панели С. Фоновая активность эквивалентна активности лизатов неинфицированных клеток, и количество клеток, инфицированных немодифицированной бакмидой (AcMNPV) было более чем в 106 раз меньше.
На Фигуре 2 показано селективное удаление маркерных генов. А) Схема, иллюстрирующая стратегию ЕТ рекомбинации кассеты экспрессии (экспрессии) в ДНК бакмиды AcMNPV и селективное удаление только маркерных генов (отбор) посредством опосредуемой Cre рекомбинации. В) ПЦР с применением праймеров а и b в А, дорожки 1-2: два независимых рекомбинанта бакмиды после ЕТ рекомбинации, дорожки 3-6: четыре независимых рекомбинанта после опосредуемой Cre рекомбинации в целях удаления селектируемых маркеров бактерий, дорожка 7: нет образца, дорожка 8: образец ДНК немодифицированной бакмиды, дорожка 9: образец ДНК плазмиды, содержащий кассету селектируемого маркера. дорожка 10: маркер ДНК. Продукты ПЦР, соответствующие размерам, прогнозируемым для исходных и рекомбинантных продуктов опосредуемой Cre рекомбинации, помечены как Р и R, соответственно. С) Файл трассировки последовательностей репрезентативного рекомбинанта из анализа ПЦР на панели В, подтверждающий наличие дефективного loxP, включающего плечи loxP71 и 1охР66, которые отображают рекомбинант, неспособный подвергнуться дальнейшей опосредуемой Cre рекомбинации. D) Активность люциферазы Renilla для исходных и рекомбинантных бакмид, показанных на панели В, при их трансфекции в клетки насекомых. Активность люциферазы Renilla оценивали через 48 часов после инфицирования после пересева рекомбинантого вируса. Фоновая активность неинфицированных клеток отмечена обозначением «Клетки».
На Фигуре 3 показана идентификация дополнительных сайтов экспрессии рекомбинантных белков в геноме AcMNPV. А) Схема AcMNPV, иллюстрирующая относительные положения локусов, применяемых для экспрессии белков. В) Таблица, в которой указаны локусы, применяемые для встраивания, и любые дополнительные изменения, произведенные в локусе. С) Относительная активность люциферазы Renilla через 48 часов после инфицироваиия вирусом, модифицированным таким образом, чтобы он содержал дополнительную кассету экспрессии люциферазы светлячка в каждом указанном локусе. Все вирусы содержат одинаковую кассету экспрессии люциферазы Renilla в локусе р10 под контролем промотора р35. Планки погрешностей отражают стандартное отклонение для пяти повторов каждого локуса. D) Нормированная активность люциферазы светлячка, отражающая относительную экспрессию кассеты из промотора полиэдрина - терминатора полиэдрина люциферазы светлячка, встроенной в каждый локус, как указано. Планки погрешностей отражают стандартное отклонение для 5 повторов для каждого локуса. Активность люциферазы светлячка нормировали на контроль люциферазы Renilla, экспрессируемой с того же генома. Вставки люциферазы светлячка в локусы orfl 1, v-fgf, ре и orf23 были исключены, поскольку уровень активности люциферазы Renilla был более чем на 2 логарифмических единицы ниже, чем у контрольного вируса. Вирус Ph содержит ген люциферазы светлячка в локусе полиэдрина, а ген люциферазы Renilla в локусе р10. Вирус Ph* содержит такую же вставку гена люциферазы Renilla в локусе р10, но не содержит вставки гена люциферазы светлячка.
На Фигуре 4 показана экспрессия белка оболочки вируса гриппа M1 с локусов egt и полиэдрина. На левой панели показан окрашенный Кумасси полиакриламидный гель с додецилсульфатом натрия (SDS PAGE) всего белка из клеток, инфицированных контрольным бакуловирусом (дорожки 1 и 4), egt-M1 (дорожка 2) и YM1-M1 (дорожка 3). Размеры белков-маркеров (дорожка М) указаны слева от геля. На панели справа показан результат вестерн-блоттинга двойного геля, анализируемого при помощи антисыворотки анти-Н7М7.
На Фигуре 5 показана совместная экспрессия белков оболочки вируса гриппа M1 и НА. а также образование ВПЧ. А) На панели слева показан окрашенный Кумасси гель всех белков; на панели справа показан результат вестерн-блоттинга двойного геля, анализируемого при помощи антисыворотки против вируса гриппа H7N7. Клетки инфицировали двойственным бакуловирусом, экспрессирующим и НА, и M1 (дорожка 1), бакуловирусом, экспрессирующим только НА (дорожка 2), клетки контроля (дорожка 3), бакуловирусом, экспрессирующим только M1 (дорожка 4). В) Электронно-микроскопические снимки ВПЧ вируса гриппа, с отрицательной окраской. С) ВПЧ вируса гриппа после иммунного окрашивания золотом (НА); частицы золота показаны стрелками.
На Фигуре 6 показано получение бакуловируса, одновременно экспрессирующего 4 белка. A) Лизат клеток, инфицированных бакуловирусом, экспрессирующим VP2 (дорожка 1); VP5 (дорожка 2), VP3 (дорожка 3) и VP7 (дорожка 4), неинфицированных клеток (дорожка 5) или всех 4 белков (дорожки 6-10), положение белков-маркеров (М) и размер в кДа, как указано. B) Лизат клеток, экспрессирующих VP5, VP2, VP3, VP7 (дорожки 1-4) и частично очищенные ВПЧ (дорожка 5). С) В таблице указан локус встраивания и промотор вируса, применяемый для экспрессии каждого белка ВПЧ. D) Электронно-микроскопические снимки отрицательной окраски при иммунном окрашивании золотом (для VP5), показывающие очищенные ВПЧ BTV.
На Фигуре 7 показаны кристаллические пластинки, образованные при гиперэкспрессии ССТ5. Четырехугольные агрегаты белков в питательной среде очень позднего инфицирования бакуловирусом, экспрессирующим ССТ5.
На Фигуре 8 показана экспрессия ССТ в клетках насекомых. А) Окрашенный Кумасси лизат клеток, инфицированных бакуловирусом, экспрессирующим ССТ1-ССТ8 (дорожки 1-8, соответственно), только клетки (дорожка 9) или только бакуловирус, одновременно экспрессирующий 7 субъединиц ССТ (дорожка 10). В) Результат вестерн-блоттинга двойного геля с применением антисыворотки из поликлональных анти-ССТ антител мыши. C) В таблицах указаны разные генетические локусы и промоторы, применяемые для экспрессии каждой из субъединиц ССТ.
ПРИМЕРЫ
Система экспрессии на основе бакуловируса обладает твердо установленным потенциалом для получения больших количество правильно скрученных белков эукариот для исследований ферментов и структурных исследований.
Однако становится все очевиднее, что многие, если не большинство, белки активны в клетках в составе комплексов, образованных продуктами нескольких различных генов. При возрастающем темпе открытий в области структуры белков существует реальная потребность в системах для быстрого и надежного получения и очистки комплексов белков. В частности, это справедливо для крупных комплексов, которые требуют одновременной экспрессии, а также скручивания и процессинга нескольких субъединиц белков в клетке эукариот. Ранее изобретатели разработали векторы переноса на основе бакуловируса, способные к экспрессии 2, 3, 4 и 5 белков с генома одного бакуловируса. В предыдущих исследованиях главная цель изобретателей состояла в получении системы, способной синтезировать большие количества комплексов белков вируса, содержащих не эквимолярные количества кодируемых вирусом белков для исследований ферментов и структурных исследований. Одно из наблюдений, сделанных при работе с указанными системами, состоит в том, что отдельный бакуловирус, экспрессирующий несколько генов, образует желаемые комплексы белков гораздо эффективнее, чем клетки насекомых, инфицированные совместно несколькими бакуловирусами, экспрессирующими отдельные гены. В настоящем исследовании изобретатели применили новые технологии для разработки этого наблюдения для получения рекомбинантных бакуловирусов, экспрессирующих несколько белков для создания биологически значимых комплексов белков млекопитающих.
В частности, изобретатели адаптировали и усовершенствовали новые технологии конструирования хромосом бактерий для быстрого и эффективного получения рекомбинантных бакуловирусов, одновременно экспрессирующих несколько бел