Соединения и фармацевтические комбинации для лечения нейродегенеративных и ишемических болезней мозга
Иллюстрации
Показать всеИзобретение относится к пептидам, включающим фикоцианобилин (PCB), и медицинскому применению указанных пептидов и PCB, благодаря идентифицированному у них нейропротекторному и/или нейрорегенеративному действию. Фармацевтические комбинации указанных пептидов и PCB с белками или другими пептидами с синергическим эффектом могут найти применение для лечения ишемических или нейродегенеративных заболеваний ЦНС. 5 н. и 7 з.п. ф-лы, 9 ил., 2 табл., 9 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к биологии, фармакологии, нейробиологии, биотехнологии и медицине, в особенности неврологии и терапии внутренних болезней. В общем, изобретение относится к получению терапевтических средств для лечения заболеваний центральной нервной системы (ЦНС), которые вызваны или происходят в результате ишемического, воспалительного и/или нейродегенеративного повреждения.
Изобретение основано на применении производных фикоцианина-C (C-phyco) или частей данной молекулы, содержащих пиррольные кольца в своей структуре, для лечения цереброваскулярных болезней, характеризуемых гипоксией ткани и заболеваниями с воспалительными и нейродегенеративными компонентами. Они также включают фармацевтические комбинации указанных соединений с другими биомолекулами, которые вводят профилактически и терапевтически.
Уровень техники
Лечение цереброваскулярных, демиелинизирующих и нейродегенеративных заболеваний представляет новый рубеж в области неврологии. Острые нарушения мозгового кровообращения (CVA) поражают приблизительно 5% населения мира в возрасте 65 лет или старше и могут вызывать тяжелую инвалидность у пораженных лиц (World Health Organization: Statistical Information System. World Health Organization, 2004). Более 90% смертельных случаев происходит у людей в возрасте 50 лет или старше и приблизительно у 15-30% выживших пациентов сохраняются некоторые последствия (Buergo-Zuaznabar M A, et al. Revista Electrónica de las Ciencias Médicas en Cienfuegos: 2-22; Miranda Q J A. Cerebrovascular Diseases, 2004; 1:17-21; Rosamond W, et al. Circulation. 2007:169-171).
Приблизительно 80% случаев CVA, согласно данным Всемирной организации здравоохранения (ВОЗ), относятся к ишемическому типу, то есть происходят вследствие острой окклюзии одной из главных артерий мозга тромбом или эмболом (World Health Organization: Statistical Information System. World Health Organization, 2004), что приводит к уменьшению перфузии области, снабжаемой данной артерией.
Нейропротекция является профилактической и терапевтической стратегией лечения, фундаментальная задача которой состоит в предотвращении патологической потери нейронов, происходящей при болезнях ЦНС, например, в ходе ишемии. Основная цель нейрорегенерации заключается в устранении повреждения, произошедшего при нейровоспалительных и нейродегенеративных заболеваниях, таких как рассеянный склероз (РС).
Главная цель лечения ишемии мозга состоит в следующем: (1) уменьшении размера ишемической зоны, с ограничением ее возможного расширения в прилегающие области; (2) ограничении расширения области гибели клеток в восстанавливаемой зоне пенумбры или ишемической полутени в пределах адекватного терапевтического окна (Muhammad S H A S. Eur Neurol. 2008; 59:4-14).
Новые нейропротекторные и/или нейрорегенеративные терапевтические средства-кандидаты должны блокировать и/или ослаблять клеточные метаболические биохимические процессы, приводящие к развитию повреждения головного мозга в ходе и после ишемического события. Кроме того, они должны охватывать широкий спектр возможных фармакологических мишеней в патогенном механизме повреждения головного мозга (Ovbiagele B, et al. Curr Treat Options Cardiovasc Med. 2003; 5:441-449).
Существуют сведения, подтверждающие существование выделенных из природных источников соединений, обладающих нейропротективным и/или нейрорегенеративным действием при нарушениях ишемического типа, а также при нейродегенеративных заболеваниях. Несколько исследований указывают, что природные и синтетические каннабиноиды способны оказывать нейропротекторное действие при ишемии мозга (Mauler F, el at. J Pharmacol Exp Ther. 2002; 302(1): 359-68; Iadecola C. Curr Opin Neurol. 2001; 14: 89-94; Sinor A D, et al. Neurosci Lett. 2000; 278(3): 157-60), рассеянном склерозе (Baker D, Pryce G, Croxford J L, Brown P, Pertwee RG, et al. Nature. 2000; 404(6773): 84-87), болезни Хантингтона (Lastres-Becker I, et al. Brain Res. 2002; 929(2): 236-42) и болезни Паркинсона (Lange J M, et al. DDT. 2005; 10(10): 693-702) посредством различных антиоксидантных механизмов и ингибирования эксайтотоксичности, при уменьшении и блокировании высвобождения аминокислот и медиаторов воспаления.
Несмотря на это каннабиноиды связаны с существенными неблагоприятными эффектами, которые в большой степени зависят от дозы, концентрации каннабиноидных соединений в каждой дозе, от опыта пациента и времени приема.
Острые эффекты, как сообщали, в большой степени были обусловлены антихолинергическими эффектами каннабиноидов, включающими: сухость во рту, покраснение глаз, снижение четкости зрения, снижение артериального давления, повышение частоты сердечных сокращений, снижение реакции, повышение чувствительности, потеря координации и замедление психомоторного ритма. Также сообщали о хронических эффектах, таких как: дисфункция иммунной системы с возможным увеличением частоты возникновения рака, которая превосходит, в случае рака легкого, частоту заболеваемости у курящих пациентов. Увеличение риска острого инфаркта миокарда, бесплодия, фиброза печени у пациентов с гепатитом и возможный риск усиления эпилепсии в случае применения пациентами каннабиноидов все еще обсуждаются, как и некоторые психические эффекты, с учетом того, что употребление марихуаны может вызывать изменения восприятия, такие как галлюцинации, искажение пространственно-временного восприятия или явления деперсонализации и/или дереализации. Приступы тревоги, острые кризисные состояния психотического типа, эйфория, чрезмерная разговорчивость, а также когнитивная дисфункция, такая как потеря кратковременной памяти или замедленное мышление, необратимые когнитивные изменения, ухудшение существовавших ранее психиатрических проблем, повышение риска шизофрении. Также описывали изменения настроения (депрессивные и/или маниакальные), социальную изоляцию, а также зависимость от употребления марихуаны, что в некоторых случаях способствует употреблению других наркотических средств. Необходимо подчеркнуть, что употребление марихуаны при беременности может привести к когнитивным и психопатологическим изменениям потомства в подростковом периоде.
Фикоцианин-C представляет собой билипротеин, обнаруженный в некоторых синезеленых водорослях, таких как Spirulina platensis, которые часто используются во многих странах в качестве пищевой добавки с хорошо доказанными пищевыми и цитопротекторными свойствами (Bockow B I. United States Patent. No. 05709855 (1998); Kay, R.A. Crit. Rev. Food Sci. Nutr.1991; 30: 555-573; González De R C, et al. Life Sci.1993; 53: 57-61).
Большая часть исследований с фикоцианином-C была направлена на демонстрацию антиоксидантных свойств. Способность фикоцианина-C связывать свободные радикалы была продемонстрирована в анализе: (1) хемолюминесценции и (2) ингибирования повреждения 2-дезоксирибозы (Romay C, et al. Inflamm. Res. 1998; 47:36-41; Bhat V B, et al. Biochem. Biophys. Res. Commun. 2000; 275:20-25).
Было доказано, что фикоцианин-C значительно ингибирует повышение уровня продуктов перекисного окисления липидов в микросомах печени крыс после применения аскорбиновой кислоты + Fe2+ (Romay C, et al. Inflamm. Res. 1998; 47:36-41) или 2,2' азобис-2-амидинопропана гидрохлорида (HAAP). Последний является инициатором образования свободных радикалов (Bhat V B, et al. Biochem. Biophys. Res. Commun. 2000; 275:20-25), что указывает на то, что данное соединение является хорошим ингибитором перекисного окисления липидов.
С другой стороны, фикоцианин-C действует как антиканцерогенный агент, ингибируя окислительное повреждение ДНК, опосредуемое ONOO-, и ограничивая пролиферацию опухолей (Li B, et al. Biomed Pharmacother. 2005; 59: 551-60). Кроме того, было продемонстрировано, что это природное соединение ингибирует агрегацию тромбоцитов (Hui-Fen Ch, et al. British Journal of Nutrition. 2006; 95: 435-440).
Фикоцианин-C в концентрации 1-3 мг/мл предотвращает гибель нейронов из-за отсутствия калия и сыворотки в течение 24 ч в культуре зернистых клеток мозга (Rimbau V, et al. Naunyn Schmiedebergs Arch Pharmacol. 2001; 364:96-104).
Активность фикоцианина-C также исследовали в модели повреждения головного мозга на крысах при индукции каиновой кислотой (Rimbau V, et al. Neuroscience Letters.1999; 276: 75-78). Введение однократной дозы 100 мг/кг фикоцианина-C уменьшало проявления и изменения, наблюдаемые у обработанных животных по сравнению с животными в необработанной контрольной группе.
Кроме того, было продемонстрировано, что фикоцианин-C ингибирует ЦОГ-2, посредством: 1) анализа выделенного фермента и (2) анализа общей крови (Reddy C M, et al. Biochem. Biophys. Res. Commun. 2000; 277:599-603).
Фикоцианин-C мог уменьшать отеки при введении пероральным путем в дозе 100-200 мг/кг в моделях воспаления лапы, индуцированного карагинаном и глюкозооксидазой у мышей и крыс (Romay Ch, et al. Pharm. Pharmacol. 2000; 52: 367-368; Madhyastha HK, et al. J Cell Mol Med. 2008), и в модели воспаления уха на мышах, индуцированного арахидоновой кислотой (Romay Ch, et al. Pharm. Pharmacol. 2000; 52: 367-368).
В обзоре описаны главные исследования, выполненные с фикоцианином-C в различных моделях на животных (Curr Protein Pept Sci. 2003 Jun; 4(3):207-16). В большинстве экспериментов требовались высокие дозы фикоцианина-C (выше 100 мг/кг и до 300 мг/кг), чтобы наблюдался терапевтический эффект.
Фикоцианобилин (PCB) - хромофор фикоцианина-C; с химической точки зрения он характеризуется присутствием пиррольных колец без белкового фрагмента.
Интерфероны (IFN) первоначально были обнаружены в виде растворимых белков, обладающих противовирусной активностью, при этом они могут быть разделены на: IFN I типа (IFN альфа и бета) и II типа (IFN гамма). Хотя обычно считается, что IFN альфа и бета используют общий сложный рецептор, имеется несколько сообщений, в которых выдвинуто предположение, что в способности IFN альфа и бета индуцировать некоторые биологические эффекты имеются различия. Они включают выборочную индукцию IFN-специфичного гена (Rani MRS, et al. J Biol Chem 1996, 271: 22878-22884; Platanias LC, et al. J Biol Chem 1994, 269:17761-17764), ингибирующие эффекты различных факторов роста (Rosenblum MG, et al. J Interferon Res 1990, 10: 141-151) и эритропоэтические эффекты (Means RT, et al. Exp Hematol 1996, 24: 204-208). Исходя из этого, можно сделать вывод, что биологический эффект, идентифицированный для IFN альфа, не должен быть также идентифицирован для IFN бета, и наоборот.
Возможным объяснением различных событий сигнализации между IFN альфа и бета может быть существование фосфопротеинов, связанных с определенным рецептором IFN бета, который, по-видимому, фосфорилирован по тирозину и связан с рецептором 1 IFN альфа (IFNAR1) (Croze E, et al. J Biol Chem. 1996: 271: 33165-33168; Platanias LC, et al. J Biol Chem. 1996, 271: 23630-23633).
Механизмы действия IFN альфа и бета очень сложны. Эти два цитокина действуют через различные пути сигнализации. Последнее подтверждается фактами. Исследования, проведенные на клетках UIA, в которых отсутствовала JAK-киназа TYK2 (Velazquez L, et al. 1992. Cell 70: 313-322), показали, что эти клетки не могут связываться с и отвечать на IFN альфа, но могут делать это с IFN бета (Pellegrini S, et al. 1989. Mol Cell Biol 9, 4605-4612). Это позволяет предположить, что сайты связывания для IFN альфа требуют присутствия TYK2. В случае сайтов связывания для IFN бета они могут быть сформированы в отсутствии TYK2.
Клинические исследования (CT), проведенные с IFN альфа при РС, показали низкую эффективность (Gilhus EN, World Neurology 1995, 5: 10-12; Sheridan P (ed), Multiple Sclerosis Research in progress 1993-1994. Clinical Trials. International Federation of Multiple Sclerosis Societies, London, 1995, pp. 3-35; Trials with Alferon, human leukocyte interferon alpha. Clinical Trials Monitor, 1997; 4 (12): 4).
IFN бета является одним из лекарственных средств, одобренных Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для лечения РС, при этом сообщения также отражают его низкую эффективность и зависимость от высоких доз, требуемых для достижения эффекта (Zaragozá García F et al. Farm Hospit. 2002; 26:294-301).
Кроме того, для IFN терапии были описаны побочные эффекты, зависящие от пути введения и дозы. Пациенты могут испытывать псевдогриппозные реакции, такие как лихорадку, миалгию, озноб и общий дискомфорт в течение 24-48 часов после каждой инъекции. Некроз на участке инъекции наблюдается у 5% пациентов.
С другой стороны, одно из основных действий интерлейкина 2 (IL-2) in vivo заключается в стимуляции развития тимуса и периферической экспансии (cTreg) регуляторных T-клеток (Treg). Потеря активности Treg у IL-2 или IL-2Rbeta дефицитных мышей вызывает тяжелую антигензависимую лимфаденопатию с последующим развитием летальной аутоиммунной реакции. Присутствие IL-2-зависимых Treg основано на ряде анализов с адоптивным переносом и генетических экспериментов. Недавно было продемонстрировано, что Treg играют существенную роль в качестве защитных модуляторов мозга при постишемическом воспалительном повреждении головного мозга (Liesz A et al. Nat Med 200915, 192-199).
Аутоиммунное заболевание (такое как РС) и ишемия мозга характеризуются относительным дефицитом Treg. Поэтому, увеличение количества Treg может быть благоприятным при таких заболеваниях. IL-2 может вызывать увеличение количества Treg in vivo, обеспечивая потенциальное клиническое применение данного метода терапии (Liu R. Eur J Immunol. 2010; 40:1577-89).
IL-2 считается модификатором биологического ответа, который использовали для лечения рака, такого как меланома и почечноклеточная карцинома, а также ВИЧ. IL-2 тестировали в схемах с высокими дозами, так как низкие дозировки не обеспечивают достижения требуемого терапевтического эффекта.
Схема с высокими дозами предполагает введение IL-2 внутривенным путем каждые восемь часов, если пациент переносит это, до достижения 15 доз. Такая схема имеет существенные побочные эффекты, которые являются обратимыми в большинстве случаев, если лечение останавливают, однако из-за тяжести некоторых из них, пациентов приходится госпитализировать, и иногда необходима интенсивная терапия одновременно с применением данного лекарственного средства.
Другим продуктом, представляющим особый интерес, является пептид, известный как GHRP-6 ("рилизинг-пептид гормона роста 6"). Указанный пептид, описанный ранее как полученный из мета-энкефалина желудка, показал впоследствии неожиданный эффект стимуляции секреции гормона роста (ГР) у различных видов млекопитающих, включая людей (Bowers CY, et al. Endocrinology. 1984, 114: 1537-45; Pandya N, et al. J Clin Endocrinol Metab. 1998, 83:1186-9). Эту молекулу внутривенно вводили людям в качестве средства, усиливающего секрецию, для дифференциального клинического диагноза различных форм карликовости (Popovic V, et al. Lancet. 2000; 356:1137-42).
GHRP-6 повышает экспрессию инсулиноподобного фактора роста 1 (IGF-1) в ЦНС (Frago L.M, et al. Endocrinology 2002, 143:4113-4122). IGF-1 участвует в некоторых процессах, например: (1) повышает факторы, связанные с созреванием олигодендроцитов (Wilson H.C, et al. Glia 2003, 44:153-165), (2) блокирует TNF-альфа зависимые пути апоптоза и (3) уменьшает экспрессию молекул главного комплекса гистосовместимости класса I (Ito T, et al. Am. J. Pathol 2004, 164:623-634).
Было продемонстрировано, что уменьшение секреции ГР и IGF-1 связано с ишемическими процессами в мозге, которые более часто наблюдаются у пожилых людей (Frutos MG, et al. Am J Physiol Endocrinol Metab. 2007, 293:E1140-52).
Старение оси GH/IGF-1 требуется восстанавливать терапией, стимулирующей продукцию и секрецию ГР. Долговременная системная терапия взрослых крыс с применением GHRP-6 повышала уровни IGF-1 в нескольких областях мозга, таких как гипоталамус и мозжечок. Кроме того, внутриклеточные сигнальные каскады, обычно связываемые с антиапоптотическим действием, активируются в этих областях. Глутамат натрия в аномально высоких концентрациях может вызывать гипервозбуждение нейронов, приводящее к повреждению и/или гибели клеток. GHRP-6 устраняет глутамат-индуцированную гибель клеток посредством снижения активации каспазы 7 и 9 (Delgado-Rubín de Célix A, et al. J Neurochem 2006, 99:839-49).
Несмотря на успех синтетических пептидов, увеличивающих секрецию ГР, сохраняется проблема, которая состоит в том, что их необходимо вводить несколько раз день, они дорогостоящие, имеют побочные эффекты, и они вероятно регулируют внутренние рецепторы сигнального каскада, что означает, что их эффект уменьшается с течением времени. Побочными эффектами, связанными с инъекциями GHRP-6, являются: рак, гипотония, сердечно-сосудистое заболевание с застойными явлениями, неконтролируемое кровотечение, синдром запястного канала, снижение чувствительности к инсулину, гипогликемия, гинекомастия, отек, лейкоз у детей, кетогенез и аллергические реакции.
Эритропоэтин (EPO) неспецифически действует на компоненты "общего конечного каскада", определяющего тяжесть или прогрессию большого количества совершенно разных болезней мозга. EPO обладает антиапоптотическим, противовоспалительным, антиоксидантным, нейротрофическим, ангиогенным действием и модулирует стволовые клетки и поэтому способен влиять на нейронную пластичность. Сообщали о защитных и регенеративных свойствах EPO, а также об улучшении когнитивных функций в нескольких моделях неврологических и психических заболеваний на животных. Исследование "Gottingen-EPO-stroke" предоставило первое многообещающее свидетельство у людей с нейропротективной терапией при острых болезнях мозга. Экспериментальная терапия EPO для улучшения когнитивных функций у пациентов с шизофренией представляет новую стратегию лечения хронических болезней мозга. Диагностический анализ при хроническом прогрессивном РС, в качестве примера воспалительного заболевания нервной системы, дал первые положительные результаты терапии с применением EPO в отношении моторных и когнитивных функций (Ehrenreich H, et al. (2008) J Ren Nutr. 18:146-53). EPO обладает гематопоэтическими функциями в мозге и других органах, особенно в процессе развития. Асиало-EPO или EPO с низким содержанием сиаловой кислоты идентифицировали как нейротрофическое и нейропротекторное средство в различных экспериментах, от культур нейронов до in vivo моделей повреждения головного мозга. Различные механизмы, по которым асиало-EPO производит нейропротекцию, были определены как: i) снижение токсичности глутамата натрия, ii) индукция образования антиапоптотических нейронных факторов, iii) уменьшение воспаления, iv) уменьшение повреждения, вызываемого оксидом азота, и v) прямые антиоксидантные эффекты. Факты указывают, что асиало-EPO может быть новой стратегией в отношении целого ряда нарушений ЦНС у взрослых и детей, особенно в качестве возможной альтернативы при перинатальной асфиксии (S Juul. (2002) Acta Paediatrica 91 s438: 36-42).
Ишемический инфаркт связан с различными патофизиологическими изменениями, которые затрагивают нейронную и глиальную ткань мозга. Указанные изменения выражаются в высвобождении определенных белков в периферическую кровь. Нейрон-специфический белок енолаза, белок S100B и специфический глиальный фибриллярный белок являются возможными маркерами постинфарктного повреждения головного мозга у людей.
Хотя белки EPO и асиало-EPO использовались для лечения ишемии мозга и нейродегенеративных заболеваний, также сообщали о неблагоприятных эффектах, связанных с их применением. EPO терапия и повышение гематокрита связаны с нежелательными явлениями, такими как гипертония и тромбоз. В этих случаях также оправдано применение комбинаций лекарственных средств, проявляющих более высокую эффективность, что может привести к использованию более низких доз, других путей введения и снижению нежелательных явлений.
Таким образом, обнаружение более мощных лекарственных средств или комбинированных молекул для терапии ишемических или нейродегенеративных повреждений ЦНС необходимо для уменьшения нежелательных явлений, связанных с высокими дозами лекарственных средств, которые требуются для достижения необходимого эффекта.
Сущность изобретения
Настоящее изобретение решает вышеуказанную проблему, обеспечивая хромогенные пептиды (PCB-aa) с последовательностями, представленными в Списке последовательностей, которые содержат в своей структуре тетрапиррольную систему. Впервые было продемонстрировано, что такие соединения обладают свойствами, которые подтверждают их применение в профилактике или лечении ишемии или дегенерации ткани. В конкретном варианте осуществления они могут применяться для лечения ишемического и нейродегенеративного заболевания.
Хромогенные или PCB-aa пептиды изобретения содержатся в последовательностях между 3-6 аминокислотами альфа (α-C-Phyco) и бета (β-C-Phyco) цепи фикоцианина-C, полученными в результате их ферментативного расщепления.
Указанными пептидами являются:
SEQ ID NO:1: 79MAABLR84 (β-C-Phyco);
SEQ ID NO:2: 84BAR86 (α-C-Phyco);
SEQ ID NO:3: 80AABLR84 (β-C-Phyco);
SEQ ID NO:4: 82BLR84 (β-C-Phyco);
SEQ ID NO:5: 81ABLR84 (β-C-Phyco).
Где B (выделенный жирным шрифтом) является цистеином, который ковалентно связан с фикоцианобилином (PCB).
Кроме того, целью настоящего изобретения является фармацевтическая композиция, включающая по меньшей мере один пептид, идентифицированный как SEQ ID NO: 1-5, и фармацевтически приемлемые вспомогательные вещества.
Новизна изобретения состоит в демонстрации нейропротекторного и нейрорегенерационного действия, которое выше, чем у хромогенных пептидов и PCB, в отношении фикоцианина-C, показывающих защиту от повреждения, вызываемого глутаматом натрия, механизма, напоминающего ишемию мозга, в линии клеток PC12 и в моделях ишемии мозга и РС на животных.
PCB-aa и PCB пептиды демонстрировали защиту в молярных концентрациях в 25 раз ниже для PCB-aa и в 10 раз ниже для PCB (2 мкМ PCB-aa и 5 мкМ PCB защищают 100% клеток, подвергаемых повреждению), тогда как для защиты приблизительно 75% клеток требовалось 50 мкМ фикоцианина-C.
Дополнительно, в конкретном варианте осуществления было продемонстрировано уменьшение объема инфаркта в модели ишемии-реперфузии мозга I/R на когтистых песчанках при введении животным PCB-aa и PCB. Результаты показали более высокую эффективность для PCB-aa (49,2 %) по сравнению с PCB (43,1%).
Таким образом, целью настоящего изобретения также является применение соединения, выбранного из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1 - SEQ ID NO: 5, сокращенно обозначенных PCB-aa, а также PCB, для производства лекарственного средства, которое может применяться для лечения ишемии или дегенерации ткани. В конкретном варианте осуществления указанное соединение применяется при лечении или профилактике ишемического, воспалительного или нейродегенеративного заболевания, вызывающего повреждение ЦНС.
В другом аспекте изобретения предложен способ лечения или профилактики ишемии или дегенерации ткани, характеризуемый введением фармацевтической композиции, включающей соединение, выбранное из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1 - SEQ ID NO: 5, и PCV, субъекту, нуждающемуся в этом. В конкретном варианте осуществления способ согласно изобретению характеризуется тем, что ишемия или дегенерация тканей вызвана заболеваниями ЦНС, которые прогрессируют с ишемическим, воспалительным или нейродегенеративным повреждением.
В другом варианте осуществления изобретения предложена фармацевтическая комбинация, включающая первый компонент, выбранный из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1 - SEQ ID NO: 5, и фикоцианобилина, и второй компонент, выбранный из группы, состоящей из интерферонов I типа, включая альфа (IFN-a) и бета (IFN-b) интерфероны, интерлейкин-2 (IL-2), эритропоэтин (EPO), асиало-EPO и пептид-секретагог человеческого ГР (GHRP-6).
Синергический эффект активных компонентов, который относится к их нейропротективным и/или нейрорегенеративным свойствам, оправдывает их применение при ишемии мозга различного генеза и при нейродегенеративных заболеваниях, таких как РС, болезнь Альцгеймера, амиотрофический боковой склероз, спиноцеребеллярная атаксия, болезнь Хантингтона и болезнь Паркинсона.
Хотя IFN альфа и бета относятся к IFN I типа и используют сложный общий рецептор, множество наблюдений указывает, что в свойствах IFN альфа и бета имеются различия, вызывающие некоторые биологические эффекты.
В конкретном варианте осуществления оценку комбинаций PCB-aa/IFN-a и PCB/IFN-a выполняли согласно профилактической схеме в экспериментальной модели аутоиммунного энцефаломиелита (EAE), демонстрирующей синергический эффект указанных комбинаций в сравнении с отдельными действующими веществами в отношении предотвращения развития болезни.
В другом конкретном варианте осуществления комбинацию PCB-aa и PCB с IFN-a и IFN-b оценивали путем их сравнения с их отдельными действующими веществами, которые вводили в дозах 3,375 мг/кг PCB-aa, 750 мкг/кг PCB и 500 нг/кг для обоих IFN, показав относительную эффективность в уменьшении объема инфаркта головного мозга 83,3% и 89,3% для комбинаций IFN-a с PCB и PCB-aa, соответственно; и 87,0% и 93,6% для комбинаций IFN-b с PCB и PCB-aa, соответственно, что выше, чем в случае действующих веществ по отдельности в модели I/R головного мозга на когтистых песчанках.
Дополнительно, в другом конкретном варианте осуществления оценивали комбинации PCB-aa/IFN-b и PCB/IFN-b, которые вводили в ежедневной дозе 3,375 мг/кг PCB-aa/кг, 750 мкг/кг PCB и 6 доз 500 нг/кг IFN-b. Результаты показали более высокую относительную эффективность в уменьшении клинических симптомов, чем в случае действующих веществ по отдельности, в модели EAE. Следовательно, терапевтический эффект в модели EAE на животных был также продемонстрирован.
Другие варианты осуществления включали оценки комбинаций PCB-aa/IFN-b и PCB/IFN-b в виде фармацевтической комбинации, которую вводили различными путями (внутрибрюшинно, назально, перорально и ректально) в модели EAE, демонстрирующие подобный фармакологический эффект в отношении клинических симптомов. Соединения, входящие в состав указанных фармацевтических комбинаций, могут быть применены одновременно или отдельно одним и тем же индивидом в течение одной терапии. Фармацевтические комбинации, указанные в настоящем изобретении, могут предназначаться для парентерального, назального, перорального или ректального введения; с соответствующими вспомогательными веществами для указанных путей.
В другом конкретном варианте осуществления оценивали эффект PCB-aa, PCB и IL-2 при ишемии мозга. Комбинация PCB-aa/IL-2 и PCB/IL-2 производила синергический эффект в отношении уменьшения объема инфаркта мозга по сравнению с отдельными действующими веществами (эффективность 49,2% для PCB-aa, эффективность 43,1% для PCB, 25,8% для IL-2 и 84,3% для комбинации PCB-aa/IL-2, и 74,5% для комбинации PCB/IL-2) в модели ишемии мозга на когтистых песчанках.
С другой стороны, оценку комбинации PCB/GHRP-6 и отдельных действующих веществ выполняли, вводя их внутрибрюшинно в модели I/R головного мозга на животных (когтистых песчанках). С морфометрической точки зрения синергический эффект наблюдали в случае комбинации, которая показала значение эффективности 85% по сравнению с 35,8% для PCB и 36,1% для GHRP-6.
Другая новизна настоящего изобретения состояла в синергическом эффекте в отношении сокращения объема инфаркта, демонстрируемого для комбинаций PCB-aa/EPO и PCB-aa/асиало-EPO; по сравнению с отдельными компонентами (эффективность 49,2% для PCB-aa, 36,9% для EPO, 39,4% для асиало-EPO, 87,7% для комбинации PCB/EPO, 90,5% для комбинации PCB/асиало-EPO, 91,7% для комбинации PCB-aa/EPO и 94,5% для комбинации PCB-aa/асиало-EPO). Предыдущее подтверждает применение указанных комбинаций для лечения болезней ЦНС, которые прогрессируют с или являются результатом ишемического повреждения.
Компоненты, формирующие терапевтическую комбинацию изобретения, можно вводить одновременно или последовательно одному и тому же индивиду в течение курса лечения.
Также целью изобретения является применение фармацевтической комбинации, включающей первый компонент, выбранный из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1 - SEQ ID NO: 5, и фикоцианобилина, и второй компонент, выбранный из группы, состоящей из IFN I типа, включая альфа (IFN-a) и бета (IFN-b) IFN, интерлейкин-2 (IL-2), эритропоэтин (EPO), асиало-EPO и пептид-секретагог человеческого ГР (GHRP-6), для производства лекарственного средства для профилактики или лечения болезней ЦНС ишемического, воспалительного или нейродегенеративного генеза. В одном аспекте изобретения указанное лекарственное средство защищает паренхиму мозга, поврежденную вследствие острых или хронических заболеваний.
Изобретение также охватывает способ профилактики или лечения болезней ЦНС ишемического, воспалительного или нейродегенеративного генеза, который характеризуется введением фармацевтической комбинации, включающей: первый компонент, выбранный из группы, состоящей из пептидов, идентифицированных как SEQ ID NO: 1 - SEQ ID NO: 5, и фикоцианобилина; и второй компонент, выбранный из группы, состоящей из интерферонов I типа, которые включают интерферон альфа (IFN-a) и интерферон бета (IFN-b), интерлейкин-2 (IL-2), эритропоэтин (EPO), асиало-EPO и пептид-секретагог человеческого гормона роста (GHRP-6), субъекту, нуждающемуся в этом. Указанный способ характеризуется тем, что компоненты, составляющие комбинацию, можно вводить одновременно или последовательно одному и тому же субъекту в ходе лечения. В конкретной процедуре данную терапию применяли при ишемии мозга различного генеза, РС, болезни Альцгеймера, боковом амиотрофическом склерозе, спиноцеребеллярной атаксии, болезни Хантингтона и болезни Паркинсона.
Краткое описание фигур
Фигура 1. Масс-спектрометрическое исследование PCB, полученного при обработке метанолом (A), и хромогенных пептидов, полученных при обработке трипсином, вместе определенных как PCB-aa, B: SEQ ID NO: 1; C: SEQ ID NO: 2; D: SEQ ID NO: 3-5.
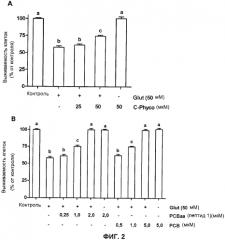
Фигура 2. In vitro исследование нейропротекторного действия фикоцианина-C (C-Phyco) (A) и PCB и PCB-aa (B) против индуцированного глутаматом натрия (50 мМ) повреждения в линии нейронов PC12. Символы указывают присутствие (+), отсутствие (-) или концентрации соответствующих соединений в культуральной среде. Различные буквы обозначают статистически значимое различие, согласно ANOVA, сопровождаемому критерием множественного сравнения Ньюмана-Кейлса, p<0,05. Значения, представленные в графиках, являются средними ± стандартная ошибка среднего (MSE).
Фигура 3. Эффект терапевтического применения PCB-aa (пептиды 1-5) в отношении объема инфаркта мозга через 24 ч после временной окклюзии (10 мин) общих сонных артерий (CCA) у когтистых песчанок. Различные буквы обозначают статистически значимое различие согласно ANOVA, сопровождаемому критерием множественного сравнения Ньюмана-Кейлса, p<0,05. Значения представлены в графиках как средние ± MSE.
Фигура 4. Эффект терапевтического применения PCB, PCB-aa (пептид 1), IFN-a и IFN-b и PCB/IFN-a, PCB/IFN-b, PCB-aa/IFN-a и комбинаций PCB-aa/IFN-b в отношении объема инфаркта мозга через 24 ч после временной окклюзии (10 мин) CCA у когтистых песчанок. Различные буквы обозначают статистически значимое различие в отношении группы I/R + солевой раствор, p<0,05. Значения представлены в графиках как средние ± MSE.
Фигура 5. Эффект PCB-aa (пептид 1)/IFN-b, комбинаций PCB/IFN-b и их отдельных действующих веществ на клиническое течение EAE у мышей C57BL6. Значения, представленные в графиках, являются средними клинического индекса каждой группы.
Фигура 6. Эффект комбинации PCB-aa (пептид 1)/IFN-b, вводимой различными путями: внутрибрюшинно, назально, перорально и ректально, на клинический индекс больных EAE мышей C57BL6. Значения, представленные в графиках, являются средними клинического индекса каждой группы.
Фигура 7. Терапевтический эффект PCB, PCB-aa (пептид 2), IL-2 или комбинаций PCB/IL-2 и PCB-aa (пептид 2)/IL-2 в отношении объема инфаркта мозга через 24 ч после временной окклюзии (10 мин) CCA у когтистых песчанок. Различные буквы обозначают значимые различия в отношении группы I/R + солевой раствор, *p<0,05. Значения, представленные в графиках, являются средними ± MSE
Фигура 8. Морфометрическая оценка терапевтического эффекта PCB-aa (пептид 3), пептида GHRP-6 или его комбинации у когтистых песчанок, подвергнутых временной окклюзии (10 мин) CCA. A: репрезентативные изображения (4× увеличение) левого гиппокампа животных, которых подвергали ложной хирургической операции (имитации) или обрабатывали солевым раствором, или PCB-aa (пептид 3) и GHRP-6 (6,25 мкг/кг, внутрибрюшинным путем), или PCB-aa (пептид 3)/GHRP-6 (с сохранением соответствующих доз и путей введения) в течение 30 минут, через 3, 6 и 12 ч после ишемического события. B: билатеральный подсчет клеток, выполненный в C2, CA3 и CA4 областях обоих гиппокампов для каждой экспериментальной группы. Различные буквы обозначают значимые различия в отношении группы I/R + солевой раствор, *p<0,05. Значения, представленные в графиках, являются средними ± MSE
Фигура 9. Эффект терапевтического применения PCB, PCB-aa (пептид 4), EPO, асиало-EPO или их соответствующих комбинаций PCB/EPO, PCB/асиало-EPO, PCB-aa (пептид 4)/EPO и PCB-aa (пептид 5)/асиало-EPO в отношении объема инфаркта мозга, через 24 ч после временной окклюзии (10 мин) CCA у когтистых песчанок. Различные буквы обозначают значимые различия в отношении группы I/R + солевой раствор, p<0,05. Значения, представленные в графиках, являются средними ± MSE
Подробное описание способов осуществления/Примеры осуществления
Пример 1. Масс-спектрометрия фикоцианобилина (PCB), полученного при обработке метанолом, и хромогенных пептидов (PCB-aa).
На Фигуре 1A показан m/z сигнал 587,26, соответствующий хромофору PCB, полученного при дифференциальной ультрафильтрации метанольного экстракта фикоцианина-C.
На Фигурах 1B, C и D показан масс-спектр PCB-aa, полученного при обработке фикоцианина-C трипсином.
Пример 2. Нейропротекторное действие фикоцианина-C, PCB и PCB-aa против индуцированного глутаматом натрия повреждения в линии клеток PC12.
Клетки PC12 (1,5x104 клетки/хорошо) предварительно обрабатывали фикоцианином-C (25, 50 мкМ), или PCB (0,5; 1; 5 мкМ), или PCB-aa (0,25; 1; 2 мкМ) в течение 24 ч и затем подвергали совместному инкубированию с 50 мкМ глутамата натрия вместе с соответствующим продуктом (различные дозы) в течение 4 ч. Жизнеспособность клеток измеряли с помощью MTT-метода (с использованием бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (MTT)) и приводили процент относительно контроля, как показано на Фигуре 2. Можно видеть, что для того чтобы достигнуть такую же жизнеспособность клеток, как с фикоцианином-C, требовались более низкие концентрации PCB и PCB-aa. Концентрации PCB-aa (пептид 1), которые обеспечивали эффект, подобный эффекту PCB и фикоцианина-C, были еще ниже по сравнению с указанными соединениями.
Пример 3. Демонстрация нейропротекторных и/или нейрорегенерационных свойств пептидов PCB-aa, при уменьшении объема инфаркта, в модели I/R на когтистых песчанках.
Животных обрабатывали солевым раствором или с суммарной дозой пептидов PCB-aa (3,375 мг/кг каждого пептида), внутрибрюшинным путем в течение 30 минут, через 3, 6 и 12 ч после ишемического события.
Процент эффективности каждой обработки вычисляли согласно следующей формуле: % эффективности = (1-Vi/VI/R)×100. Vi: объем инфаркта ишемической группы, получавшей соответствующий продукт; VI/R: объем инфаркта ишемической группы, получавшей солевой раствор.
Как можно видеть на Фигуре 3, животные, получавшие хромогенные пептиды (PCB-aa), содержащиеся в SEQ ID NO: 1 - SEQ ID NO: 5, показали существенное сокращение объема инфаркта по сравнению с ишемической группой, получавшей солевой раствор.
Пример 4. Эффект комбинаций PCB/IFN-a, PCB-aa (пептид 1)/IFN-a, PCB/IFN-b и PCB-aa (пептид 1)/IFN-b в модели билатеральной ишемии-реперфузии на песчанках.
Животных обрабатывали солевым раствором (внутрибрюшинным путем) или отдельными соединениями в дозе PCB (750 мкг/кг, внутрибрюшинный путь), или PCB-aa (пептид 1) (3,375 мг/кг), IFN-a и IFN-b (500 нг/кг, подкожный путь) или комбинациями PCB/IFN-a, PCB/IFN-b, PCB-aa (пептид 1)/IFN-a и PCB-aa (пептид 1)/IFN-b согласно дозам, указанным на Фигуре 4, через 30 минут, 3, 6 и 12 ч после ишемического события. Процент эффективности вычисляли, как описано в Примере 3.
Уменьшение объема инфаркта мозга в группах подтверждает эффективность оцениваемых обработок (Фигура 4), при этом наблюдали уменьшение степени инфаркта в группе, получавшей PCB, с эффективностью 43,1%; PCB-aa (пептид 1) - 49,2%; в группе, получавшей IFN-a - 35,4%; IFN-b - 37,0%; в группе, получавшей PCB/IFN-a - 83,3%; PCB-aa (пептид 1)/IFN-a - 89,3%; PCB/IFN-b 87,0%; и PCB-aa (пептид 1)/IFN-b - 93,6%; подтверждающее синергический эффект обоих действующих веществ у животных, получавших комбинацию.
Пример 5. Демонстрация фармакологического эффекта комбинаций PCB/IFN-a и PCB-aa (пептид 1)/IFN-a по сравнению с отдельными действующими веществами, в отношении клинических проявлений в модели EAE.
С другой стороны, оценку комбинаций PCB/IFN-a и PCB-aa (пептид 1)/IFN-a выполняли в профилактической схеме, в модели EAE (Таблица 1), где был продемонстрирован синергический эффект указанной комбинации в отношении предотвращения развития болезни в дозах, указанных выше.
| Таблица 1Оценка комбинаций PCB-aa (пептид 1)/IFN-a и PCB/IFN-a и их действующих веществ в отдельности в профилактической схеме в модели EAE | ||||
| Группы | Частота (%) | Первый день(Средний ± SD) | Клинический Индекс | |
| Клиническая оценка (Среднее ± SD) | Дни болезни | |||
| Контроль | 0 | 0 | 0 | 0 |
| PCB-aa (пептид 1)(3,375 мг/кг) | 75 | 9,5±0,2 | 1,23±1,1 | 7,2± |