Кристаллическая форма бензил-бензольного ингибитора sglt
Иллюстрации
Показать всеИзобретение относится к новой кристаллической форме ингибитора натрий-зависимого котранспортера глюкозы SGLT2 формулы
характеризущейся порошковой рентгеновской дифрактограммой (XRPD) с использованием излучения CuKα1, включающей пики при 11,2, 12,9, 15,5, 17,8, 19,1, 20,0 и 20,7 градусах 2θ (±0,1 градуса 2θ), спектром комбинационного рассеяния, включающим пики при 353, 688, 825, 1178, 1205, 1212, 1608, 2945, 3010 и 3063 см-1, а также эндотермой, полученной методом дифференциальной сканирующей калориметрии (DSC), при 136°С, ее получению перекристаллизацией из этанола или метанола добавлением воды и фармацевтическим композициям на ее основе для лечения заболеваний, патогенез которых требует ингибирования натрий-зависимого котранспортера глюкозы 2 (SGLT2). Предложена новая кристаллическая форма биологически активного вещества с низкой гигроскопичностью. 6 н. и 27 з.п. ф-лы, 8 ил., 5 табл., 12 пр.
Реферат
Перекрестные ссылки на родственные заявки
Для настоящего изобретения испрашивается приоритет по заявке PCT/CN2010/073865, поданной 12 июня, 2010, включенной в настоящий документ во всей своей полноте для всех возможных целей.
Уровень техники
Натрий-зависимые («активные») котранспортеры глюкозы (SGLT), включая SGLT1 (обнаруживается преимущественно в щеточной каемке кишечника) и SGLT2 (локализован в проксимальных почечных канальцах), являются предметом тщательных исследований. В частности, было обнаружено, что SGLT2 ответственен за большую часть обратного захвата глюкозы почками. В настоящее время считается, что ингибирование почечного SGLT представляет собой плодотворный подход для лечения гипергликемии путем увеличения количества выводимой с мочой глюкозы (Arakawa К, et al., Br J Pharmacol 132:578-86, 2001; Oku A, et al., Diabetes 48:1794-1800, 1999). Потенциал этого терапевтического подхода дополнительно подтверждается недавними данными о мутациях в гене SGLT2, обнаруживаемых в случаях наследственной почечной глюкозурии, неопасного, по всей видимости, синдрома, для которого характерно выведение глюкозы с мочой при нормальных уровнях глюкозы в сыворотке и отсутствии системных нарушений функции почек или других заболеваний (Santer R, et al., J Am Soc Nephrol 14:2873-82, 2003). Таким образом, соединения, ингибирующие SGLT, в особенности SGLT2, являются перспективными кандидатами для применения в качестве антидиабетических средств (см. обзор Washbum WN, Expert Opin Ther Patents 19:1485-99, 2009). Кроме того, поскольку раковые клетки характеризуются усиленным поглощением глюкозы по сравнению с нормальными клетками, ингибирование SGLT предлагалось в качестве способа лечения рака путем лишения раковых клеток питательных веществ. Например, исследования показывают, что SGLT2 играет определенную роль в захвате глюкозы в метастатических очагах при раке легкого (Ishikawa N, et al., Jpn J Cancer Res 92:874-9, 2001). Таким образом, ингибиторы SGLT2 также могут быть полезны в качестве противораковых средств.
Помимо, собственно, фармацевтической активности, успешная разработка лекарственного препарата дополнительно подразумевает рассмотрение параметров, связанных с физической природой активного вещества. Некоторые из этих параметров представляют собой стабильность активного вещества в различных условиях окружающей среды, стабильность активного вещества в ходе производства фармацевтической композиции и стабильность активного вещества в конечных композициях лекарственного препарата. Для обеспечения необходимой стабильности фармацевтически активное вещество, применяемое в лекарственном препарате, должно быть как можно более чистым, что приводит к его стабильности при долговременном хранении в различных условиях окружающей среды.
Другой фактор, который необходимо учитывать, представляет собой однородность распределения активного вещества в композиции, в особенности, если активное вещество предназначено для введения в малых дозах. Для обеспечения однородного распределения размер частиц активного вещества должен быть уменьшен до подходящего уровня, например путем измельчения. Однако следует избегать разрушения фармацевтически активного вещества, которое может происходить как побочный эффект измельчения (или микронизации). В результате, в связи с жесткими условиями, налагаемыми этим процессом, активное вещество должно быть стабильным на протяжении всего процесса измельчения. Более того, если активное вещество не стабильно в ходе процесса измельчения, то, скорее всего, способ получения гомогенной фармацевтической композиции с заданным количеством активного вещества окажется слабо воспроизводимым.
Еще одно соображение, связанное с процессом измельчения для получения желаемой фармацевтической композиции, заключается в затратах энергии на этот процесс и нагрузках на поверхностях кристаллов. Этот фактор может в некоторых обстоятельствах приводить к полиморфным превращениям, переходу в аморфное состояние или к изменению в кристаллической решетке. Поскольку фармацевтическая композиция фармацевтического качества всегда должна иметь активное вещество с одинаковой кристаллической морфологией, стабильностью и свойствами, к с этой точки зрения к кристаллическому активному веществу также предъявляют строгие требования.
Другое соображение в отношении фармацевтически активного вещества касается его стабильности в композиции, что в свою очередь приводит к более длительному сроку годности конкретного лекарственного препарата. В данном случае под сроком годности понимается продолжительность временного периода, в течение которого лекарственный препарат может быть введен без риска того, что активное вещество деградировало. Высокая стабильность лекарственного препарата в упомянутых выше фармацевтических композициях при различных условиях хранения, таким образом, представляет собой дополнительное преимущество, как для пациента, так и для производителя.
Кроме того, наличие четко определенной кристаллической формы позволяет проводить очистку вещества лекарственного соединения путем перекристаллизации.
Наряду с указанными выше требованиями необходимо в целом учитывать, что любые изменения в твердом состоянии фармацевтической композиции, способные улучшить ее физическую и химическую стабильность, дают значительное преимущество по сравнению с менее стабильными формами того же лекарственного препарата.
Соединение по настоящему изобретению было получено в соответствии со способами, раскрытыми в публикации США №2009/0118201, дата подачи 22 августа 2008, в заявке США №12/545,400 и в PCT/US 2009/054585, в настоящее время WO 2010/022313, обе из которых поданы 21 августа 2009. Цель настоящего изобретения заключается в получении стабильной кристаллической формы соединения, которая отвечает важным требованиям, предъявляемым к фармацевтически активным веществам, как указано выше.
Раскрытие изобретения
Настоящее изобретение относится к кристаллическим формам (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, обладающего способностью ингибировать натрий-зависимый котранспортер глюкозы 2 (SGLT2). Изобретение также относится к фармацевтическим композициям, способам получения кристаллической формы соединения и способам применения соединений, отдельно или в комбинации с другими терапевтическими агентами, для лечения заболеваний и состояний, на которые влияет ингибирование SGLT2.
Краткое описание чертежей
На фиг.1 представлены спектры кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, полученные методом рентгеновской порошковой дифрактометрии (XRPD).
На фиг.2 представлена таблица данных XRPD для спектров XRPD, представленных на фиг.1.
На фиг.3 представлены спектры комбинационного рассеяния для кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола.
На фиг.4 представлен перечень пиков интенсивности для спектров комбинационного рассеяния, представленных на фиг.3.
На фиг.5 представлены результаты термического гравиметрического анализа (TGA) для кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола.
На фиг.6 представлены спектры дифференциальной сканирующей калориметрии (DSC) для кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола.
На фиг.7 представлена таблица данных по элементарным ячейкам для кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола.
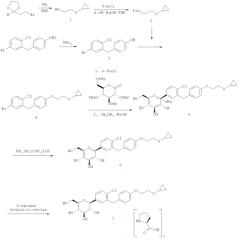
На фиг.8 представлена схема получения кристаллического (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола.
Осуществление изобретения
I. Определения
В настоящем изобретении термины «лечить» и «лечение» означают задержку наступления, замедление или обращение прогрессирования, или облегчение, или предупреждение заболевания или состояния, к которому этот термин применяется, или одного или нескольких симптомов такого заболевания или состояния.
В настоящем изобретении термин «введение» означает введение субъекту перорально, в виде суппозиториев, местно, внутривенно, внутрибрюшинно, внутримышечно, в очаг поражения, интраназально или подкожно лекарственного средства или имплантацию субъекту устройства с замедленным высвобождением лекарственного средства, например, осмотического мини-насоса. Введение осуществляют любым способом, включая парентеральный и трансмукозальный (например пероральный, назальный, вагинальный, ректальный или трансдермальный). Парентеральное введение включает, например, внутривенное, внутримышечное, интраарериолярное, внутрикожное, подкожное, внутрибрюшинное, внутрижелудочковое и внутричерепное введение. Другие способы доставки включают применение липосомальных композиций, внутривенную инфузию, трансдермальные пластыри и т.п., но не ограничиваются этим.
В настоящем изобретении термин «пролекарство» означает соединение-предшественник, которое после его введения высвобождает биологически активное соединение in vivo в результате некоего химического или физиологического процесса (например, пролекарство превращается в биологически активное соединение при достижении физиологического pH или под действием ферментов). Пролекарство само по себе может как обладать, так и не обладать желаемой биологической активностью.
В настоящем изобретении термин «соединение» означает молекулу, полученную любым способом, включая синтез in vitro или образование in situ или in vivo, но не ограничиваясь только этим.
Предполагается, что термины «контролируемое высвобождение», «замедленное высвобождение», «пролонгированное высвобождение» и «высвобождение в определенный момент времени» взаимозаменяемо относятся к любой содержащей лекарственное средство композиции, в которой высвобождение лекарственного средства происходит не безотлагательно, т.е. при применении композиции с «контролируемым высвобождением», а пероральное введение не приводит к незамедлительному высвобождению лекарственного средства в абсорбционный пул. Эти термины применяют взаимозаменяемо с термином «немгновенное высвобождение» как он определен в Remington: The Science и Practice of Pharmacy, 21st Ed., Gennaro, Ed., Lippencott Williams & Wilkins (2003). Как указано в этом документе, немедленное и немгновенное высвобождение можно разделить кинетически с помощью следующего уравнения:
Термин «абсорбционный пул» означает раствор лекарственного средства, введенный в определенное место абсорбирования, a kr, ka и ke представляют собой константы скорости первого порядка для, соответственно, (1) высвобождения лекарственного средства из композиции, (2) абсорбции и (3) выведения. Для лекарственных форм с мгновенным высвобождением константа скорости высвобождения лекарственного средства kr значительно превышает константу скорости абсорбции ka. Для композиций с контролируемым высвобождением верно обратное, т.е. kr<<kg, так что высвобождение лекарственного средства из лекарственной формы представляет собой лимитирующую стадию в процессе доставки лекарственного средства к целевой области.
Термины «замедленное высвобождение» и «пролонгированное высвобождение» применяют в общепринятом смысле этих слов для отсылки к композиции лекарственного средства, обеспечивающей постепенное высвобождение лекарственного средства в течение длительного периода времени, например 12-ти часов или более, и преимущественно, хотя и не обязательно, приводящей к практически постоянному уровню лекарственного средства в крови в течение длительного периода времени.
В настоящем изобретении термин «отсроченное высвобождение» означает фармацевтический препарат, который проходит через желудок в неизмененном виде и растворяется в тонком кишечнике.
В настоящем изобретении термин «фармацевтически приемлемое вспомогательное вещество» означает вещество, способствующее введению активного агента и абсорбированию его субъектом. Фармацевтические вспомогательные вещества, применяемые в настоящем изобретении, включают связующие вещества, наполнители, разрыхлители, лубриканты, покрытия, подсластители, ароматизаторы и красители, но не ограничиваются только ими. Специалисту в данной области техники известны и другие фармацевтические вспомогательные вещества, которые могут быть использованы в настоящем изобретении.
В настоящем изобретении термин «субъект» означает животных, таких как млекопитающие, включая приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и тому подобных, но не ограничиваясь только ими. В определенных вариантах осуществления субъект представляет собой человека.
В настоящем изобретении термины «терапевтически эффективное количество или доза» или «терапевтически достаточное количество или доза» или «эффективное или достаточное количество или доза» означает дозу, которая позволяет достичь тех терапевтических эффектов, ради которых она вводится. Точная доза будет зависеть от цели лечения, и будет установлена специалистом в данной области техники с помощью известных методик (см., например, Lieberman, Pharmaceutical Dosage Forms (vols.1-3, 1992); Lloyd, The Art, Science and Technology of Pharmaceutical Compounding (1999); Pickar, Dosage Calculations (1999); и Remington: The Science and Practice of Pharmacy, 20th Edition, 2003, Gennaro, Ed., Lippincott, Williams & Wilkins).
II. Кристаллические формы
Настоящее изобретение относится к кристаллической форме соединения, обладающего ингибирующим эффектом на натрий-зависимый котранспортер глюкозы SGLT, предпочтительно SGLT2. Таким образом, кристаллическое соединение по настоящему изобретению подходит для предупреждения и лечения заболеваний и состояний, в особенности метаболических нарушений, включая сахарный диабет 1-го и 2-го типов, гипергликемию, осложнения, вызываемые диабетом (такие как ретинопатия, нефропатия, например прогрессирующее заболевание почек, нейропатия, язвы, микро- и макроангиопатии и синдром диабетической стопы), резистентность к инсулину, метаболический синдром (синдром X), гиперинсулинемия, повышенное артериальное давление, гиперурикемия, ожирение, отечность, дислипидемия, хроническая сердечная недостаточность, атеросклероз и связанные с ними заболевания, но не ограничиваясь только указанным.
Настоящее изобретение также относится к фармацевтическим композициям и пролекарствам кристаллической формы по настоящему изобретению.
Настоящее изобретение, кроме того, относится к способам синтеза для получения кристаллического соединения по настоящему изобретению.
Настоящее изобретение также относится к способам применения кристаллической формы соединения по настоящему изобретению, отдельно или в комбинации с другими терапевтическими агентами, для лечения заболевания и состояния, на которые может воздействовать ингибирование SGLT.
Настоящее изобретение также относится к способам применения соединения по настоящему изобретению для получения лекарственного препарата для лечения заболеваний и состояний, на которые может воздействовать ингибирование SGLT.
В одном из аспектов настоящее изобретение относится к кристаллической форме (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола. Его химическая структура приведена ниже:
Кристаллическое соединение по настоящему изобретению может быть охарактеризовано порошковой рентгеновской дифрактограммой (XRPD), спектрами комбинационного рассеяния, эндотермой, полученной методом дифференциальной сканирующей калориметрии (DSC), термогравиметрическим анализом (TGA), демонстрирующим температуру разложения, и элементарной ячейкой кристаллической структуры.
В некоторых вариантах осуществления настоящее изобретение относится к кристаллической форме соединения, XRPD-спектр которой по существу соответствуют показанному на фиг.1, и XRPD пики которого по существу соответствуют пикам, приведенным на фиг.2. Кристаллическое соединение по настоящему изобретению может характеризоваться любой комбинацией пиков, по существу соответствующих пикам на фиг.2. Кроме того, величина каждого пика, приведенного на фиг.2, может быть определена с погрешностью, лежащей в диапазоне ±0,2 градуса 2θ, предпочтительно ±0,1 градуса 2θ.
В других вариантах осуществления кристаллическая форма соединения характеризуется порошковой рентгеновской дифрактограммой, включающей один или несколько пиков при 5,4, 11,2, 11,3, 11,9, 12,9, 15,5, 16,3, 17,8, 19,1, 20,0, 20.6, 20,7, 21,2, 22,8, 23,0, 23,4, 23,6, 23,9, 24,7, 25,4, 25,8, 27,8 и 28,2 градусах 2θ (±0,1 градуса 2θ), при этом указанный XRPD-спектр получают с использованием излучения CuKα1. В другом воплощении кристаллическая форма соединения характеризуется XRPD-спектром, включающим два или более, три или более, четыре или более, или пять или более пиков при 5,4, 11,2, 11,3, 11,9, 12,9, 15,5, 16,3, 17,8, 19,1, 20,0, 20,6, 20,7, 21,2, 22,8, 23,0, 23,4, 23,6, 23,9, 24,7, 25,4, 25,8, 27,8 и 28,2 градусах 2θ (±0,1 градуса 2θ). В некоторых других вариантах осуществления кристаллическая форма соединения характеризуется XRPD-спектром, включающим пики при 12,9, 19,1 и 20,7 градусах 2θ (±0,1 градуса 2θ). В еще одних вариантах осуществления кристаллическая форма соединения характеризуется XRPD-спектром, включающим пики при 11,2, 12,9, 15,5, 17,8, 19,1, 20,0 и 20,7 градусах 2θ (±0,1 градуса 2θ). Еще в одних вариантах осуществления кристаллическая форма соединения характеризуется XRPD-спектром, включающим пики при 5,4, 11,2, 11,9, 12,9, 15,5, 16,3, 17,8 и 19,1 градусах 2θ (±0,1 градуса 2θ). Еще в одних вариантах осуществления кристаллическая форма соединения характеризуется XRPD-спектром, включающим пики при 5,4, 11,2, 11,9 и 12,9 градусах 2θ (±0,1 градуса 2θ). В другом воплощении кристаллическая форма соединения характеризуется XRPD-спектром, включающим пики при 11,2 и 12,9 градусах 2θ (±0,1 градуса 2θ). В других вариантах осуществления кристаллическая форма соединения характеризуется пиками XRPD, которые по существу соответствуют пикам фиг.2.
Кристаллическое соединение по настоящему изобретению также характеризуется спектрами комбинационного рассеяния, которые по существу соответствуют спектрам, представленным на фиг.3, а пики которых по существу соответствуют пикам, представленным на фиг.4. В некоторых вариантах осуществления кристаллическая форма соединения характеризуется спектрами комбинационного рассеяния, включающим один или несколько пиков при примерно 353, 688, 825,1178, 1205, 1212, 1608, 2945, 3010 и 3063 см-1. В другом воплощении кристаллическая форма соединения характеризуется спектрами комбинационного рассеяния, включающими два или более, три или более, четыре или более или пять или более пиков. В других вариантах осуществления кристаллическая форма соединения характеризуется спектрами комбинационного рассеяния, включающими пики при примерно 353, 688 и 825 см-1. В некоторых других вариантах осуществления кристаллическая форма соединения характеризуется пиками на спектрах комбинационного рассеяния, которые по существу соответствуют пикам на фиг.4.
Кристаллическое соединение по настоящему изобретению также характеризуется эндотермой, определенной методом дифференциальной сканирующей калориметрии (DSC). В некоторых вариантах осуществления кристаллическая форма соединения характеризуется эндотермой DSC при примерно 136°С.
Кристаллическое соединение по настоящему изобретению также характеризуется данными об элементарной ячейке, которые по существу соответствуют данным, представлены на фиг.7. Для определения кристаллического соединения по настоящему изобретению также может быть применен термогравиметрический анализ (TGA). Например, типичный TGA по существу соответствует приведенному на фиг.5 и демонстрирует термическую устойчивость кристаллического соединения при температуре выше 200°С.
В некоторых вариантах осуществления кристаллическое соединение характеризуется по меньшей мере одним из следующих: по меньшей мере одним пиком XRPD, как описано выше, по меньшей мере одним пиком в спектре комбинационного рассеяния, как описано выше, эндотермой DSC, такой как описана выше, данными TGA относительно термической устойчивости, как описано выше, и данными об элементарной ячейке, как они описаны выше и приведены на фиг.7. В других вариантах осуществления кристаллическое соединение характеризуется по меньшей мере двумя характеристиками из следующих: по меньшей мере одним пиком XRPD, как описано выше, по меньшей мере одним пиком в спектре комбинационного рассеяния, как описано выше, эндотермой DSC, такой как описанная выше, данными TGA относительно термической устойчивости, как описано выше, и данными об элементарной ячейке, такими как описанные выше и приведенные на фиг.7. Например, кристаллическое соединение может быть охарактеризовано по меньшей мере одним пиком XRPD и по меньшей мере одним пиком в спектре комбинационного рассеяния, или по меньшей мере одним пиком XRPD и эндотермой DSC, или по меньшей мере одним пиком в спектре комбинационного рассеяния и эндотермой DSC, или по меньшей мере одним пиком XRPD и данными об элементарной ячейке, или по меньшей мере одним пиком в спектре комбинационного рассеяния и данными об элементарной ячейке и т.д.
В некоторых вариантах осуществления кристаллическое соединение по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой (XRPD), включающей один или несколько пиков при 5,4, 11,2, 11,3, 11,9, 12,9, 15,5, 16,3, 17,8, 19,1, 20,0, 20,6, 20,7, 21,2, 22,8, 23,0, 23,4, 23,6, 23,9, 24,7, 25,4, 25,8, 27,8 и 28,2 градусах 2θ (±0,1 градуса 2θ), при этом указанную XRPD получают, используя излучение CuKα1, и спектром комбинационного рассеяния, включающим один или несколько пиков при примерно 353, 688, 825, 1178, 1205, 1212, 1608, 2945, 3010 и 3063 см-1. В других вариантах осуществления кристаллическое соединение по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой (XRPD), включающей один или несколько пиков при 11,2, 12,9, 15,5, 17,8, 19,1, 20,0, 20,6, 20,7, 21,2 и 22,8 и 28,2 градусах 2θ (±0,1 градуса 2θ), при этом указанную XRPD получают, используя излучение CuKα1, и спектром комбинационного рассеяния, включающим один или несколько пиков при примерно 353, 688 и 825 см-1. В некоторых других вариантах осуществления кристаллическое соединение по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой (XRPD), включающей один или несколько пиков при 11,2 и 12,9 градусах 2θ (±0,1 градуса 2θ), при этом указанную XRPD получают, используя излучение CuKα1, и спектром комбинационного рассеяния, включающим один или несколько пиков при примерно 353, 688 и 825 см-1.
В других вариантах осуществления настоящее изобретение относится к соединению (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол в кристаллической форме.
Настоящее изобретение также включает меченные изотопами формы (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-иклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, в которых один или несколько атомов замещены одним или несколькими атомами, обладающими определенными атомными массами или массовыми числами. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фтора, серы и хлора (такие как 2H, 3H, 13С, 14С, 15N, 18O, 17O, 18F, 35S и 36Cl), но не ограничиваются только ими. Меченные изотопами соединения и их пролекарства, а также меченные изотопами фармацевтически приемлемые соли и их пролекарства, входят в объем настоящего изобретения. Меченные изотопами соединения по настоящему изобретению применяются в анализах для изучения тканевого распределения соединений и их пролекарств и метаболитов; предпочтительные изотопы для таких анализов включают 3H и 14C. Кроме того, в некоторых случаях замещение более тяжелыми изотопами, такими как дейтерий (2H) может придать повышенную метаболическую стабильность, которая привносит терапевтические преимущества, такие как увеличение периода полувыведения in vivo или снижение требуемой дозы. Меченные изотопами соединения по настоящему изобретению и их пролекарства как правило могут быть получены в соответствии со способами, описанными в настоящем документе, путем замены немеченого изотопами реагента реагентом, меченным изотопами.
II.1. Способы получения кристаллической формы
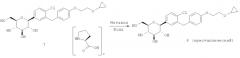
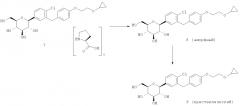
Кристаллическая форма по настоящему изобретению может быть получена с помощью различных способов, как показано на фиг.8. Например, кристаллическое соединение 8 может быть получено непосредственно из комплекса L-пролина 7. В качестве альтернативного варианта L-пролин может быть удален из комплекса L-пролина 7, что позволит получить аморфное соединение 8, которое затем кристаллизуют до кристаллического соединения 8. Кристаллическое соединение 8 также может быть получено непосредственно из неочищенного соединения 6, путем исходного выделения и последующей кристаллизации аморфного соединения 8 для получения кристаллического соединения 8, или непосредственно из неочищенного соединения 6.
Специалистам в данной области техники известны и другие способы получения кристаллического соединения 8. Кроме того, каждый процесс кристаллизации может быть повторен для удаления примесей. В некоторых вариантах осуществления для получения кристаллического соединения по настоящему изобретению может быть применен более чем один из различных способов кристаллизации.
В некоторых вариантах осуществления кристаллическое соединение 8 может быть получено из продукта совместной кристаллизации бис-L-пролина и (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2Я-пиран-3,4,5-триола, как описано в примерах. Вкратце, исходные вещества для совместной кристаллизации помещают в подходящий растворитель (например в метанол или этанол) и получают раствор, к которому для кристаллизации желаемого соединения добавляют осаждающий растворитель (например воду).
Соответственно, настоящее изобретение, кроме того, относится еще и способу получения кристаллической формы (2S,3R,4R,5S,6R)-2-(4-xnop-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, включающему (а) объединение при перемешивании комплекса (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола и бис(L-пролина) и подходящего растворителя с получением раствора; (b) добавление к раствору осаждающего растворителя для получения смеси; и (c) выделение кристаллической формы из смеси стадии (b).
В некоторых вариантах осуществления настоящее изобретение относится к способу получения кристаллической формы (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, включающему (а) объединение при перемешивании (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола и подходящего растворителя с получением раствора; (b) добавление к раствору осаждающего растворителя для получения смеси; и (с) выделение кристаллической формы из смеси стадии (b).
В других вариантах осуществления настоящее изобретение относится к способу получения кристаллической формы (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-иклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, включающему (а) объединение при перемешивании аморфного (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола и подходящего растворителя с получением раствора; (b) добавление к раствору осаждающего растворителя для получения смеси; и (с) выделение кристаллической формы из смеси стадии (b).
На стадии (а) перечисленных выше способов растворитель может представлять собой любой растворитель, подходящий для образования раствора, который легко смешивается с применяемым на стадии (b) осаждающим растворителем. Обычно растворитель на стадии (а) представляет собой полярный растворитель, который в некоторых вариантах осуществления представляет собой протонный растворитель. Подходящие растворители включают C1-C4-спирты, этиленгликоль и полиэтиленгликоль, такой как PEG400, алканоаты, такие как этилацетат, изопропилацетат, пропилацетат и бутилацетат, ацетонитрил, алканоны, такие как ацетон, бутанон, метилэтилкетон и метилпропилкетон, и смеси из двух или нескольких таких растворителей. Более предпочтительные растворители выбирают из группы, состоящей из метанола, этанола, изопропанола, этилацетата, ацетона, и смеси из двух или нескольких таких растворителей. Метанол и этанол представляют собой еще более предпочтительные растворители. В одном из конкретных воплощений растворитель, применяемый на стадии (а), представляет собой метанол.
Стадия (а) перечисленных выше способов может быть осуществлена при температуре, как правило, от примерно 0°С до температуры кипения растворителя (например 65°С для метанола). Предпочтительный диапазон температур находится примерно между 35°С и 100°С, еще более предпочтительный - от примерно 45°С до 80°С. Как только раствор получен, добавляют осаждающий растворитель. Осаждающий растворитель представляет собой растворитель, в котором продукт значительно хуже растворим, чем в исходном растворителе. Подходящие осаждающие растворители включают воду, простые эфиры, циклические простые эфиры, алканы, циклоалканы, фенилы и их смеси, в частности С4-С6-алифатические простые эфиры, С6-С8-алканы, С6-C8-циклоалканы, такие фенилы, как бензол, толуол и ксилол, и их смеси. Примеры осаждающих растворителей включают диизопропиловый эфир, трет-бутилметиловый эфир (ТВМЕ), циклогексан, метилциклогексан, гексан, гептан, октан и их смеси. В одном из конкретных воплощений осаждающий растворитель представляет собой воду.
Точное соотношение растворителей и исходного вещества не столь важно для изобретения, однако оптимизированные отношения могут дать более высокие выходы и более однородный кристаллизованный продукт. Отношение растворителей в описанных выше способах может представлять собой любое подходящее отношение от примерно 1:1 до примерно 1:9, включая примерно 1:2, 1:3, 1:4, 1:5, 1:6, 1:7 и примерно 1:8. Отношения растворителей находятся в диапазоне предпочтительно от примерно 1:1 до примерно 1:9, более предпочтительно от примерно 1:2 до примерно 1:7, еще более предпочтительно от примерно 1:2 до примерно 1:5. В одной из групп воплощений, если в качестве растворителя применяют метанол, а осаждающий растворитель представляет собой воду, то отношение метанола к воде в смеси на стадии (b) равно от примерно 1:1 до примерно 1:9 (по объему), более предпочтительно примерно 1:5 (по объему).
Отношение комплекса к растворителю, такому как смесь метанола и воды, может представлять собой любое подходящее отношение, способствующее кристаллизации. Например, отношение комплекса к растворителю может быть равно от примерно 1:5 (масса/объем или масс./об.) до примерно 1:50 (масс./об.), включая примерно 1:6, 1:7, 1:8, 1:9, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:20, 1:25, 1:30, 1:35, 1:40 и примерно 1:45 (масс./об.). Отношение комплекса к растворителю предпочтительно равно от примерно 1:10 до примерно 1:25 (масс./об.), более предпочтительно от примерно 1:10 до примерно 1:15 (масс./об.). В другой группе воплощений отношение комплекса к растворителю и осаждающему растворителю в смеси на стадии (b) равно от примерно 1:10 до примерно 1:25 (масс./об.). В других вариантах осуществления отношение комплекса к метанолу и воде в смеси на стадии (b) равно от примерно 1:10 до примерно 1:25 (масс./об.). В некоторых других вариантах осуществления отношение комплекса к метанолу и воде в смеси на стадии (b) равно от примерно 1:2:7 (масс./об./об.) до примерно 1:3:10 (масс./об./об.), предпочтительно примерно 1:2:10 (масс./об./об.).
Смесь для кристаллизации кристаллического соединения 8 также может содержать множество других компонентов, таких как кислоты, основания и соли. Кислоты, применяемые в настоящем изобретении, включают уксусную кислоту, муравьиную кислоту, соляную кислоту, серную кислоту и другие слабые и сильные кислоты но не ограничиваются только ими. Основания, применяемые в настоящем изобретении, включают аммиак, гидроксид натрия и другие, но не ограничиваются только ими. Соли, применяемые в настоящем изобретении, включают хлорид натрия, хлорид калия, карбонат калия и другие, но не ограничиваются только ими. В некоторых вариантах осуществления смесь стадии (b) в перечисленных выше способах включает гидроксид натрия. В других вариантах осуществления смесь стадии (b) в перечисленных выше способах включает хлорид натрия.
После добавления осаждающего растворителя смесь, как правило, хранят при комнатной температуре или охлаждают в течение достаточного периода времени, чтобы дать возможность процессу формирования кристаллов продукта пройти полностью. Температура смеси на стадии (b) предпочтительно примерно равна температуре на стадии (а) или ниже ее. Во время хранения температуру раствора, содержащего продукт, предпочтительно снижают до температуры в диапазоне от -10°С до 25°С или даже ниже, еще более предпочтительно - в диапазоне от -5°С до 15°С. Стадия (b) может быть проведена с перемешиванием или без него. Как отмечено выше, условия проведения стадии (b) могут повлиять на размер, форму и качество полученных кристаллов.
Кристаллизацию можно индуцировать с помощью способов, известных в данной области техники, например, механическим способом, царапая или потирая контактирующую поверхность реакционного сосуда, например, стеклянной палочкой. В насыщенный или пересыщенный раствор могут необязательно быть внесены затравочные кристаллы. Смесь для кристаллизации кристаллического соединения 8 также может содержать затравочные кристаллы кристаллического соединения 8. В некоторых вариантах осуществления раствор или смесь в перечисленных выше способах включают затравочный кристалл кристаллического соединения по настоящему изобретению.
Выделение желаемой кристаллической формы может быть завершено удалением из кристаллов растворителя и осаждающего растворителя. Как правило, это осуществляют с помощью известных способов, например, таких как фильтрация, фильтрация с отсасыванием, декантация или центрифугирование. Кроме того, выделить кристаллическую форму можно удалением избытка растворителя(растворителей) из кристаллической формы с помощью способов, известных специалисту в данной области техники, например, таких как применение пониженного давления, и/или нагреванием до температуры выше 20°С, предпочтительно в температурном диапазоне ниже 80°С, еще более предпочтительно ниже 50°С.
В других вариантах осуществления настоящее изобретение относится к способу получения кристаллической формы (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола, включающему (а) объединение (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола и подходящего растворителя при перемешивании с получением раствора; и (b) выделение кристаллической формы из раствора. В других вариантах осуществления этот способ также включает добавление к раствору осаждающего растворителя. На стадии (а) перечисленных выше способов растворитель может представлять собой любой растворитель, подходящий для образования раствора. Подходящие растворители включают алканоаты, такие как этилацетат, изопропилацетат, пропилацетат и бутилацетат, простые эфиры, такие как этиловый эфир, метил-трет-бутиловый эфир, и смеси из двух или более таких растворителей. Более предпочтительные растворители выбирают из группы, состоящей из этилацетата, этилового эфира, метил-трет-бутилового эфира и смеси двух или более из этих растворителей. Еще более предпочтительные растворители представляют собой этилацетат и метил-трет-бутиловый эфир. (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол может иметь любую подходящую форму, включая аморфную, кристаллическую или их комбинацию. Кроме того, (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-(2-циклопропоксиэтокси)бензил)фенил)-6-(гидроксиметил)тетрагидро