Сорбент, представляющий собой наноалмазный материал (варианты), способы получения и использования.
Иллюстрации
Показать всеГруппа изобретений относится к сорбентам на основе наноалмазов, которые могут быть использованы для иммобилизации или удаления вирусов, специфических антител, иммуносорбции, в диагностических целях, для дезактивации и удаления вирусов из внешней среды. Сорбенты из наноалмазсодержащих материалов получают в результате детонационного синтеза и модификации. Поверхность детонационных наноалмазов подвергают целенаправленному изменению путем модифицирования химически активными жидкими и газообразными веществами при повышенных температурах. В результате модифицирования состав поверхностных радикалов, содержащих атомы неуглеродной природы (O, H, N, S), пополняется дополнительными атомами, что приводит к появлению дополнительных аналогичных или новых функциональных групп, способных образовывать связи с функциональными группами биологических объектов. Изобретение обеспечивает возможность удаления широкого спектра белковых материалов с помощью полученных сорбентов из различных биологических жидкостей. 12 н. и 9 з.п. ф-лы, 10 ил., 9 пр.
Реферат
Изобретение относится к медицине, в частности вирусологии, а также технологии сорбентов, конкретно к детонационным наноалмазсодержащим материалам, способу получения иммуносорбентов на их основе для иммобилизации или удаления вирусов, специфических антител, иммуносорбции, и может быть использовано в диагностических целях, для дезактивации и удаления вирусов из внешней среды.
Загрязнение окружающей среды продуктами жизнедеятельности человека, вредными, токсичными для людей веществами, патогенными микроорганизмами, в том числе и вирусами, ставит вопрос об их дезактивации и удалении из окружающей среды. Для деконтаминации растворов, содержащих вирусы, необходимо использовать фильтры, работающие на принципе геометрического отбора (размера пор) или состоящие из веществ, способных сорбировать микроорганизмы. К последним, например, относятся иммуносорбенты, действие которых основано на образовании комплексов антиген -антитело. Для создания высокоэффективных сорбентов, наряду с использованием уже известных, идет активный поиск новых материалов, основанных на использовании нанотехнологий.
Во второй половине 20 века были получены новые углеродсодержащие материалы - модифицированный с помощью различных методов графит, наноуглеродные трубки, детонационная шихта, получаемые из нее ультрадисперсные алмазы детонационного синтеза или детонационные наноалмазы (ДНА).
ДНА впервые были получены Волковым К.В., Даниленко В.В., Елиным В.И. в 1963 г. в СССР [1]. Кристаллы ДНА (1-10 нм) образуются обычно при детонации взрывчатых веществ с отрицательным кислородным балансом, например смесей тротил(ТНТ)/гексоген 50/50, при давлении 22 ГПа, температуре 3200 К в течение 1 мкс, с последующей очисткой в кислотных средах для удаления неалмазных форм углерода с поверхности кристаллитов и удаления неуглеродных примесей [2]. Получаемая шихта - первичный продукт детонационного синтеза. Она содержит 30-60 масс.% ДНА, средний размер которых 4.2 нм. Удельная поверхность шихты составляет 450 м2/г, что существенно выше, чем у ДНА, которая составляет 250-300 м2/г [3]. Существенные отличия поверхностных свойств шихты от ДНА могут быть обусловлены как различием в величине поверхности, так и ее строением. В шихте содержится аморфный углерод, большая доля атомов которого находится в sp2 электронном состоянии. Структура поверхности наноалмазов имеет дефекты, обусловленные способом получения и очистки. Наличие на поверхности наноалмазов атомов углерода, имеющих некомпенсированные связи, приводит к высокой поверхностной активности наноалмазов. В среднем ДНА состоит из 80-88% углерода, который находится в алмазной фазе. Помимо углерода в ДНА обнаружены значительные концентрации других элементов - кислорода, водорода, азота, а также Fe, Ti, Cr, Cu, K, Ca, Si, Zn, Pb, относящихся к группе трудноудаляемых твердофазных примесей [4]. Наличие этих элементов на поверхности ДНА приводит к образованию функциональных групп - метиленовых, метальных, кислородсодержащих - гидроксильных, карбонильных, альдегидных, карбоксильных, эфирных и ангидридных, сера- и азотсодержащих - сульфогруппы, нитрогруппы, аминные и амидные и многие другие [5].
Известно несколько способов получения наноалмазов из шихты. Например, предложен способ удаления примеси неалмазного углерода путем пропускания через шихту озоновоздушной смеси с одновременным нагревом до 120-400°C до полного выгорания неалмазного углерода [6] или способ получения наноалмазов путем неизотермического окисления алмазной шихты на воздухе при 380-440°C, со скоростью 2,5-10,0 град/мин с последующей изотермической выдержкой в течение 2-4 ч [7]. Известен способ выделения ДНА из шихты жидкофазным методом с помощью двухстадийной обработки азотной кислотой при температурах от 80 до 280°C и давлении ~80 атм [8].
Известно, что стадия очистки наноалмазов из шихты является определяющей в формировании их потребительских свойств, именно этим определяется возможность получения разнообразных модифицированных наноалмазов. Поверхность ДНА, полученных из шихты, может быть модифицирована при воздействии химических веществ в диапазоне высоких температур [9]. Для очистки и модифицирования поверхности предложено использовать обработку наноалмазов при высокой температуре в водород- (H2, NH3) и хлорсодержащей (Cl2, CCl4) газовой среде [10]. В инертной атмосфере в интервале температур 720-1400 K происходит изменение структуры наночастиц ДНА (в кластерах) при фазовом переходе алмаз-графит [11].
Для биомедицинских целей работа химиков-синтетиков и токсикологов должна привести к оптимизации функций наноалмазов и минимизации негативного воздействия для здоровья.
Для наноалмазов характерно отсутствие или наличие малой токсичности при оральном введении в организм животного [12]. Известна разработка, в которой ДНА применяют в качестве вещества, проявляющего противоопухолевую активность [13]. Предложена композиция ДНА с фуллереном, модифицированным порфирином, обладающая иммуностимулирующими свойствами [14].
Для ДНА присущи высокие сорбционные свойства по отношению к биомакромолекулам. Модифицированные наноалмазы детонационного синтеза, содержащие молекулы железа и сформированные в кластеры, способны сорбировать линейные фрагменты молекулы ДНК от 0,25 kb до 10 kb, однако они не связывают кольцевые молекулы плазмидной ДНК pUC19 [15]. Известно использование сорбционных свойств наноалмазов для выделения и очистки (с помощью десорбции) белков, например рекомбинантных белков из E.coli [16]. Наноалмазы способны сорбировать белок лизоцим, который при этом сохраняет антибактериальную активность, например, к E.coli [17]. Сорбционные свойства наноалмазов использованы для создания люминесцентного биочипа на основе светоизлучающего белка - люцеферазы, однако при этом наблюдается частичная десорбция фермента с поверхности частиц наноалмазов [18]. Наноалмазы, соединенные в кластеры размером до 100 нм, способны сорбировать лекарства и транспортировать их к раковым клеткам [19].
Известно изобретение [20], в котором предложено использовать детонационные наноалмазы для иммобилизации вируса иммунодефицита человека (ВИЧ) и его ДНК, т.е. для удалении вируса из растворов, с целью создания антиВИЧ вакцины. Удаление биологических объектов проводится с помощью комплексов, созданных из наноалмазов и лигандов из полимерных молекул. Для сорбции вируса ВИЧ-1 предложено в качестве лиганда использовать белок - конковалин A, который обладает сильным сродством к соединениям, содержащим углевод - маннозу. Таким веществом является поверхностный белок ВИЧ-1 - gp120 - гликопротеин, содержащий маннозу. С помощью gp120 вирусы присоединяются к рецепторам, находящимся на внешней поверхности клеток иммунной системы [21]. Таким образом, указанная особенность структуры конковалина A и гликопротеина gp120 и обуславливает их специфическое взаимодействие. Для сорбции нуклеиновых кислот на наноалмазы в качестве лиганда предложена смола или модифицированный полистирол. Известно изобретение, в котором для связи ДНА с конковалином A введен дополнительный лиганд - полиметакриловая кислота [22]. Недостатком этих технических решений является то, что сорбент обладает специфической сорбцией и не может быть использован для других вирусов, так как строение и химический состав белков наружных оболочек различных вирусов отличны от gp120 вируса ВИЧ. У других вирусов гликопротеины содержат различные сахара, а не только маннозу, как у белка gp120. В то же время существует большое число вирусов, которые не обладают наружной оболочкой, например вирус полиомиелита. В силу перечисленных выше данных нам представлялось важным исследовать сорбционную способность детонационных наноалмазсодержащих материалов к вирусам.
Предлагаемое изобретение решает задачу создания сорбентов вирусов на основе наноалмазных материалов, не прибегая к использованию вспомогательных лигандов различной природы и, таким образом, удешевляя процесс, расширить спектр их применения. Это достигается путем сорбции вирусов, вирусных антител, белков невирусной природы или фрагментов ДНК непосредственно на наноалмазсодержащие материалы детонационного синтеза или на их модифицированные продукты. Для этого поверхность ДНА подвергается целенаправленному изменению путем модифицирования, включающего обработку поверхности наноалмазов химически активными жидкими и газообразными веществами при повышенных температурах. При этом состав поверхностных радикалов, содержащих атомы неуглеродной природы (O, H, N, S), пополняется дополнительными атомами аналогичной природы или другими, например Cl, и, соответственно, появляются дополнительные аналогичные или новые функциональные группы, способные образовывать связи с функциональными группами биологических объектов.
Поэтому представляло интерес исследовать ДНА с различными модифицированными поверхностями, с целью отбора материалов, наиболее способных к адсорбции из водных растворов биологических объектов. В качестве сорбируемого вещества были взяты вирусы с различными антигенными свойствами, обладающие или не обладающие наружной оболочкой, вирусные антитела, белки невирусной природы, а также к фрагменты ДНК.
В качестве вирусов, имеющих внешнюю оболочку, предложены вирусы гриппа A и B семейства ортомиксовирусов. Их выбор в качестве модельных обусловлен не только широким распространением гриппа среди млекопитающих и птиц и тяжелыми последствиями, которые они вызывают, но и тем фактом, что их распространение имеет как воздушно-капельный, так водный путь передачи. Последний способ характерен для вирусов гриппа птиц. В 21 веке зарегистрировано большое число заболеваний человека, вызванных постоянно регистрируемой интродукцией вирусов гриппа птиц с гемагглютинином A/H5, A/H7 в человеческую популяцию. Выбор в качестве вируса, не имеющего внешней оболочки, вируса полиомиелита I типа (вакцинный штамм Сэбина) из семейства пикорновирусов обусловлен тем, что он имеет размеры 24-30 нм и является тест-вирусом в дезинфектологии. Этот вирус распространяется водным путем. Выбор шихты, ДНА и их модификаций был обусловлен тем, что они является углеродными материалами с известной структурой, химическим составом и физико-химическими свойствами. Наноалмазы, их модификации и шихта обладают шероховатой поверхностью, и их химическое состояние обеспечивает способность вступать во взаимодействия с другими материалами, например с вирусными антигенами или антителами или фрагментами ДНК.
Сущность изобретения заключается в разработке сорбента (варианты) из наноалмазсодержащих материалов с такой структурой и таким составом, которые обеспечивают высокую сорбционную способность к вирусам животных, обладающих или не обладающих наружной (внешней) оболочкой, вирусным антителам, белкам невирусной природы, а также к фрагментам ДНК, в создании иммуносорбентов с фиксированным антигеном или антителом, а также для иммобилизации или удаления вирусов и специфических антител. Это достигается путем использования наноалмазсодержащих материалов, полученных в результате детонационного синтеза и модифицированных с помощью химических реагентов, которые также могут быть использованы в качестве матрицы для создания иммуносорбента с фиксированным антигеном или антителом.
Сорбенты, представляющие собой алмазные нанопорошки, получены путем детонационного синтеза при нижеуказанных условиях. Предлагаемые наноалмазсодержащие материалы представляют собой шихту, содержащую неалмазные и неуглеродные примеси, ДНА и их модификации. Их индивидуальные частицы группируются в кластеры различных размеров и форм, содержат агрегаты наноалмазов и обладают сорбционной способностью, в том числе к вирусам. Наноструктурированные сорбенты используют для удаления из различных жидкостей вирусов, имеющих наружную (внешнюю) оболочку, например вирусов гриппа, или не имеющих ее, например вирусов полиомиелита, либо антител, а также для получения иммуносорбента (варианты), с помощью которого проводят иммобилизацию специфических антител или антигенов. Предлагаемое изобретение решает задачу увеличения сорбционной способности сорбента (варианты), упрощения и расширения возможностей и условий сорбции.
Сорбенты
Взятые для исследований наноалмазсодержащие материалы получены при следующих условиях:
1. Шихта, извлекаемая со стен взрывной камеры после взрыва смеси ТНТ /гексоген = 50/50, подвергается нагреву в течение 1 ч при температуре T=120°С для очистки от летучих примесей.
2. Детонационные наноалмазы (ДНАгазфаз) получены в результате газофазовой (газфаз) очистки шихты, в парах азотной кислоты при температуре до 300°C, в ходе чего происходит окисление неалмазных форм углерода. Последующая очистка порошка ДНА от неуглеродных примесей проведена в токе осушенного хлористого водорода при температуре 850°C, pH суспензий такого ДНА с концентрацией 1 г/л составляет 5.
3. Детонационные наноалмазы (ДНАжидфаз) получены в результате жидкофазной (жидфаз) очистки шихты, в разбавленной азотной кислоте при давлении ~80 атм и температуре ~220°C с последующей многостадийной отмывкой порошка ДНА от кислоты, использованной в процессе очистки шихты. pH суспензии составляет 6,2 при концентрации ДНА 1 г/л.
4. Детонационные графитизированные наноалмазы ДНАграф, получаемые из ДНАжидфаз, (подвергнутые частичному фазовому переходу алмаз - графит) в течение 1 ч нагревом в аргоне высокой чистоты при T=1000°C.
5. Детонационные хлорированные наноалмазы ДНАхл, которые получены нагревом ДНАжидфаз в парогазовой смеси CCl4/Ar, содержащей 3% (по объему) CCl4, при температуре T=450°C в течение 2 ч.
6. Детонационный аминированный ДНАамин получен из ДНАхл нагревом в аммиаке высокой чистоты при давлении 1 атм в течение 1 часа при температуре T=400°C.
Краткое описание чертежей
Для более ясного понимания предлагаемого изобретения, суть которого отражена в формуле изобретения, а также для демонстрации его особенностей и преимуществ, далее подробно описаны чертежи.
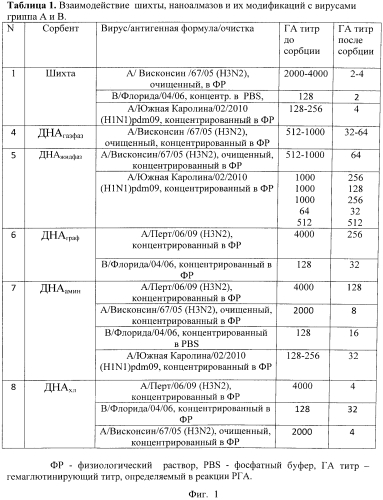
Фиг.1. Представлены в виде Таблицы 1 результаты взаимодействия наноалмазсодержащих материалов (шихты, ДНА и их модификаций) с вирусами гриппа A и B, изолированными в разные годы, имеющими различную антигенную структуру наружных белков, концентрированными или очищенными в градиенте концентрации сахарозы в растворах. (Способ получения иммуносорбента.) Наличие вирусов регистрировали до и после сорбции в реакции гемагглютинации (РГА).
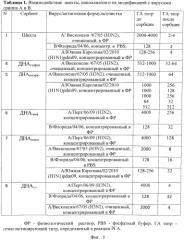
Фиг.2. Представлены в виде Таблицы 2 данные по сорбции вирусов на шихту и ДНАгазфаз в зависимости от температуры. Опыты проводили в диапазоне температур от 4 до 37°C.
Фиг.3. Представлена в виде Таблицы 3 эффективность сорбции от времени контакта вируса гриппа A(H3N2) с шихтой и ДНАгазфаз. Опыты проводили в течение 10-60 мин.
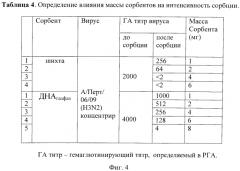
Фиг.4. Представлена в виде Таблицы 4 зависимость сорбции вирусов гриппа A(H3N2) от массы сорбентов (шихты и ДНАгазфаз).
Фиг.5. Представлено в виде Таблицы 5 влияние различной концентрации альбумина на последующую сорбцию вирусов гриппа A(H3N2). Сорбент - шихта.
Фиг.6. Представлено в виде Таблицы 6 выявление антител в сыворотках крыс, иммунизированных иммуносорбентом, представляющим собой комплекс ДНАжидфаз с концентрированным вирусом A(H1N1)pdm09. В качестве контроля использованы крысы, иммунизированные аллантоисными вирусами гриппа A(H1N1)pdm09 или B/Бангладеш/3333/07.
Фиг.7. Представлены в виде Таблицы 7 данные по сорбции вирусспецифических антител на иммуносорбенты - комплексы, содержащие наноалмазные сорбенты и вирусы гриппа A(H3N2).
Фиг.8. Представлены в виде Таблицы 8 данные по сорбции вирусспецифических антител, полученных к вирусам гриппа B/Флорида/04/06, на наноалмазные сорбенты. (Способ получения иммуносорбента.)
Фиг.9. Представлены в виде диаграммы сорбция и десорбция аллантоисного пандемического вируса гриппа A/Калифорния/04/09 (H1N1)pdm09 и концентрированного вируса B/Флорида/04/06 на ДНАгазфаз. Десорбция вирусов с иммуносорбентов проведена в течение 24 и 48 часов.
Фиг.10а, б - представлены результаты электрофореза в 2% агарозе фрагментов кДНК вирусов гриппа A и B до и после сорбции из растворов на наноалмазные материалы(шихту, ДНА и их модификации):
10а. Наличие в геле полосы кДНК после сорбции (дорожки 4, 5) свидетельствует о неполной сорбции нуклеиновой кислоты на ДНАгазфаз. Отсутствие полосы ДНК (дорожки 6, 7) свидетельствует о полной сорбции кДНК на шихту.
10б. Наличие в геле полосы кДНК после сорбции (дорожки 13, 14) свидетельствует о неполной сорбции нуклеиновой кислоты на ДНА амин и ДНАхл.. Отсутствие полосы ДНК (дорожки 10, 11, 12) свидетельствует о полной сорбции кДНК на ДНАграф.
Вирусы, вируспецифические антитела и нуклеиновые кислоты
Как известно, вирусы семейства ортомиксовирусов (например, вирусы гриппа), парамиксовирусов, тогавирусов (например, флавивирусы) имеют внешнюю оболочку, которая обусловливают их способность сорбироваться, например, на эритроциты животных.
В качестве представителей вирусов, имеющих внешнюю оболочку, были взяты эталонные и эпидемические штаммы вируса гриппа A(H1N1), (H3N2) и В, изолированные в период 1995-2011 гг., и пандемические штаммы вируса гриппа A(H1N1)pdm09, изолированные в 2009-10 гг. и обладающие различной структурой поверхностных белков и, соответственно, антигенными свойствами. Вирусы были культивированы в различных системах (куриные эмбрионы, культуры тканей клеток MDCK (Madin Darby Canine Kidney). В работе использовались также концентрированные вирусы, выращенные в куриных эмбрионах и сконцентрированные при ультрацентрифугировании. В качестве вируса, не имеющего внешней оболочки, выбран вирус полиомиелита I типа (вакцинный штамм Сэбина) из семейства пикорновирусов, культивирование которых проводили в клетках Vero. Для исследования антител использовались сыворотки иммунных животных (крыс). Биологическим объектом были ампликоны - двухцепочные молекулы ДНК размером 190-560 пн, полученные в результате полимеразной цепной реакции изолятов вирусов гриппа A и B.
Методы
1) Выявление вирусов гриппа в растворе проводили с помощью реакции гемагглютинирующей активности (РГА), позволяющей оценить по величине гемагглютинирующего (ГА) титра концентрацию вируса в растворе, выявление вируса полиомиелита - с помощью цитопатического действия его на клетки.
2) Для определения наличия инфекционной активности вируса проводили титрование вирусов в последовательных разведениях в куриных эмбрионах.
3) Для определения титра антител в растворах, содержащих иммунные сыворотки, использовали реакцию торможения гемагглютинирующей активности (РТГА) с использованием 0.75% взвеси эритроцитов человека 0 (I) группой крови.
4) Выявление цитопатического действия вируса полиомиелита на клеточную культуру.
5) Получение ампликонов проводили в две стадии: вначале РНК вирусы гриппа переводили в ДНК с помощью обратной транскриптазы и затем с помощью тест-системы "ДНК технология" получали ампликоны в полимеразной цепной реакции (ПЦР) по протоколу фирмы.
6) Для определения кДНК-ампликонов использовали горизонтальный электрофорез в 2% агарозе в течение 1.5 ч при напряжении 80 вольт.
7) Электронно-микроскопическое исследование сорбентов позволяет визуально исследовать форму и структуру поверхности сорбентов. Взвеси сорбентов в воде были окрашены 2% раствором уранилацетата и изучены методом электронной микроскопии с увеличением 20000-25000×. Исследования подтвердили, что исследуемые сорбенты являются ДНА-содержащими материалами, которые образуют разнообразной формы кластеры различного размера, с зернистой поверхностью и содержат индивидуальные частицы размером от 5 нм до кластеров различной формы размером 300 нм.
В исследованиях с сорбентом на разных стадиях использовали шейкер (Shaker PSU 2T plus); настольную низкоскоростную центрифугу (Comb spin); термостат Гном, фирмы ДНК-технология; амплификатор фирмы Rotor Gene Corbett research.
В этой разработке представлены данные по изучению условий сорбции и десорбции с сорбентов вирусов гриппа A, B, полиомиелита I типа и фрагментов ДНК.
Для более полной иллюстрации настоящего изобретения ниже приводятся примеры. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Сорбция вирусов гриппа A и B на сорбентах
Процедура сорбции вирусов была нами разработана ранее [23]. Сорбент добавляли к анализируемому объекту (вирус-содержащему, антителсодержащему или ДНК-содержащему раствору) и емкость помещали на шейкер для активного контакта аналита с сорбентом. После контакта вируса или ДНК с сорбентом смесь центрифугировали при 2000 об/мин в течение 4 мин, надосадочную жидкость исследовали на наличие аналита: например вируса гриппа в РГА или ДНК при электрофорезе в агарозе.
В последующем осадок, содержащий сорбент и иммобилизованный вирус, т.е. иммуносорбент, исследовали в экспериментах по взаимодействию с гомологичными антителами, по десорбции вируса, а также по сорбции антител на иммуносорбент. Сорбция вирусов изучалась в зависимости от природы сорбентов, антигенной структуры вирусов гриппа A и B, а также от различных условий эксперимента. Падение гемагглютинирующего титра в растворе сопровождалось снижением инфекционного титра. В случае шихты уменьшение составляло 4,5lg ЭИД50 (эмбриональная инфекционная доза). Исследования сорбции различных штаммов вирусов гриппа A и B на выбранных сорбентах показали, что они с изменяемой эффективностью способны сорбировать вирусы из растворов, независимо от антигенной структуры поверхностных белков (фиг.1). Подобные результаты получены для вируса полиомиелита.
Пример 2. Взаимодействие вирусов с сорбентами в зависимости от условий эксперимента
Для успешного применения выбранных материалов необходимо выявить влияние условий опытов на сорбционную способность наноалмазных материалов. Варьировали следующие параметры - температура среды, масса сорбентов, время сорбции и состав растворов.
Например, вирусы гриппа A и B сорбировались на сорбент из вируссодержащих жидкостей: физиологического раствора (ФР) и фосфатного буфера PBS pH 7.2. В опытах навески сорбента варьировались от 1,0 до 10,0 мг, объем (V) вируссодержащей жидкости варьировал от 150,0 до 300,0 мкл. Начальные титры вирусов, исследуемых в данном эксперименте, в пересчете на 1,0 мг сорбента находились в диапазоне от 10 до 400 гемагглютинирующих единиц (ГАЕ). Конечные титры в пересчете на 1 мг сорбента варьировали в диапазоне меньше 2-10 ГАЕ. Падение гемагглютинирующего титра вирусов гриппа, содержащихся в растворе после сорбции, происходило в 8-1000 раз, в зависимости от начальной концентрации вирусов и массы сорбентов.
Было проанализировано влияние температуры на сорбцию вирусов. Параметры опыта: контакт 20 мин, масса сорбента 2 мг, объем смеси V=150, растворитель ФР. Полученные данные свидетельствовали, что адсорбция вирусов происходила с практически одинаковой интенсивностью при температурах 4°, 20° и 37°C (фиг.2).
Для определения оптимального времени контакта вирус - сорбент были проведены исследования влияния длительности взаимодействия вируса с сорбентом на сорбцию вирусов в диапазоне времени от 10 до 60 мин.
Параметры опыта: контакт 10, 20, 60 мин, масса сорбента 3 мг, объем смеси V=150,0, температура среды 22°C, растворитель ФР. Результаты исследования показали, что сорбция вирусов гриппа происходила наиболее интенсивно в первые 10-20 мин, затем интенсивность снижалась (фиг.3).
Для определения оптимального соотношения массы сорбентов к используемому постоянному объему раствора вируса, V=150,0 мкл, были проведены исследования сорбентов, масса которых варьировала от 1,0 до 10,0 мг, температура среды T=22°C, растворитель ФР. Как показали исследования, сорбция вирусов происходила интенсивно при навесках ДНА или шихты в 2,0-4,0 мг. Было установлено, что практически полное удаление вирусов из растворов происходило при навесках от 4,0 до 6,0 мг, в случае шихты наступала полная деконтаминация растворов от вирусов, в случае наноалмазов она происходила при большей массе сорбента - 8,0 мг (фиг.4).
Пример 3. Взаимодействие сорбентов с белками невирусной природы
Определение возможности конкуренции белков и вирусов за места связывания на сорбенте проведено с помощью сорбции белков невирусной природы, а именно сывороточных белков: иммуноглобулинов и бычьего сывороточного альбумина, которые активно используются в иммунологических исследованиях. В таблице 5 (фиг.5) приведены результаты влияния сорбции альбумина на последующую сорбцию вирусов на примере вируса гриппа A.
Исследования возможности конкурировать за места связывания на сорбенте белков с вирионными белками проводили по следующей схеме. Первый этап включал сорбцию препаратов альбумина с концентрацией C=1,0, 2,0,4,0 мг/мл на шихту в качестве сорбента, объем 120,0 мкл, контакт 1 ч. Затем комплекс шихта + альбумин массой 2,0 мг добавляли в растворы, содержащие равное количество вируса. Далее анализировали по вышеописанному методу. Как видно из Таблицы 5 (фиг.5), альбумин в концентрациях 2,0-4,0 мг/мл конкурировал с вирусом за места связывания на сорбенте. При концентрации альбумина 1,0 мг/мл он не препятствовал связыванию сорбента с вирусами, что приводило к снижению ГА титра с 4000 до 4 ГА единиц, то есть в 1000 раз. Таким образом, показано, что белок невирусной природы - бычий сывороточный альбумин - способен взаимодействовать с сорбентами, содержащими ДНА и конкурировать за места связывания.
Пример 4. Формирование вирусспецифических антител к гемагглютинину вирусов гриппа при иммунизации иммуносорбентом, представленным комплексом ДНА с вирусом гриппа A
Для выяснения, сохранена ли антигенная (биологическая) активность вирионных поверхностных белков, в частности гемагглютинина, в иммуносорбенте проведено исследование возможности формирования антител к гемагглютинину в модельных опытах на животных. С этой целью крыс иммунизировали иммуносорбентом - комплексом ДНАжидфаз с вирусом A/Южная Каролина/02/2010 (H1N1)pdm09. Контролем служили крысы, иммунизированные аллантоисным пандемическим штаммом вируса гриппа A/Южная Каролина/02/2010 (H1N1)pdm09 или эталонным штаммом вируса гриппа B/Бангладеш/3333/07. В реакции торможения гемагглютинации (РТГА) после обработки крыс получены следующие титры антител, представленные в таблице 6 (фиг.6). После иммунизации комплексов вирусов с ДНА в организме животных формировались антитела в титре 80, что свидетельствует о сохранении антигенных свойств вирусов в составе комплексов с ДНА. В контрольных сыворотках животных, иммунизированных вирусами гриппа A или B, также выявлены антитела к соответствующим вирусам.
Пример 5. Иммобилизация специфических антител на иммуносорбент (Иммуносорбция).
Определение способности гемагглютинина вирусов гриппа, например штамма A/Перт/06/09 (H3N2) в комплексе с сорбентом, связываться с антителами в растворах проводили следующим образом. В раствор 1% альбумина помещали комплексы вирусов с шихтой и вирусов с ДНА на 1 ч, T=20°C, для соединения свободных функциональных групп сорбента с белковыми группами альбумина. Далее несвязанный альбумин удаляли центрифугированием, добавляли по 150,0 мкл сыворотки и ставили на контакт в холодильник на 18 ч при 4°C. После контакта сыворотку отделяли от образованного комплекса центрифугированием и исследовали на наличие антител в реакции торможения гемагглютинации (РТГА). Результаты, представленные в таблице 7 (фиг.7), показывают, что произошла иммобилизация специфических антител на иммуносорбент.
Пример 6. Получение иммуносорбента. С этой целью на наноалмазные материалы, например на ДНА, сорбировали антитела из разведенной иммунной сыворотки, например сыворотки к вирусу B.
Образовавшийся иммуносорбент отделяли центрифугированием. Титр сыворотки определяли в РТГА. Результаты показывают, что ДНА содержащие материалы способны связываться с вирусспецифическими антителами из раствора (фиг.8).
Пример 7. Десорбция вируса с иммуносорбента
Как известно, иммуносорбент - это вещество с сорбированными на нем антигенами или антителами, используемое для извлечения соответственно антител или антигенов из сложных смесей. Особый интерес представляло определить, насколько стабильно связан вирус с сорбентом в иммуносорбентах. Для этого исследовали десорбцию вируса с иммуносорбентов, например с иммуносорбентов, представленных комплексом ДНАгазфаз с вирусами гриппа A или B Десорбция вируса с иммуносорбентов была исследована на аллантоисных вирусах гриппа A/Калифорния/04/06(НШ1)рс1 т09 и концентрированных вирусах гриппа B/Флорида/04/06. Иммуносорбенты смешивали в ФР и ставили на контакт при 4°C и 22°C в течение 1, 24, 48 ч. Затем иммуносорбенты осаждали и центрифугировали в центрифуге в течение 5 мин. Надосадочную жидкость исследовали на наличие вируса в РГА. Было установлено, что десорбция вирусов с поверхности иммуносорбента не наблюдалась при заданных условиях (фиг.9).
Пример 8. Определение токсичности ДНА
Для исследования токсичности ДНА использовали 2 модели - клетки и животные (белые крысы). При анализе влияния ДНА на культуру клеток MDCK не была выявлена токсичность ДНА и шихты при концентрации ≤1,0 mg/ml. Для исследования животные были иммунизированы комплексами ДНАжидфаз с концентрированным вирусом гриппа пандемический штамм A/Южная Каролина/02/2010 (H1N1)pdm09. Контрольная группа крыс была иммунизирована только вирусом A/Южная Каролина/02/2010 (H1N1)pdm09, вторая была не иммунная. Результаты исследования иммунограмм выявили двухкратное увеличение уровня только моноцитов в сыворотках животных, иммунизированных комплексами ДНА с вирусами гриппа A, в то время как другие параметры формулы крови были в норме.
Пример 9. Взаимодействие двунитевых фрагментов ДНК с ДНА
Фрагменты кДНК получены в полимеразной цепной реакции при амплифицировании фрагментов генов (РНК) вирусов гриппа A и B. Сорбция проведена при температуре T=22°C. Результаты анализа представлены на Фиг.10а, б. Фрагменты кДНК вируса гриппа B с размерами 190 пн адсорбировались как на ДНА, так и на шихту, фрагменты с размерами 560 пн полностью сорбировались только шихтой (Фиг.10 а, б).
При исследовании сорбции кДНК вирусов гриппа A на модифицированные при разных температурах от 600 до 1000°C ДНАграф, установлена полная сорбция кДНК, в то время как на амининированные и хлорированные ДНА - лишь частичная. Сорбция фрагментов кДНК на наноалмазные материалы существенно зависит от состояния их поверхности. Наибольшая сорбция наблюдалась в случае шихты и графитизированных при разных температурах наноалмазов.
Таким образом, предлагаемые сорбенты - шихта, ДНА и их модифицированные аналоги, способны в широком диапазоне температур за короткое время сорбировать вирусы как оболочечные, так и необолочечные. Вирусы, в том числе и вирусы гриппа, независимо от их антигенной структуры, степени очистки и способа культивирования, с помощью предлагаемых сорбентов могут быть удалены из вируссодержащих жидкостей. При этом иммобилизованные на наноалмазные материалы вирусы сохраняют способность взаимодействовать с антителами в растворах и вызывать продукцию сывороточных вирусспецифических антител при иммунизации животных. Кроме того, из раствора на сорбенты могут сорбироваться иммуноглобулины - вирусспецифические антитела. Изученные сорбенты можно также использовать для деконтаминации растворов от других вирусов. Полученные данные указывают на широкий спектр белковых материалов, которые могут быть удалены с помощью предлагаемых сорбентов из различных биологических жидкостей. Это белки невирусной природы, например альбумин и иммуноглобулины. Изобретение также решает задачу создания сорбентов для деконтаминации растворов от нанопатогенов, например вирусов, на основе наноалмазных материалов. Предлагаемое изобретение может быть использовано для обеззараживания жидкостей. В последние годы участились случаи передачи вируса гриппа A от птиц к людям в районах близкого контакта птиц с человеком. Предлагаемое изобретение можно использовать для удаления вирусов из водных резервуаров, зараженных вирусами гриппа птиц. Комплексы вирусов с наноалмазсодержащими сорбентами - иммуносорбенты - могут быть использованы для адресной доставки вирионных белков или ампликонов. Совокупность выявленных адсорбционных свойств препаратов наноалмазных сорбентов с уникальными физико-химическими свойствами (инертностью), экономичностью (дешевизной сырья: 1 г наноалмаза стоит порядка 2.5$ и 1 грамм шихты в порядка 1$), позволяет приступить к разработке фильтров. Модифицирование ДНА увеличивает их стоимость не более чем на 50%.
Литература
1. Даниленко В.В. Из истории открытия синтеза наноалмазов. Физика твердого тела. 2004, т.46, вып.4, с.581-584.
2. Долматов В.Ю., Веретеннникова М.В., Марчуков В.А и др. Современные промышленные возможности синтеза наноалмазов. Физика твердого тела, 2004, т.46, в. 4, с.596-600.
3. Долматов В.Ю. Ультрадисперсные алмазы детонационного синтеза: свойства и применение. Успехи химии. 2001, т.70(7), с.687-708.
4. Кулакова И.И. Химия поверхности наноалмазов. Физика твердого тела. 2004, т.46, №4, с.621-628.
5. Кулакова И.И. Модифицирование детонационного наноалмаза: влияние на физико-химические свойства. Рос. хим. ж. (Ж. Рос. хим. Общества им. Д.И.Менделеева). 2004, т.XLVIII, 5, с.97-106.
6. Павлов Е.В., Скрябин Ю.А. Способ удаления примеси неалмазного углерода и устройство для его осуществления. Патент RU 2019502.
7. Ларионова И.С., Молостов И.Н., Кулагина Л.С и др. Способ очистки синтетических ультрадисперсных алмазов. Патент RU 2168462.
8. Долматов В.Ю., Сущев В.Г., Марчуков В.А. и др. Способ выделения синтетических ультрадисперсных алмазов. Патент RU 2109683.
9. Долматов В.Ю., Веретенникова М.В., Марчуков В.А. и др. Современные промышленные возможности синтеза наноалмазов. Физика твердого тела. 2004, т.46, вып.4, с.596-600.
10. Spitsyn B.V. et al. Inroad to modification of detonation nanodiamond, Diamond and Related Material. 2006, v. 15, p.296-299.
11. Долматов В.Ю. Ультрадисперсные алмазы детонационного синтеза: свойства и применение. Успехи химии. 2001, т.70(7), с.687-708.
12. Пузырь А.П., Бондарь B.C., Селимханова З.Ю. и др. Результаты исследования возможности применения детонационных наноалмазов в качестве энтеросорбента. Сибирское медицинское обозрение. 2004, т.2-3, с.25-28.
13. Долматов В.Ю. Биологические активные ультрадисперсные алмазы детонационного синтеза. Патент RU 2203068.
14. Елинсон В.М., Плотников В.М. и др. Композиция, обладающая иммуностимулирующими свойствами. Патент RU 2348416.
15. Purtov K.V. et al. The interaction of linear and ring form of DNA molecules with nanodiamonds synthesized by detonation. Nanotechnology 2008, 325101, v. 19, p.1-3.
16. Бондарь B.C., Позднякова И.О., Пузырь А.П. Применение наноалмазов для разделения и очистки белков. Физика твердого тела. 2004, т.46, вып.4, с.737-739.
17. E. Perevedentseva et al. The interaction of the protein lysozyme with bacteria E.coli observed using nanodiamond labeling. Nanotechnology 2007, v. 18, 315102; Liu Y. L., Sun K.W. Protein Functionalized Nanodiamond Arrays. Nanoscale Res. Lett, 2010, June 5(6), p.1045-1050.
18. Пузырь А.П., Позднякова И.О., Бондарь B.C. Создание люминесцентного биочипа с использованием наноалмазов и бактериальной люциферазы. Физика твердого тела, 2004, т.46, вып.4, с.740-742.
19. Adnan A., Lam R., Chen H et al. Nanodiamond: Atomistic Simulation and Measurement of pH Dependent Cancer Therapeutic Interactions with Nanodiamond Carrier. Molecular Pharmaceutics, 2011, v. 8 (2), p.368-374) (http://www.nanonewsnet.ru/news/2007/nanoalmazy-protiv-raka).
20. Fujimura et al. Carrier of a diamond fine particle for immobilizing virus. Patent US 7491554.
21. Sirois S., Touaibia M. Glycosylation of HIV-1 gp 120 V3 loop: towards the rational design of a synthetic carbohydrate vaccine. Curr. Med. Chem. 2007, 14(30), p.3232-42).
22. Fujimura et al. Carrier of a diamond fine particle for immobilizing virus. Patent US 7498178.
23. Иванова B.T., Курочкина Я.Е., Буравцев B.H. и др. Изучение взаимодействия вирусов гриппа А и В с углеродсодержащим сорбентом. Вопросы вирусологии. 2008, 2, с.40-43.
1. Сорбент, представляющий собой наноалмазный материал, являющийся продуктом детонационного синтеза, полученный посредством взрыва смеси тринитротолуола и гексогена, взятых в отношении 50/50 при давлении 16-23 ГПа и температуре 3000 K, содержащий индивидуальные частицы размером от 5 нм до агрегатов различной формы размером 300 нм, используемый для удаления вирусов, вирусных антител, фрагментов ДНК, белков невирусной природы и в качестве основы для получения иммуносорбентов.
2. Сорбент, представляющий собой наноалмазный материал, полученный в результате жидкофазной очистки шихты в разбавленной азотной кис