Анализ митральной регургитации посредством ультразвукового формирования изображений
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к средствам для оценки регургитационного потока. Система содержит ультразвуковой датчик, содержащий матрицу преобразователей, процессор изображений, доплеровский процессор, процессор для вычисления потоков, выполненный с возможностью создания модели поля скоростей потока около местонахождения регургитационного потока и устройство отображения. Способ содержит этапы, на которых формируют изображения местонахождения регургитационного потока, создают модель поля скоростей потока, получают доплеровские ультразвуковые измерения скорости кровотока, сравнивают аппроксимированные значения скоростей потока, полученные из модели, корректируют параметр модели и отображают местонахождение регургитационного потока. Изобретение позволяет улучшить точность местонахождения регургитационного отверстия клапана. 2 н. и 15 з.п. ф-лы, 6 ил.
Реферат
Настоящая заявка притязает на приоритет по предварительной патентной заявке США № 61/426,669, поданной 23 декабря 2010 г.
Настоящее изобретение относится к системам медицинской ультразвуковой диагностики и, в частности к применению систем диагностических систем ультразвукового формирования изображений для анализа регургитационного потока митрального клапана.
Регургитационный поток является тяжелым медицинским состоянием, которое требует анализа и соответствующего лечения. Непосредственно перед сокращением левого желудочка для накачивания крови в тело митральный клапан должен полностью закрыться, чтобы сокращение вытолкнуло всю кровь в аорту. Если клапан закрывается не полностью, то некоторое количество крови, находящейся в левом желудочке, будет выталкиваться обратно в левое предсердие через отверстие в не полностью закрытом клапане. Данный обратный ток крови, представляющий собой обычно небольшую, кратковременную струю кровотока через не полностью закрытые створки клапана, уменьшает отток крови от сердца и, следовательно, снижает эффективность каждого сердечного сокращения. В таком случае, сердцу приходится быстрее качать кровь, чтобы подавать кровь для необходимого снабжения питающим кровотоком. Сердце переутомляется вследствие его неэффективности, что приводит к сердечной недостаточности.
Врачи уже много лет применяли ультразвуковое формирование изображений для обнаружения регургитационного кровотока. Ультразвуковое обнаружение клапанной регургитации сначала осуществляли путем поиска вышеупомянутой струи крови в ультразвуковом изображении левой стороны сердца. За последние двадцать лет наблюдение струи удалось облегчить благодаря двумерному (2-мерному) цветовому доплеровскому формированию изображений потока, в процессе которого высокую скорость и турбулентность небольшой струи крови обнаруживают посредством внимательного поиска упомянутых аномальных локальных скоростей крови вблизи подтекающего сердечного клапана. Однако сбор данных плоскости изображения, в которой струя является наиболее мощной, в сочетании с движением сердца и клапана и турбулентностью кровотока около митрального клапана, а также кратковременным появлением струи, осложняет упомянутый субъективный подход. В последние годы, в случаях, когда местонахождение струи можно наблюдать ультразвуковым способом, врачи применяли метод, называемый PISA, сокращение от площади проксимальной изоскоростной поверхности, для количественного определения регургитационного кровотока. При данном способе, подозрительный клапан и область внутри сердечной камеры левого желудочка (LV) и проксимальную относительно клапана формируют изображения методом цветового доплеровского картирования потока. Во время появления струи область конвергенции потока (FCR) формируется в проксимальной области, когда скорости кровотока в области мгновенно ускоряются к регургитационному отверстию. Данная схема потока приводит к искажениям дискретизации на цветовой карте потока, когда скорости потока на мгновение превышают диапазон скоростей, используемый для цветовой карты потока. В данный момент цветовая карта потока вводится и фиксируется на экране дисплея. Затем выполняется измерение скорости v на первой линии с искажениями дискретизации в области конвергенции потока (FCR), и выполняется измерение расстояния r от линии с искажениями дискретизации до предполагаемого центра отверстия клапана. Затем два данных измерения используют для вычисления объемной скорости кровотока через отверстие с использованием выражения Qt=2πr2v.
При проведении вышеописанной процедуры возникает ряд затруднений. Одно затруднение заключается в том, что максимальную точность получают, когда струю на цветовой карте потока записывают в момент ее пика. Продолжительность струи во время сердечного цикла может составлять только 300-450 миллисекунд, однако, тогда как типичная частота кадров цветовой карты потока может быть в диапазоне 10-20 кадров в секунду. Таким образом, вероятно, что время сбора данных одного из кадров цветовой карты потока не будет в точности совпадать с моментом, когда струя проходит свой пик. Врач может повторять последовательность сбора данных цветовой карты потока в течение дополнительных сердечных циклов или может вводить поправку на причины неточности при выполнении измерений не точно в момент пика струи.
Другая проблема заключается в том, что на цветовой карте потока не просто определить центр отверстия клапана. Ткань клапана создает сильные отражения ультразвука и быстро двигается, когда выполняют сканирование, и может представляться в виде большой, размытой или нечеткой массы в изображении. Таким образом, возможно, точность измерения r будет снижена из-за невозможности оценки точного местонахождения отверстия.
Третья проблема заключается в том, что базовый метод PISA включает в себя только одно одномерное измерение. Выполняют только одно измерение скорости, и в вычислении используют только один радиус r для отверстия. Способ предполагает, что остальной кровоток в области FCR имеет такие же характеристики, как при единственном измерении. Очевидно, любая неточность при выполнении единственного измерения приведет к неточному результату.
Расширение базового метода PISA, которое имеет целью устранение упомянутых неточностей, предполагает выполнение нескольких измерений скорости по дуге, определяющей внешнюю границу области FCR в двумерном изображении. От каждой точки измерения скорости измеряют расстояние r до отверстия, и несколько измерений используют для вычисления объемной скорости потока Qt. Хотя несколько измерений могут исключить зависимость от единственного неточного измерения, возникает другая проблема. Метод (1-мерный) с единственным измерением обычно исполняют путем направления центрального пучка ультразвукового датчика через верхушку сердца и непосредственно через предполагаемое регургитационное отверстие и путем выполнения измерений скорости v и расстояния r вдоль данной линии пучка. С использованием линии пучка, выставленной вышеописанным образом по упомянутому вектору регургитационного потока, измеренная скорость будет точной и не зависящей от ненулевого доплеровского угла. Как известно, ультразвуковые доплеровские измерения скорости зависят от угла между направлением потока и направлением ультразвукового пучка. Поток, который точно совпадает с направлением пучка, будет измерен точно, а поток, который направлен под ненулевым углом к направлению пучка, будет приведенным из-за умножения на косинус угла. Поток, который направлен ортогонально (90°) к направлению пучка, не создаст доплеровского отклика. Следовательно, доплеровскую скорость, измеренную ультразвуковым способом, следует корректировать в зависимости от угла между вектором потока и направлением пучка, чтобы получить более точное измерение скорости. В случае 2-мерного метода PISA, дополнительное измерения скорости по дуге области FCR будут неточными из-за изменения углов между векторами потока и направлением пучка в каждой точке, в которой выполняют измерение скорости. Таким образом, несмотря на то что несколько измерений могут компенсировать погрешность, получаемую при однократном измерении скорости, совокупность измерений даст заниженную объемную скорость потока вследствие изменения доплеровских углов в каждой точке измерения.
Еще одной проблемой, характерной для метода PISA, является недостоверность знания точного местонахождения регургитационного отверстия клапана. Как упоминалось выше, искажения дискретизации на цветовой карте потока преобладают вблизи места утечки через клапан вследствие резкого ускорения кровотока к отверстию и через него. Тем самым цветовое изображение потока забивается вспышкой паразитных цветов в доплеровском изображении вблизи отверстия.
Кроме того, плоскость митрального клапана находится в движении во время сокращения сердца. Так как точность метода PISA зависит от знания местонахождения отверстия для измерения расстояния r, то упомянутые помехи точному знанию местонахождения отверстия могут привести к неточному измерению r и, следовательно, неточному вычислению объемной скорости потока. Эксперименты показали, что погрешность всего в один миллиметр в определении местонахождения отверстия может привести к значительной погрешности при вычислении объемной скорости потока через место утечки. Кроме того, известно, что многие клапаны с регургитацией характеризуются местом утечки не в форме единственного небольшого отверстия, а местом утечки в форме щели при неточном закрытии клапана. Следовательно, предположение, что место утечки является единственным небольшим сквозным отверстием в клапане, может быть необоснованным.
В соответствии с вышеизложенным, существует необходимость в создании способа и устройства для количественного определения объемной скорости потока и объемного потока регургитации митрального клапана, которые лишены вышеописанных ограничений метода PISA. Целью настоящего изобретения является достоверная идентификация точного местонахождения регургитационного отверстия клапана. Дополнительной целью настоящего изобретения является создание комплекса измерений, которые не зависят от доплеровского угла в каждом месте измерения. Дополнительной целью настоящего изобретения является создание возможности идентификации и количественного определения регургитации митрального клапана, обусловленной наличием места утечки не в виде единственного небольшого отверстия, но также обусловленной щелью вдоль линии закрытия клапана.
В соответствии с принципами настоящего изобретения предлагаются диагностическая система ультразвукового формирования изображений и способ для количественного определения регургитационного кровотока. Определяют контуры аркообразной (двумерной) или полусферической (трехмерной) области кровотока, близкой к предполагаемому месту утечки митрального клапана на ультразвуковом изображении клапана с регургитацией. Внутренняя граница области находится непосредственно на границе или немного за границей области с искажениями дискретизации, прилегающей к отверстию утечки, и внешняя граница области находится снаружи внутренней границы и концентрично ей. Делают исходные предположения относительно регургитационного потока, в том числе относительно местонахождения регургитационного отверстия. Упомянутые предположения используют для вычисления модели поля скоростей регургитационного потока. Параметры модели корректируют в соответствии с физическими параметрами ультразвукового излучения и/или настройками ультразвуковой системы, чтобы определить ожидаемые вектора скорости, которые должны наблюдаться ультразвуковой системой VOBS в оконтуренной области. В оконтуренной области выполняют измерения скорости ультразвуковой системой, и измеренные скорости сравнивают с ожидаемыми скоростями. Вычисляют разности между измеренными и ожидаемыми значениями и, посредством подбора нелинейной аппроксимирующей кривой, вносят поправки в, по меньшей мере, одно значение модели. Процедуру итерационно повторяют вплоть до допустимого схождения ожидаемых и измеренных значений. Параметры итерационно скорректированной модели можно использовать для получения количественного измерения объемной скорости потока или местонахождения подтекающего отверстия в клапане.
В соответствии с дополнительным аспектом настоящего изобретения, исходно принятое местонахождение регургитационного отверстия на ультразвуковом изображении автоматически корректируется посредством выполнения вышеописанной процедуры, для указания фактического местонахождения отверстия на изображении. Таким образом, врачу представляется точное местонахождение регургитационного отверстия, независимо от присутствия искажений в изображении вблизи митрального клапана.
В соответствии с еще одним аспектом настоящего изобретения, вышеописанный метод повторяют в нескольких пространственных положениях вдоль митрального клапана. Совокупный регургитационный поток, измеренный в пространственных положениях, обеспечивает количественный показатель регургитационного потока, обусловленного утечкой регургитации, местом которой является щель по линии закрытия митрального клапана, а не одно подтекающее небольшое отверстие.
В соответствии с дополнительным аспектом настоящего изобретения предлагается описание характеристик нескольких фильтров выделения стенок, которые являются предпочтительными для осуществления измерения регургитационного потока в соответствии с настоящим изобретением, в том числе фильтра выделения стенок с характеристикой, которая имеет пик при промежуточных скоростях потока, которые часто обнаруживаются в области потока вблизи регургитационного отверстия.
На чертежах:
Фиг.1 - блок-схема диагностической системы ультразвукового формирования изображений, выполненной в соответствии с принципами настоящего изобретения.
Фиг.2 - блок-схема, поясняющая функционирование процессора для вычисления потоков, показанного на фиг.1.
Фиг.3 - ультразвуковое доплеровское изображение регургитационной струи.
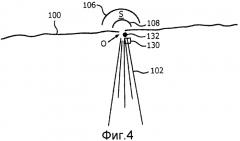
Фиг.4 - ультразвуковое изображение с исходно принятым местонахождением отверстия и автоматически указанным местонахождением отверстия в соответствии с настоящим изобретением.
Фиг.5 - иллюстрирует метод количественного определения регургитационного потока через щель в клапане, в соответствии с настоящим изобретением.
Фиг.6 - иллюстрирует амплитудно-частотную характеристику фильтра выделения стенок, пригодного для использования в ультразвуковой системе в соответствии с настоящим изобретением.
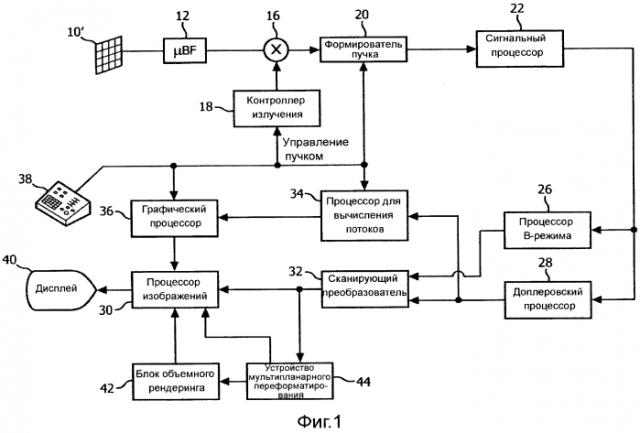
На фиг.1 представлена блок-схема диагностической системы ультразвукового формирования изображений, выполненной в соответствии с принципами настоящего изобретения. Как показано на фиг.1, в ультразвуковом датчике 10 обеспечена матрица 10' преобразователей для излучения ультразвуковых волн и приема эхосигнальной информации. В предпочтительном варианте, матрица 10' преобразователей является двумерной матрицей преобразовательных элементов, способных сканировать в трех измерениях, например, как по углу места, так и по азимуту около местонахождения митрального клапана, для 3-мерного формирования изображений. Матрица преобразователей соединена с формирователем 12 тонко-сфокусированных пучков в датчике, который управляет излучением и приемом сигналов элементами матрицы. Формирователи тонко-сфокусированных пучков способны, по меньшей мере, частично формировать пучок из сигналов, принятых группой или «участками» преобразовательных элементов, как подробно поясняется в патентах США 5,997,479 (Savord et al.), 6,013,032 (Savord) и 6,623,432 (Powers et al.). Формирователь тонко-сфокусированных пучков соединен кабелем датчика с переключателем 16 излучения/приема (T/R), который переключается между излучением и приемом и защищает основной формирователь 20 пучка от высокоэнергетических излучаемых сигналов. Излучение ультразвуковых пучков матрицей 10 преобразователей под управлением формирователя 12 тонко-сфокусированных пучков направляется контроллером 18 излучения, соединенным с переключателем T/R 16 и формирователем 20 пучка, который принимает данные ввода от пользователя, работающего на пользовательском интерфейсе или панели 38 управления. Одной из функций, управляемых контроллером излучения, является направление, в котором направляют пучки. Пучки могут быть направлены прямо вперед (ортогонально) от матрицы преобразователей или под разными углами для расширения поля обзора.
Сигналы, полученные методом формирования частичных пучков в формирователе 12 тонко-сфокусированных пучков, подаются в основной формирователь 20 пучка, в котором сигналы, обработанные методом формирования частичных пучков, из отдельных участков элементов объединяются в сигнал, обработанный методом формирования полного пучка. Например, основной формирователь 20 пучка может содержать 128 каналов, каждый из которых получает сигнал, обработанный методом формирования частичных пучков, от участка из 12 преобразовательных элементов. При этом сигналы, полученные более чем 1500 преобразовательными элементами двумерной матрицы, могут обеспечивать эффективный вклад в один сигнал, обработанный методом формирования пучка.
Сигналы, обработанные методом формирования пучка, подаются в сигнальный процессор 22. Сигнальный процессор 22 может обрабатывать полученные эхо-сигналы различным образом, например, полосовой фильтрацией, прореживанием, разделением на I и Q составляющие, а также выделением гармонических сигналов, которое выполняет функцию разделения линейных и нелинейных сигналов, чтобы допускать идентификацию нелинейных эхо-сигналов, отраженных от ткани и микропузырьков. Сигнальный процессор может также выполнять дополнительное повышение отношение сигнала к шуму, например, удаление спеклов, смешение сигналов и подавление шумов.
Обработанные сигналы подаются в процессор 26 B-режима и доплеровский процессор 28. Процессор 26 B-режима использует амплитудное детектирование для формирования изображений таких структур в теле, как ткань сердечной стенки, митральный клапан и клетки крови. Изображения структуры тела в B-режиме могут быть сформированы либо в режиме гармоники, либо в основном режиме, либо в режиме, сочетающем оба упомянутых режима, как поясняется в патенте США 6,283,919 (Roundhill et al.) и патенте США 6,458,083 (Jago et al.). Доплеровский процессор 28 обрабатывает различные по времени сигналы от ткани и кровотока для обнаружения движения веществ, например, потока клеток крови в поле изображения. Доплеровский процессор обычно содержит фильтр выделения стенок с параметрами, которые могут быть установлены для пропускания и/или подавления эхо-сигналов, отраженных от материалов выбранных типов в теле. Например, фильтр выделения стенок может быть настроен на такую характеристику полосы пропускания данного фильтра, чтобы пропускать сигнал с относительно низкой амплитудой от материалов с более высокой скоростью, при подавлении относительно сильных сигналов от материала с меньшей или нулевой скоростью. Данная характеристика полосы пропускания будет пропускать сигналы от протекающей крови, при подавлении сигналов от соседних неподвижных или медленно двигающихся объектов, например, стенки сердца. Обратная характеристика будет пропускать сигналы от движущейся ткани сердца, при подавлении сигналов кровотока, что применяется для так называемого доплеровского формирования изображений тканей, обнаружения и описания движения ткани. Доплеровский процессор принимает и обрабатывает последовательность различные по времени эхо-сигналы из разных точек в поле изображения, при этом последовательность эхо-сигналов от конкретной точки называется набором. Набор эхо-сигналов, принятых в быстрой последовательности в течение относительно короткого интервала, можно использовать для оценки частоты доплеровского сдвига протекающей крови, при соответствии доплеровской частоты скорости, указывающей скорость кровотока. Набор эхо-сигналов, принятых в течение более длительного периода времени, используют для оценки скорости медленнее протекающей крови или медленно движущейся ткани. Для оценки митральной регургитации быстро протекающей струи, обычно используют короткие длины наборов (меньшее число отсчетов), чтобы можно было реализовать высокую частоту кадров сбора данных. Доплеровский сдвиг Δf можно вычислить из уравнения Δ f = 2 ν f 0 cos θ c , где f0 является частотой излучения, c является скоростью распространения ультразвука, ν означает скорость, и θ является углом между направлением пучка и направлением кровотока.
Сигналы структур и движения, формируемые процессором B-режима и доплеровским процессором, подаются в сканирующий преобразователь 32 и устройство 44 мультипланарного переформатирования. Сканирующий преобразователь упорядочивает эхо-сигналы в пространственном соотношении из того, в котором они были приняты, в требуемом формате изображения. Например, сканирующий преобразователь может упорядочивать эхо-сигнал в двумерный (2-мерный) секторный формат или пирамидальное трехмерное (3-мерное) изображение. Сканирующий преобразователь может покрывать изображение структур в B-режиме цветами, соответствующими движению в точках в поле изображения, соответствующему их скоростям, рассчитанным доплеровским методом, для получения цветовой доплеровской карты потока, которое описывает движение ткани и кровоток в поле изображения. Устройство мультипланарного переформатирования будет преобразовывать эхо-сигналы, которые приняты из точек в общей плоскости в объемной области тела, в ультразвуковое изображение данной плоскости, как поясняется в патенте США 6,443,896 (Detmer). Блок 42 объемного рендеринга преобразует эхо-сигналы набора 3-мерных данных в проектируемое 3-мерное изображение, наблюдаемое из данной начальной точки, как поясняется в патенте США № 6,530,885 (Entrekin et al.). 2-мерные или 3-мерные изображения выводятся из сканирующего преобразователя 32, устройства 44 мультипланарного переформатирования и блока 42 объемного рендеринга в процессор 30 изображений для дальнейшего улучшения, буферизации и временного хранения для отображения на дисплее 40 изображений.
В соответствии с принципами настоящего изобретения, значения скорости кровотока, полученные доплеровским процессором 28, подаются в процессор 34 для вычисления потоков. Процессор для вычисления потоков работает, как поясняется ниже, для получения количественного показателя объемной скорости потока через регургитационное отверстие, объемного потока через отверстие и пространственного местонахождения отверстия. Процессор для вычисления потоков может принимать данные ввода с панели 38 пользовательского управления, например, исходную оценку местонахождения отверстия, как поясняется ниже. Выходные данные из процессора для вычисления потоков подаются в графический процессор 36 для воспроизведения выходных данных из процессора вместе с изображением на дисплее 40. Графический процессор 36 может также формировать графические оверлеи для отображения с ультразвуковыми изображениями. Упомянутые графические оверлеи могут содержать стандартную идентификационную информацию, например имя пациента, дату и время изображения, параметры формирования изображений и т.п. С данной целью, графический процессор принимает данные ввода из пользовательского интерфейса 38, например введенное на клавиатуре имя пациента. Пользовательский интерфейс соединен также с контроллером 18 излучения для управления генерацией ультразвуковых сигналов из матрицы 10' преобразователей и, следовательно, формированием изображения, получаемого матрицей преобразователей и ультразвуковой системой. Пользовательский интерфейс соединен также с устройством 44 мультипланарного переформатирования для выбора и управления отображением нескольких мультипланарно переформатированных (MPR) изображений, которые можно использовать для количественного определения регургитационного потока в MPR изображениях, в соответствии с настоящим изобретением, как поясняется ниже.
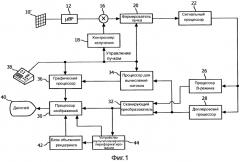
На фиг.2 поясняется работа процессора для вычисления потоков, показанного на фиг.1. В основу процессора положена математическая модель поля скоростей потока в точках дискретизации внутри зоны включения, как поясняется ниже. В варианте осуществления с 2-мерным изображением, зона включения является, предпочтительно, изогнутой полосой, оконтуренной двумя дугами с центрами на местонахождении регургитационного отверстия, {x0, y0, z0}. В варианте осуществления с 3-мерным изображением, изогнутая полоса имеет форму полусферического слоя, как поясняется ниже в связи с фигурой 3. В предпочтительном варианте осуществления, является векторной моделью скоростей поля скоростей потока вида
V → M o d e l ( r ) = n → r e l | V ( r ) |
или
V → M o d e l ( r ) = − r → ‖ r ‖ ∘ | V ( r ) | ,
где | V ( r ) | = F → 2 π r 2 для вектора F → потока, и r означает расстояние от точки (x, y, z) в трехмерных координатах в зоне включения до регургитационного отверстия, и отверстие имеет координаты {x0, y0, z0} местонахождения в трехмерном пространстве. То есть расстояние r в векторном выражении для указания направления к отверстию имеет форму
r → = { x − x 0 , y − y 0 , z − z 0 } .
В ходе операции 50 на фиг.2 описанным образом моделируется скорость потока в каждой точке в зоне включения. Первоначально модель может начинаться с предположения или оценки значений неизвестных параметров, например потока F → и местонахождения {x0, y0, z0} регургитационного отверстия. Например, модель может начинаться с параметров, которые являются номинальными характеристиками регургитационного потока. Пользователь может ввести параметры, например, путем указания предполагаемого местонахождения регургитационного отверстия на ультразвуковом изображении. Или возможно использование известного метода, например метода PISA, для вычисления значений, используемых в качестве исходных параметров для поля скоростей потока.
Модель поля скоростей потока аппроксимирует векторы скоростей, которые были бы точными, если бы были известны истинные вектора физиологической скорости. Вектора скоростей, аппроксимированные моделью, указаны как ~VTRUE на выходе операции 50. Затем операция 52 вводит некоторые ограничения и поправки для ~VTRUE, обусловленные такими практическими факторами, как физические свойства ультразвука и рабочие параметры используемой ультразвуковой системы. Затем модель поля скоростей потока корректируется или изменяется в масштабе для учета упомянутых практических факторов при рассмотрении фактических значений скорости, которые будут наблюдаться ультразвуковой системой. Одним из практических факторов, с учетом которого может выполняться коррекция, является доплеровский угол. Как упоминалось выше, доплеровские измерения, выполненные ультразвуковой системой, являются высокоточными только в том случае, когда направление потока совпадает с направлением ультразвукового пучка, т.е. доплеровский угол равен нулю. Для всех других углов между направлением пучка и направлением потока скорость занижается. В вышеприведенном уравнении доплеровского сдвига доплеровский угол умножается на весовой коэффициент в результате члена cosθ, где θ является доплеровским углом. Другим практическим фактором ультразвуковой системы является смещение фильтра выделения стенок. Доплеровский фильтр выделения стенок будет иметь, обычно, нелинейную характеристику, которая, для обнаружения кровотока, будет иметь нулевой отклик при постоянном сигнале (в отсутствие движения) и повышаться для максимального отклика на выбранной высокой частоте ±f. В альтернативном варианте, фильтр выделения стенок может иметь максимальный отклик на частоте, которая ниже частоты, определяемой пределом Найквиста частоты дискретизации по набору, как поясняется ниже. Отсчетный объем в теле, в котором измеряется доплеровский сдвиг, будет не одной точкой в теле, а будет иметь конечные размеры, что будет приводить к отраженным доплеровским сигналам, характеризующим диапазон скоростей. Неравномерный отклик фильтра выделения стенок может вызывать широкий разброс скоростей с получением более высокого усиления в разных местах амплитудно-частотной характеристики, например более высокие скорости выделяются сильнее, чем меньшие скорости. Данный неравномерный отклик может создать сдвиг воспринимаемого центра разброса скоростей, называемый смещением фильтра выделения стенок. Эффект смещения фильтра выделения стенок также можно учесть коррекцией модели. Другим связанным фактором, который можно учитывать, является спектральный разброс, эффект доплеровского спектрального уширения, обусловленный разными траекториями и углами из отсчетного объема к каждому приемному элементу активной апертуры матричного преобразователя. Смотри патент США 5,606,972 (Routh). Еще одним фактором, который можно учитывать, является эффект искажений дискретизации, сообщение неверных доплеровских частот и скоростей, когда движение кровотока происходит со скоростью, превышающей скорость, которую можно однозначно обнаружить по пределу Найквиста для частоты дискретизации набора эхо-сигналов. В процессе операции 52 такие факторы, как, например, вышеописанные факторы, учитываются коррекцией скалярным произведением модели поля скоростей потока, что, для вышеописанных моделей, может иметь вид
V → O B S ( r ) = | V ( r ) | [ − r → ‖ r ‖ ∘ n → s c a n ] ,
где n → s c a n является векторным представлением факторов физического характера и ультразвуковой системы, с учетом которых выполняется коррекция. Результатом, показанным на фиг.2, является is V0BS, модель, скорректированная ожидаемыми эффектами, и которую следует ожидать в сигналах, измеренных ультразвуковой системой.
Компаратор 54 сравнивает ожидаемые значения скоростей из модели поля скоростей потока, V0BS, с фактическими измерениями скоростей в точках (отсчетных объемах) поля, VMEAS, полученными доплеровским процессором 28. В ходе операции 56, разности между ожидаемыми и принятыми значениями возводятся в квадрат для получения члена погрешности для каждой точки. Члены погрешности интегрируются по всей зоне включения, которая может быть одномерной (например, 1-мерной линией), двумерной (например, 2-мерной аркообразной зоной) или трехмерной (например, 3-мерным полусферическим слоем) зоной включения, чтобы получить член среднеквадратической погрешности для всей зоны. Затем член погрешности служит для коррекции таких параметров модели поля, как r и объемная скорость потока, чтобы обеспечить уменьшение измеряемого впоследствии члена погрешности. Предпочтительный метод коррекции заключается в использовании аппроксимации нелинейной кривой для доработки модели в сторону уменьшения погрешности. Один подобный метод аппроксимации нелинейной кривой, которым можно воспользоваться, представлен алгоритмом Левенберга-Марквардта, который уточняет координаты местонахождения регургитационного отверстия и поток ( F → ) или объемную скорость потока (Qt) поля к отверстию или через него.
Цикл на фиг.2 итерационно повторяется для уменьшения члена погрешности. С каждым проходом цикла более точно доработанная модель корректируется и сравнивается с измерениями скорости ультразвука из зоны приема, и член погрешности итерационно уменьшается. Когда член погрешности уменьшен до допустимого низкого значения, модель представляет собой требуемые фактические измерения местонахождения отверстия и кровотока через отверстие. Упомянутые члены и, по желанию, другие формируются как выходные данные процессором 34 для вычисления потоков и представляются на дисплее для пользователя.
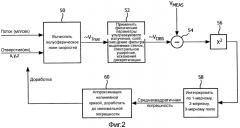
На фиг.3 представлено схематичное 2-мерное ультразвуковое изображение, поясняющее практическое применение настоящего изобретения для измерения регургитации митрального клапана. Линия 100 представляет плоскость митрального клапана, на которой существует место утечки регургитации в виде отверстия O. Когда левый желудочек сокращается, струя крови 102 истекает обратно в правое предсердие. По способу PISA, данную струю зондировали бы доплеровским пучком 110, продолжающимся через отверстие O. В патенте США 6,719,697 (Li) предложено усовершенствование метода PISA, в соответствии с которым формируется цветное отображение M-режима в течение сердечного цикла из местоположения доплеровского пучка 110. Дисплейный процессор для цветового доплеровского картирования настроен на пределы отображения, указанные контрольной цветной полосой 120 с правой стороны изображения, продолжающейся из центральной начальной точки нулевой скорости (BK=черный) к +V и -V максимальным скоростям в противоположных направлениях. Диапазон цветов (Y=желтый; DR-темно-красный и т.п.) отображается в соответствии с данным диапазоном скоростей. Искажения дискретизации возникают, когда измеряемая скорость превышает пределы Найквиста +V и -V. Непосредственно вблизи отверстия находится область 104 конвергенции потока (FCR). За пределами области конвергенции потока находится зона 112 приема (S), используемая в варианте осуществления настоящего изобретения.
В основу как метода PISA, так и настоящего изобретения положено предположение, что регургитационный поток в левом желудочке вблизи отверстия сходится и протекает к местонахождению O отверстия. Упомянутое схождение показано векторами V → 1 , V → 2 и V → 3 потока в зоне S приема. Но, как показывает направление доплеровского пучка 110, фактически, ни один вектор потока не будет совпадать с направлением пучка, даже когда используют изменяющиеся углы пучков секторного датчика с фазированной решеткой. Следовательно, для разных векторов потока будут существовать доплеровские углы разной величины, что учитывается операциями коррекции доплеровских углов в модели поля скоростей потока в ходе операции 52 на фиг.2, как поясняется выше.
Цветовое доплеровское изображение области FCR 104 будет хаотичной и непостоянной. Данный эффект объясняется тем, что пространственная ориентация клеток крови и скорости кровотока изменяются в данной области очень быстро по мере того, как кровоток изменяет направление и немедленно ускоряется к отверстию O во время систолического сокращения. Отсчеты набора, полученные во время данного интервала, часто не коррелируются между собой, что нарушает корреляцию внутри набора, которая положена в основу обычных процессоров, выполняющих доплеровские расчеты. В результате, даже если поток в области FCR может быть, в