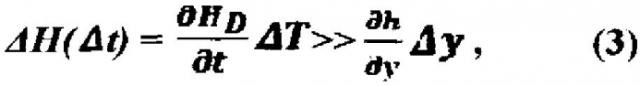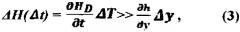Способ определения функционального состояния клетки
Иллюстрации
Показать всеИзобретение относится к медицине и биологии и может быть использовано для определения функционального состояния клетки. Для этого растровое изображение клетки и ее органелл получают в функции от оптической разности хода, представленной как фазовая толщина локального участка клетки или ее органелл, получают построчным последовательным сканированием каждого элемента клетки или ее органелл, попадающего в строку, с последующим переходом в следующую строку, расположенную под строкой, прошедшей сканирование. При этом сканирование каждого последующего элемента клетки и ее органелл осуществляют с контролируемой во времени задержкой после сканирования предыдущего элемента клетки или ее органелл в строке, с регистрацией данных величины локальной оптической разности хода для каждого отсканированного элемента растрового изображения. О параметрах клетки и ее органелл и о наличии динамических процессов в клетке или ее органеллах судят по разнице величин фазовой толщины в соседних элементах клетки или ее органелл. Изобретение обеспечивает одновременное получение информации о структуре и о динамических характеристиках раковых клеток и клеток крови. 2 ил.
Реферат
Изобретение относится к микроскопии и цифровой обработке изображений, может быть использовано при лабораторных исследованиях в области биологии и медицины для определения функционального состояния клеток и органелл, определения диагноза на клеточном уровне. Изобретение может быть использовано для получения диагностически значимой информации о клетках и органеллах.
Фазовые микрообъекты, прозрачные для излучения видимого оптического диапазона, широко распространены как в промышленности, так и в биологии и медицине. К ним относятся различные полимерные пленки, кристаллы, оптические микродетали, оптоволоконные изделия и, наконец, биологические микрообъекты - клетки и др. Эти объекты описываются трехмерным (3D) пространственным распределением показателя преломления n (x, y, z), с которым связаны плотность, температура, концентрация и другие физические параметры объекта (Вест Ч. Голографическая интерферометрия. - М.: Мир, 1982, 504 с.).
При изучении фазовых объектов сразу возникает задача их визуализации. На сегодняшний день она решена. Широко известны следующие методы: фазовый контраст (метод Цернике), интерференционный контраст, дифференциально-интерференционный контраст (метод Номарского, DIC), метод темного поля, поляризационный контраст и пр. (Скворцов Г.Е., Панов В.A., Поляков Н.И., Федин Л.А. Микроскопы. - Л.: Машиностроение, 1969, 512 с.). Однако в настоящее время при исследовании фазовых микрообъектов требуется не только наблюдать и оценивать различные геометрические параметры (площадь, периметр), но и проводить измерения их локальных и интегральных характеристик.
Исходным измеряемым параметром фазового объекта является оптическая разность хода (ОРХ). Это интегральная характеристика, так как ОРХ представляет собой интеграл от функции распределения показателя преломления вдоль луча или одномерную (1D) луч-сумму. Двумерное (2D) распределение ОРХ, полученное вдоль набора параллельных лучей, является параллельной 2D - проекцией, а вдоль набора лучей, пересекающихся в одной точке - конической 2D - проекцией. Будем далее называть 2D распределение ОРХ фазовым изображением. По набору значений ОРХ, измеренных при различных углах зондирования, можно реконструировать 3D - пространственное распределение показателя преломления n (x, y, z) - локальный по пространству параметр фазового объекта. Из ОРХ и 3D - распределения n (x, y, z) могут быть вычислены различные производные характеристики, от этих величин:
- плотность (Вест Ч. Голографическая интерферометрия. - М.: Мир, 1982, 504 с.);
- концентрация (Вест Ч. Голографическая интерферометрия. - М.: Мир, 1982, 504 с.);
- морфометрические характеристики, например объем, средний радиус, площадь клетки и т.п. (Метелин В.Б., Минаев В.Л., Валов А.Л., Конрадов А.А., Василенко И.А., Бабакова С.В. Компьютерная фазово-интерференционная микроскопия в биологии и медицине // Сборник научных трудов. - г. Красноярск, 2003);
- масса сухих веществ биологической клетки (Левин Г.Г., Ковалев А.А., Минаев В.Л., Сухоруков К.А. Оценка точности измерения сухой массы клетки на автоматизированном интерференционном микроскопе // Измерительная техника. - 2004. - С. 62-67) (в (Dunn G.A. Transmitted-light interference microscopy: a technique born before its time // Proceedings of the Royal Microscopical Society. - 1998. - 33. - P. 189-196) показана связь между оптической разностью хода света, прошедшего через клетку, и массой ее сухого вещества, а в (Barer R. Determination of dry mass, thickness, solid and water concentration in livinq cells // Nature. - 1953. -172. - P. 1097-1098 и Barer R., Joseph S. Refractometry of living cells. I. Basic principles // Quart. J. Microscop. Sci.. 1954 - 95. - P. 399-423) - возможность ее измерения с помощью интерференционного микроскопа);
- величина двулучепреломления (ДЛП) (традиционно измеряемый поляризационными методами, показатель ДЛП может быть измерен интерференционно-поляризационным методом, который выгодно отличается от аналогичных поляризационных методов отсутствием необходимости измерения толщины исследуемого объекта (Сребницкая Л.К., Вишняков Г.Н., Нейман С.А., Рождественская З.Е., Андреев О.А., Левин Г.Г. Двумерная реконструкция карты двулучепреломления саркомера скелетной мышцы в релаксированном и ригорном состояниях по данным интерференционной микроскопии // Биофизика. - 2001. - Т. 46. - Вып. 3. - С. 518-523)).
Показатель преломления связан с поляризуемостью белковых структур клетки, следовательно, фазовое изображение несет ценную диагностическую информацию о состоянии биологического микрообъекта (Статья «Интерференционные методы измерений интегральных и локальных параметров фазовых микрообъектов», выложенная в разделе «Микроскопия» на официальном сайте «TOMOSCAN» компании «Томо-Скан» в сети Интернет в режиме он-лайн доступа по адресу: http://tomoscan.ru/article.php?ind=9, обнаружено 19.02.2014). Таким образом, способ определения функционального состояния клетки, включающий получение ее изображения методом интерференционной микроскопии, позволяет по корреляции между различными процессами, происходящими в живой клетке, и величиной ОРХ использовать фазовое изображение также для исследования этих динамических процессов. Это послужило основанием для создания способа определения функционального состояния клетки, включающего получение методом интерференционной микроскопии фазового изображения клетки в виде растрового изображения в функции от оптической разности хода, по величине и распределению которой судят о параметрах клетки и ее органеллах (Тычинский В.П. Когерентная фазовая микроскопия внутриклеточных процессов // Успехи физических наук. - 2001. - Т. 171. - №6). Данное решение принято в качестве прототипа.
Поэтому с помощью интерференционного микроскопа можно вести мониторинг состояния как отдельной клетки (Левин Г.Г., Булыгин Ф.В., Вишняков Г.Н. Когерентные осцилляции состояния молекул белка в живых клетках // Цитология. - 2005. - Т. 47. - №4. - С. 348-356), так и целой популяции клеток (Стрелецкая Е.А., Цыба Н.Н., Козинец Г.И., Левин Г.Г., Вишняков Г.Н. Сопоставление интегральных характеристик лимфоцитов здоровых людей и больных хроническим лимфолейкозом // Клиническая лабораторная диагностика. - 2000. - №4. - С. 21-23). Это может быть использовано, например, для диагностики состояния системы крови.
Количественные исследования характеристик фазовых микрообъектов можно проводить только с помощью интерференционных микроскопов (Захарьевский А.Н., Кузнецова А.Ф. Интерференционные биологические микроскопы // Цитология. - 1961. - Т. 3. - №2. - С. 213-224). Только они позволяют измерять ОРХ. Другие способы позволяют лишь визуализировать, либо измерять производную по направлению от ОРХ (DIC). Однако широкому распространению интерференционных микроскопов препятствовало отсутствие автоматизированных методов расшифровки интерферограмм, что тормозило внедрение данных микроскопов в практику лабораторных исследований и рутинных измерений.
Изучение динамических процессов в живых клетках и их органеллах является одним из фундаментальных направлений биологии. Оптические методы фазовой или интерференционной микроскопии благодаря уникальным свойствам фазовых изображений, открывают новые перспективы получения количественной информации о процессах в живых клетках. Методы фазовой или интерференционной микроскопии привлекают особое внимание из-за уникальных свойств фазовых изображений и перспективы получения новой количественной информации о процессах в живых клетках. В этих методах изображения представлены в виде распределения физически значимой величины - оптической разности хода, которая зависит от структуры и свойств объекта. Современные методы фазовой микроскопии неинвазивны, обладают высокой чувствительностью к изменению показателя преломления и параметров структуры объекта.
Поскольку живая клетка является важным объектом многих исследований, то для регистрации происходящих в ней процессов были также разработаны различные методы, в т.ч. трек-диаграмм и кадровой съемки.
Изобретение направлено на достижение технического результата, заключающегося в повышении достоверности измерений за счет получения изображений исследуемого объекта, в которых одновременно содержится информация как о структуре, так и о динамических характеристиках этого объекта.
Указанный технический результат достигается тем, что в способе определения функционального состояния клетки, включающем получение методом интерференционной микроскопии фазового изображения клетки в виде растрового изображения в функции от оптической разности хода, по величине и распределению которой судят о параметрах клетки и ее органеллах, растровое изображение клетки и ее органелл получают в функции от оптической разности хода, представленной как фазовая толщина локального участка клетки или ее органелл, получают построчным последовательным сканированием каждого элемента клетки или ее органелл, попадающего в строку, с последующим переходом в следующую строку, расположенную под строкой, прошедшей сканирование, при этом сканирование каждого последующего элемента клетки и ее органелл осуществляют с контролируемой во времени задержкой после сканирования предыдущего элемента клетки или ее органелл в строке, с регистрацией данных величины локальной оптической разности хода для каждого отсканированного элемента растрового изображения, а о параметрах клетки и ее органелл и о наличии динамических процессов в клетке или ее органеллах судят по разнице величин фазовой толщины в соседних элементах клетки или ее органелл.
Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Изобретение поясняется конкретным примером исполнения, который, однако, не является единственно возможным, но наглядно демонстрирует возможность достижения требуемого технического результата.
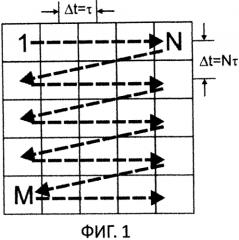
На фиг. 1 - растровый метод сканирования изображения, показана последовательность ввода элементов изображения (топограммы) с размерностью M×N;
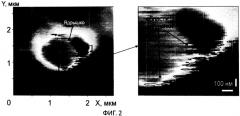
фиг. 2 - регистрация метаболической активности в ядрышках клеток НСТ-116.
До настоящего времени не были известны такие изображения объекта, в которых одновременно содержится информация как о структуре, так и о динамических характеристиках объекта. В заявке представлены результаты разработки растрового метода регистрации динамических процессов (РРДП). Этот метод является дальнейшим развитием метода динамической фазовой микроскопии (ДФМ) и позволяет обнаруживать области динамической активности на фазовых изображениях живых клеток и органелл.
Методы КФМ и ДФМ были разработаны в 1985-90 годах в МИРЭА под руководством профессора Тычинского В.П. Оптическая схема микроскопа «Эйрискан», разработанного на базе интерференционного микроскопа МИИ-4 ЛОМО, является модификацией схемы микроинтерферометра Линника. В нем в качестве источника когерентного излучения используется одномодовый гелий - неоновый лазер с длиной волны =632,8 нм. Для регистрации интерференционного сигнала и его аналого-цифрового преобразования в локальные значения фазы используется координатно-чувствительный фотоприемник - диссектор ЛИ-620 и электронный блок. Управление разверткой диссектора позволяет изменять размер и положение области сканирования. Поле зрения микроскопа могло изменяться в пределах 5-50 мкм. Периодичность выборки и скорость ввода изображения определяется частотой модуляции пьезопреобразователя (1000 Гц).
Согласно изобретению рассматривается новый способ определения функционального состояния клетки, включающий получение методом интерференционной микроскопии фазового изображения клетки в виде растрового изображения в функции от оптической разности хода, по величине и распределению которой судят о параметрах клетки и ее органеллах. В этом способе растровое изображение клетки и ее органелл получают в функции от оптической разности хода, представленной как фазовая толщина локального участка клетки или ее органелл, получают построчным последовательным сканированием каждого элемента клетки или ее органелл, попадающего в строку, с последующим переходом в следующую строку, расположенную под строкой, прошедшей сканирование, при этом сканирование каждого последующего элемента клетки и ее органелл осуществляют с контролируемой во времени задержкой после сканирования предыдущего элемента клетки или ее органелл в строке, с регистрацией данных величины локальной оптической разности хода для каждого отсканированного элемента растрового изображения, а о параметрах клетки и ее органелл и о наличии динамических процессов в клетке или ее органеллах судят по разнице величин фазовой толщины в соседних элементах клетки или ее органелл.
Способ определения функционального состояния клеток и органелл заключается в записи фазового (интерференционного) изображения исследуемого объекта методом сканирования растра, таким образом, чтобы между моментами записи соседних элементов изображения присутствовала временная задержка - Δt.
Динамические процессы, происходящие в живых клетках и органеллах, приводят к изменениям регистрируемой фазовой толщины объекта в соседних пикселях изображения. По величине изменения фазовой высоты Δh в соседних пикселях фазового изображения за время Δt определяется интенсивность динамических процессов объекта, их частота.
Участки изображения, в которых величина Δh выше заданного порога, называются активными областями. Выбор порога определяется уровнем шума прибора и структурой объекта. Диагностика функционального состояния основывается на анализе параметров активных областей: величина Δh, частота ƒ регистрируемых динамических процессов, координаты областей активности и их положение относительно структуры объекта.
На фиг. 1 показан растровый метод сканирования изображения - последовательность ввода элементов изображения (топограммы) с размерностью M×N.
Контролируемые программой параметры сканирования в КФМ "Эйрискан" позволяют реализовать последовательный ввод элементов изображения с различной скоростью по строкам и столбцам. При сканировании растра ввод элементов изображения производится построчно, начиная с первой строки (фиг. 1). При растровом вводе фазового изображения между его соседними элементами появляется временная задержка, которая лежит в основе предлагаемого метода регистрации сигналов (РРДП - Растровая Регистрация Динамических Процессов). Благодаря этой задержке возможно локализовать динамические процессы, период которых соизмерим со временем задержки.
Фазовую высоту в каждой точке изображения (топограммы) можно представить суммой трех слагаемых. Первое Hs (x, y) отображает пространственные статические характеристики структуры объекта, второе - HD (x, y, t) временные изменения (или флуктуации) фазовой высоты объекта, связанные с динамическими процессами, третье - S(t) шумовая компонента с гауссовым распределением:
где x, y - пространственные координаты, t - момент времени записи элемента топограммы с координатами (x, y).
Разделение статической и динамической компонент фазового изображения осуществляется методом Растровой Регистрации Динамических Процессов (РРДП). В основе метода РРДП лежат следующие предположения:
- функция Hs (x, y) является «гладкой», ее приращение ∂ H S ∂ y Δ y (Δy - размер пикселя) по столбцам медленно изменяется по сравнению с ∂ H d ∂ l Δ T и не испытывает скачков:
- функция HD (x, y, t) быстроменяющаяся по сравнению с Hs (x, y),
- временные изменения фазовой высоты с характерными периодами порядка Т=1/(2Nфр) будут оказывать преобладающий вклад в приращение ΔH(Δt) на участке Δy=y(i)-y(i-l):
- динамическая компонента может быть обнаружена, если ее амплитуда выше уровня шума:
Для разделения вкладов динамической и статической компонент фазового изображения был выбран метод цифровой фильтрации столбцов фазового изображения. В методе РРДП столбцы фазового изображения рассматриваются как временные ряды с периодом дискретизации.
структура объекта Нs(x, y) представляет собой низкочастотный сигнал, динамические процессы Hd(x, y, t), зарегистрированные в процессе записи топограммы - высокочастотная компонента. Обе компоненты могут быть разделены путем использования фильтра с частотой среза ƒ0. Выбор частоты среза ƒ0 должен обеспечивать подавление компоненты Hs (i, j), ƒ0 зависит от минимального пространственного периода Δ структуры объекта. Связь между ƒ0 и Δ выглядит следующим образом:
где L [мкм] - размер поля зрения микроскопа, N - количество элементов строки топограммы, M - количество строк топограммы, τp - время записи пикселя. В результате применения цифровой фильтрации к столбцам фазового изображения получается массив элементов:
Значение элементов D (x, y) зависит от динамических процессов объекта с частотой выше ƒ0 и шума прибора S(t). Полученные методом РРДП изображения D (x, y) (7) мы будем в дальнейшем обозначать термином растровое дифференциальное изображение (РДИ). Использование РДИ позволяет получить набор новых количественных параметров для описания состояния динамического объекта:
- амплитуда и координаты активных пикселей топограммы,
- площадь активных пикселей (АП) объекта.
Для анализа распределения динамических процессов относительно морфологии объекта, функция РДИ изображается в виде контурных линий на исходном фазовом изображении.
Живая клетка и ее органеллы представляют собой динамическую систему, оптические параметры которой изменяются во времени. Изучение динамических процессов в живых клетках является актуальной задачей для исследования механизмов межклеточных взаимодействий, экспресс диагностики физиологического состояния на клеточном уровне, клеточного метаболизма. Изменение оптических параметров клетки, вызванное ее метаболизмом, носит локальный характер, его затруднительно зарегистрировать методом ДФМ при отсутствии априорной информации о локализации динамических процессов на клетке. Растровый метод регистрации динамических процессов (РРДП) позволяет обнаружить и локализовать области метаболической активности клеток и органелл. В ходе апробации метод был применен к различным биологическим объектам: клеткам Т-лимфоцитов, клеткам крови - эритроцитам, раковым клеткам НСТ-116, митохондриям.
Из учебников по иммунологии известно, что основные функции T лимфоцитов состоят в создании «сигналов» об опасности в ответ на появление в крови чужеродных белков, токсинов и др. В результате последовательности сложных процессов распознавания внешними рецепторами, передачи команд через определенное время начинается синтез "сигнальных" макромолекул (цитокинов). В современной биологии клетки их регистрация осуществляется сложными и трудоемкими биохимическими методами. Из-за малых размеров макромолекулы "сигналов" не могут наблюдаться традиционными оптическими средствами. Процессы выброса цитокинов в некоторых случаях могут быть зарегистрированы методом РРДП. Приведенные ниже результаты являются, по нашему мнению, иллюстрацией возможности регистрации таких «сигналов» в активированных Т-лимфоцитах.
Результаты обработки методом РРДП фазовых изображений митохондрий показали наличие в митохондриях локальных динамических процессов. Кроме того, нам было известно влияние ингибиторов на мембранный потенциал митохондрий и его изменения во времени. Под действием ингибиторов мембранный потенциал возрастал, фазовая высота увеличивалась, флуктуации фазовой высоты также увеличивались. В связи с этими результатами, измерения митохондрий имели большое методическое значение. Фильтрация топограмм производилась по у-координате (по столбцам) в полосе 1,8-4 Гц. Сравнение профилей показало увеличение фазовой толщины при АТФ-стимуляции, что подтверждает существование электрооптического эффекта. Максимальная интенсивность (до 23 нм2) наблюдалась на периферии митохондрии, вблизи участков профиля большой крутизны. Приведенные выше результаты согласуются с хорошо известными фактами ингибирования ротеноном I-го комплекса ферментов дыхательной цепи и генерации трансмембранного потенциала при гидролизе АТФ V-м комплексом. Возникновение локальных флуктуации фазовой толщины в митохондрии при АТФ-стимуляции мы объясняем работой ферментов V-го комплекса и появлением мембранного потенциала. Ранее нами было установлено, что связанные с АТФазной активностью характерные частоты флуктуации митохондрий лежат в интервале 1,5-3 Гц. Существенно новым результатом является оценка радиуса корреляции (50-100 нм).
Следующим объектом, для которого был применен метод РРДП, были опухолевые клетки НСТ-116. Синтез пре-рибосом происходит в строго определенной области ядрышек интерфазных клеток на границе с плотным фибриллярным компонентом (ПФК). Согласно косвенным данным и прямым измерениям эти процессы сопровождаются локальными флуктуациями фазовой толщины. Использование метода РРДП позволило получить независимые доказательства локальности флуктуации в окрестности ядрышка и определить его диагностическую ценность. Наиболее часто активные области наблюдались на периферии органелл или вблизи участков повышенной крутизны профиля (фиг. 2). Интенсивность флуктуации достигала 80 нм2 при размерах активной области от 50 до 200 нм. На фиг. 2 показано применение нового метода регистрации динамических процессов внутри нативной клетки на примере регистрации метаболической активности в ядрышках клеток НСТ-116.
Возможность регистрации флуктуации на участках, меньших радиуса Эйри, имеет объяснение в ранних работах лаборатории Когерентная фазовая микроскопия и была обозначена как сверхразрешение в динамических фазовых изображениях. Размеры ядрышка и связанная с синтезом пре-рибосом интенсивность флуктуации являются диагностически значимыми параметрами для характеристики функционального состояния клетки.
Важное значение имеет определение понятия пространственного разрешения метода РРДП и ограничений, связанных с регистрацией размеров активных областей. Задача состоит в определении минимально возможного размера области активности. Условие обнаружения активных пикселей состоит в том, что приращение фазовой высоты h при переходе от одного пикселя к соседнему должно быть выше уровня шума. При этом между пикселями растрового изображения всегда существует временная задержка t, которая зависит от их взаимного расположения. Таким образом, если за время t между элементами изображения фазовая высота изменилась на величину h выше заданного порога П, то размер области активности будет равен расстоянию между пикселями. Из этого следует, что размер области активности может определяться площадью одного пикселя изображения при условии превышения амплитуды изменения ФВ h над уровнем шума.
Применение метода РРДП для обработки «статических» фазовых изображений позволяет получить количественные, физически значимые параметры о динамических процессах объекта, такие как распределение интенсивности флуктуации на топограмме объекта I (x, y) и площадь S активных областей.
Таким образом, способ определения функционального состояния клетки основан на получении растрового изображения клетки или ее органелл методом интерференционной микроскопии путем последовательного, с контролируемой во времени задержкой, ввода его элементов (пикселей) (изображения) со значениями локальной оптической разности хода (ОРХ), а для характеристики состояния клетки используют изменение значений оптической разности хода в элементах изображения: определяют характерные частоты, радиус корреляции временных изменений объекта. При этом для определения функционального состояния клетки в его изображении выделяют области с локальными временными изменениями ОРХ и в этих областях вычисляют параметры изменения ОРХ, а ОРХ в каждом элементе изображения (пикселе) определяют компенсационным методом.
Важным в новом способе определения функционального состояния клеток и органелл при записи фазового (интерференционного) изображения исследуемого объекта методом сканирования растра является условие, чтобы между моментами записи соседних элементов изображения присутствовала временная задержка - Δt. Динамические процессы, происходящие в живых клетках и органеллах, приводят к изменениям регистрируемой фазовой толщины объекта в соседних пикселях изображения. По величине изменения фазовой высоты Δh в соседних пикселях фазового изображения за время Δt определяется интенсивность динамических процессов объекта, их частота. Участки изображения, в которых величина Δh выше заданного порога, называются активными областями. Выбор порога определяется уровнем шума прибора и структурой объекта. Диагностика функционального состояния основывается на анализе параметров активных областей: величина Δh, частота f регистрируемых динамических процессов, координаты областей активности и их положение относительно структуры объекта.
Живая клетка и ее органеллы представляют собой динамическую систему, оптические параметры которой изменяются во времени. Изучение динамических процессов в живых клетках является актуальной задачей для исследования механизмов межклеточных взаимодействий (cell signaling), экспресс диагностики физиологического состояния на клеточном уровне, клеточного метаболизма. Изменение оптических параметров клетки, вызванное ее метаболизмом, носит локальный характер, его затруднительно зарегистрировать методом ДФМ при отсутствии априорной информации о локализации динамических процессов на клетке. Растровый способ регистрации динамических процессов (РРДП) позволяет обнаружить и локализовать области метаболической активности клеток и органелл.
Полученные результаты позволяют использовать предложенный способ в лабораторных исследованиях живых клеток и их органелл. Способ может быть использован для биоскрининга лекарственных препаратов, исследования временных процессов в живых клетках и органеллах. Изобретение может быть использовано для получения диагностически значимой информации о клетках и органеллах.
Способ определения функционального состояния клетки, включающий получение методом интерференционной микроскопии фазового изображения клетки в виде растрового изображения в функции от оптической разности хода, по величине и распределению которой судят о параметрах клетки и ее органеллах, отличающийся тем, что растровое изображение клетки и ее органелл получают в функции от оптической разности хода, представленной как фазовая толщина локального участка клетки или ее органелл, получают построчным последовательным сканированием каждого элемента клетки или ее органелл, попадающего в строку, с последующим переходом в следующую строку, расположенную под строкой, прошедшей сканирование, при этом сканирование каждого последующего элемента клетки и ее органелл осуществляют с контролируемой во времени задержкой после сканирования предыдущего элемента клетки или ее органелл в строке, с регистрацией данных величины локальной оптической разности хода для каждого отсканированного элемента растрового изображения, а о параметрах клетки и ее органелл и о наличии динамических процессов в клетке или ее органеллах судят по разнице величин фазовой толщины в соседних элементах клетки или ее органелл.