Ферментная заместительная терапия с увеличением дозы для лечения недостаточности кислой сфингомиелиназы
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для лечения субъектов-людей, имеющих недостаточность кислой сфингомиелиназы. Лечение осуществляют с введения начальной низкой нетоксичной дозы кислой сфингомиелиназы (ASM). Затем последовательно вводят более высокие дозы ASM. Выполняют мониторинг в отношении одного или нескольких нежелательных побочных эффектов после каждой последующей дозы, на которые указывают повышенные концентрация общего билирубина, концентрация церамида в плазме, концентрация С-реактивного белка (CRP) в плазме или связанное нежелательное явление. Затем применяют поддерживающую схему, включающую введение дозы ASM, равной или меньшей, чем самая высокая доза, переносимая субъектом, в качестве поддерживающей дозы субъекту. В другом воплощении изобретения лечение включает введение кислой сфингомиелиназы (ASM) по схеме с увеличением дозы в следующих последовательных дозах: 0,1 мг/кг, 0,3 мг/кг и 0,6 мг/кг. Использование группы изобретений обеспечивает безопасное введение высоких доз фермента ASM, что сопровождается меньшими побочными эффектами. 2 н. и 33 з.п. ф-лы, 15 ил., 9 табл., 4 пр.
Реферат
Данная заявка заявляет приоритет по Предварительной патентной заявке США под номером 61/238113, поданной 28 августа 2009 года, которая включена в данный документ ссылкой во всей своей полноте.
1. ВВЕДЕНИЕ
Данное изобретение относится к ферментной заместительной терапии с увеличением дозы с помощью кислой сфингомиелиназы (ASM) для лечения субъектов-людей, имеющих недостаточность кислой сфингомиелиназы (ASMD), и, в частности, не неврологические проявления болезни Ниманна-Пика (NPD), и в определенных вариантах осуществления NPD типа B.
2. ПРЕДПОСЫЛКИ
Кислая сфингомиелиназа, E.C. 3.1.4.12, (ASM) представляет собой фермент - лизосомальную фосфодиэстеразу, которая гидролизует сфингомиелин, фосфолипидное запасное вещество, обнаруживаемое в мозге, печени, легких, селезенке и лимфатических узлах, на церамид и фосфорилхолин. Недостаточности в активности ASM приводят к неспособности организма разрушать сфингомиелин, вызывая образование лизосомальной болезни накопления, имеющей название болезнь Ниманна-Пика.
Болезнь Ниманна-Пика является врожденным аутосомным рецессивным нарушением накопления липидов, которое характеризуется чрезмерным накоплением сфингомиелина в лизосомах клеток, таких как макрофаги и нейроны, что нарушает нормальную клеточную функцию. Тип A болезни Ниманна-Пика представляет собой быстро прогрессирующее нейродегенеративное заболевание у новорожденных и обычно приводит к смерти в возрасте двух-трех лет. Тип B болезни Ниманна-Пика приводит к увеличению печени и селезенки и дыхательной недостаточности со смертельным исходом, который имеет место, как правило, в юности. Эти две формы болезни Ниманна-Пика, обе из которых связаны с недостаточностями ASM, в данном документе называются обобщенно болезнь Ниманна-Пика, или недостаточность ASM (ASMD). Другие типы болезни Ниманна-Пика, например тип C, не вовлекают мутации в гене ASM и не вносят напрямую вклад в функцию ASM. Природа биохимических и молекулярных дефектов, которые лежат в основе значительной клинической гетерогенности подтипов A и B, остается неизвестной. Хотя пациенты с обоими подтипами имеют остаточную активность ASM (приблизительно 1-10% от нормальной), биохимический анализ не может достоверно отличить два фенотипа. Более того, течение болезни NPD типа B является высоко вариабельным, и в настоящее время невозможно сопоставить тяжесть заболевания с уровнем остаточной активности ASM.
NPD чаще возникает среди особей ашкеназо-еврейского происхождения, чем в общей популяции. Как оценивается, частота возникновения заболевания типа A среди евреев ашкенази составляет приблизительно 1 на 40000, частота гена (q) приблизительно 1 на 200 и частота гетерозиготных носителей (2 pq) 1 на 100 (Goodman, 1979, в Genetic Disorders Among The Jewish People, John Hopkins Univ. Press, Baltimore, pp. 96-100). Частота возникновения гетерозиготного носителя типа B NPD в популяции евреев ашкенази является менее распространенной (Goodman, ранее). Объединенная частота гетерозиготных носителей для типов A и B NPD, как оценили, составляет приблизительно 1 на 70 среди особей ашкеназо-еврейского происхождения. Хотя ферментная диагностика пациентов, страдающих либо типом A, либо B NPD, может быть достоверно проведена (Spence and Callahan, ранее), определение ферментов у облигатных гетерозигот имеет доказанную проблематичность, особенно с применением лейкоцитов в качестве источника фермента. Вероятно, возникновение нейтральных сфингомиелиназ в нескольких источниках и (или) присутствие остаточной активности ASM, возникающей как результат мутантного аллеля, внесли вклад в неспособность достоверно различать носителей для любого подтипа заболевания. Даже применение культивированных фибробластов кожи, которые не экспрессируют нейтральную сфингомиелиназу, не давало однозначных результатов с гетерозиготами. В эпидемиологических исследованиях, проведенных в отдельных странах, объединенная частота возникновения болезни Ниманна-Пика A и B в некоторых странах в мире, как оценивается, находится в диапазоне от 1 на 167000 до 1 на 250000 новорожденных (Miekle et al., 1999 JAMA 281(3):249-254; Poorthuis et al., 1999 Hum Genet 105:151-156; Pinto et al., 2004 Euro. J. Hum. Gene. 12:87-92). Соотношение гетерозиготных носителей, как полагают, находится в диапазоне от 1 на 200 до 1 на 250 особей.
Ферментную заместительную терапию применяли для других лизосомальных болезней накопления. Ферментная заместительная терапия делает попытку восполнить недостаточную ферментативную активность с помощью экзогенно поставляемого фермента. В случае ферментной заместительной терапии для болезни Ниманна-Пика целью будет дать возможность пораженной особи обрабатывать сфингомиелин и избегать его накопления внутри лизосом. Чтобы быть эффективной, такая терапия изначально будет нуждаться в существенно большом количестве заместительного фермента для разрушения накопленного сфингомиелина, а также в непрерывном введении заместительного фермента во избежание дальнейшего накопления сфингомиелина.
3. КРАТКОЕ ОПИСАНИЕ
Данное изобретение относится к ферментной заместительной терапии с увеличением дозы для лечения субъектов-людей, имеющих ASMD - в частности, субъектов, имеющих не неврологические проявления NPD и, в конкретных вариантах осуществления, NPD типа B. Более конкретно, фермент, ASM, вводят таким пациентам в начальной низкой, нетоксичной дозе, которую затем увеличивают в последующих введениях. Самую высокую дозу ASM, которая переносится пациентом, затем можно использовать в качестве поддерживающей дозы. Альтернативно, в качестве поддерживающей дозы можно применять терапевтически эффективную дозу, которая меньше самой высокой переносимой дозы.
Данное изобретение основано, частично, на открытии, что дозы ASM, которые будут необходимы для устранения накопленного сфингомиелинового субстрата у субъектов-людей, т.е. пациентов с ASMD или пациентов с Ниманна-Пика, приводят к токсичным побочным эффектам (включая клинические признаки токсичности). Это особенно неожиданно у пациентов с менее тяжелой формой ASMD, NPD типа B, у которых есть недостаточность, но по крайней мере некоторая ферментная активность.
Более конкретно, лечение NPD будет требовать доз, достаточно высоких для достижения достаточного распределения фермента ASM в органах патологии (например, в частности, в печени, селезенке, легких, сердце, почке и мозге). Исследования в модели на мышах, нокаутных по ASM (ASKMO-мыши), показали, что основная часть введенной рекомбинантной ASM человека (rhASM) распределяется в печени и селезенке, где она уменьшает субстрат, но намного в меньшей степени в легком, сердце и мозге (Miranda et al. FASEB 2000, 14:1988; смотрите также фиг.9B He et al., 1999, Biochimica et Biophsyica Acta 1432: 251-264). В последующих исследованиях с помощью более высоких доз rhASM в ASMKO-мышиной модели субстрат уменьшался, и токсичность не наблюдалась при дозах ≤3,0 мг/кг; фактически, клинические симптомы токсичности не наблюдались вплоть до применения доз ≥10 мг/кг. Смотрите Dose Responsive Toxicological Findings Following Intravenous Administration of Recombinant Human Acid Sphingomyelinase (rhASM) to Acid Sphingomyelinase Knock-out (ASMKO) Mice. C. Nickerson, J. Murray, A. Vitsky, M. Hawes, S. Ryan, P. Ewing, B. Thurberg, L. Andrews. Dept Pharm/Tox, Pathology, Genzyme Corp., Framingham, MA., American Society of Human Genetics 2005; и Elevations of Pro-Inflammatory Cytokines and Decreases in Cardiovascular Hemodynamics Following Intravenous Administration of Recombinant Human Acid Sphingomyelinase (rhASM) to Acid Sphingomyelinase Knock-out (ASMKO) Mice. J. Murray, A.M. D'Angona, C. Nickerson, A. Vitsky, M. Hawes, S. Ryan, P. Ewing, B. Thurberg, L. Andrews. Dept. Pharmacology/Toxicology & Pathology, Genzyme Corp., Framingham, MA., Society of Toxicology 2006.
На основании этих данных ASKMO мы лечили субъектов-людей, имеющих не нейронопатическую ASMD, консервативной максимальной дозой 1,0 мг/кг rhASM, как описано в разделе 6, ниже. Достаточно неожиданно токсичность у субъектов-людей, включая появление связанных нежелательных явлений с клиническими симптомами, наблюдали при применении дозы до 0,3 мг/кг! Этот результат был особенно неожиданным, поскольку фермент ASM отсутствует в модели на нокаутных мышах, которая должна отражать более тяжелое состояние, чем у этих субъектов-людей, имеющих по крайней мере некоторую ферментативную активность и относительно легкую форму заболевания.
Не намереваясь быть связанным какой-либо теорией, токсические побочные эффекты, которые возникают при лечении ASM, могут являться результатом разрушения накопленного субстрата сфингомиелина у пациента с ASMD и высвобождения продукта, церамида, который является проапоптическим и вызывает провоспалительный цитокиновый ответ и гипербилирубинемию. Чтобы решить данную проблему, мы разработали режим, который обеспечивает безопасное введение высоких доз фермента ASM, необходимого для достижения достаточного распределения в органах патологии. В соответствии с этой схемой начальное лечение с ASM в очень низких дозах применяют для достижения медленного разрушения накопленного субстрата, которое сопровождается меньшими побочными эффектами. По мере исчерпания субстрата у субъекта (по мере «уменьшения по массе» запасного субстрата) дозу можно безопасно увеличивать.
В соответствии с этим протоколом вначале пациенту с заболеванием NPD вводят низкую нетоксичную дозу фермента ASM и с течением времени дозу увеличивают. По мере повышения дозы фермента ASM пациента можно подвергать мониторингу в отношении общей концентрации билирубина, продуцирования острофазовых агентов, продуцирования медиаторов воспаления и связанных нежелательных явлений. Введение низкой дозы ASM и увеличение дозы облегчает сокращение массы накопленного сфингомиелина. По мере сокращения массы сфингомиелина у пациента можно безопасно вводить более высокие дозы пациенту для обеспечения достаточного распределения фермента ASM в целевых органах (например, в печени, селезенке, легких, сердце, почке, мозге, костном мозге, скелете, суставах и т.д.). В определенных вариантах осуществления максимальную дозу, переносимую пациентом, можно использовать в качестве поддерживающей дозы. В некоторых вариантах осуществления, основываясь на состоянии пациента, поддерживающая доза может быть увеличена или уменьшена с течением времени.
В определенных вариантах осуществления лечение пациента подвергают мониторингу путем измерения уровней сфингомиелина в плазме, уровней церамида в плазме, продуцирования «острофазовых агентов» и медиаторов воспаления, которые являются мерой воспалительных реакций, концентраций билирубина (общей, прямой и непрямой) и (или) других биохимических маркеров для обеспечения стабильного ответа до увеличения дозы до следующего уровня. Эти маркеры включают, но без ограничений, C-реактивный белок (CRP) или CRP высокой чувствительности (hs-CRP), цитокины (например, IL-8, IL-6), кальцитонин и ферритин. В конкретных вариантах осуществления пациента можно подвергать мониторингу в отношении одного или нескольких связанных нежелательных явлений, которые могут включать, но без ограничений, системные симптомы (например, лихорадку, тошноту, рвоту, боль, миалгию) и желтуху.
Дозы менее 1 мг/кг являются предпочтительными для начала лечения. Начальную дозу последовательно увеличивают, пока не достигнут терапевтической дозы. Такое увеличение дозы можно применять для определения самой высокой переносимой дозы. Например, как только у пациента сокращается масса накопленного субстрата сфингомиелиназы, дозу можно далее увеличивать, пока не наблюдается токсичность. Поддерживающую дозу можно соответственно корректировать и можно постоянно и периодически повторно корректировать в зависимости от состояния пациента.
В конкретном варианте осуществления способ лечения субъекта-человека, имеющего недостаточность кислой сфингомиелиназы, включает: (a) схему для сокращения массы накопленного субстрата сфингомиелина у субъекта-человека, включающий: (i) введение начальной низкой нетоксичной дозы ASM субъекту-человеку; (ii) введение последовательно более высоких доз ASM субъекту-человеку и мониторинг субъекта в отношении одного или нескольких неблагоприятных побочных эффектов после каждой последующей дозы, которые определяются повышенным билирубином или связанным нежелательным явлением; и (b) поддерживающую схему, включающую введение дозы, равной или меньшей, чем самая высокая доза, переносимая субъектом, в качестве поддерживающей дозы для субъекта.
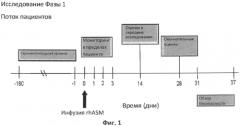
В другом конкретном варианте осуществления способ лечения субъекта-человека, имеющего недостаточность кислой сфингомиелиназы, включает введение rhASM по схеме с увеличением дозы со следующими последовательными дозами: 0,1 мг/кг; 0,3 мг/кг; 0,6 мг/кг; и 1,0 мг/кг, где каждую дозу rhASM вводят по меньшей мере дважды, и каждую дозу вводят с двухнедельными интервалами, и где пациента подвергают мониторингу в отношении токсических побочных эффектов перед повышением дозы до следующего уровня.
В другом конкретном варианте осуществления, описанном в данном документе, представлена кислая сфингомиелиназа (ASM) для применения в лечении недостаточности кислой сфингомиелиназы у субъекта-человека, подготовленная для введения: (a) в схеме для сокращения массы накопленного субстрата сфингомиелина, включающей: (i) введение начальной низкой нетоксичной дозы кислой сфингомиелиназы (ASM); (ii) введение последовательно более высоких доз ASM, и мониторинг субъекта в отношении одного или нескольких нежелательных побочных эффектов после каждой последующей дозы, которые определяют по повышенному билирубину или связанному нежелательному явлению; и (b) в поддерживающей схеме, включающей введение дозы, равной или меньшей, чем самая высокая доза, переносимая субъектом, в качестве поддерживающей дозы для субъекта.
В другом конкретном варианте осуществления, описанном в данном документе, представлена рекомбинантная ASM человека для применения в лечении недостаточности кислой сфингомиелиназы у субъекта-человека, подготовленная для введения в схеме с увеличением дозы со следующими последовательными дозами: 0,1 мг/кг; 0,3 мг/кг; 0,6 мг/кг; и 1,0 мг/кг, где каждую дозу вводят по меньшей мере дважды, и каждую дозу вводят с двухнедельными интервалами, и где субъекта подвергают мониторингу в отношении токсических побочных эффектов перед повышением дозы до следующего уровня.
3.1. ТЕРМИНОЛОГИЯ
Применяемые в данном документе выражения «приблизительно» и «примерно» применяются взаимозаменяемо в контексте данной величины для обозначения диапазона вокруг данной величины, где полученная величина является, по сути, такой же, как точно перечисленная величина. В конкретном варианте осуществления «приблизительно» означает в пределах 10%, 15%, 25% данной величины или диапазона.
Применяемое в данном документе выражение «пожилой человек» относится к человеку 65 лет или старше.
Применяемое в данном документе выражение «взрослый человек» относится к человеку, которому 18 лет или старше.
Применяемое в данном документе выражение «человек-ребенок» относится к человеку, которому от 1 года до 18 лет.
Применяемое в данном документе выражение «человек-младенец» относится к человеку от новорожденного до возраста 1 года.
Применяемое в данном документе выражение «человек-ребенок ясельного возраста» относится к человеку, которому от 1 года до 3 лет.
Применяемое в данном документе выражение «нежелательное явление» относится к «любому неблагоприятному медицинскому случаю у пациента или субъекта клинического испытания, которому ввели фармацевтический продукт», как определено в стандартной терминологии Clinical Data Interchange Standards Consortium Study Data Tabulation Model v.3.1.1. «Связанное нежелательное явление» представляет собой нежелательное явление, которое имеет причинную взаимосвязь с лечением.
Применяемое в данном документе выражение «поддерживающая доза (дозы)» и т.п. относится к дозировке, вводимой пациентам с ASMD для поддержания желательного терапевтического эффекта. В конкретных вариантах осуществления поддерживающая доза (дозы) поддерживает один, два, три, четыре или более из следующих желательных терапевтических эффектов: (i) снижение объема селезенки, что оценивается с помощью техник, известных в данном уровне техники, например МРТ (магнитно-резонансная терапия); (ii) снижение уровней сфингомиелина печени, что оценивается с помощью техник, известных в данном уровне техники, например биохимического анализа и (или) гистоморфометрического анализа образцов печени; (iii) увеличение способности переносить физическую нагрузку, что оценивается с помощью техник, известных в данном уровне техники, например максимальная рабочая нагрузка с помощью велоэргометрии, включая относительную расчетную максимальную рабочую нагрузку, пиковое потребление кислорода и продуцирование диоксида углерода; (iv) увеличение легочной функции, что оценивается с помощью техник, известных в данном уровне техники, например техник, описанных в American Thoracic Society, 1991, Am. Rev. Respir. Dis. 144: 1202-1218, такой как диффузионная емкость легких (DLCO), относительная расчетная форсированная жизненная емкость легких (FVC), которая измеряется с помощью, например, спирометрических техник, объем форсированного выдоха за 1 секунду (FEV1), который измеряется с помощью, например, спирометрических техник, и общая емкость легких; (v) уменьшение сфингомиелина бронхоальвеолярного лаважа (BAL); (vi) уменьшение объема печени, которое оценивается с помощью техник, известных в данном уровне техники, например МРТ: (vii) улучшение внешнего вида легкого, которое оценивается с помощью техник, известных в данном уровне техники, например изображения компьютерной томографии с высоким разрешением (CT) или рентгенографии грудной клетки; (viii) уменьшение концентрации сфингомиелина в печени, коже, плазме и сухой капле крови (DBS), которое измеряется с помощью, например, тандемной масс-спектрометрии; (ix) снижение или ослабление тяжести ASMD и (или) симптома, связанного с ней; (x) снижение длительности симптома, связанного с ASMD; (xi) профилактика рецидива симптома, связанного с ASMD; (xii) снижение частоты госпитализации субъекта; (vi) снижение длительности госпитализации; (xiii) увеличение выживания субъекта; (xiv) снижение смертности; (xv) уменьшение частоты госпитализации; (xvi) снижение числа симптомов, связанных с ASMD; (xvii) увеличение бессимптомного выживания пациентов с ASMD; (xviii) улучшение неврологической функции (например, психомоторной функции, социальной ответственности и т.д.); (xix) улучшение очищения легких, которое измеряется с помощью, например, количества клеток и профиля BAL; (xx) уменьшение уровней хитотриозидазы в сыворотке; (xxi) уменьшение уровней хемокина (c-c) motif ligand 18 (CCL18) в сыворотке; (xxii) улучшение липидного профиля (например, HDL [липопротеины высокой плотности, или ЛВП], LDL [липопротеины низкой плотности, или ЛНП], холестерина, триглицеридов и соотношения общий холестерин:HDL); и (xxiii) улучшенное качество жизни, которое оценивается с помощью, например, опросника. В определенных вариантах осуществления поддерживающая доза представляет собой самую высокую или максимальную дозу, переносимую пациентом.
В некоторых вариантах осуществления поддерживающая доза представляет собой дозу от 0,5 мг/кг до 1,5 мг/кг, от 0,75 мг/кг до 1,25 мг/кг, от 1 мг/кг до 2,5 мг/кг, от 1 мг/кг до 2,75 мг/кг, от 1,5 мг/кг до 2,5 мг/кг, от 1,5 мг/кг до 2,75 мг/кг, от 2 мг/кг до 2,5 мг/кг, от 2 мг/кг до 2,75 мг/кг, от 2,5 мг/кг до 2,75 мг/кг, от 2,5 мг/кг до 3 мг/кг, от 3 мг/кг до 4 мг/кг, от 3 мг/кг до 5 мг/кг, от 4 мг/кг до 5 мг/кг, от 2 мг/кг до 5 мг/кг или от 5 мг/кг до 10 мг/кг ASM. В определенных вариантах осуществления поддерживающая доза представляет собой дозу от 5 мг/кг до 15 мг/кг, от 10 мг/кг до 15 мг/кг, от 10 мг/кг до 20 мг/кг, от 15 мг/кг до 20 мг/кг, от 20 мг/кг до 30 мг/кг, от 25 мг/кг до 50 мг/кг, от 30 мг/кг до 40 мг/кг, от 30 мг/кг до 45 мг/кг или от 40 мг/кг до 50 мг/кг ASM. В некоторых вариантах осуществления поддерживающая доза составляет 0,75 мг/кг, 0,80 мг/кг, 0,85 мг/кг, 0,90 мг/кг, 0,95 мг/кг, 1 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,25 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,75 мг/кг или 2 мг/кг ASM. В определенных вариантах осуществления поддерживающая доза составляет 2,5 мг/кг, 2,75 мг/кг, 3 мг/кг, 3,25 мг/кг, 3,5 мг/кг, 3,75 мг/кг, 4 мг/кг, 4,25 мг/кг, 4,5 мг/кг, 4,75 мг/кг, 5 мг/кг, 5,5 мг/кг, 6 мг/кг, 6,5 мг/кг, 7 мг/кг, 7,5 мг/кг, 8 мг/кг, 8,5 мг/кг, 9 мг/кг, 9,5 мг/кг или 10 мг/кг ASM. В некоторых вариантах осуществления поддерживающая доза составляет 11 мг/кг, 12 мг/кг,13 мг/кг, 14 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 45 мг/кг или 50 мг/кг ASM. В некоторых вариантах осуществления поддерживающая доза составляет по меньшей мере 1 мг/кг, по меньшей мере 2 мг/кг, по меньшей мере 3 мг/кг, по меньшей мере 4 мг/кг, по меньшей мере 5 мг/кг, по меньшей мере 6 мг/кг, по меньшей мере 7 мг/кг, по меньшей мере 8 мг/кг ASM, при этом самая высокая доза составляет 10 мг/кг ASM. В определенных вариантах осуществления поддерживающая доза составляет по меньшей мере 10 мг/кг, по меньшей мере 15 мг/кг, по меньшей мере 20 мг/кг, по меньшей мере 25 мг/кг, по меньшей мере 30 мг/кг или по меньшей мере 35 мг/кг ASM, при этом самая высокая доза составляет 50 мг/кг.
Применяемое в данном документе выражение «нетоксичная доза (дозы)» и т.п. относится к дозировке, вводимой пациентам с ASMD, не приводя к одному, двум, трем или всем из следующего: (i) умеренное или тяжелое связанное нежелательное явление, которое определяется по клиническому симптому, который препятствует нормальному ежедневному функционированию и требует дополнительного мониторинга, вмешательства или лечения, или, патологическому лабораторному значению или процедурному результату клинической задачи, которая требует дальнейшего отслеживания, лечения или исследования. Смотрите, например, стандартную терминологию Clinical Data Interchange Standards Consortium Study Data Tabulation Model v.3.1.1; (ii) величина общего билирубина составляет больше 1,5 мг/дл, 1,75 мг/дл, 2,0 мг/дл, 2,1 мг/дл, 2,2 мг/дл, 2,3 мг/дл, 2,4 мг/дл, 2,5 мг/дл, 2,6 мг/дл, 2,7 мг/дл, 2,75 мг/дл, 2,8 мг/дл, 2,9 мг/дл, 3,0 мг/дл, 3,1 мг/дл, 3,2 мг/дл, 3,3 мг/дл, 3,4 мг/дл, 3,5 мг/дл, 3,6 мг/дл, 3,7 мг/дл, 3,8 мг/дл, 3,9 мг/дл или 4 мг/дл или в диапазоне от 2,1 мг/дл до 2,5 мг/дл, от 2,1 мг/дл до 3,0 мг/дл или от 2,1 мг/дл до 4 мг/дл, которая сохраняется в течение более 18 часов, 24 часов, 36 часов, 48 часов или 72 часов, 5 дней, одной недели, двух недель или трех недель после введения дозы ASM; (iii) концентрация церамида в плазме больше 8,2 мкг/дл, 8,3 мкг/дл, 8,4 мкг/дл, 8,5 мкг/дл, 8,75 мкг/дл, 9 мкг/дл, 9,5 мкг/дл, 10 мкг/дл, 11 мкг/дл, 12 мкг/дл, 13 мкг/дл, 14 мкг/дл, 15 мкг/дл, 16 мкг/дл, 17 мкг/дл, 18 мкг/дл, 19 мкг/дл, 20 мкг/дл, 25 мкг/дл, 30 мкг/дл, 35 мкг/дл, 40 мкг/дл, 45 мкг/дл, 50 мкг/дл, 55 мкг/дл, 60 мкг/дл, 65 мкг/дл, 70 мкг/дл, 75 мкг/дл или 80 мкг/дл или в диапазоне от 8,2 мкг/дл до 10 мкг/дл, от 8,5 мкг/дл до 10 мкг/дл, от 9 мкг/дл до 12 мкг/дл, от 10 мкг/дл до 12 мкг/дл, от 10 мкг/дл до 15 мкг/дл, от 10 мкг/дл до 20 мкг/дл, от 15 мкг/дл до 20 мкг/дл или от 20 мкг/дл до 30 мкг/дл через 6 часов, 8 часов, 10 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM; или (iv) острофазовый ответ/реакция. «Нетоксичная доза» ASM может изменяться в зависимости, например, от стабильности применяемого фермента, активности применяемого фермента и (или) пути введения фермента. Например, доза модифицированного фермента ASM с увеличенной активностью может быть ниже дозировки немодифицированной ASM. Специалист в данной области будет способен скорректировать дозу вводимого фермента на основании стабильности фермента, активности фермента и (или) пути введения фермента.
Острофазовая реакция представляет собой раннюю реакцию (как правило, например, в пределах 12-72 часа) после введения ASM, которая является характерной для воспалительного ответа. Острофазовый ответ можно оценить путем изменения концентрации острофазового агента (такого как, например, CRP/hs-CRP, ферритин, фибриноген, железо или трансферрин), изменения процентного соотношения нейтрофилов, изменения протромбинового времени или изменения частичного тромбопластинового времени. В конкретном варианте осуществления увеличение концентрации CRP/hs-CRP через 6 часов, 8 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации CRP/hs-CRP у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрация CRP/hs-CRP в плазме, которая больше нормальной концентрации CRP/hs-CRP в плазме через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, может быть использована в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию CRP/hs-CRP в плазме больше чем примерно 8,1 мг/л, 8,2 мг/л, 8,3 мг/л, 8,4 мг/л, 8,5 мг/л, 9 мг/л, 9,5 мг/л, 10 мг/л, 11 мг/л или 12 мг/л или в диапазоне от 8,5 мг/л до 10 мг/л, или от 8,5 мг/дл до 12 мг/л, или от 10 мг/л до 12 мг/л через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM можно применять в качестве измерения острофазового ответа.
В конкретном варианте осуществления увеличение в концентрации ферритина через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации ферритина у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрацию ферритина в плазме, которая больше нормальной концентрации ферритина в плазме через 6 часов, 8 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно применять в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию ферритина в плазме больше чем примерно 300 нг/мл, 325 нг/мл, 350 нг/мл, 375 нг/мл, 400 нг/мл, 425 нг/мл, 450 нг/мл, 475 нг/мл, 500 нг/мл, 525 нг/мл, 550 нг/мл, 575 нг/мл, 600 нг/мл, 625 нг/мл, 650 нг/мл, 675 нг/мл, 700 нг/мл, 725 нг/мл, 750 нг/мл, 775 нг/мл, 800 нг/мл, 850 нг/мл, 900 нг/мл, 950 нг/мл, 1000 нг/мл, 1050 нг/мл, 1100 нг/мл, 1150 нг/мл или 1200 нг/мл или в диапазоне от 600 нг/мл до 800 нг/мл, от 650 нг/мл до 850 нг/мл, от 600 нг/мл до 1000 нг/мл, от 600 нг/мл до 1200 нг/мл, от 800 нг/мл до 1000 нг/мл, от 900 нг/мл до 1000 нг/мл или от 1000 нг/мл до 1200 нг/мл через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM можно применять в качестве измерения острофазового ответа.
В конкретном варианте осуществления увеличение в концентрации IL-8 в плазме или сыворотке через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации IL-8 у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрацию IL-8 в плазме или сыворотке, которая больше чем нормальной концентрации IL-8 в плазме через 6 часов, 8 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию IL-8 в плазме больше чем примерно 24 пг/мл, 50 пг/мл, 75 пг/мл, 100 пг/мл, 200 пг/мл, 300 пг/мл, 400 пг/мл, 500 пг/мл, 600 пг/мл, 700 пг/мл, 800 пг/мл или 900 пг/мл через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа.
В конкретном варианте осуществления увеличение концентрации IL-6 в плазме или сыворотке через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации IL-6 у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрацию IL-6 в плазме или сыворотке, которая больше нормальной концентрации IL-6 в плазме или сыворотке через 6 часов, 8 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию IL-6 в плазме больше чем примерно 4,4 пг/мл, 6 пг/мл, 8 пг/мл, 10 пг/мл, 15 пг/мл, 20 пг/мл, 25 пг/мл или 30 пг/мл через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM можно использовать в качестве измерения острофазового ответа.
В конкретном варианте осуществления увеличение концентрации кальцитонина в плазме или сыворотке через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации кальцитонина у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрацию кальцитонина в плазме или сыворотке, которая больше нормальной концентрации кальцитонина в плазме через 6 часов, 8 часов, 12 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию в плазме кальцитонина больше чем примерно 9,4 пг/мл, 20 пг/мл, 30 пг/мл, 40 пг/мл, 50 пг/мл, 75 пг/мл, 100 пг/мл, 150 пг/мл, 200 пг/мл или 250 пг/мл через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа.
В конкретном варианте осуществления увеличение концентрации фибриногена через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, относительно концентрации фибриногена у пациента до введения ASM, можно использовать в качестве измерения острофазового ответа. В другом конкретном варианте осуществления концентрацию фибриногена в плазме, которая больше нормальной концентрации фибриногена в плазме через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа. В определенных вариантах осуществления концентрацию в плазме фибриногена больше чем примерно 350 мг/дл, 375 мг/дл, 400 мг/дл, 425 мг/дл или 450 мг/дл или в диапазоне от 350 мг/дл до 400 мг/дл, от 350 мг/дл до 450 мг/дл или от 400 мг/дл до 450 мг/дл через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM можно использовать в качестве измерения острофазового ответа.
В одном варианте осуществления увеличение относительного содержания нейтрофилов от общего количества лейкоцитов через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM по сравнению с относительным содержанием у пациента нейтрофилов от общего количества лейкоцитов до введения ASM можно использовать в качестве измерения острофазового ответа. В другом варианте осуществления увеличение относительного содержания нейтрофилов от общего количества лейкоцитов, которое больше нормального относительного содержания нейтрофилов от общей концентрации лейкоцитов через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа. В определенных вариантах осуществления увеличение относительного содержания нейтрофилов от общего количества лейкоцитов, которое составляет 70%, 75%, 80%, 85%, 90%, 95% или больше, через 6 часов, 8 часов, 12 часов, 16 часов, 18 часов, 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM, можно использовать в качестве измерения острофазового ответа.
Применяемое в данном документе выражение «низкая, нетоксичная доза (дозы)» и т.п. в контексте начальной дозы или доз, вводимых субъекту, относится к дозировке, которая является первой дозой или дозами ASM, вводимыми субъекту для лечения ASMD, которая является нетоксичной. В определенных вариантах осуществления низкая, нетоксичная доза (дозы) представляет собой дозу от 0,001 мг/кг до 0,01 мг/кг, от 0,001 мг/кг до 0,01 мг/кг, от 0,001 мг/кг до 0,05 мг/кг, от 0,001 мг/кг до 0,1 мг/кг, от 0,001 мг/кг до 0,5 мг/кг, от 0,05 мг/кг до 0,275 мг/кг, от 0,075 мг/кг до 0,275 мг/кг, от 0,05 мг/кг до 0,2 мг/кг, от 0,075 мг/кг до 0,2 мг/кг, от 0,1 мг/кг до 0,275 мг/кг, от 0,1 мг/кг до 0,25 мг/кг, от 0,1 мг/кг до 1 мг/кг, от 0,5 мг/кг до 1 мг/кг, от 0,75 мг/кг до 1 мг/кг, от 0,1 мг/кг до 2 мг/кг, от 0,5 мг/кг до 2 мг/кг, от 0,75 мг/кг до 2 мг/кг, от 1 мг/кг до 2 мг/кг или от 1,25 мг/кг до 2 мг/кг, от 1,5 мг/кг до 2 мг/кг или от 1,75 мг/кг до 2 мг/кг ASM. В некоторых конкретных вариантах осуществления низкая, нетоксичная доза представляет собой дозу 0,001 мг/кг, 0,005 мг/кг, 0,0075 мг/кг, 0,01 мг/кг, 0,0125 мг/кг, 0,025 мг/кг, 0,05 мг/кг, 0,075 мг/кг, 0,1 мг/кг, 0,125 мг/кг, 0,15 мг/кг, 0,175 мг/кг, 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,75 мг/кг, 0,8 мг/кг, 0,9 мг/кг или 1 мг/кг ASM.
Выражения «субъект» и «пациент» применяются в данном документе взаимозаменяемо для обозначения человека. В конкретном варианте осуществления человек диагностируется или был продиагностирован как имеющий ASMD.
Применяемое в данном документе выражение «терапевтически эффективный» в контексте введения дозы ASM субъекту относится к количеству ASM, которое приводит к благоприятному или терапевтическому эффекту. В конкретных вариантах осуществления выражение «терапевтически эффективный» в контексте введения дозы ASM субъекту относится к количеству ASM, которое является достаточным для достижения по меньшей мере одного, двух, трех, четырех или более из следующих эффектов: (i) уменьшение объема селезенки, которое оценивается с помощью техник, известных в данном уровне техники, например МРТ; (ii) снижение уровней сфингомиелина печени, которое оценивается с помощью техник, известных в данном уровне техники, например биохимический анализ и (или) гистоморфометрический анализ образцов печени; (iii) увеличение способности переносить физическую нагрузку, которое оценивается с помощью техник, известных в данном уровне техники, например максимальная рабочая нагрузка с помощью велоэргометрии, включая процентную расчетную максимальную рабочую нагрузку, пиковое потребление кислорода и продуцирование диоксида углерода; (iv) увеличение легочной функции, которое оценивается с помощью техник, известных в данном уровне техники, например, техник, описанных в American Thoracic Society, 1991, Am. Rev. Respir. Dis. 144: 1202-1218, таких как диффузионная емкость легких (DLCO), относительная расчетная форсированная жизненная емкость легких (FVC), которая измеряется с помощью, например, спирометрических техник, объем форсированного выдоха с течение 1 секунды (FEV1), который измеряется с помощью, например, спирометрических техник, и общая емкость легких; (v) уменьшение сфингомиелина бронхоальвеолярного лаважа (BAL); (vi) уменьшение объема печени, которое оценивается с помощью техник, известных в данном уровне техники, например МРТ: (vii) улучшение внешнего вида легкого, которое оценивается с помощью техник, известных в данном уровне техники, например изображения КТ высокого разрешения или рентгенографии грудной клетки; (viii) уменьшение концентрации сфингомиелина в коже, плазме и сухой капле крови (DBS), которое измеряется с помощью, например, тандемной масс-спектрометрии; (ix) снижение или облегчение тяжести ASMD и (или) симптома, связанного с ней; (x) снижение длительности симптома, связанного с ASMD; (xi) профилактика рецидива симптома, связанного с ASMD; (xii) снижение частоты госпитализации субъекта; (vi) снижение длительности госпитализации; (xiii) увеличение выживания субъекта; (xiv) снижение смертности; (xv) уменьшение частоты госпитализации; (xvi) снижение числа симптомов, связанных с ASMD; (xvii) увеличение бессимптомного выживания пациентов с ASMD; (xviii) улучшение неврологической функции (например, психомоторной функции, социальной ответственности и т.д.); (xix) улучшение очищения легких, что измеряется с помощью, например, количества клеток и профиля BAL; (xx) уменьшение уровней хитотриозидазы в сыворотке; (xxi) уменьшение уровней CCL18 в сыворотке; (xxii) улучшение липидного профиля (например, HDL, LDL, холестерина, триглицеридов и соотношения общий холестерин:HDL); и (xxiii) улучшенное качество жизни, которое оценивается с помощью, например, опросника.
Применяемые в данном документе выражения «терапии» и «терапия» могут относиться к любому протоколу (протоколам), способу (способам), композициям, составам и (или) средству (средствам), которые можно применять в лечении, тактике или облегчении ASMD или состояния или симптома, связанного с ней. В определенных вариантах осуществления выражения «терапии» и «терапия» относятся к биологической терапии, вспомогательной терапии и (или) другим терапиям, пригодным в лечении, тактике, профилактике или облегчении ASMD или состояния или симптома, связанного с ней. В вариантах осуществления выражение «терапия» относится к терапии, которая достигает одного, двух или более эффектов из следующих: (i) усиливает доставку ASM к местам патологии, (ii) усиливает активность ASM и (iii) усиливает стабильность ASM. В определенных вариантах осуществления выражение «терапия» относится к терапии, отличной от ASM. В конкретных вариантах осуществления «дополнительная терапия» и «дополнительные тера