Мутеины липокалина слезы, связывающие альфа il-4 r
Иллюстрации
Показать всеГруппа изобретений относится к новым мутеинам, полученным из липокалина слезы человека, которые связываются с альфа-рецептором IL-4. Последовательности этих мутеинов содержат конкретные комбинации аминокислот. В частности, мутированный аминокислотный остаток присутствует по любому одному или более чем одному из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Мутированный аминокислотный остаток также присутствует по любым 2 или более чем 2 из положений 26, 32, 34, 55, 56, 58 и 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Группа изобретений также относится к соответствующей молекуле нуклеиновой кислоты, кодирующей такой мутеин, и способу получения такого мутеина и кодирующей его молекуле нуклеиновой кислоты. Группа изобретений имеет улучшенные связывающие свойства в отношении альфа-рецептора IL-4, в частности более высокую связывающую аффинность, что обуславливает их пригодность в диагностических и терапевтических приложениях. 4 н. и 10 з.п. ф-ы, 5 ил., 3 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет согласно предварительной заявке США 61/61/352,461, поданной в USPTO 8 июня 2010 года, полное содержание которой включено в данное описание посредством ссылки.
Область изобретения
Настоящее изобретение относится к мутеинам липокалина слезы человека, которые связываются с альфа-рецептором IL-4. Изобретение также относится к соответствующим молекулам нуклеиновой кислоты, кодирующим такой мутеин, и к способу их получения. Данное изобретение также относится к способу получения такого мутеина. И наконец, изобретение относится к фармацевтической композиции, которая содержит такой мутеин липокалина, а также к различным применениям этого мутеина.
Предшествующий уровень техники
Белки, которые селективно связываются с выбранными мишенями посредством нековалентного взаимодействия, играют ключевую роль в качестве реагентов в биотехнологии, медицине, биоаналитике, а также в биологических науках и науках о жизни в целом. Антитела, то есть иммуноглобулины, являются известным примером этого класса белков. Несмотря на разнообразные потребности в таких белках в сочетании с распознаванием, связыванием и/или разделением лигандов/мишеней, в настоящее время используются почти исключительно иммуноглобулины. Использование других белков с определенными лиганд-связывающими характеристиками, например пектинов, оставалось ограниченным специальными областями.
Дополнительными белок-подобными связывающими молекулами, которые обладают антитело-подобными функциями, являются члены семейства липокалинов, которые естественным образом развивались для связывания лигандов. Липокалины встречаются во многих организмах, включая позвоночных, насекомых, растения и бактерии. Члены семейства липокалиновых белков (Pervaiz, S., & Brew, К. (1987) FASEB J. 1, 209-214) обычно являются небольшими секретируемыми белками и имеют одну полипетидную цепь. Они характеризуются рядом различных свойств молекулярного распознавания: способностью связываться с различными, преимущественно гидрофобными молекулами (такими как ретиноиды, жирные кислоты, холестерины, простагландины, биливердины, феромоны, тастанты и одоранты), связыванием со специфическими рецепторами клеточной поверхности и образованием макромолекулярных комполексов. Хотя в прошлом они были классифицированы главным образом как транспортные белки, в настоящее время очевидно, что липокалины выполняют разнообразные физиологические функции. Они включают участие в транспорте ретинола, обоняние, передача сигналов феромонов и синтез простагландинов. Липокалины также вовлечены в регулирование иммунного ответа и опосредование клеточного гомеостаза (обзор смотри, например, в Flower, D.R. (1996) Biochem. J. 318, 1-14, и Flower, D.R. et al. (2000) Biochim. Biophys. Acta 1482, 9-24).
Липокалины демонстрируют необычно низкие уровни общей консервативности последовательностей, часто идентичности последовательностей составляют менее 20%. Напротив, их тип укладки является высококонсервативным. Центральная часть структуры липокалина состоит из одной восьминитевой анти-параллельной β-складки, замкнутой саму на себя с образованием непрерывного водород-связанного β-цилиндра. Этот β-цилиндр формирует центральную полость. Один конец цилиндра стерически блокирован N-концевым пептидным сегментом, который идет вдоль его дна, а также тремя пептидными петлями, соединяющими β-нити. Другой конец β-цилиндра открыт для растворителя и охватывает сайт связывания мишени, который образован четырьмя гибкими пептидными петлями. Именно это разнообразие петель в жестком в других отношениях скелете липокалина обеспечивает разнообразие разных типов связывания, каждый из которых способен вмещать мишени разного размера» формы или химического характера (смотри, например, обзор в Flower, D.R. (1996), выше; Flower, D.R. et al. (2000), выше, или Skerra, A. (2000) Biochim. Biophys. Acta 1482, 337-350).
В международной заявке на патент WO 99/16873 раскрыты полипептиды семейства липокалинов с мутированными аминокислотными положениями в области четырех пептидных петель, которые располагаются в конце цилиндрической структуры β-цилиндра, охватывающей связывающий карман, и которые соответствуют тем сегментам в линейной полипептидной последовательности, которые включают аминокислотный положения с 28 по 45, с 58 по 69, с 86 по 99 и со 114 по 129 билин-связывающего белка Pieris brassicae. Сообщали, что члены семейства липокалинов являются пост-трансляционно модифицированными, например, фосфорилирование и гликозилирование липокалина слезы (например, You, J., et al. (2010) Electrophoresis 31, 1853-1861). Тем не менее, никаких пост-трансляционных модификаций не требуется для их свойств молекулярного распознавания.
В международной заявке на патент WO 00/75308 описаны мутеины билин-связывающего белка, которые специфически связывают дигоксигенин, а международные заявки на патент WO 03/029463 и WO 03/029471 относятся к мутеинам человеческого нейтрофильного желатиназа-ассоциированного липокалина (hNGAL) и аполипопротеина D, соответственно. Для того, чтобы дополнительно улучшить и точно отрегулировать лигандную аффинность, специфичность, а также стабильность укладки варианта липокалина, были предложены различные подходы с использованием различных членов семейства липокалинов (Skerra, A. (2001) Rev. Mol. Biotechnol. 74, 257-275; Schlehuber, S., and Skerra, A. (2002) Biophys. Chem. 96, 213-228), такие как замена дополнительных аминокислотных остатков. В РСТ публикации WO 2006/56464 описаны мутеины человеческого нейтрофильного желатиназа-ассоциированного липокалина со связывающей аффинностью в отношении CTLA-4 в низком наномолярном диапазоне.
В международной заявке на патент WO 2005/19256 описаны мутеины липокалина слезы с по меньшей мере одним связывающим сайтом для разных или одного и того же лиганда-мишени и предложен способ получения таких мутеинов липокалина слезы человека. Согласно этой заявке РСТ, определенные аминокислотные участки в пределах первичной последовательности липокалина слезы, в частности петлевые области, которые включают аминокислоты 7-14, 24-36, 41-49, 53-66, 69-77, 79-84, 87-98 и 103-110 зрелого липокалина слезы человека, подвергают мутагенезу для того, чтобы получить мутеины со связывающими аффинностями. Полученные в результате мутеины имеют связывающие аффинности в отношении выбранного лиганда (Ко) в наномолярном диапазоне, в большинстве случаев более 100 нМ. В международной заявке на патент WO 2008/015239 описаны мутеины липокалина слезы, связывающиеся с данным лигандом неприродного происхождения, включая альфа-рецептор IL-4. Связывающие аффинности находятся в наномлярном диапазоне, составляя почти 1×10-10 М в экспериментах по поверхностному плазменному резонансу.
Липокалин слезы человека (TLPC или Tic), также называемый липокалин-1, пред-альбумин слезы или белок железы вон Эбнера (von Ebner), был первоначально описан как главный белок слезной жидкости человека (приблизительно одна треть общего содержания белка), но также был идентифицирован в некоторых других секреторных тканях, включая предстательную железу, надпочечную железу, тимус, молочную железу, яичко, слизистую оболочку носа и слизистую оболочку трахеи, а также кортикотропы гипофиза. Гомологичные белки были обнаружены у макак-резусов, шимпанзе, крысы, мыши, свиньи, хомяка, коровы, собаки и лошади. Липокалин слезы является необычным липокалиновым членом в том смысле, что он демонстрирует необычно широкую лигандную специфичность по сравнению с другими липокалинами и высокий промискуитет в отношении относительно нерастворимых липидов (смотри Redl, В. (2000) Biochim. Biophys. Acta 1482, 241-248). Этой особенностью липокалина слезы объяснялась функция белка в ингибировании роста бактерий и грибов в роговице. Значительное число липофильных соединений разных химических классов, таких как жирные кислоты, жирные спирты, фосфолипиды, гликолипиды и холестерин, являются эндогенными лигандами этого белка. Интересно, что в противоположность другим липокалинам, сила связывания лиганда (мишени) коррелирует с длиной углеводородного хвоста как для алкиламидов, так и для жирных кислот.Так, липокалин слезы связывает наиболее сильно наименее растворимые липиды (Glasgow, B.J. et al. (1995) Curr. Eye Res. 14, 363-372; Gasymov, O.K. et al. (1999) Biochim. Biophys. Acta 1433, 307-320). 1,8-Å кристаллическая структура липокалина слезы выявила необычно большую полость внутри его β-цилиндра (Breustedt, D.A. et al. (2005) J. Biol. Chem. 280, 1, 484-493).
Несмотря на этот прогресс, было бы желательно иметь мутеин липокалина слезы человека, который имеет улучшенные связывающие свойства в отношении альфа-рецептора IL-4, в частности более высокую связывающую аффинность, просто по причине дополнительного улучшения пригодности мутеинов липокалина слезы человека в диагностических и терапевтических приложениях.
Краткое изложение сущности изобретения
Соответственно, задача изобретения состояла в том, чтобы предложить дополнительный мутеин липокалина слезы человека с высокой аффинностью связывания в отношении альфа-рецептора IL4.
Эта задача решается мутеином липокалина слезы человека с признаками, указанными в формуле изобретения, в частности в п.1.
В первом аспекте настоящего изобретения предложен мутеин липокалина слезы человека. Этот мутеин связывается с альфа-рецептором IL4. Этот мутеин содержит мутированный аминокислотный остаток в любом одном или более чем одном из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Этот мутеин дополнительно содержит мутированный аминокислотный остаток в любых двух или более чем двух из положений 26, 32, 34, 55, 56, 58 и 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Аминокислотная последовательность мутеина липокалина слезы человека содержит одну из следующих совокупностей аминокислотных комбинаций: (1) Ser 26, Glu 34, Leu 55, Lys 58, (2) Ser 26, Asn 34, Ala 55, Lys 58, (3) Ser 26, Val 34, (4) Pro 26, Ser 34 (5) Pro 26, Ala 55, (6) Leu 26, Trp 34, Ala 55, (7) Leu 26, Trp 34, lie 58, (8) Asn 26, Asp 34, (9) Asn 26, Ala 55, (10) Tyr 26, His 34, Ala 55, (11) Tyr 26, His 34, Ala 58, (12) Lys 26, Arg 34, Ala 55, (13) Lys 26, Arg 34, Asn 58, (14) Glu 26, Gly 34, Ala 55 или (15) Glu 26, Gly 34, Leu 58.
Термин "положение" при его использовании в соответствии с изобретением означает положение любой аминокислоты в пределах представленной здесь аминокислотной последовательности или положение нуклеотида в пределах представленной здесь нуклеиново-кислотной последовательности. Термин "соответствующее" при его использовании здесь также подразумевает, что положение не является определяемым только числом предшествующих нуклеотидов/аминокислот. Соответственно, положение данной аминокислоты в соответствии с изобретением, которая может быть заменена, может варьировать из-за делеции или вставки аминокислот где-либо в липокалине (мутантном или дикого типа). Аналогично, положение данного нуклеотида в соответствии с настоящим изобретением, который может быть заменен, может варьировать из-за делеций или дополнительных нуклеотидов в каком-либо участке в 5'-нетранслируемой области (UTR) в мутеине или липокалине дикого типа, включая промотор и/или любые другие регулятроные последовательности или ген (включая экзоны и интроны).
Таким образом, под "соответствующим положением" в соответствии с изобретением следует предпочтительно понимать, что нуклеотиды/аминокислоты могут отличаться в указанном номере, но могут все еще иметь сходные соседние нуклеотиды/аминокислоты. Указанные нуклеотиды/аминокислоты, которые могут быть заменены, делегированы или добавлены, также охватываются термином "соответствующее положение".
Конкретно, для того чтобы определить, соответствует ли нуклеотидный остаток или аминокислотный остаток аминокислотной последовательности липокалина, отличного от мутеина липокалина Tic по изобретению, определенному положению в нуклеотидной последовательности или аминокислотной последовательности мутеина липокалина Tic как описано, в частности любой из SEQ ID NO: 2-11, или тех последовательностях, которые имеют одну или более аминокислотных замен в положении 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 линейной полипептидной последовательности Tic (SEQ ID NO: 20), специалист в данной области может использовать средства и способы, хорошо известные в данной области, например выравнивания, либо вручную, либо посредством использования комьютерных программ, таких как BLAST2.0, которая принадлежит Basic Local Alignment Search Tool, или ClustalW, или любую другую приемлемую программу, которая подходит для генерирования выравниваний последовательностей. Соответственно, мутеин липокалина любой из SEQ ID No: 2-11 или имеющий одну или более аминокислотных замен в положении 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 линейной полипептидной последовательности Tic (SEQ ID NO: 20), может служить в качестве "предметной последовательности", тогда как аминокислотная последовательность липокалина, отличного от Tic, служит в качестве "уточняемой последовательности".
Во втором аспекте настоящего изобретения предложен способ получения мутеина липокалина слезы человека. Этот мутеин связывается с альфа-рецептором IL-4. При этом способе молекулу нуклеиновой кислоты,кодирующей липокалин слезы человека, подвергают мутагенезу по любому одному или более положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 аминокилотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Далее, при этом способе молекулу нуклеиновой кислоты, кодирующей липокалин слезы человека, подвергают мутагенезу по любым двум или более положениям 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, по меньшей мере по одному из двух или более положений 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В результате получают одну или более нуклеиновых кислот, кодирующих мутеин липокалина слезы человека. Аминокислотная последовательность кодируемого мутеина включает одну из следующих совокупностей комбинаций аминокислот: (1) Ser 26, Glu 34, Leu 55, Lys 58, (2) Ser 26, Asn 34, Ala 55, Lys 58, (3) Ser 26, Val 34, (4) Pro 26, Ser 34, (5) Pro 26, Ala 55, (6) Leu 26, Trp 34, Ala 55, (7) Leu 26, Trp 34, lie 58, (8) Asn 26, Asp 34, (9) Asn 26, Ala 55, (10) Tyr 26, His 34, Ala 55, (11) Tyr 26, His 34, Ala 58, (12) Lys 26, Arg 34, Ala 55, (13) Lys 26, Arg 34, Asn 58, (14) Glu 26, Gly 34, Ala 55, и (15) Glu 26, Gly 34, Leu 58. Способ также включает экспрессирование полученной таким образом одной или более кодирующих мутеин молекул нуклеиновой кислоты в системе экспрессии. Тем самым способ включает получение одного или более мутеинов. Дополнительно этот способ включает обогащение полученных таким образом одного или более мутеинов, которые связываются с альфа-рецептором IL 4, посредством селекции и/или выделения.
В третьем аспекте настоящего изобретения предложена молекула нуклеиновой кислоты. Эта молекула нуклеиновой кислоты включает нуклеотидную последовательность, которая кодирует мутеин согласно первому аспекту.
В четвертом аспекте настоящего изобретения предложена клетка-хозяин. Эта клетка-хозяин содержит молекулу нуклеиновой кислоты согласно третьему аспекту.
В пятом аспекте настоящего изобретения предложена фармацевтическая композиция. Эта фармацевтическая композиция содержит мутеин липокалина слезы человека согласно первому аспекту. Эта фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
Данное изобретение будет более понятным со ссылкой на подробное описание при рассмотрении в сочетании с неограничивающими примерами и сопровождающими их графическими материалами.
Описание графических материалов
На Фиг.1 показана полипептидная последовательность S191.4-B24 мутеина липокалина слезы человека, обладающего аффинностью связывания в отношении альфа-рецептора IL-4.
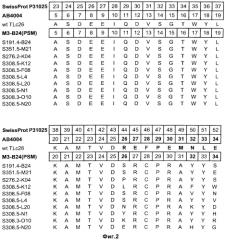
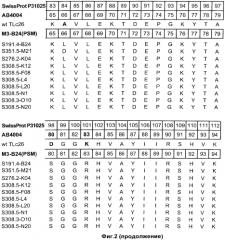
На Фиг.2 показаны полипептидные последовательности иллюстративных мутеинов с высокой афинностью в отношении альфа-рецептора IL-4 (SEQ ID NOs: 2-11).
На Фиг.3 показано ингибирование пролиферации клеток TF-1 возрастающими количествами мутеинов по изобретению в присутствии IL-4 (А) nlL-13 (B).
На Фиг.4 представлены величины IC50 для Фиг.3 и данные измерений с помощью Biacore связывания мутеинов липокалина слезы человека по изобретению с альфа-рецептором IL-4, таким как человеческий альфа-рецептор IL-4.
Подробное описание изобретения
В настоящем изобретении предложены мутеины липокалина слезы человека, которые обладают особенно высокой афинностью в отношении альфа-рецептора IL-4. Альфа-рецептор IL-4, представляющий собой мишень для мутеина по настоящему изобретению, как правило, является белком млекопитающего, таким как человеческий белок. In vivo альфа-рецептор IL-4 может связывать интерлейкин 4 и интерлейкин 13 с регулированием продукции IgE антител в В-клетках.
Было установлено, что аффинности связывания мутеинов согласно изобретению обычно имеют KD ниже 0,1 нМ и в ряде воплощений примерно 1 пикомоль (пМ) (см. Фиг.4). Мутеины липокалина по изобретению соответственно способны связывать альфа-рецептор IL-4 с обнаружимой аффинностью, то есть с константой диссоциации по меньшей мере 200 нМ. В ряде воплощений мутеин липокалина по изобретению связывает альфа-рецептор IL-4 с константой диссоциации в отношении альфа-рецептора IL-4 по меньшей мере приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 0,1 нМ, приблизительно 10 пМ или даже менее. Аффинность связывания мутеина с выбранной мишенью, в данном случае альфа-рецептором IL-4, может быть измерена и посредством этого могут быть определены величины Ко комплекса мутеин-лиганд с помощью многочисленных способов, известных специалистам в данной области. Такие способы включают, без оганичения ими, флуоресцентное тирование, конкурентный El-ISA (твердофазный иммуноферментный анализ), калориметрические способы, такие как изотермальная титрационная калориметрия (ITC), и поверхностный плазменный резонанс (BIAcore). Примеры таких способов подробно описаны ниже (см., например, Пример 2).
Цепь человеческого альфа-рецептора интерлейкина-4 может иметь аминокислотную последовательность с номером доступа в банке данных SWISS PROT № Р24394 (SEQ ID NO: 18) или ее фрагменты. Иллюстративный пример фрагмента цепи человеческого альфа-рецептора интерлейкина-4 включает аминокислоты с 26 по 232 альфа-рецептора IL-4. Аминокислотная последовательность человеческого альфа-рецептора 1 к IL-13 показана в SEQ IDNO: 19.
В общем, термин "фрагмент", как он используется в данном описании в отношении белковых лигандов мутеинов липокалина слезы по изобретению, относится к N-терминально и/или С-терминально укороченным белковым или пептидным лигандам, которые сохраняют способность полноразмерного лиганда распознаваться и/или связываться мутеином согласно изобретению.
Мутеин липокалина слезы человека, связывающий альфа-рецептор IL-4, может действовать как антагонист IL-4 и/или антагонист IL-13, либо как обратный агонист IL-4 и/или обратный агонист IL-13. Обратный агонист связывается с тем же самым сайтом связывания, что и агонист для конкретного рецептора и уменьшают конститутивную активность соответствующего рецептора. Поскольку о рецепторах IL-4 не сообщалось как об обладающих собственной киназной активностью, постольку мутеин по изобретению может обычно действовать как антагонист IL-4 и/или антагонист IL-13. В одном воплощении мутеины липокалина слезы человека действуют как антагонисты человеческого IL-4 и/или человеческого IL-13. В ряде воплощений мутеин является перекрестно-реагирующим с альфа-рецептором IL-4 яванского макака (Cynomolgus) и как таковой действует как антагонист лигандов Cynomolgus, таких как IL-4 и/или IL-13. В ряде воплощений мутеин является перекрестно-реагирующим с альфа-рецептором IL-4 игрунки (Marmoset) и как таковой действует как антагонист лигандов игрунки, таких как IL-4 и/или IL-13.
Альфа-рецептор IL-4 может быть использован для определения лиганда липокалина слезы человека неприродного происхождения. Термин "лиганд неприродного происхождения" относится к соединению, которое не связывается с нативным зрелым липокалином слезы человека при физиологических условиях. Термин "липокалин слезы человека", как он используется в данном описании, относится к зрелому липокалину слезы человека, соответствующему белку из SWISS-PROT Data Bank с номером доступа Р31025. Зрелый липокалин слезы человека не включает N-терминальный сигнальный пептид, который включен в последовательность из SWISS-PROT с номером доступа Р31025 (смотри Фиг.2).
Аминокислотная последовательность мутеина по изобретению обладает высокой идентичностью последовательности со зрелым липокалином слезы человека при сравнении идентичностей последовательности с другими липокалинами (см. выше). В этом общем контексте аминокислотная последовательность мутеина по изобретению по меньшей мере по существу одинакова с аминокислотной последовательностью зрелого липокалина слезы человека. Соответствующая последовательность мутеина по изобретению, будучи по существу сходной с последовательностями зрелого липокалина слезы человека, имеет в ряде воплощений по меньшей мере 70%-ную, по меньшей мере 75%-ную, по меньшей мере 80%-ную, по меньшей мере 82%-ную, по меньшей мере 85%-ную, по меньшей мере 87%-ную, по меньшей мере 90%-ную идентичность, включая по меньшей мере 95%-ную идентичность, с последовательностью зрелого липокалина слезы человека, при условии, что сохраняется измененное положение или последовательность.
Под "идентичностью" понимают свойство последовательностей, которое измеряет их сходство или соотношение. Идентичность измеряют путем деления количества идентичных остатков на общее число остатков и умножая результат на 100. В качестве двух иллюстративных примеров, мутеин с последовательностью SEQ ID NO: 3 имеет идентичность последовательности 83,3% с аминокислотной последовательностью зрелого липокалина слезы человека, и мутеин с последовательностью SEQ ID NO: 7 имеет идентичность аминокислотной последовательности 82,0% со зрелым липокалином слезы человека.
"Бреши" представляют собой промежутки в выравнивании, которые являются результатом вставок или делеций аминокислот.Так, две копии точно одной и той же последовательности имеют 100%-ную идентичность, но последовательности, которые являются менее высококонсервативными или имеют делеций, вставки или замены, могут иметь более низкую степень идентичности. Специалисту в данной области известно, что для определния идентичности последовательностей доступно несколько компьютерных программ с использованием стандартных параметров, например Blast (Altschul, et al. (1997) Nucleic Acids Res. 25, 3389-3402), Blast2 (Altschul, et al. (1990) J. Mol. Biol. 215, 403-410) или Smith-Waterman (Smith, et al. (1981) J. Mol. Biol. 147, 195-197).
Термин "мутированный" или "мутант" при ссылке на нуклеиновую кислоту или полипептид относится к замене, делеций или вставке одного(ой) или более нуклеотидов или аминокислот, соответственно, по сравнению с существующими в природе нуклеиновой кислотой или полипептидом. Мутеин по настоящему изобретению содержит по меньшей мере три замены при сравнении с соответствующим нативным липокалином слезы человека.
В ряде воплощений мутеин согласно изобретению содержит по меньшей мере две аминокислотных замены, включая 2, 3, 4, 5 или более аминокислотных замен нативной аминокислоты остатком аргинина. Замененная аминокислота в ряде воплощений может быть локализована по любому из положений 27, 30, 57 и 83 касательно аминокислотной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин согласно изобретение включает аминокислотную замену нативного остатка цистеина в положениях 61 и/или 153 остатком серина. В этом контексте следует отметить, что было обнаружено, что удаление структурной дисульфидной связи (на уровне библиотеки соответственных наивных нуклеиновых кислот) липокалина слезы дикого типа, которая образована остатками цистеина 61 и 153 (смотри Breustedt, et al., 2005, выше) обеспечивает мутеины липокалина слезы, которые не только стабильно уложены, но кроме этого также способны связывать данный лиганд неприродного происхождения с высокой аффинностью. Не желая ограничиваться теорией, также полагают, что элиминация структурной дисульфидной связи обепечивает дополнительное преимущество обеспечения возможности генерирования (спонтанного) или преднамеренного введения искусственных дисульфидных связей неприродного происхождения в мутеины по изобретению (смотри Примеры), тем самым повышая, например, стабильность этих мутеинов. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка цистеина в положении 101 остатком серина. Далее, в ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка аргинина в положениях 111 остатком пролина. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка лизина в положениях 114 остатком триптофана.
Мутеин липокалина слезы человека согласно изобретению обычно имеет одну из аминокислот аспарагин, глутаминовая кислота, пролин, лейцин, лизин, серин и тирозин в положении, которое соответствует аминокислотному положению 26 зрелого липокалина слезы человека. В ряде воплощений мутеин по изобретению имеет последовательность, в которой аминокислотное положение 34 является неизмененным относительно зрелого липокалина слезы человека, и где последовательность этого мутеина включает аминокислотные замены Arg 26→Ser, Met 55→Leu, Ser 58→Lys. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Pro и Glu 34→Ser. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Pro и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Ser и Glu 34→Val. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Leu, Glu 34→Trp или Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Leu, Glu 34→Trp и Ser 58→IIe. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Ser, Glu 34→Asn, Met 55→Ala и Ser 58→Lys. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Asn и Glu 34→Asp. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Asn и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Tyr, Glu 34→His и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Tyr, Glu 34→His и Ser 58→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Lys, Glu 34→Arg и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Lys, Glu 34→Arg и Ser 58→Asn. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Glu, Glu 34→Arg и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Glu, Glu 34→Arg и Ser 58→Leu.
В ряде воплощений мутеин липокалина слезы человека по изобретению, который связывает альфа-рецептор IL-4, имеет, при сравнении с аминокислотной последовательностью зрелого липокалина слезы человека, мутированный аминокислотный остаток в положении последовательности 58 или в положении последовательности 63. В ряде воплощений последовательность мутеина по изобретению выбирают таким образом, что, при сравнении с аминокислотной последовательностью зрелого липокалина слезы человека, серин присутствует не в обоих аминокислотных положениях 26 и 34.
Мутеин липокалина может дополнительно содержать, относительно аминокислотной последовательности зрелого липокалина слезы человека, одну или более, включая по меньшей мере две, по меньшей мере три или по меньшей мере четыре аминокислотные замены нативных аминокислотных остатков остатками цистеина в любых из положений 26-28, 30-34, 53, 55-58, 61, 63, 64, 66, 80, 83, 104-106 и 108 нативного зрелого липокалина слезы человека. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативной аминокислоты остатком цистеина в положениях 28 или 105 относительно аминокислотной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативной аминокислоты остатком цистеина в положениях 28 или 105 относительно аминокислотной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин согласно изобретение содержит мутированный аминокислотный остаток в любых трех или более, включая 3, 4, 5, 6 или 7, из положений 26, 32, 34, 55, 56, 58 или 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 26, который представляет собой один из следующих: аспарагин, глутамин, пролин, лейцин, лизин, серин и тирозин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 32, который представляет собой один из следующих: гистидин, лизин, тирозин и валин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 34, который представляет собой один из следующих: аргинин, аспарагиновая кислота, аспарагин, гистидин, серии, триптофан и валин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 55, который представляет собой один из следующих: аланин и лейцин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 56, который представляет собой один из следующих: аланин, глутамин, гистидин, метионин, лейцин и лизин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 58, который представляет собой один из следующих: аланин, аргинин, аспарагин, гистидин, изолейцин и лизин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 63, который представляет собой один из следующих: глутамин,лизин, пролин и серин.
В ряде воплощений мутеин согласно изобретению содержит по меньшей мере одну из замен Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104→Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин согласно изобретению содержит две или более, например 3, 4, 5, 6 или все из следующих замен: Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104→Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин согласно изобретение содержит замену Val 53→Phe или Val 53→Leu. Мутированный аминокислотный остаток может включать также замену Val 64→Tyr или Val 64→Met. Он может включать также замену Ala 66→Leu или Ala 66→Asp.
В ряде воплощений мутеин липокалина слезы человека согласно изобретению содержит аминокислоту по меньшей мере одного или обоих остатков цистеина, присутствующих в каждом из положений 61 или 153 последовательности, замененную другой аминокислотой, и мутацию по меньшей мере трех аминокислотных остатков по любым из положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Положения 26-28 и 30-34 включены в АВ петлю, положения 53 и 55 локализованы на самом конце бета-слоя, а следующие положения 56-58 включены в CD петлю. Удивительно, что положения 63, 64 и 66 включены в пределах бета-слоя ((3D), и положение 80 локализовано в области α-спирали. Положение 83 представляет собой одиночную определяющую петлю аминокислоту между этой α-спиральной областью и бета-слоем (βF). Положения 104-106 и 108 включены в петлю GH в сайте связывания по открытому концу β-цилиндрической структуры липокалина слезы. Определение этих районов используется в данном описании в соответствии с Flower (Flower, 1996, выше, Flower, et al., 2000, выше) и Breustedt et al. (2005, выше). Такой мутеин может содержать по меньшей мере 2, включая 3, 4, 5, 6, 8, 10, 12, 14, 15, 16, 17 или 18, мутированных аминокислотных остатков в положениях 26-34, 55-58, 63, 64, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин содержит аминокислотные замены Cys 61→Ala, Phe, Lys, Arg, Thr, Asn, Tyr, Met, Ser, Pro или Trp и Cys 153→Ser или Ala. Такая замена, как показано, полезна для предотвращения образования существующего в природе дисульфидного мостика, связывающего Cys 61 и Cys 153, и, таким образом, для облегчения обработки мутеина. Однако, мутеины липокалина, которые связывают альфа-рецептор IL-4 или которые имеют дисульфидный мостик, образованный между Cys 61 и Cys 153, составляют часть настоящего изобретения.
В ряде воплощений мутеин содержит по меньшей мере одну аминокислотную замену, которая может представлять собой дополнительную аминокислотную замену, выбранную из Arg 111→Pro и Lys 114→Trp. Мутеин по изобретению может дополнительно содержать цистеин в положении 101 последовательности нативного зрелого липокалина слезы человека, замененный другой аминокислотой. Эта замена может, например, представлять собой мутацию Cys 101→Ser или Cys 101→Thr.
Как определено выше, мутеин по изобретению содержит по меньшей мере одну аминокислотную замену, которая локализована в положениях 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин по изобретению содержит две или более, например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16, аминокислотных замен этих положений последовательности зрелого липокалина слезы человека. В одном воплощении мутеин имеет мутированный аминокислотный остаток в каждом из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутированный аминокислотный остаток по любому одному или более из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека относительно аминокислотной последовательности зрелого липокалина слезы человека содержит одну или более следующих замен: Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин по изобретению содержит две или более, например 3, 4, 5, 6 или 7 аминокислотных замен в этих положениях последовательности зрелого липокалина слезы человека.
В оставшейся области, то есть области, отличной от положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 последовательности, мутеин липокалина по изобретению может содержать аминокислотную последовательность дикого типа (природного) вне положений мутированной аминокислотной последовательности. В ряде воплощений мутеин липокалина согласно изобретению может также нести одну или более аминокислотных мутаций в положении/положениях последовательности в той степени, в которой такая мутация не препятствует, по меньшей мере существенно, или не оказывает отрицательного воздействия на связывающую активность и укладку мутеина. Такие мутации могут быть осуществлены очень легко на уровне ДНК с помощью существующих стандартных способов. Иллюстративными примерами изменений аминокислотной последовательности являются вставки или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, то есть аминокислотный остаток заменяют аминокислотным остатком со сходными химическими свойствами, в частности в отношении полярности, а также размера. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и 6) фенилаланин, тирозин и триптофан. С другой стороны, также возможно вводить неконсервативные изменения в аминокислотную последовательность. Кроме того, вместо замены одного аминокислотный остатка возможно либо вставить, либо удалить одну или более соседних аминокислот первичной структуры липокалина слезы так, чтобы эти делеции или вставки давали в результате стабильно уложенный/функциональный мутеин (смотри, например, экспериментальный раздел, в котором получают мутеины с усеченным N- или С-концом).
Такие модификации аминокислотной пос