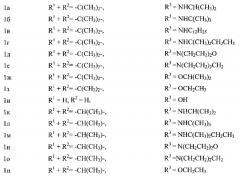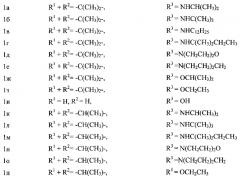Бета-адреноблокаторы на основе производных пиридоксина
Иллюстрации
Показать всеИзобретение относится к синтетическим биологически активным веществам гетероциклического ряда, обладающим высокой антиадренергической активностью, представляющим собой бета-замещенные спирты, содержащие фрагмент пиридоксина общей формулы 1:
, где:
Соединения общей формулы 1 обладают высокой эффективностью и продолжительностью антиадренергических свойств на фоне короткого времени наступления действия и низкой токсичности. 2 ил., 20 пр.
Реферат
Изобретение относится к синтетическим биологически активным веществам гетероциклического ряда, обладающим высокой антиадренергической активностью и представляющим собой β-замещенные спирты, содержащие фрагмент пиридоксина общей формулы 1:
где:
Соединения формулы 1 обладают высокой антиадренергической активностью на фоне низкой токсичности и могут найти применение в медицине.
Сердечно-сосудистые заболевания представляют собой группу болезней сердца и кровеносных сосудов. Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смертности во всем мире: ни по какой другой причине ежегодно не умирает столько людей, сколько от ССЗ. [Мировой отчет по неинфекционным заболеваниям, 2010 г., Женева, ВОЗ]. Только в 2010 году число умерших от ишемической болезни сердца (ИБС) во всем мире составило более 7 млн человек, что значительно превышает количество смертей по той же причине в 1980-м (4,5 млн. чел), 1990-м (5,2 млн чел.) и 2000-м (6,3 млн чел.) годах. Из всех смертей от ИБС в 2010 году 25,6% случаев относится к лицам, не достигшим 65 лет, по сравнению с 26,5% в 1980 году [Morgan А.Е., Forouzanfar М.Н., Roth G.A., Mensah G.A., Ezzati М., Murray С.J.L., Naghavi M. Temporal Trends in Ischemic Heart Disease Mortality in 21 World Regions, 1980 to 2010: The Global Burden of Disease 2010 Study // Circulation. The American heart assotiation. - 2014. - 129. - P. 1483-1492.].
Для борьбы с ССЗ применяется ряд препаратов различного действия. Среди препаратов широкое применение получили адреноблокаторы - химические вещества, которые из-за наличия в своем составе этаноламинового фрагмента и схожести с катехоламинами конкурентно связываются с адренорецепторами и тем самым блокируют действие катехоламинов. Адреноблокаторы в зависимости от типа блокируемых рецепторов подразделяются на α-адреноблокаторы и β-адреноблокаторы, которые, в свою очередь, делятся на неселективные β-адреноблокаторы, селективные β1-адреноблокаторы и β-адреноблокаторы комбинированного действия (обладают дополнительными вазодилатирующими свойствами: блокада α-адренорецепторов, активация синтеза оксида азота NO).
Широкое применение среди β-адреноблокаторов получил метопролол [US 5034545. Process for s-metoprolol via oxazolidin-2-one / Astra Pharmaceutical Production Aktiebolag. - Опубл. - 30.05.1990], который является селективным β1-адреноблокатором. Недостатком большинства β-адреноблокаторов (включая метопролол, карведилол, бисопролол, пропранолол, атенолол) является большое количество побочных действий, таких как: брадикардия, бронхоспазмы и риск их развития, гипогликемия, гипергликемия, ослабление половой функции, псориатические высыпания, синдром отмены и т.д.
Заявленное техническое решение иллюстрировано Фиг. 1, на которой представлена сравнительная характеристика показателей по снижению частоты сердечных сокращений (ЧСС) у мышей под действием наиболее близкого аналога (метопролола) и заявленных соединений; в таблице, представленной на Фиг. 2, показаны результаты цитотоксичности синтезированных соединений по сравнению с наиболее близким аналогом (метопрололом).
Сущность предлагаемого изобретения состоит в том, что бета-адреноблокаторы на основе производных пиридоксина общей формулы 1 обладают высокой антиадренергической активностью на фоне низкой токсичности:
где:
Заявляемые вещества общей формулы 1 относятся к аналогам β-адреноблокаторов, используемых при терапии ССЗ, и их применение может значительно увеличить терапевтическую эффективность ввиду высокой активности и продолжительности антиадренергических эффектов, а также низкой токсичности и короткого времени до начала действия.
Следует отметить, что описанные в литературе соединения, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному техническому решению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре. Однако эти соединения являются аналогами по техническому результату(ам), обладающими указанными недостатками. Задача заявленного технического решения состоит в создании новых безопасных биологически активных соединений с высокой, длительной антигипертензивной активностью с коротким временем до начала действия.
Поставленная задача решается путем синтеза веществ общей формулы 1:
,
где:
В современной медицине не используются антиадренергические препараты аналогичной структуры. Заявляемые вещества на фоне низкой токсичности проявляют высокую и продолжительную антиадренергическую активность и могут найти применение в медицине ввиду короткого времени до начала действия (на 30% короче времени начала действия одного из лучших антиадренергических препаратов - метопролола).
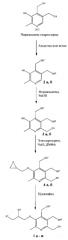
Предлагаемые в данном изобретении соединения формулы 1 получены согласно нижеприведенной схеме:
, где
Характеристики новых соединений приведены в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии.
Спектры ЯМР 1Н зарегистрированы на приборе «Bruker» AVANCE 400 (400 МГц). Химический сдвиг определен относительно сигналов остаточных протонов дейтерированного растворителя.
HRMS-эксперимент проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Эксперименты под микроволновым излучением проведены в лабораторном микроволновом реакторе Discover®-CEM в закрытых сосудах на 10 мл.
Температура плавления веществ определена на приборе OptiMelt МРА100 (Stanford Research Systems).
Контроль за ходом реакций проведен методом ТСХ на пластинах Sorbfil ПТСХ-АФ-А-УФ. Препаративная хроматография соединений проведена на силикагеле КСКГ фр. 0.10-0.16 (Экофарм).
Примеры конкретного выполнения заявленного технического решения
Пример 1. Синтез 3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ола (2а)
Через суспензию 20 г (97.3 ммоль) пиридоксина гидрохлорида в 300 мл ацетона, при охлаждении до плюс 3…5°С и перемешивании пропускают 22 г (603 ммоль) хлористого водорода. Полученную реакционную смесь перемешивают в течение 20 ч. Осадок отфильтровывают, промывают эфиром и нейтрализуют водным раствором поташа. Продукт отфильтровывают и перекристаллизовывают из этилового спирта. Выход 94%. Соединение 2а описано в статье [Korytnyk, W. A seven-membered cyclic ketal of pyridoxol [Текст] / W. Korytnyk // J. Org. Chem. - 1962. - V. 27, N. 10. - P. 3724-3726].
Пример 2. Синтез 3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ола (2б)
Продукт получают по вышеописанной методике, используют пиридоксина гидрохлорид, ацетальдегид и моногидрат п-толуолсульфокислоты. Выход 65%. Соединение 2б описано в патенте [GB 1034483 (A) A process for the Manufacture of Pyridine Derivatives / J.M. Osbond. - Опубл. - 1966-06-29].
Общая методика введения гидроксиметильного фрагмента в шестое положение ароматического кольца пиридоксина (3а, 3б)
Смесь 7 г (33.5 ммоль) соединения, 2.15 г (53.8 ммоль) NaOH и 4.7 г (58.0 ммоль) 37%-ного водного раствора формальдегида в 50 мл воды нагревают 60 ч при температуре плюс 70°С. После охлаждения реакционную смесь нейтрализуют конц. HCl, выпавшую смолу отделяют, а фильтрат отгоняют в вакууме. Сухой остаток экстрагируют ацетоном, не растворившуюся часть отфильтровывают, а растворитель отгоняют в вакууме. Остаток промывают ацетоном.
Пример 3. Синтез 6-гидроксиметил-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ола (3а)
Продукт получают по вышеописанной методике, в качестве исходного кеталя используют соединение 2а. Соединение 3а описано в статье [Shtyrlin, N.V.; Strel′Nik; Sysoeva; Lodochnikova; Klimovitskii; Shtyrlin, Yu. G. New synthetic method for 2,3,4-tris(hydroxymethyl)-6-methylpyridin-5-ol [Текст] / N.V. Shtyrlin, A.D. Strel′nik, L.P. Sysoeva, O.A. Lodochnikova, E.N. Klimovitskii, Yu.G. Shtyrlin // Rus. J. of Org. Chem. - 2009. -V. 45, N. 8 p. 1266-1268.].
Пример 4. Синтез 6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ола (3б)
Продукт получают по вышеописанной методике, в качестве исходного ацеталя используют соединение 2б. Соединение 3б описано в статье [Pugachev, M.V. Bisphosphonium salts of pyridoxine: The relationship between structure and antibacterial activity [Текст] / M.V. Pugachev, N.V. Shtyrlin, S.V. Sapozhnikov, L.P. Sysoeva, A.G. Iksanova, E.V. Nikitina, R.Z. Musin, O.A. Lodochnikova, E.A. Berdnikov, Yu.G. Shtyrlin // Bioorg. Med. Chem., - 2013. - V. 21, I. 23 - p. 7330-7342].
Общая методика введения 2,3-эпоксипропанового фрагмента в ароматическое кольцо (4а, 4б)
Эпихлоргидрин (1 мл, 12,5 ммоль) добавляют к раствору ацеталя/кеталя 6-(гидроксиметил) пиридоксина (1 г, 4,4 ммоль) и NaH (0,16 г, 6,7 ммоль) в 15 мл ДМФА и перемешивают в течение 24 ч при плюс 70°С. Растворитель отгоняют при пониженном давлении, продукт очищают с помощью колоночной хроматографии на силикагеле [этилацетат].
Пример 5. Синтез (3,3,8-триметил-9-(оксиран-2-илметокси)-1,5-дигидро-[1,3]диоксепино[5,6-с] пиридин-6-ил)метанола (4а)
Продукт получают по вышеописанной методике, используют кеталь 3а в качестве исходного соединения. Выход 65%, бесцветные кристаллы, т.пл. плюс 150…152°С; ЯМР1Н (CDCl3), δ м.д.: 1.49 с (6Н, 2СН3), 2.48 с (3Н, СН3), 2.70 дд (1H, 2J=-4.7 Гц, 3J=2.7 Гц, СН), 2.89 т (1Н, 2J=-4.7 Гц, СН2), 3.33 м (1Н, 3J=2.7 Гц, 3J=6.4 Гц, 3J=2.6 Гц, СН), 3.64 дд (1Н, 2J=-11.2 Гц, 3J=6.4 Гц, СН), 4.09 дд (1Н, 2J=-11.2 Гц, 3J=2.6 Гц, СН), 4.53 с (2Н, СН2), 4.70 с (2Н, СН2), 4.82 с (2Н, СН2); ЯМР13С (CDCl3), δ м.д.: 18.96, 23.80, 44.52, 50.35, 58.91, 59.08, 61.24, 74.46, 102.80, 129.54, 141.57, 148.40, 148.44, 149.43; HRMS (TIS): найдено [М+Н]+: 296.1492, рассчитано для C15H22NO5 [М+Н]+: 296.1492.
Пример 6. Синтез (3,8-диметил-9-(оксиран-2-илметокси)-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-6-ил)метанола (4б)
Продукт получают по вышеописанной методике, используют ацеталь 3б в качестве исходного соединения. Выход 58%, бесцветные кристаллы, т.пл. плюс 95…96°С; ЯМР1Н (CDCl3), δ м.д.: 1.41 д (3Н, 3J=5.2 Гц, СН3), 2.52 с (3Н, СН3(Pyr)), 2.70 тд (1Н, 2J=-4.7 Гц, 3J=2.7 Гц, СН2), 2.90 т (1Н, 3J=4.5 Гц, СН2), 3.31-3.37 м (1Н, СН), 3.6-3.70 м (1Н, СН2), 4.07-4.17 м (1Н, СН2), 4.54-4.65 м (3Н, СН2(Pyr), СНСН3), 4.84 дд (3Н, 2J=-15.4 Гц, СН2(Pyr), ОН), 5.10-5.18 м (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ м.д.: 18.92, 19.36, 19.41, 44.43, 44.45, 50.23, 50.26, 61.18, 61.75, 61.86, 62.16, 62.21, 74.65, 74.73, 102.42, 102.52, 129.98, 141.90, 148.57, 148.97, 148.99, 149.46, 149.51; HMRS (TIS): найдено [М+Н]+: 282.1336, рассчитано для C14H19NO5 [М+Н]+: 282.1336.
Общая методика раскрытия оксиранового цикла соединений 4а и 4б азотсодержащими нуклеофилами (1а-1е, 1к-1о).
3.39 Ммоль эпоксида 4а или 4б растворяют в 5 мл метанола. К раствору добавляют 6,8 ммоль азотсодержащего нуклеофила. Реакцию проводят под действием микроволнового излучения в течение 1,5 часов при температуре плюс 100°С. Растворитель выпаривают при пониженном давлении, продукт очищают при помощи колоночной хроматографии на силикагеле [этилацетатом, затем ацетоном].
Пример 7. Синтез 1-(изопропиламино)-3-((3,3,6,8-тетраметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-2-ола (1а)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и изопропиламин в качестве нуклеофила. Выход 73%, бесцветные кристаллы, т.пл. плюс 86°С; ЯМР1Н (CDCl3), δ м.д.: 1.09 д (6Н, 3J=6.2 Гц, 2СН3), 1.50 с (6Н, 2СН3), 2.49 с (3Н, СН3(Pyr)), 2.71 (1Н, АВХ, 2JAB=-12.0 Гц, 3JAX=8.3 Гц), 2.88 (1H, АВХ, 3JBX=3.9 Гц), 2.82 гекс. (1H, iPr), 3.74 (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=5.6 Гц), 3.76 м (1H, АВХ, 3JBX=4.2 Гц), 3.93-3.99 м (1Н, АВХ), 4.54 с (2Н, СН2(Pyr)), 4.71 с (2Н, СН2(Pyr)), 4.84 уш.с (1Н, ОН), 4.97 с (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.68, 20.98, 21.07, 23.64, 48.47, 50.07, 58.64, 59.23, 61.60, 67.53, 75.42, 102.62, 130.01, 141.31, 148.16, 148.65, 149.09; HMRS (TIS): найдено [М+Н]+: 339.2280, рассчитано для C18H31N2O4 [М+Н]+: 339.2284;
Пример 8. Синтез 1-(трет-бутиламино)-3-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-2-ола (1б)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и трет-бутиламин в качестве нуклеофила. Выход 56%, прозрачное маслообразное вещество желто-палевого цвета. ЯМР1Н (CDCl3), δ м.д.: 1.06 с (9Н, 3СН3), 1.38 с (6Н, 2СН3), 2.32 с (3Н, СН3(Pyr)), 2.61 (1Н, АВХ, 2JAB=-11.4 Гц, 3JAX=8.9 Гц), 2.73 (1Н, 3JBX=3.2 Гц), 3.61 д (2Н, СН2, 3J=4.8 Гц), 3.94 м (1Н, СН), 4.24 уш. с (2Н, 20Н), 4.45 с (2Н, СН2(Pyr)), 4.67 с (2Н, СН2(Pyr)), 4.84 с (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.93, 23.76, 27.00, 45.17, 55.49, 58.79, 59.13, 61.39, 67.07, 75.32, 102.74, 129.67, 141.40, 148.20, 148.46, 149.16; HMRS (TIS): найдено [М+Н]+: 369.2390, рассчитано для C19H33N2O5 [М+Н]+: 369.2389;
Пример 9. Синтез 1-(додециламин)-3-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-2-ола (1в)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и додециламин в качестве нуклеофила. Выход 69%, прозрачное маслообразное вещество желто-палевого; ЯМР1Н (CDCl3), δ м.д.: 0.85 т (3Н, 3J=6.8 Гц, СН3), 1.16-1.34 м (18Н, 9СН2), 1.47 с (6Н, 2СН3), 1.55 м (2Н, СН2), 2.42 с (3Н, СН3(Pyr)), 2.56-2.94 м (4Н, NCH2, ОСН2), 3.73 м (2Н, СН2), 4.08-4.15 м (1Н, СН), 4.28 уш. с (2Н, 2OH), 4.52 с (2Н, СН2(Pyr)), 4.70 с (2Н, СН2(Pyr)), 4.92 с (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 14.24, 18.78, 22.77, 23.71, 27.00, 27.36, 29.34, 29.43, 29.65, 29.72, 31.98, 49.17, 50.91, 58.65, 59.25, 61.64, 66.84, 75.08, 102.75, 129.94, 141.30, 148.10, 148.68, 148.92; HMRS (TIS): найдено [М+Н]+: 481.3647, рассчитано для C27H49N2O5 [М+Н]+: 481.3641;
Пример 10. Синтез 1-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-(трет-пентиламино)пропан-2-ола (1г)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и трет-амиламин в качестве нуклеофила. Выход 37%, бесцветные кристаллы, т.пл. 73-74°С; ЯМР1Н (acetone-d6), δ м.д.: 0.85 т (3Н, 3J=7.5 Гц, CCH3), 1.04 с (6Н, 2СН3), 1.33-1.49 м (8Н, NCH2, 2СН3), 2.43 с (3Н, СН3(Pyr)), 2.66 (1H, АВХ, 2JAB=-11.2 Гц, 3JAX=7.2 Гц), 2.77 (1H, АВХ, 3JBX=4.4 Гц), 3.42 уш. с (2Н, 2OH), 3.77 (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=6.0 Гц), 3.88 (1H, АВХ, 3JBX=4.1 Гц), 3.96 м (1Н, СН), 4.54 с (2Н, СН2(Pyr)), 4.83 с (2Н, СН2(Pyr)), 4.99 с (2Н, СН2(Pyr)); ЯМР13С (acetone-d6), δ: 8.51, 19.06, 23.96, 26.79, 26.81, 33.80, 45.08, 52.75, 59.31, 60.14, 62.90, 70.56, 77.15, 102.97, 131.61, 142.25, 148.83, 150.21, 150.42; HRMS (TIS): найдено [М+Н]+: 383.2546, рассчитано для C20H35N2O5 [М+Н]+: 383.2546;
Пример 11. Синтез 1-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-морфолинопропан-2-ол (1д)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и морфолин в качестве нуклеофила. Выход 87%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 1.47 с (6Н, 2СН3), 2.44 уш. м (2Н, СН2), 2.44 с (3Н, СН3(Pyr)), 2.50 (1H, АВХ, 2JAB=-12.0 Гц, 3JAX=4.7 Гц), 2.54 (1Н, АВХ, 3JBX=9,4 Гц), 2.64 м (2Н, СН2), 3.59 уш. с (1H, ОН), 3.66-3.80 м (6Н, 3СН2), 4.05 м (1H, СН), 4.51 с (2Н, СН2(Pyr)), 4.69 с (2Н, СН2(Pyr)), 4.84 уш. с (1Н, ОН), 4.92 и 4.96 (АВ, 2Н, CH2(Pyr), 2J=-16.4 Hz); ЯМР13С (CDCl3), δ: 18.87, 23.74, 53.79, 58.82, 59.04, 60.65, 61.22, 65.93, 67.03, 75.43, 102.68, 129.44, 141.40, 148.24, 148.34, 149.34; HMRS (TIS): найдено [М+Н]+: 383.2182, рассчитано для C19H31N2O6 [М+Н]+: 383.2182;
Пример 12.1-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-(пиперидин-1-ил)пропан-2-ола (1е)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и пиперидин в качестве нуклеофила. Выход 71%, прозрачное маслообразное вещество желто-палевого; ЯМР1Н (CDCl3), δ м.д.: 1.46 м (2Н, СН2), 1.47 с (6Н, 2СН3), 1.59 м (4Н, 2СН2), 2.37 уш. м (2Н, NCH2), 2.47 м (2Н, СН2), 2.45 с (3Н, СН3(Pyr)), 2,62 м (2Н, NCH2), 3.69 (1H, ABX, 2JAB=-9.6 Гц, 3JAX=5.5 Гц), 3.74 (1H, АВХ, 3JBX=3.7 Гц), 4.05 м (1H, СН), 4.37 уш. с (1H, ОН), 4.52 с (2Н, СН2(Pyr)), 4.69 с (2Н, СН2(Pyr)), 4.93 и 4.98 (АВ, 2Н, CH2(Pyr)) 2J=-16,4 Hz); ЯМР13С (CDCl3), δ: 18.90, 23.75, 24.10, 25.90, 54.81, 58.90, 59.03, 60.80, 61.21, 65.82, 75.74, 102.68, 129.39, 141.44, 148.13, 148.38, 149.46; HMRS (TIS): найдено [M+H]+: 381.2390, рассчитано для C20H33N2O5 [M+H]+: 381.2389;
Пример 13. Синтез 1-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-(изопропиламино)пропан-2-ол (1к)
Продукт получают по вышеописанной методике, используют 4б в качестве эпоксида и изопропиламин в качестве нуклеофила. Выход 48%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 1.10 д (6Н, 3J=5.9 Гц, 2СН3), 1.33 д (3Н, 3J=5.2 Гц, СН3), 1.91 с (1Н, NH), 2.38 с (3Н, СН3(Pyr)), 2.69-2.94 м (3Н, АВХ, NCH2CH, NCH(СН3)2), 3.61-3.72 м (2Н, АВХ, ОСН2СН), 4.01-4.11 м (1Н, АВХ), 4.45-4.90 м (7Н, 2СН2(Pyr), СНСН3, 2OH), 5.07 м (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.80, 19.35, 21.97, 22.01, 48.86, 49.30, 61.56, 61.66, 61.72, 62.43, 68.11, 76.16, 102.36, 102.41, 130.32, 141.64, 148.82, 148.92, 149.37; HMRS (TIS): найдено [М+Н]+: 341.2071, рассчитано для C17H29N2O5 [М+Н]+: 341.2076;
Пример 14. Синтез 1-(трет-бутиламино)-3-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-2-ола (1л)
Продукт получают по вышеописанной методике, используют 4б в качестве эпоксида и трет-бутиламин в качестве нуклеофила. Выход 93%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 1.18 с (9Н, 3СН3), 1.30 д (3Н, 3J=4.7 Гц, СН3), 1.88 с (1H, NH), 2.35 с (3Н, СН3(Pyr)), 2.73-2.93 м (2Н, АВХ, NCH2CH), 3.66 м (2Н, ABX, OCH2CH), 4.06-4.16 м (1H, СН), 4.50 с (2Н, СН2(Pyr)), 4.56 д (1H, 2J=-15.2 Гц, СНСН3), 4.76 дд (2Н, 2J=-15.3 Гц, СН2(Pyr)), 4.97-5.11 м (2Н, СН2(Pyr)), 5.47 уш. с (2Н, 2OH); ЯМР13С (CDCl3), δ: 18.77, 19.29, 19.30, 24.67, 27.45, 44.62, 52.99, 61.61, 61.68, 67.63, 76.00, 102.29, 102.34, 130.40, 141.60, 148.84, 148.88, 149.35; HMRS (TIS): найдено [М+Н]+: 355.2227, рассчитано для C18H31N2O5 [М+Н]+: 355.2233;
Пример 15. Синтез 1-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с] пиридин-9-ил)окси)-3-(трет-пентиламино)пропан-2-ола (1м)
Продукт получают по вышеописанной методике, используют 4б в качестве эпоксида и трет-амиламин в качестве нуклеофила. Выход 47%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 0.88 т (3Н, 3J=7.5 Гц, СН3), 1.17 с (6Н, 2СН3), 1.35 д (3Н, 3J=5.2 Гц, СН3), 1.53 кв (2Н, 3J=7.4 Гц, CH2CH3), 2.41 с (3Н, СН3(Pyr)), 2.71-3.00 м (2Н, АВХ, NCH2CH), 3.66-3.79 м (2Н, АВХ, OCH2CH), 4.01-4.19 м (1Н, АВХ, СН), 4.54 м (2Н, СН2(Pyr)), 4.58 д (1H, 2J=-15.2 Гц, СНСН3), 4.79 дд (2Н, 2J=-15.3 Гц, СН2(Pyr)), 5.02-5.14 м (2Н, СН2(Pyr)), 5.26 уш. с (2Н, 2OH); ЯМР13С (CDCl3), δ: 8.21, 18.93, 19.37, 25.06, 25.11, 32.38, 44.41, 44.72, 55.79, 61.43, 61.79, 62.28, 62.31, 67.87, 76.07, 102.39, 102.41, 130.14, 141.69, 148.67, 148.90, 149.42; HMRS (TIS): найдено [M+H]+: 369.2384, рассчитано для C19H33N2O5 [М+Н]+: 369.2389;
Пример 16. Синтез 1-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-морфолинопропан-2-ола (1н)
Продукт получают по вышеописанной методике, используют 4б в качестве эпоксида и морфолин в качестве нуклеофила. Выход 70%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 1,30 уш. с (3Н, СН3), 2.00-2.69 м (6Н, N(CH2)2, АВХ, NCH2CH), 2.35 с (3Н, СН3(Pyr)), 3.45-3.77 (6Н, 2СН2, АВХ, ОС2СН), 3.98 м (1H, СН), 4.41-4.59 м (3Н, СНСН3, СН2(Pyr)), 4.75 дд (2Н, 2J=-15.1 Гц, СН2(Pyr)), 5.03 м (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.66, 19.22, 53.63, 60.51, 60.48, 61.56, 62.30, 65.87, 66.70, 75.63, 102.20, 102.24, 130.21, 141.52, 148.67, 148.78, 149.26; HMRS (TIS): найдено [М+Н]+: 369.2020, рассчитано для C18H29N2O6 [М+Н]+: 369.2026;
Пример 16. Синтез 1-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-(пиперидин-1-ил)пропан-2-ола (1о)
Продукт получают по вышеописанной методике, используют 4б в качестве эпоксида и пиперидин в качестве нуклеофила. Выход 65%, прозрачное маслообразное вещество желто-палевого цвета; ЯМР1Н (CDCl3), δ м.д.: 1,35 д (3Н, 3J=5.2 Гц, СН3), 1.40-1.52 м (2Н, СН2), 1.56-1.70 м (4Н, 2СН2), 2.41 с (3Н, СН3(Pyr)), 2.47-2.77 м (6Н, 2СН2, АВХ, NCH2CH), 3.63-3.76 (2Н, АВХ, ОСН2СН3), 4.07-4.18 м (1H, СН), 4.47-4.61 м (3Н, СНСН3, СН2(Pyr)), 4.65-4.81 м (4Н, 2J=-15.1 Гц, CH2(Pyr), 2OH), 5.04-5.15 м (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.89, 19.38, 23.67, 25.29, 54.77, 60.80, 61.40, 61.80, 62.34, 65.63, 75.90, 102.41, 102.45, 130.08, 141.68, 148.57, 148.94, 149.45; HMRS (TIS): найдено [М+Н]+: 367.2227, рассчитано для C19H31N2O5 [М+Н]+: 367.2233;
Общая методика раскрытия оксиранового цикла соединений 4а и 4б кислородсодержащими нуклеофилами (1ж, 1з, 1п)
0.68 Ммоль эпоксида 4а или 4б растворяют в 15 мл спирта (этанола или изопропанола в зависимости от структуры целевого соединения). К раствору добавляют 0,68 ммоль NaOH. Реакцию проводят при перемешивании в течение 48 часов при температуре плюс 50°С. Растворитель выпаривают при пониженном давлении, и продукт очищают при помощи колоночной хроматографии на силикагеле [этилацетатом, затем ацетоном].
Пример 17. Синтез 1-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)-3-изопропоксипропан-2-ола (1ж)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и изопропанол в качестве растворителя. Выход 68%, бесцветное кристаллическое вещество, т.пл. плюс 84…85°С; ЯМР1Н (CDCl3), δ м.д.: 1.13 д (6Н, 3J=6.1 Гц, 2СН3), 1.44 с (6Н, 2СН3), 2.40 с (3Н, СН3(Pyr)), 3.58 (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=5.8 Гц), 3.60 (1Н, АВХ, 3JBX=5.0 Гц), 3.64 гепт (1Н, СН), 3.78 м (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=5.7 Гц), 3.80 (1Н, АВХ, 3JBX=4.6 Hz), 4.09 м (1H, СН), 4.52 с (2Н, СН2(Pyr)), 4.72 с (2Н, СН2(Pyr)), 4.96 с (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 18.65, 22.14, 23.76, 58.89, 59.04, 60.92, 68.49, 69.68, 72.53, 74.23, 102.79, 129.66, 142.04, 148.07, 148.31, 149.43; HRMS (TIS): найдено [М+Н]+: 356.2073, рассчитано для C18H30NO6 [М+Н]+: 356.2073;
Пример 18. Синтез 1-этокси-3-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-2-ола (1з)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и этанол в качестве растворителя. Выход 39%, бесцветное кристаллическое вещество, т.пл. плюс 104°С; ЯМР1Н (CDCl3), δ м.д.: 1.21 т (3Н, 3J=7.0 Гц, СН3); 1,48 с (6Н, 2СН3), 2.45 с (3Н, СН3(Pyr)), 3.51-3.63 м (4Н, CH3CH2O+CHCH2O), 3.77 (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=5.7 Гц), 3.79 (1H, АВХ, 3JBX=4.7 Гц), 4.12 м (1Н, СН), 4.53 с (2Н, СН2(Pyr)), 4.70 с (2Н, СН2(Pyr)), 4.94 с (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 15.20, 18.80, 23.76, 58.82, 59.06, 61.18, 67.08, 69.56, 71.02, 74.15, 102.75, 129.42, 141.46, 148.20, 148.42, 149.27; HRMS (TIS): найдено [М+Н]+: 342.1917, рассчитано для C17H28NO6 [М+Н]+: 342.1917;
Пример 19. Синтез 1-этокси-3-((6-(гидроксиметил)-3,8-диметил-1,5-дигидро[1,3]диоксепино[5,6-с]пиридин-9-уил)окси)пропан-2-ола (1п)
Продукт получают по вышеописанной методике, используют 4а в качестве эпоксида и этанол в качестве растворителя. Выход 78%, бесцветное кристаллическое вещество, т.пл. плюс 81…82°С; ЯМР1Н (CDCl3), δ м.д.: 1.23 т (3Н, 3J=7.0 Гц, СН3), 1,41 д (3Н, 3J=5.3 Гц, СН3), 2.58 с (3Н, СН3(Pyr)), 2.65 уш.с (1Н, ОН), 3.52-3.65 м (4Н, CH3CH2O, АВХ, ОСН2СН), 3.78-3.90 м (АВХ, 2Н, CHCH2O), 4.08-4.21 м (1H, СН), 4.62-4.72 м (3Н, СНСН3, СН2(Pyr)), 4.88 дд (2Н, 2J=-15.5 Гц, СН2(Pyr)), 5.12-5.22 м (2Н, СН2(Pyr)); ЯМР13С (CDCl3), δ: 15.23, 18.07, 19.30, 60.33, 61.72, 61.80, 62.13, 67.16, 69.57, 70.89, 74.92, 102.40, 102.45, 131.07, 148.13, 148.45, 149.97; HRMS (TIS): найдено [М+Н]+: 328.1755, рассчитано для C16H26NO6 [М+Н]+: 328.1760;
Пример 20. Синтез 3-((6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ил)окси)пропан-1,2-диола (1и)
Эпоксисоединение 4а (0.2 г, 0.68 ммоль) перемешивают в 25 мл воды в присутствии гидроксида калия (0.046 г, 0.82 ммоль). Перемешивание проводят в течение 3 дней при плюс 50°С. Далее растворитель отгоняют при пониженном давлении, и продукт очищают с помощью колоночной хроматографии на силикагеле [ацетон]. Выход 31%, бесцветные кристаллы, т.пл. плюс 149…150°С; ЯМР1Н (CD3OD), δ м.д.: 1.48 с (6Н, 2СН3), 2.45 с (3Н, СН3(Pyr)), 3.66 (1Н, АВХ, 2JAB=-11.2 Гц, 3JAX=5.8 Гц), 3.68 м (1H, АВХ, 3JBX=5.7 Гц), 3.76 (1Н, АВХ, 2JAB=-9.6 Гц, 3JAX=6.1 Гц), 3.86 (1Н, АВХ, 3JBX=3.9 Гц), 3.92-4.01 м (1Н, СН), 4.59 с (2Н, СН2(Pyr)), 4.94 с (2Н, СН2(Pyr)), 5.01 с (2Н, СН2(Pyr)); ЯМР13С (CD3OD), δ: 18.51, 23.97, 59.82, 61.22, 63.85, 64.19, 72.23, 75.80, 103.74, 133. 96, 143.44, 149.98, 151.24, 151.32; HRMS (TIS): найдено [M+H]+: 314.1604, рассчитано для C15H24NO6 [М+Н]+: 314.1604.
Определение цитотоксичности синтезированных соединений на культуре эмбриональных клеток почки человека.
Цитотоксичность заявляемых соединений общей формулы 1 исследовали на культурах клеток HEK-293 с использованием пролиферативного МТТ-теста (3-(4,5-Диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) (Promega, США). Клетки (1 тыс. клеток в лунке) культивируют в 90 мкл питательной среды согласно условиям культивирования в стандартных условиях в 96-луночном планшете в течение суток. Далее добавляют 10 мкл исследуемого препарата и инкубируют в стандартных условиях в течение 72 часов. Концентрация стоковых растворов составляет 282×10-5 М. Далее среду с препаратами заменяют на питательную среду (80 мкл) и добавляют по 20 мкл МТТ-реагента (5 мг/мл), инкубируют в течение 3,5 часов, затем убирают среду и добавляют 100 мкл ДМСО. По истечении 10 минут измеряют оптическую плотность клеточных растворов при 555 нм (референтная длина волны - 650 нм) на планшетном ридере TECAN (Швейцария). Результаты представлены в процентном отношении к контролю, не подвергавшемся действию препаратов. Для препаратов построена кривая «доза-эффект» и определены величины IC50 и IC25 (Р<0,05). Результаты цитотоксичности синтезированных соединений представлены в таблице (Фиг. 2).
Из представленных в таблице данных следует, что исследуемые вещества представляют собой малотоксичные соединения.
Исследование антиадренергических свойств соединения 1а на мышечных полосках предсердия крысы
Исследования действия соединения 1а на сократительную активность миокарда проводили in vitro на изолированных полосках предсердия инбредных крыс (Rattus Norvegicus, возраст - старше двух месяцев). Все эксперименты проводили в соответствии с этическими нормами Казанского государственного медицинского университета.
Наркотизированных животных фиксируют на специальном хирургическом столе, грудь вскрывают. Сердце вынимают быстро и промывают шприцом для очистки сосудов. Далее сердце помещают в специальный лоток (баня) с буфером Кребса ((мМоль): NaCl - 137.0; KCl - 5.0; MgSO4 - 1.0; NaHCO3 - 11.0; CaCl2 - 2.2; глюкоза - 11.0; аскорбиновая кислота - 0.3; NaH2PO4 - 1.0, рН 7.2-7.4 (Sigma). Буфер оксигенируют карбогеном (95% O2 - 5% CO2) в течение 20 мин. РН измеряют с помощью рН-метра (Mettler Toledo, Швейцария)). Сердечную ткань разрезают на полоски длиной в 4-6 мм и 0.2-0.4 мм в диаметре в зависимости от анатомического строения. Полоски размещают вертикально в лотке (бане), содержащем 20 мл нагретого до плюс 37°С насыщенного кислородом буфера. Верхнюю часть каждой полоски подключают к преобразователю напряжения через металлическую планку, нижнюю часть полоски фиксируют. Ткань стимулируют двумя платиновыми электродами с частотой 0.1 Гц, амплитудой сигнала 40 мВ и длительностью 5 мс электростимулятором ESL - 2 (Россия). Разработку ткани проводят 40-60 мин. В течение этого периода мышечные волокна принимают оптимальное натяжение. Оптимальное натяжение отмечено в точке, после чего сила сжатия мышечной полоски уменьшилась. Эксперименты по исследованию сократимости миокарда проведены на изометрическом приборе PowerLab (Biopac, США) с датчиком силы 0-50 г (Biopac, США). После разрабатывания полос сигналы зарегистрированы специальной программой "Elph_3p9" в течение 5 мин и взяты в качестве контроля. Исследуемые вещества использованы после стабилизации сигнала (изометрическое сокращение).
Согласно результатам эксперимента метопролол показывает значительное ослабление силы сокращения в концентрации 10 мкМоль (74.4±8.1% (n=3, р<0.05%) от первоначальной силы сокращения мышечной полоски сердца). Соединение 1а в той же концентрации снижает силу сокращения мышечной полоски сердца несколько сильнее, чем метопролол (в среднем на 3%, т.е. до 71.2±3.4% (n=5, р<0.05) от первоначального значения).
Исследование кардиодепрессивных свойств соединений общей формулы 1.
Кардиодепрессивное действие (снижение частоты сердечных сокращений - ЧСС) соединений исследовано в опытах на наркотизированных изофлураном мышах. Соединения введены внутрижелудочно в дозе 60 мкмоль/кг однократно за 3±1 минуты до наркотизации изофлураном (1,5-1 об. %) (EICKMEYER ISOFLO Vaporiser, EICKMEYER, Германия). Регистрация ЭКГ у животных проведена во всех стандартных отведениях в течение 1,5-2 часов после внутрижелудочного введения соединений с помощью цифровой записывающей станции PowerLab 4/35 (ADInstruments, Австралия). В качестве препарата сравнения использован метопролол. Снижение ЧСС наиболее активных соединений представлено на Фиг 1. Показано, что полученные вещества по способности снижать ЧСС у мышей не уступают метопрололу или превосходят его.
Метопролол снижает ЧСС у мышей на 35±3%. Время наступления максимального эффекта 44±2 мин, длительность действия 76±5 мин.
Соединение 1е снижает ЧСС у мышей на 53±3%. Время наступления максимального эффекта 67±2 мин, длительность действия 79±3 мин. Таким образом, заявляемое соединение по двум из трех показателей превосходит метопролол.
Соединение 1з снижает ЧСС у мышей на 29±4%. Время наступления максимального эффекта 30±7 мин, длительность действия 70±7 мин. Таким образом, заявляемое соединение также по двум из трех показателей превосходит метопролол.
Соединение 1и снижает ЧСС у мышей на 29±4%. Время наступления максимального эффекта 28±5 мин, длительность действия 94±7 мин. Таким образом, заявляемое соединение также по двум из трех показателей превосходит метопролол.
Соединение 1н снижает ЧСС у мышей на 30±6%. Время наступления максимального эффекта 32±4 мин, длительность действия 82±9 мин. Таким образом, заявляемое соединение также по двум из трех показателей превосходит метопролол.
Таким образом, соединения общей формулы 1 обладают высокой эффективностью и продолжительностью антиадренергических свойств на фоне короткого времени наступления действия.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Заявителем не выявлены источники, в которых содержались бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. Указанное новое свойство объекта обусловливает, по мнению заявителя, соответствие изобретения критерию «изобретательский уровень».
Соединения общей формулы 1 можно внедрить в производство по причине коммерческой доступности исходных веществ, используемых при их синтезе, и возможности использования классического технологического оборудования, применяемого в производстве фармацевтических субстанций.
Бета-адреноблокаторы на основе производных пиридоксина общей формулы 1, обладающие высокой антиадренергической активностью на фоне низкой токсичности: где: