Способ подготовки ожогового бельма роговицы к кератопротезированию
Иллюстрации
Показать всеИзобретение относится к офтальмологии и предназначено для подготовки ожоговых бельм к кератопротезированию. Иссекают поверхностные слои бельма и размещают на поверхности стромы трансплантат. В качестве трансплантата используют культивированный аутологичный хрящевой эквивалент, который моделируют в процессе культивирования или непосредственно перед его размещением на поверхности стромы роговицы. Способ обеспечивает усиление прочностных свойств ожогового бельма для последующего кератопротезирования со снижением или полным исключением отторжения протеза. 4 ил., 2 пр.
Реферат
Предлагаемый способ относится к офтальмологии и предназначен для подготовки ожоговых бельм к последующему кератопротезированию.
Наиболее тяжелым последствием ожогов глаз остается формирование бельм 4-5 категории по классификации Филатова В.П. и Бушмич Д.Г., часто сочетающихся с патологией в придаточном аппарате, переднем и заднем отделах глаза. Наиболее эффективным способом восстановления зрения у таких больных остается метод кератопротезирования, клиническое внедрение которого началось в 50-х годах прошлого века. Однако, несмотря на многообразие клинически апробированных моделей и материалов для кератопротезов, процент их отторжения колеблется от 10 до 75% (Гундорова Р.Л., Малаева Л.В. Отдаленные результаты оптического кератопротезирования. Офтальмологический журнал, 1979, №7; Girard L.J., Hawkins R., Nieves R., et all. Keratoprosthesis: A 12-year follow up. Trans. Amer. Acad. Ophthalmol. Otolaringol., 1977, N 2). Существенную роль в сохранении кератопротеза в бельме играет исходное состояние бельма, т.е. его истончение, которое требует дополнительных хирургических вмешательств.
В клинической практике после имплантаций кератопротезов большинству авторов не удалось избежать таких осложнений, как протрузия имплантата, врастание эпителия в переднюю камеру, выраженная воспалительная реакция (Hicks C.R., Chirila T.V., Clayton А.В., et all. Clinical results of implantation of the Chirila keratoprosthesis in rabbits. Br. J. Ophthalmol., 1998; Marchi V., Ricci R., Pecorella I., Ciardi A., Di Tondo U. Osteo-odonto-keratoprosthesis. Description of surgical technique with results in 85 patients. Cornea, 1994), лизис и протеолиз адгезивного вещества, что значительно уменьшает прочность соединения, вплоть до распада всей конструкции.
Для подготовки ожоговых бельм известно использование имплантата в виде аутослизистой с губы, которую пересаживают на бельмо (Пучковская Н.Л. и др. Офтальмологический журнал, 1978, №7, с. 498-500). Кроме пересадки аутослизистой, через 1,5-2 месяца больному проводят интраламеллярную керато- или склеропластику с использованием гомотрансплаптата роговицы или склеры, высушенного силикагелем или нативного. Кератопротезирование проводят через 3-4 месяца после укрепления бельма.
Однако в ходе этой операции обнаруживается истончение пересаженной аутослизистой с губы и почти полное рассасывание (лизис) трансплантатов. Склеральные трансплантаты меньше лизируются, чем роговичные, но не полностью прорастают сосудами, можно ожидать их дальнейший лизис. Известно применение имплантата для укрепления роговицы в виде аутонадкостницы большеберцовой кости (Волков В.В., Ушаков Н.А., в кн. Вопросы восстановительной офтальмологии. Л., 1972, с. 37). Кусочек аутонадкостницы вводят в карман расслоенного на уровне средних слоев бельма и фиксируют узловыми швами к глубоким слоям бельма. Кератопротезирование возможно через 2-3 месяца, при этом опорную пластину кератопротеза помещают под слой приживленной надкостницы. Однако данный вид трансплантата крайне плохо поддается моделированию, что значительно затрудняет процесс имплантации в связи с необходимостью проведения дополнительных манипуляций, на которые затрачивается достаточно много времени и требуется специальный инструментарий.
Ближайшим аналогом предлагаемого способа является способ того же назначения, включающий использование имплантата для укрепления роговицы в виде аутохряща ушной раковины (Краснов М.М. и др. Офтальмологический журнал, 1978, №7, с. 392-394). Аутохрящ достаточно плотен и гистологически близок к ткани роговицы. Для полного его приживления достаточно 3-4 месяцев, после чего возможно проведение кератопротезирования. Однако общим недостатком аутоимплантатов является то, что они все подвержены лизису в раннем или позднем послеоперационном периоде, что зачастую требует повторения всего комплекса оперативных вмешательств. Кроме того, отбор аутоимплантатов связан с дополнительными операциями и заживлением ран после изъятия аутоимплантатов, часто болезненным и продолжительным. Аутохрящ ушной раковины из-за своей плотности плохо поддастся моделированию, то есть не обладает достаточной сферичностью для того, чтобы внутренняя поверхность хряща полностью совпадала с поверхностью укрепляемого бельма. Это в итоге приводит к прорезыванию краев хрящевого диска, что требует повторных хирургических вмешательств.
Задачей изобретения является разработка нового подхода для подготовки ожоговых бельм роговицы к последующему кератопротезированию.
Техническим результатом предлагаемого изобретения является усиление прочностных свойств ожогового бельма для последующею кератопротезирования со снижением или полным исключением отторжения протеза.
Технический результат достигается за счет использования в качестве трансплантата для подготовки ожогового бельма к кератопротезированию аутологичного хрящевого эквивалента.
Хрящевой эквивалент (Волков А.В. КТТИ, 2006, №2, с. 24-25) культивируется непосредственно из клеток реципиента, при этом достигается аутологичная трансплантация, которая исключает иммунный ответ. Кроме того, культивирование позволяет повлиять на физико-химические и геометрические свойства препарата (плотность материала, форма, толщина, высока, диаметр). С помощью такого метода возможно создавать ткань с необходимым для нас количеством клеточных элементов, что определяет плотность и толщину трансплантата, также иметь возможность задавать форму и необходимую величину.
Пионером в области регенеративной медицины является Паоло Маккиарини, который в течение многих десятков лет работал над созданием хрящевых эквивалентов, и в 2008 г. смог создать хрящевой эквивалент участка трахеи, а в дальнейшем и трансплантировать его человеку.
Аутологичный хрящевой эквивалент для имплантации изготовлен из биоптата хрящевой ткани реципиента лабораторией проблем клеточной пролиферации Института биологии развития им. Кольцова РАН.
Для этого с внутренней поверхности уха кролика после антисептической обработки под местной анестезией (подкожное введение 0,5 мл 2%-ного лидокаина) берут биоптат хрящевой ткани (3×3 мм). В условиях культурального бокса биоптат тщательно промывают в растворе Хэнкса, содержащем антибиотики (200 ед./мл гентамицина). Для выделения хондроцитов из донорского материала используют комбинацию механического измельчения и ферментативной дезагрегации в 0,2%-ном растворе коллагеназы 2 типа в течение 10-16 часов при 37°С. После чего добавляют среду ДМЕМ, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), тщательно пипетируют, клетки осаждают центрифугированием при 300 g 10 мин. Клеточный осадок ресуспендируют в среде ДМЕМ, 10% ЭТС. Клеточную суспензию фильтруют через нейлоновый фильтр с размерами пор 100 мкм, затем клетки вновь осаждают центрифугированием. Клеточный осадок ресуспендируют в ростовой среде ДМЕМ/F12, 10% ЭТС. Через 3 суток среду меняют на полную ростовую среду - ДМЕМ/F12, 10% ЭТС, 50 мкг/мл аскорбиновой кислоты и 10 мМ β-глицерофосфата. Клетки пассируют по достижении монослоя с помощью растворов Версенаи 0,125% трипсина.
Приготовление тканеинженерной конструкции. Все манипуляции приготовления коллагенового геля сделаны в стерильных условиях культурального бокса и на ледяной бане для предотвращения быстрой желатинизации. Стерильный 0,34 М раствор NaOH объединяют с концентрированной (×10) питательной средой 199 в соотношении 1:2 и на каждые 100 мл смеси добавляют 100 мг глутамина и 9 мл 7,5%-ного бикарбоната натрия. Полученную смесь соединяют с охлажденным раствором коллагена в уксусной кислоте в соотношении 1:4. Незастывший гель быстро смешивают с суспензией хондроцитов в концентрации 2×106 кл/мл. После желатинизации коллагенового геля (15-30 мин в CO2 инкубаторе) аккуратно добавляют среду для культивирования хондроцитов. Тканеинженерные конструкции культивируют в течение 7 суток до трансплантации, смену среды осуществляют каждые 2 суток. За сутки до трансплантации тканеинженерные конструкции переводят на среду без сыворотки. Благодаря выбору формочки со средой можно задавать первоначальную форму хрящевого эквивалента, а непосредственно перед хирургическим вмешательством при необходимости создать окончательную модель, которую и трансплантируют. Аутологичные хрящевые эквиваленты представляют из себя полусферичные диски, диаметр и толщина которых для подготовки бельма были выбрана, в частности, величиной 12 и 2-3 мм соответственно.
Полученные хрящевые эквиваленты использованы для аутологичной имплантации в несквозные дефекты роговичной ткани.
В экспериментальном исследовании использовано 20 глаз со сформированными ожоговыми бельмами (Obenberger J. Paper strips and rings as simple tools for standardisation of experimental eye injuries // Ophtalm. Res. - 1975. - Vol. 6. - P. 363-366). Бельма созданы по стандартной методике. Ожог получен 10%-ным раствором NaOH, в котором промокались бумажные диски диаметром 10 мм, фиксируемые на поверхности роговицы животных в течение 20 секунд. Затем глазное яблоко и конъюнктивальную полость обильно промывали физиологическим раствором. В течение 14 дней животные получили противовоспалительную терапию - 0,3%-ный офтаквикс, мазь Флоксал, в/м введен раствор Гентамицина 1,0 мл. Срок формирования бельма составил 180 дней.
Способ осуществляют следующим образом.
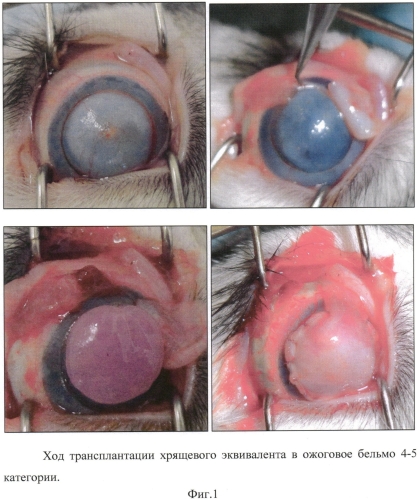
Накладывают блефаростат. Трепаном 8,0 мм производят центральный надрез роговичной ткани до 1/3 толщины стромы. Выкраивают послойный лоскут ткани в пределах трепанации. В несквозной дефект роговицы укладывают трансплантат в виде хрящевого эквивалента, который фиксируют перекидными швами. В 2 мм от лимба в верхней части глазного яблока производят линейный разрез конъюнктивы. Конъюнктиву отсепаровывают тупым способом, формируют лоскут на ножке, которым, как это принято, покрывают роговично-хрящевой комплекс и ушивают непрерывными круговыми швами. Производят блефарорафию (принудительное сшивание век) (Фиг. 1. Ход трансплантации хрящевого эквивалента в ожоговое бельмо 4-5 категории).
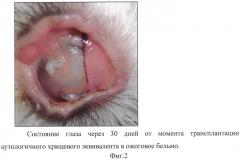
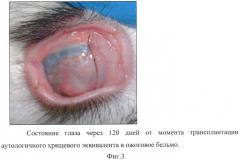
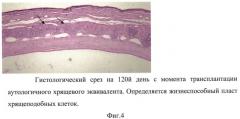
Пример №1. Экспериментальный кролик №1 со сформированным химическим ожогом 4-5 категории. Произведен забор биоптата хряща из уха, культивирован хрящевой эквивалент полусферичной формы, диаметром 12 мм и толщиной 2 мм. Перед оперативным вмешательством из данной модели выкроен трепаном диск диаметром 8,5 мм и подготовлен для имплантации в ожоговое бельмо. Трансплантация аутологичного хрящевого эквивалента выполнена по описанной выше методике. Так как веки сшиты, клиническую картину оценивали только по наличию или отсутствию воспалительной реакции. Удаление швов проведено через 1 месяц после трансплантации. За этот срок наблюдения признаков воспаления и отторжения трансплантата зафиксировано не было (Фиг. 2. Состояние глаза через 30 дней от момента трансплантации аутологичного хрящевого эквивалента в ожоговое бельмо). При проведении на данном сроке оптической когерентной томографии выявлено увеличение толщины ожогового бельма. Наблюдение было продолжено еще в течение 90 дней. К концу периода наблюдения (120 дней) выявлен трансплантат с выраженной конъюнктивизацией и развитой сосудистой сетью (Фиг. 3. Состояние глаза через 120 дней от момента трансплантации аутологичного хрящевого эквивалента в ожоговое бельмо). При этом толщина роговично-хрящевого комплекса сохранилась стабильной и признаков отторжения ткани не выявлено, что было подтверждено при гистологическом исследовании (Фиг. 4. Гистологический срез на 120-й день с момента трансплантации аутологичного хрящевого эквивалента. Определялся жизнеспособный пласт хрящеподобных клеток).
Пример №2. Экспериментальный кролик №10 со сформированным химическим ожогом 4-5 категории. Произведен забор биоптата хряща из уха, культивирован хрящевой эквивалент с полусферичной формой, диаметром 10 мм и толщиной 3 мм. В клинической практике для укрепления ожогового бельма роговицы используются хрящевые трансплантаты диаметром 9-10 мм, полученные из собственных тканей ушной раковины пациентов. Это обусловлено тем, что для долговременной и стабильной имплантации кератопротеза порой в единственно зрячие глаза ожоговых пациентов необходимо укрепление бельма «от лимба до лимба», чтобы исключить возможный лизис тканей и отторжение кератопротезов. В связи с этим на данном этапе исследования мы использовали хрящевой эквивалент с параметрами, заданными еще на этапе культивирования и не подвергали дополнительному моделированию перед хирургическим вмешательством. Ход операции аналогичен представленному выше описанию. В течение всего рафического периода признаков воспаления и отторжения трансплантата выявлено не было. Швы с век были удалены через 1 месяц. При осмотре на поверхности глазного яблока определялась выраженная конъюнктивизация с хорошо развитой сетью сосудов, что свидетельствует о полном приживлении трансплантата. В данном экспериментальном исследовании весь срок наблюдения также составил 120 дней. За этот период не выявлено признаков отторжения трансплантата.
Использованная нами стандартная модель нанесения щелочного ожога и формирования бельма 4-5 категории (Obenberger J. Paper strips and rings as simple tools for standarlisalion of experimental eye injuries // Ophtalm. Res. - 1975. - Vol. 6. - P. 363-366) является достаточно адекватной, что позволяет обоснованно экстраполировать полученные экспериментальные данные на клинические условия для подготовки пациентов с ожоговыми бельмами к кератопротезированию. Способ позволяет повысить качество хирургического лечения пациентов с тяжелыми постожоговыми бельмами за счет использования в качестве трансплантата при подготовке бельм культивированного аутологичного хрящевого эквивалента, параметры которого возможно моделировать.
Способ подготовки ожогового бельма роговицы к кератопротезированию, включающий укрепление роговицы, отличающийся тем, что иссекают поверхностные слои бельма до 1/3 толщины стромы, аутологичный хрящевой эквивалент моделируют по форме в виде полусферы диметром 10 и 12 мм и толщиной 2-3 мм и размещают его в строме роговицы, причем хрящевой эквивалент моделируют в процессе культивирования или непосредственно перед его размещением на поверхности стромы роговицы.