Композиции и способы модулирования гемостаза
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к увеличивающим гемостаз вариантам фактора Ха, кодирующим их нуклеиновым кислотам, получению и применению фактора Xa для лечения расстройств, связанных с гемостазом. Заявленный фактор Xa включает аминокислотную замену в последовательности фактора X дикого типа в положении 16, 17 или 194 в системе нумерации химотрипсина. Изобретение позволяет эффективно увеличивать гемостаз. 7 н. и 14 з.п. ф-лы, 11 ил., 5 табл., 1 пр.
Реферат
По настоящей заявке испрашивается приоритет на основании свода законов США 35 §119(е) по предварительной заявке на патент США US 60/736680, поданной 15 ноября 2005 г., полное содержание которой включено в настоящее описание в виде ссылки, несмотря на то, что оно полностью изложено ниже.
В соответствии со сводом законов США 35 §202(с) признается, что правительство США обладает бесспорными правами на настоящее изобретение, которое было выполнено совместно с Национальным институтом здоровья, грант PO1 HL-74124-01.
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины и гематологии. Более конкретно, настоящее изобретение предусматривает новые коагулирующие агенты и способы их применения для модулирования каскада коагуляции у пациентов, нуждающихся в этом.
Уровень техники
В описании настоящего изобретения цитируются публикации и патентные материалы для описания состояния области, к которой относится настоящее изобретение. Каждая из цитируемых работ включена в настоящее изобретение в виде ссылки на ее сущность.
Коагулирующими ферментами являются ферменты типа трипсина, которые принадлежат семейству протеаз пептидазы S1, которые несут складчатость, подобную складчатости химотрипсина. Коагулирующие протеазы содержат каталитические домены, которые в высокой степени гомологичны друг другу и родовым сериновым протеазам пищеварения. Структурная гомология/идентичность настолько велика (>70%), что остатки в каталитических доменах коагулирующих ферментов пронумерованы в соответствии с соответствующими остатками в химотрипсиногене.
Ферменты коагуляции циркулируют в крови в виде неактивных предшественников, зимогенов, которым требуется протеолитическое расщепление для активирования. Зимогены обладают ~10000-кратной или меньшей протеолитической активностью при сопоставлении с сериновыми протеазами, вырабатываемыми в ходе активирования. Инициация коагуляции в месте повреждения сосуда приводит к сериям реакций, в которых зимоген конвертируется в протеазу через специфическое протеолитическое расщепление и формирует фермент для последующей реакции. В результате достигается активирование клеток крови и конверсия растворимого фибриногена в нерастворимый фибрин, после чего формируется сгусток. Избыток протеаз удаляется реакцией с циркулирующими в кровяном русле ингибиторами протеаз, выступающими в качестве «самоубийственных» субстратов, или с теми, которые распознают действующие ферменты. Таким образом, протеолитическое активирование зимогенов коагуляции является ключевым моментом в регуляции каскада коагуляции.
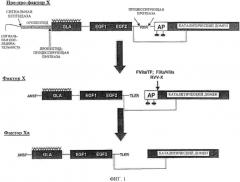
Хотя некоторых зимогены коагуляции расщепляются по двум или нескольким сайтам в соответствующих реакциях активирования, формирование протеаз требует расщепления по одному сайту. Расщепление по такому сайту и его структурные последствия оцениваются наиболее простым способом, используя систему гомологической нумерации, основанную на химотрипсиногене, причем интенсивная работа по структуре была проделана с трипсиногеном и трипсином. Конверсия зимогена в сериновую протеазу требует расщепления после Arg15 (обычно расщепление связи между Arg15 и ILe16), что обычно приводит к активированию пептида и проявлению нового N-конца в каталитическом домене, начинающемся с Ile16. В трипсине и факторе Ха новая N-концевая последовательность начинается с Ile16-Val17-Gly19-Gly19. Для ферментов коагуляции новая N-концевая последовательность является вариацией на ту же тему. N-концевая последовательность затем сворачивается в каталитический домен и встраивается в N-концевую связующую щель способом, зависящим от специфичности последовательности, который называется «молекулярной сексуальностью». См. фиг.2. Соответственно варианты с измененными N-концевыми последовательностями предположительно не претерпевают молекулярную сексуальность по сопоставимому пути. N-концевые инсерции приводят к формированию соляного мостика между группой α-NH2 остатков Ile16 и Asp194 внутри каталитического домена. Формирование солевого мостика связано с многочисленными изменениями в структуре каталитического домена, включая: реаранжировки так называемых доменов активирования (фиг.3), формирование оксианионной щели, необходимой для катализа и формирование субстратного сайта связывания. Эти изменения приводят к созреванию активной сериновой протеазы. Ключевое значение специфических по последовательностям взаимодействий нового N-конца через формирование молекулярной сексуальности и солевого мостика для созревания активной протеазы доказывается следующими фактами: бактериальные протеазы, не требующие расщепления для активации, имеют другую боковую цепь в каталитическом домене к солевому мостику с Asp194; трипсиноген может быть активирован в протеиназа-подобную конформацию без расщепления, но в чрезвычайно высоких концентрациях дипептида Ile-Val, который встраивают в щель, хотя и весьма неэффективно; дипептид Val-Ile и другие варианты гораздо менее эффективны; кроме того, есть два примера бактериальных белков, которые активируют зимогены коагуляции в отсутствии расщепления путем разрушения механизма активации через обеспечение их собственных N-концов, которые встраивают в N-концевую связывающую щель.
Структурные изменения, описанные выше, дают молекулярное объяснение для конверсии предшественника зимогена в действующую сериновую протеазу. Однако в отличие от трипсина, который в полной мере активен после расщепления по сайту Arg15, многие коагулирующие ферменты действуют очень слабо, находясь на соответствующих протеиновых субстратах. Даже если бы они располагали полностью функционально активными сайтами и могли расщеплять низкомолекулярные пептидильные субстраты, эффективное расщепление биологического субстрата часто требует кофакторного белка (фиг.2). В этих случаях кофакторные белки увеличивают скорость расщепления белкового субстрата в несколько тысяч раз. Хотя механизм, с помощью которого функция кофакторных белков по-прежнему может быть разрешена, они вряд ли действуют, придавая протеазе более ферментоподобный вид и, следовательно, делая более эффективной. Ключевой момент, за одним исключением, заключается в том, что кофакторы избирательно связывают протеазу и не связывают соответствующий зимоген. Например, фактор Ха с высоким сродством связывается с мембрано-связанным FVa, несмотря на то, что зимогенный фактор Х не связывает FVa.
В зависимости от состояния пациента может быть желательным создание белков измененного каскада коагуляции, которые проявляют повышенную или пониженную функцию коагуляции. Это объект настоящего изобретения, предусматривающий такие белки для применения в качестве лекарственных средств.
Краткое описание изобретения
В соответствие с настоящим изобретением композиции и способы предусмотрены для воздействия на регуляторные сайты в метаболическом пути транзиции FX зимогена → протеазы, тем самым вызывая выработку более «зимоген-подобных» видов FXa. Композиции и способы настоящего изобретения эффективны для модуляции гемостаза у пациентов, нуждающихся в этом.
В одном из вариантов осуществления настоящего изобретения предусмотрен вариант фактора Х/фактора Ха зимогена/протеазы, который модулирует гемостаз. Предпочтительно вариант зимогена/протеазы кодируется последовательностью SEQ ID NO:2, в которой нуклеотиды 1684-1695 могут соответствовать какой-либо аминокислоте, при условии, что нуклеотиды 1684-1686 не кодируют Val или Ala. Более предпочтительно вариант зимогена/протеазы содержит по меньшей мере одну модификацию в последовательности SEQ ID NO:1, выбранную из группы, состоящей из а) Не в положении 16 является Leu, Phe, Asp или Gly, б) Val в положении 17 является Leu, Ala или Gly, в) Asp в положении 194 является Asn или Glu. Нуклеиновые кислоты, кодирующие вариант зимогена/протеазы настоящего изобретения и способы их применения также описаны в настоящем изобретении. Такие нуклеотиды могут необязательно кодировать внутриклеточный сайт расщепления РАСЕ/фурина.
В другом варианте осуществления настоящего изобретения предусмотрена нуклеиновая кислота с последовательностью SEQ ID NO:2, в которой нуклеотиды в положениях 1684-1695 кодируют аминокислоты, выбранные из группы, включающей Leu-Val-Gly, Gly-Val-Gly, Ile-Ala-Gly, Phe-Val-Gly и Ile-Gly-Gly, причем указанная нуклеиновая кислота необязательно включает нуклеотиды в положениях 2233-2235, которые кодируют аминокислоту, выбранную из группы, состоящей из Asn или Glu.
Также предусмотрена фармацевтическая композиция, включающая вариант фактора Ха настоящего изобретения в биологически совместимом носителе. К другому предпочтительному объекту настоящего изобретения относятся способы лечения расстройств, связанных с гемостазом, у пациентов, нуждающихся в этом, заключающихся во введении в организм терапевтически эффективного количества фармацевтических композиций, содержащих вариант фактора Х/Ха зимогена/протеазы, описанный в настоящем изобретении. Такие способы могут быть эффективны при лечении расстройств, в которых требуется прокоагулянт и к которым без ограничения относятся: гемофилия А, гемофилия В, гемофилия А и гемофилия В, ассоциированные с ингибирующими антителами, недостаточность фактора коагуляции, недостаточность витамин К-эпоксидредуктазы С1, недостаточность гамма-карбоксилазы, кровотечение, связанное с травмой, повреждением, тромбозом, тромбоцитопенией, инсультом, коагулопатией, диссеминированной внутрисосудистой коагуляцией;
расстройства, связанные с избыточным антикоагуляционным лечением, синдром Бернара-Сулье, тромбоцитастения Гланцманна и недостаточность кровяного депо.
Некоторые варианты зимогена/протеазы могут быть применимы для лечения расстройств в тех случаях, когда желательна антикоагуляция. К таким расстройствам без ограничений относятся тромбоз, тромбоцитопения, инсульт и коагулопатия.
К другому объекту настоящего изобретения относятся клетки-хозяева, экспрессирующие вариант зимогена/протеазы настоящего изобретения, для выработки его больших количеств.
Краткое описание фигур
Фиг.1. Процессинг фактора X. Фактор Х (FX) синтезируется с сигнальной последовательностью и пропептидом, которые удаляются до его секреции. Фактор Х является зимогеном и не обладает ферментной активностью. FX конвертируется в фактор Ха после расщепления связи Arg15-Ile16, что приводит к высвобождению пептида активации.
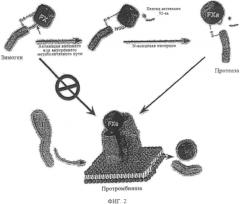
Фиг.2. Конверсия зимогена в протеазу. Переход зимогена в протеазу для фактора Х и сборка фактора Ха в протромбиназу (FXa, FVa, фосфолипид и ионы кальция). Этот фермент конвертирует протромбин (II) в тромбин (IIa).
Фиг.3. Рентгеноструктура FXa. Каталитический домен FXa в стандартной ориентации. Отмечены структурные области наряду с важными остатками. По публикации Brandstetter и др., J. Biol. Chem. 271, 1996, cc.29988-29992.
Фиг.4. SDS-PAGE анализ вариантов FX/Xa. 4-12% SDS-PAGE гели прогоняют или в невосстановительных, или в восстановительных условиях, и затем окрашивают красителем кумасиновым синим.
Фиг.5. Аминокислотная последовательность (SEQ ID NO:1) и последовательность нуклеиновой кислоты (SEQ ID NO:2) фактора Ха. Сайты и положения аминокислот в желательных модификациях последовательности SEQ ID NO:1 выделены жирным шрифтом.
Фиг.6. Активность фактора Ха в плазме при гемофилии В. Дикого типа FXa или FXaI16L (2 нМ) вносили в плазму больного гемофилией В и через определенные интервалы времени образцы разводили (0,1 нМ) и исследовали по коагуляции с учетом АПТВ - активированного частичного (парциального) тромбопластинового времени.
Фиг.7. Коррекция АПТВ. Фактор Xa-I16L (200 мкг/кг; n=7 мышей) или фосфатно-солевой буфер (ФСБ) вводят инъекцией мышам с гемофилией В (C57BL/6) в хвостовую вену. После инъекции через 5 и 30 мин отбирают кровь и проводят исследование методом АПТВ. Красная пунктирная линия представляет величину АПТВ нормальных животных линии C57D1/6.
Фиг.8. Оценка гемостаза с последующим анализом методом зажима хвоста у мышей с гемофилией В (ГВ). Потеря крови измеряется по содержанию гемоглобина в физиологическом растворе (ФСБ) с помощью А525 после нанесения раны. Число мышей (Balb с): дикого типа (n=7), с ГВ-ФСБ (n=6), ГВ-FXaI16L (n=7).
Подробное описание изобретения
Протеолиз является важным фактором коагуляции крови и лежит в основе многих механизмов, регулирующих нормальный гемостаз. Прокофакторы и зимогены не могут в какой-либо значительной степени участвовать в их соответствующих макромолекулярных ферментных комплексах. Это свидетельствует о том, что протеолитическая активация должна привести к соответствующим структурным изменениям и к экспрессии сайтов, которые наделяют фермент, субстрат и кофактор связывающими способностями. Хотя активация прокофактора и зимогена интенсивно исследовалась, взаимосвязь между протеолизом и экспрессией сайтов связывания, которая обусловливает функцию, полностью не установлена. В настоящем изобретении предусмотрены модельные композиции и системы, которые разъясняют молекулярные механизмы, лежащие в основе экспрессии макромолекулярных связывающих взаимодействий, сопровождающих транзиции от состояния зимогена к ферменту.
Фактор Ха (FX)1 является витамин K-зависимым двухцепочечным гликопротеином, который играет главную роль в коагуляции крови (фиг.1). Зимоген сериновой протеазы является субстратом и для внешних (тканевый фактор/FVIIa), и для внутренних (FVIIIa/FIXa) ферментных комплексов, расщепляющих неустойчивую химическую связь Arg15-Ile16 в FX, высвобождая состоящий из 52 аминокислот активирующий пептид, который генерирует FXa. Фактор Ха является протеазой, ответственной за конверсию протромбина в тромбин (фиг.2), Хотя фактор Ха является полностью компетентной протеазой и осуществляет каталитический механизм расщепления протромбина, он весьма слабый катализатор для данной реакции. Его тесное связывающее взаимодействие с кофактором, фактором Va, на поверхности мембраны сильно увеличивает степень формирования тромбина без существенного воздействия на другие реакции, катализируемые фактором Ха. Изменения N-концевой последовательности (Ile-Val-Gly) после расщепления сайта Arg15, которые приводят к субоптимальной молекулярной сексуальности, предположительно вызывает формирование «зимоген-подобного» производного Ха, которое обладает пониженной, или даже нулевой, протеолитической активностью. Такие производные предположительно не чувствительны к подавлению ингибиторами плазматической протеазы, например, антитромбином III, и не участвуют в инициации коагуляции с последующим сосудистым поражением, поскольку предположительно они не связываются очень сильно с TFPI. Фактор Ха плотно связывает фактор Va в отличие от зимогенного фактора X. Таким образом, ожидается, что зимоген-подобные формы фактора Ха связываются с Va слабее, но полностью восстанавливаются при достаточно высоких концентрациях кофактора и эффективно катализируют формирование тромбина. Зимоген-подобные формы фактора Ха с подобными свойствами предположительно действуют в качестве долгоживущих в кровяном русле протеаз, которые с другой стороны разрушаются, но сохраняют способность катализировать формирование тромбина при связывании с фактором Va. Они могут быть терапевтическими прокоагулянтами, которые шунтируют недостаточности других факторов свертывания крови в каскаде без вредных воздействий, связанных с инфузией полностью функционального фактора дикого типа FXa.
I. Определения:
Различные термины, связанные с биологическими молекулами настоящего изобретения, используют в описании и формуле настоящего изобретения.
Понятие «вариант зимогена/протеазы» означает модифицированный зимоген FX или протеазу FXa, которые была изменены генетически таким образом, что их протеазная активность при конверсии в FXa снижена или «зимоген-подобна» в отсутствии специфических кофакторов (например, связывающее сродство для активного сайта ниже, чем у молекулы дикого типа). Важно отметить, что такое сродство/активность восстанавливается в присутствии характерных кофакторов, к которым относится без ограничений фактор Va. К предпочтительным сайтам аминокислотных изменений в исходной молекуле FX относятся замещение изолейцина в положении 16, замещение валина в положении 17 и замещение аспарагиновой кислоты в положении 194, при условии, что аминокислота в положении 16 не является валином или аланином.
Фраза «расстройства, связанные с гемостазом» подразумевает расстройства, связанные с кровотечением, например, гемофилию А и В, пациентов с гемофилией А и В с ингибирующими антителами, недостаточность факторов коагуляции, например, факторов VII, IX, X, XI, V, XII, II, фактора фон Виллебранда, комбинированная недостаточность факторов FV/FVIII, недостаточность витамин K-эпоксидредуктазы С1, недостаточность гамма-карбоксилазы; кровотечение, связанное с травмой, повреждением, тромбозом, тромбоцитопенией, инсультом, коагулопатией, диссеминированной внутрисосудистой коагуляцией; избыточная антикоагуляция, связанная с гепарином, низкомолекулярным гепарином, пентасахаридом, варфарином, низкомолекулярными антитромботическими факторами (т.е. ингибиторами FXa); расстройства, связанные с тромбоцитами, например, синдром Бернара-Сулье, тромбоцитастения Гланцманна и недостаточность кровяного депо. К расстройствам, связанным с гемостазом, также относятся кровотечения, связанные с тромботическими расстройствами, например, тромбозом глубоких вен, тромбозом, связанным с сердечнососудистым заболеванием или с онкологическим заболеванием, тромбозом, возникающим в результате установки постоянных катетеров или других инвазивных хирургических процедур, а также с тромбозом, ассоциированным с аутоиммунным заболеванием, например, красной волчанкой. Варианты зимогена/протеазы также могут обеспечить необходимый гемостаз пациентам с диссеминированной внутрисосудистой коагуляцией или коагулопатией потребления, которые возникают при различных болезненных состояниях.
Применительно к нуклеиновым кислотам настоящего изобретения иногда используется понятие «выделенная нуклеиновая кислота». Это понятие применительно к ДНК означает, что молекула ДНК отделена от последовательностей, с которыми она немедленно конъюгирует (в 5' и 3' направлениях) в нативном геноме организма, от которого она происходит. Например, «выделенная нуклеиновая кислота» может быть молекулой ДНК или кДНК, инсертированной в состав вектора, например, вирусного или плазмидного вектора, или может быть интегрирована в ДНК прокариота или эукариота.
Относительно молекул РНК настоящего изобретения понятие «выделенная нуклеиновая кислота» в первую очередь относится к молекуле РНК, кодируемой выделенной молекулой ДНК, описанной выше. В другом варианте это понятие может относиться к молекуле РНК, которая в существенной степени отделена от молекул РНК, с которыми она может быть связана в естественных условиях (т.е. в клетках или тканях), и в результате находится в «существенно чистой» форме (понятие «существенно чистая» форма характеризуется ниже).
В контексте настоящего изобретения применительно к белкам иногда употребляется понятие «выделенный белок» или «выделенный и очищенный белок». Это понятие преимущественно относится к белку, вырабатываемому в результате экспрессии выделенной молекулы нуклеиновой кислоты настоящего изобретения. В другом варианте это понятие относится к белку, который существенным образом отделен от других белков, с которыми он может быть естественным образом ассоциирован, при этом белок находится в «существенно чистой» форме.
Понятие «промоторная область» относится к областям регуляции транскрипции гена, которые могут располагаться с 5'- или 3'-конца кодирующей области, или внутри кодирующей области, или внутри интронов.
Понятие «вектор» относится к несущей молекуле ДНК небольшого размера, в состав которой может быть встроена последовательность ДНК для последующей интродукции в клетку-хозяина, в которой она может реплицироваться. Понятие «экспрессирующий вектор» означает специальный вектор, который содержит ген или последовательность нуклеиновой кислоты с необходимыми регуляторными областями, требуемыми для экспрессии в клетке-хозяине.
Понятие «оперативно связанный» означает, что регуляторные последовательности, необходимые для экспрессии кодирующей последовательности, расположены в молекуле ДНК в определенных положениях относительно кодирующей последовательности таким образом, чтобы влиять на экспрессию кодирующей последовательности. То же определение иногда используют применительно к сборке кодирующих последовательностей и элементов контроля транскрипции (например, промоторов, энхансеров, элементов терминации) в составе экспрессирующего вектора. Это определение иногда также применяют к сборке последовательностей нуклеиновых кислот из первой и второй молекулы нуклеиновой кислоты, в результате чего возникает гибридная молекула.
Понятие «существенно чистое» относится к препарату, включающему по меньшей мере 50-60 мас.% целевого соединения (например, нуклеиновой кислоты, олигонуклеотида, белка и т.д.). Более предпочтительно препарат включает по меньшей мере 75 мас.%, наиболее предпочтительно 90-99 мас.% целевого соединения. Чистоту определяют методами, применимыми для целевого соединения (т.е. хроматографическими методами, гель-электрофорезом в агарозе или полиакриламиде, ВЭЖХ и др.).
Фраза «в значительной степени состоящая из» применительно к определенной аминокислотной или нуклеотидной последовательности означает последовательность, имеющей свойства данной последовательности SEQ ID NO:. Например, при ссылке на аминокислотную последовательность эта фраза относится к последовательности самой по себе, а также к молекулярным модификациям, которые не влияют на основные и новые свойства последовательности.
Понятие «олигонуклеотид» в контексте настоящего изобретения относится к праймерам и зондам настоящего изобретения и представляет молекулу нуклеиновой кислоты, включающую два или более рибо- или дезоксирибонуклеотидов, предпочтительно более трех. Точный размер олигонуклеотида может зависеть от различных факторов и от конкретного назначения, для которого олигонуклеотид применяют.
Понятие «зонд» в контексте настоящего изобретения относится к олигонуклеотиду, полинуклеотиду или нуклеиновой кислоте, или РНК, или ДНК, которые либо естественным образом присутствуют после ферментного расщепления или вырабатываются синтетически, и способны к отжигу или специфической гибридизации с последовательностями нуклеиновых кислот, комплементарными зонду. Зонд может быть одноцепочечным или двухцепочечным. Реальная длина зонда может зависеть от многих факторов, включая температуру, источник зонда и способ применения. Например, для диагностики, в зависимости от сложности последовательности-мишени, олигонуклеотидный зонд обычно содержит 15-25 или более нуклеотидов, хотя также может быть меньше нуклеотидов.
В контексте настоящего изобретения зонды выбирают таким образом, что они «существенно» комплементарны разным цепям конкретной последовательности нуклеиновой кислоты-мишени. Это означает, что зонды должны быть существенно комплементарными, чтобы осуществлять «специфическую гибридизацию» или отжиг с их соответствующими цепями-мишенями при ряде заранее определенных условий. Следовательно, последовательность зонда не должна точно отражать комплементарную последовательность мишени. Например, некомплементарный нуклеотидный фрагмент может быть присоединен к 5'- или 3'-концу зонда, а оставшаяся последовательность зонда является комплементарной цепи-мишени. В другом варианте некомплементарные основания или более длинные последовательности могут быть распределены в зонде, при условии, что последовательность зонда в значительной степени комплементарна последовательности нуклеиновой кислоты-мишени, что позволяет специфически осуществлять отжиг.
Понятие «специфическая гибридизация» относится к ассоциации между двумя однонитевыми молекулами нуклеиновой кислоты с существенно комплементарными последовательностями для осуществления такой гибридизации при заранее определенных условиях, обычно применяемых в данной области (иногда употребляют понятие «существенная комплементарность»). В частности, это понятие относится к гибридизации олигонуклеотида с существенно комплементарной последовательностью, присутствующей в однонитевой молекуле ДНК или РНК настоящего изобретения, для реального исключения гибридизации олигонуклеотида с однонитевыми нуклеиновыми кислотами с некомплементарной последовательностью.
В контексте настоящего изобретения понятие «праймер» означает олигонуклеотид, или из РНК, или из ДНК, либо однонитевой, либо двунитевой, полученный из биологической системы, или выработанный в результате обработки ферментами рестрикции, или полученный синтетически, который при помещении в определенную среду может функционировать в качестве инициатора матричного синтеза нуклеиновой кислоты. При наличии соответствующей матрицы нуклеиновой кислоты, необходимых нуклеозидтрифосфатов - предшественников нуклеиновых кислот, фермента полимеразы, соответствующих кофакторов и условий, например, определенной температуры и рН, праймер может удлиняться со своего 3'-конца добавлением нуклеотидов за счет действия полимеразы или близкого действия для получения праймер-протяженного продукта.
Праймер может варьировать в длину в зависимости от определенных условий и потребностей. Например, для диагностики олигонуклеотидный праймер обычно содержит 15-25 или более нуклеотидов в длину. Праймер должен обладать достаточной комплементарностью по отношению к целевой матрице для индукции синтеза целевого наращиваемого продукта, т.е. быть способным к отжигу с целевой цепью матрицы способом, достаточным для обеспечения 3'-гидроксильной части молекулы праймера при соответствующем сопоставлении для применения в инициации синтеза полимеразой или близким по действию ферментом. Необязательно, чтобы последовательность праймера представляла точную копию целевой матрицы. Например, некомплементарная нуклеотидная последовательность может быть присоединена к 5'-концу другого комплементарного праймера. В другом варианте некомплементарные основания могут быть распределены в составе олигонуклеотидной последовательности праймера, при условии, что последовательность праймера обладает достаточной комплементарностью по отношению к последовательности целевой матричной цепи для функционального обеспечения комплекса матрицы-праймера для синтеза наращиваемого продукта.
В контексте настоящего изобретения понятие «процент идентичности» относится к сравнению последовательностей нуклеиновых кислот или аминокислотных последовательностей. Последовательности нуклеиновых кислот и аминокислот часто сравнивают, используя компьютерные программы, которые сопоставляют последовательности нуклеиновых кислот или аминокислот и выявляют разницу между двумя последовательностями. Для целей настоящего изобретения сравнение последовательностей нуклеиновых кислот проводят, используя программу GCG Wisconsin Package, версия 9.1, которую можно получить в Компьютерной генетической группе в Мэдисоне, штат Висконсин. Для удобства параметры, принимающие значение по умолчанию (пенальти создания гэпа = 12, пенальти протяженности гэпа = 4), устанавливаемые данной программой, предназначены для применения в настоящем изобретении для сравнения идентичности последовательностей. В другом варианте может применяться программа Blastn 2.0, предоставляемая Национальным центром информации в области биотехнологии (на сайте http://www.ncbi.nlm.nih.gov/blast/; Altschul и др., J Mol Biol 215, 1990, cc.403-410), использующая выверку гэпов с параметрами, принимающими значение по умолчанию, для определения уровня идентичности и близости между последовательностями нуклеиновой кислоты и последовательностями аминокислот.
II. Приготовление молекул нуклеиновой кислоты, кодирующей вариант зимогена-протеазы, и полипептидов
А. Молекулы нуклеиновой кислоты
Молекулы нуклеиновой кислоты, кодирующие зимоген/протеазы настоящего изобретения, могут быть получены с помощью методов рекомбинантной ДНК. Благодаря информации о нуклеотидной последовательности приготовление молекул отдельных нуклеиновых кислот настоящего изобретения возможно разными способами. Например, последовательности нуклеиновых кислот, кодирующие полипептид зимогена/протеазы, могут быть выделены из соответствующих биологических источников с помощью стандартных протоколов, хорошо известных в данной области.
Нуклеиновые кислоты настоящего изобретения могут поддерживаться в виде ДНК в каком-либо обычном клонирующем векторе. В предпочтительном варианте осуществления настоящего изобретения клоны поддерживают в плазмидном клонирующем/экспрессирующем векторе, например, pBluescript (фирма Stratagene, La Jolla, Калифорния), который размножается в соответствующих клетках-хозяевах Е. coli. В другом варианте нуклеиновые кислоты могут поддерживаться в векторе, пригодном для экспрессии в клетках млекопитающего. В тех случаях, когда пост-трансляционные модификации воздействуют на функцию зимогена/протеазы (например, фактор Ха), предпочтительно экспрессировать молекулу в клетках млекопитающего.
В одном из вариантов осуществления настоящего изобретения нуклеиновые кислоты, кодирующие варианты зимогена фактора X, могут быть дополнительно модифицированы за счет инсерции внутриклеточного сайта протеолитического расщепления. Для экспрессии «активированных» зимоген-подобных вариантов FXa в клетках млекопитающих внутриклеточный сайт протеолитического расщепления может быть встроен между положениями Arg15 и Arg16 в варианте зимогена FX. К таким сайтам расщепления относятся: Arg-Lys-Arg или Arg-Lys-Arg-Arg-Lys-Arg. Эти сайты расщепления эффективно распознаются протеазами (РАСЕ|фурин-подобными ферментами) в клетках и выводятся. Это приводит к процессированному варианту РХ(а), в котором тяжелая цепь молекулы теперь начинается с положения 16. Интродукция данного сайта расщепления в указанное положение может привести к внутриклеточной конверсии FX в FXa.
В другом варианте осуществления настоящего изобретения целый состоящий из 52 аминокислот активирующий пептид может быть удален и внутриклеточный сайт расщепления протеазой может быть встроен в место, которое приведет к формированию варианта FXa.
В конечном счете, эти типы модификаций позволяют секретироваться «активно» процессированной форме варианта РХ из клеток, экспрессирующих модифицированный вариант FX. Секреция фактора расщепления устраняет необходимость в протеолитическом расщеплении во время свертывания крови или при последующем выделении белка.
К вариантам молекул нуклеиновых кислот, кодирующих вариант зимогена/протеазы настоящего изобретения, относятся кДНК, геномная ДНК, РНК, их фрагменты, которые могут быть одно- или двунитевыми. Таким образом, настоящее изобретение предусматривает олигонуклеотиды (смысловые или антисмысловые цепи ДНК или РНК), чьи последовательности могут гибридизироваться по меньшей мере с одной последовательностью молекулы нуклеиновой кислоты настоящего изобретения. Такие олигонуклеотиды применимы в качестве зондов для выявления экспрессии зимогена/протеазы.
Б. Белки
Полипептид настоящего изобретения зимогена/протеазы полной длины или в виде варианта, может быть приготовлен разными способами, известными в данной области. Белок может быть очищен из соответствующих источников, например, из трансформированных бактерий или культивируемых животных клеток или тканей, которые экспрессируют зимоген/протеазу, методом иммуноаффинной очистки. Однако этот способ не является предпочтительным из-за низкого количества белка, присутствующего в клетках данного типа в данное время.
Доступность молекул нуклеиновой кислоты, кодирующих вариант полипептида зимогена/протеазы, позволяет вырабатывать зимоген/протеазу, используя in vitro методы экспрессии, известные в данной области. Например, кДНК или ген могут быть клонированы в соответствующем векторе транскрипции in vitro, например, pSP64 или pSP65 для транскрипции in vitro, с последующей трансляцией в бесклеточной системе в соответствующем бесклеточной системе трансляции, например, в лизатах проростков пшеницы или в лизатах ретикулоцитов кролика. Системы трансляции и транскрипции in vitro коммерчески доступны, например, в фирме Promega Biotech, Мэдисон, Висконсин, или в фирме BRL, Роквилл, Мэриленд.
В другом варианте согласно предпочтительному варианту осуществления настоящего изобретения могут быть получены повышенные количества зимогена/протеазы путем экспрессии в приемлемой прокариотической или эукариотической системе экспрессии. Например, часть или все молекулы ДНК, кодирующие вариант фактора Ха, могут быть встроены в плазмидный вектор, адаптированный для экспрессии в бактериальных клетках, например, Е. coli, или в клетках млекопитающих, например, клетках СНО или Hela. В другом варианте предпочтительного осуществления настоящего изобретения могут быть получены меченые гибридные белки, включая зимоген/протеазу. Такие зимоген/протеаза-меченые гибридные белки кодируются частью или целой молекулой ДНК, лигированной в корректный кодон рамки считывания в нуклеотидной последовательности, кодирующей часть или всю метку целевого полипептида, которая встроена в плазмидный вектор, адаптированный для экспрессии в бактериальных клетках, например, Е. coli, или в эукариотических клетках, например, дрожжевых или клетках млекопитающих, но ими перечень не ограничивается. Векторы, например, описанные выше, включают регуляторные элементы, необходимые для экспрессии ДНК в клетке-хозяине, расположенные таким образом, чтобы допустить экспрессию ДНК в клетке-хозяине. Такие регуляторные элементы, необходимые для экспрессии, включают, но ими не ограничиваются, промоторные последовательности, последовательности инициации транскрипции и энхансерные последовательности.
Варианты белков зимогена/протеазы, вырабатываемых генной экспрессией в рекомбинантной прокариотической или эукариотической системе, могут быть очищены способами, известными в данной области. В предпочтительном варианте осуществления настоящего изобретения может быть использована коммерчески доступная система экспрессии/секреции, с помощью которой рекомбинантный белок экспрессируется и впоследствии секретируется из клеток-хозяев, и которая способствует легкой очистке от окружающей среды, Если не используют векторы экспрессии/секреции, применяют другой подход, предусматривающий очистку рекомбинантного белка аффинным разделением, например, иммунологическим взаимодействием с антителами, которые специфически связываются с рекомбинантным белком или никелевой колонкой для выделения рекомбинантных белков, меченых 6-8 остатками гистидина с N-или С-конца. Другие метки могут включать эпитоп FLAG, GST или эпитоп гемагглютинина. Такие методы часто используются опытными специалистами.
Белки зимогена/протеазы, приготовленные указанными выше способами, могут анализироваться по стандартным методикам. Например, такие белки могут быть подвергнуты анализу аминокислотной последовательности по известным в данной области методикам.
Выше указывалось, что обычный способ получения полипептида настоящего изобретения заключается в экспрессии нуклеиновой кислоты, кодирующей его, при использовании этой нуклеиновой кислоты в системе экспрессии. Разные системы экспрессии, используемые в настоящем изобретении, хорошо известны специалистам в данной области.
Таким образом, настоящее изобретение также предусматривает способ получения полипептида (согласно описанному), способ, включающий экспрессию с нуклеиновой кислоты, кодирующей полипептид (в общем смысле с нуклеиновой кислоты). Этого можно достичь культивированием клеток-хозяев, содержащих такой вектор, в соответствующих условиях, которые вызывают или допускают выработку полипептида. Полипептиды также могут вырабатываться в сис