Бета-лактамаза, способ ее модификации, получения и применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой бета-лактамазу, включающую аминокислотную последовательность, которая, по крайней мере, на 90% идентична SEQ ID NO: 1. При этом бета-лактамаза обладает бета-лактамазной активностью против пенициллина и цефалоспорина, выбранного из цефтриаксона и цефоперазона, и включает гидрофильный аминокислотный остаток, любой кроме аспарагиновой кислоты (D), в положении, соответствующем положению 276, согласно классификации Ambler, при этом гидрофильный аминокислотный остаток выбран из аргинина (R) и аспарагина (N). Изобретение относится также к способу получения бета-лактамазы, включающему стадии трансформации бактериальной клетки-хозяина геном, кодирующим бета-лактамазу, и выделения бета-лактамазы. Изобретение касается также фармацевтической композиции для применения при лечении или профилактике вызванных бета-лактамными антибиотиками неблагоприятных явлений в желудочно-кишечном тракте, причем фармацевтическая композиция включает бета-лактамазу и фармацевтически приемлемый носитель. Изобретение позволяет получить новую эффективную бета-лактамазу. 7 н. и 10 з.п. ф-лы, 4 ил., 4 табл., 6 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лекарственным средствам и модифицированным бета-лактамазам. Более конкретно настоящее изобретение относится к новым рекомбинантным бета-лактамазам и фармацевтическим композициям, содержащим бета-лактамазы.
Настоящее изобретение также относится к способам модификации бета-лактамазы, способам получения бета-лактамазы, а также к способам лечения или профилактики побочных эффектов, вызванных приемом бета-лактамных антибиотиков. Кроме того, настоящее изобретение относится к бета-лактамазе, которая может использоваться в качестве самостоятельного лекарственного средства или для производства лекарственного средства, предназначенного для лечения и профилактики побочных эффектов, вызванных приемом бета-лактамных антибиотиков.
Настоящее изобретение также относится к полинуклеотиду и клетке-хозяину, содержащей указанный полинуклеотид.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Бета-лактамные антибиотики характеризуются наличием бета-лактамного кольца в своей молекулярной структуре. Целостность бета-лактамного кольца необходима для биологической активности антибиотиков, которая проявляется в инактивации ряда транспептидаз, которые катализируют конечные реакции перекрестного связывания в синтезе пептидогликанов. Членами семейства бета-лактамных антибиотиков являются пенициллины, цефалоспорины, клавамы (или оксапенамы), цефамицины и карбапенемы.
Бета-лактамазы представляют собой защитные ферменты бактерий, которые гидролизуют бета-лактамные антибиотики. Продукция бета-лактамаз является основным механизмом, определяющим устойчивость Грам-отрицательных бактерий к бета-лактамам. Бета-лактамазы катализируют очень эффективный необратимый гидролиз амидной связи бета-лактамного кольца, что приводит к образованию биологически неактивного продукта(ов).
По причине того, что разные типы бета-лактамаз имеют различные ферментные характеристики, было предложено несколько систем для их классификации. Эти классификации базируются на двух основных подходах и представляют собой функциональную и молекулярную классификации.
Схема функциональной классификации бета-лактамаз предложена (Bush et al., 1995, Antimicrob. Agents Chemother. 39: 1211-1233) и включает четыре группы бета-лактамаз, в зависимости от их субстрата и ингибитора. Группа 1 включает цефалоспориназы, которые не очень хорошо ингибируются клавулановой кислотой. Группа 2 включает пенициллиназы, цефалоспориназы и бета-лактамазы широкого спектра, которые, в целом, ингибируются активными сайт-направленными ингибиторами бета-лактамаз. Группа 3 включает металло-бета-лактамазы, которые гидролизуют пенициллины, цефалоспорины и карбапенемы и слабо ингибируются большинством бета-лактам-содержащих молекул. Группа 4 включает пенициллиназы, которые плохо ингибируются клавулановой кислотой. Помимо этого, на основании скорости гидролиза карбенициллина или клоксациллина (оксациллина) среди пенициллиназ из 2 группы выделяют несколько подгрупп.
Наиболее широко используемой является классификация Ambler, которая разделяет бета-лактамазы на четыре класса (A, B, C, D) и базируется на аминокислотной последовательности ферментов (Ambler 1980, Philos Trans R Soc Lond В Biol Sci. 289: 321-331). Классы A, C и D объединяют эволюционно различные группы сериновых бета-лактамазных ферментов, а класс В включает цинк-зависимые ("ЭДТА-ингибируемые") бета-лактамазы (Ambler R.P. et al., 1991, Biochem J. 276:269-270). Классы A, C и D включают сериновые бета-лактамазы, в которых гидролиз бета-лактама опосредуется серином в активном сайте. Сериновые бета-лактамазы относятся к DD пептидазам (D-аланил-D-аланин карбоксипептидаза), мишенями которых являются бета-лактамы. Считается, что механизм, при помощи которого сериновые бета-лактамазы гидролизуют бета-лактамные антибиотики, представляет собой трехэтапный каскад, включающий образование нековалентного комплекса Генри-Михаэлиса (Henri-Michaelis), ковалентного промежуточного ацил-фермента и реакцию деацетилирования (Matagne et al., 1998, Biochem J 330:581-598). Существует мнение, что механизм ацетилирования - это общий механизм для всех групп сериновых бета-лактамаз, между тем как, на основании теоретических расчетов, предполагается, что механизмы деацетилирования субстрата сериновых бета-лактамаз классов A, C и D отличаются. Механизмы деацетилирования имеют как и общие для всех групп черты, так и специфические для каждой группы молекулярные реакции (Hata et al., 2006, Biol Pharm Bull. 29: 2 151- 21 59).
Семейства сериновых бета-лактамаз Bacillus spp и семейства ТЕМ-1, SHV-1 и СТХ-М первоначально классифицировались как бета-лактамазы класса А и как пенициллиназы, обладающие хорошей способностью к гидролизу, например, пенициллина и ампициллина. Бета-лактамазы класса А впервые были идентифицированы у пенициллин-резистентного St. aureus в 1940-х г.г. Ген резистентности к пенициллину ТЕМ-1, связанный с плазмидой, был открыт у E.coli на 20 лет позже. В дальнейшем также было показано, что бета-лактамазы обладают способностью к гидролизу большинства цефалоспоринов и, кроме того, приспособились к гидролизу специфической субпопуляции цефалоспоринов. Большинство указанных бета-лактамаз с расширенным спектром действия (ESBL, от англ. Extended-Spectrum Beta-Lactamases) являются производными ферментов ТЕМ-1, ТЕМ-2 или SHV-1. Последнее время появляется все больше сообщений о выявлении большого числа СТХ-М ферментов, новой группы ESBLs класса А. В настоящее время СТХ-М ферменты являются наиболее часто встречающимися ESBLs и подразделяются на пять основных семейств. Ферменты СТХ-М имеют широкий спектр субстратов, включая пенициллин и первое, второе и третье поколение цефалоспоринов (Bonnet, R. 2004. Antimicrob Agents Chemother. 48:1-14).
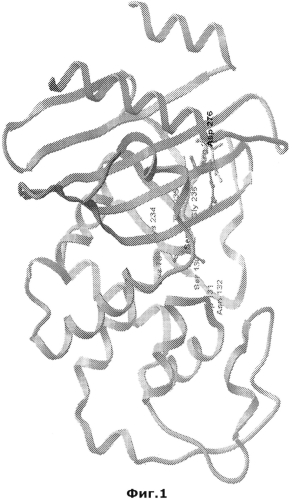
Несмотря на то, что сходство последовательностей бета-лактамаз класса А (ТЕМ, SHV, СТХ-М, бета-лактамазы Bacillus spp.) является незначительным, кристаллические структуры всех сериновых бета-лактамаз имеют высокую степень сходства (Matagne et al., 1998, Biochem J 330:581-598, Tranier S. et al., 2000, J Biol Chem, 275: 28075-28082; Santillana E. et al., 2007, Proc Natl Acad Sci. USA, 104: 5354-5359). Ферменты состоят из двух доменов. Один домен состоит из пятицепочечного бета-складчатого слоя, уложенного вплотную к трем альфа-спиралям, в то время как второй домен, альфа-домен, состоит из восьми альфа спиралей. Карман активного сайта является частью поверхности раздела между указанными двумя доменами и ограничен омега-петлей. Омега-петля представляет собой консервативный структурный элемент всех бета-лактамаз класса А, который главным образом участвует в каталитической реакции (Фиг.1).
У бета-лактамаз класса А были идентифицированы несколько консервативных пептидных последовательностей (элементов), которые имеют отношение к катализу или распознаванию субстрата. Первый консервативный элемент 70-Ser-X-X-Lys-73 (классификация Ambler) включает активный остаток серина в положении 70 в альфа-спиралиг и остаток лизина в положении 73. Второй консервативный элемент представляет собой SNX петлю в альфа домене (в положениях между 130 и 132, согласно классификации Ambler), где она формирует одну сторону каталитического углубления. Третий консервативный элемент (в положениях между 234 и 236, согласно классификации Ambler) находится на самой глубокой цепи бета-складчатой структуры3 и формирует другу сторону каталитического углубления. Третий консервативный элемент обычно представляет собой KTG. Однако, в некоторых исключительных случаях, лизин (К) может быть замещен гистидином (Н) или аргинином (R), а у некоторых бета-лактамаз треонин (Т) может быть замещен серином (S) (Matagne et ai, 1998. Biochem J 330: 581-598).
Устойчивость к бета-лактамам, обусловленная бета-лактамазами, широко распространена среди патогенной и условно-патогенной микрофлоры по причине чрезмерного использования бета-лактамов в последние десятилетия. Более того, устойчивость к антибиотикам представляет собой хорошо изученную клиническую проблему в медицине и ветеринарии; сотни различных бета-лактамаз, выделенных у Грам-положительных и Грам-отрицательных бактерий, были очищены и описаны в научной литературе. Поскольку использование антибиотиков не сокращается и, более того, устойчивость к антибиотикам стала частью повседневной жизни, для решения этой медицинской проблемы постоянно и достаточно срочно требуются новые подходы.
Кишечная микрофлора человека представляет собой сложное бактериальное сообщество, которое играет важную роль в здоровье человека, например, стимулирует систему иммунного ответа, способствует перевариванию пищи и препятствует чрезмерному росту потенциально патогенных бактерий. Известно, что антимикробные агенты, например, бета-лактамы, оказывают воздействие на нормальную микрофлору. Способность антимикробных агентов вызывать изменения нормальной кишечной микрофлоры определяется несколькими факторами, включая дозу препарата, способ его введения и фармакокинетику/фармакодинамику, а также свойства антибиотика (A. et al., 2001, Lancet 1: 101-114). Даже несмотря на то, что кишечная микрофлора обладает способностью восстанавливаться после завершения лечения антибиотиками, сообщается о длительной перстистенции определенных устойчивых условно-патогенных бактерий (Sjolund M. et al., 2003, Ann Intern Med. 139:483-487). Такая персистенция и обмен генами устойчивости к антибиотикам делают условно-патогенные микроорганизмы предполагаемым резервуаром генов устойчивости к антибиотикам.
Определенные бета-лактамы, вводимые парентерально, такие, как ампициллин, цефтриаксон, цефоперазон и пиперациллин частично выводятся с желчью в проксимальные отделы тонкого кишечника (двенадцатиперстной кишки). Оставшиеся неабсорбированные бета-лактамы в кишечнике могут оказывать нежелательное влияние на экологический баланс нормальной кишечной микрофлоры, что проявляется ассоциированной с приемом антибиотиков диареей, избыточным ростом патогенных микроорганизмов, таких, как ванкомицин-резистентные энтерококки (VRE, от англ. Vancomycin-resistant Enterococci), Грам-отрицательные палочки, продуцирующие бета-лактамазы с расширенным спектром действия (ESBL), Clostridium difficWe и грибы, а также отбором устойчивых к антибиотикам штаммов среди нормальной кишечной микрофлоры и потенциально патогенных бактерий.
Терапевтической целью бета-лактамаз является инактивация неабсорбированных антибиотиков в желудочно-кишечном тракте (GIT, от англ. Gastrointestinal Tract), русская аббревиатура ЖКТ, что позволяет поддерживать нормальную кишечную микрофлору и препятствует избыточному росту потенциально патогенных микроорганизмов (WO 93/13795).
Существует, по крайней мере, три основных требования для лекарственных продуктов, содержащих бета-лактамазы и подходящих для направленной терапии ЖКТ. Первое требование заключается в том, что лекарственное средство должно сохранять свою активность в условиях, существующих в ЖКТ. Устойчивость к протеолитическому расщеплению разнообразными протеазами, секретируемыми различными железами в ЖКТ, является важнейшим условием для успешного осуществления лечения бета-лактамазами. Другим важным фактором является разброс величин рН, существующий в различных отделах тонкого кишечника. Указанные величины рН обычно варьируют от 5 (двенадцатиперстная кишка) до 7,5 (подвздошная кишка). Следовательно, для того, чтобы соответствовать требованиям, предъявляемым к препаратам для указанных лечебных целей, бета-лактамазы должны демонстрировать высокую ферментативную активность при величине рН в пределах 5-7,5.
Вторым требованием, предъявляемым к бета-лактамазам или продуктам, их содержащим, является высокая эффективность гидролиза бета-лактамного кольца. Концентрация бета-лактамного антибиотика в химусе тонкого кишечника во время лечения антибиотиками обусловлена, главным образом, элиминацией определенного бета-лактама за счет экскреции с желчью. Подходящая бета-лактамаза должна обладать кинетическими параметрами, которые обеспечивают способность фермента эффективно гидролизировать низкие концентрации бета-лактамов в ЖКТ и снижать их концентрации до уровня, который не приводит к нежелательным нарушениям со стороны кишечной микрофлоры. Идеальный набор кинетических величин включает численно низкую величину константы Михаэлиса КМ в сочетании с численно высокой величиной максимальной скорости реакции Vmax. Высокая Vmax требуется для того, чтобы обеспечить достаточный уровень способности к гидролизу, в то время как низкая Км необходима для реализации активности фермента при низкой концентрации субстрата.
Третье требование, предъявляемое к бета-лактамазам или продуктам, их содержащим, заключается в том, что они должны выдерживать условия производства, такие, как относительно высокие температуры, используемые в процессе получения фармацевтических композиций. Кроме того, в процессе производства смешивание дисперсии водных носителей и лекарственного вещества требует высокого уровня растворимости при соответствующих величинах рН.
Ферментативная терапия, называемая Ipsat P1A, была разработана для профилактики побочных эффектов бета-лактамных антибиотиков в кишечнике. Система доставки Ipsat P1A была разработана для инактивации вводимых парентерально бета-лактамов из группы пенициллинов (например, пенициллина,
амоксициллина, ампициллина и пиперациллина) как вместе с ингибиторами бета-лактамазы, так и без них (например, тазобактам, сульбактам, клавулановая кислота) и экскретируемых с желчью (WO 2008065247; Tarkkanen, A.M. et al., 2009, Antimicrob Agents Chemother. 53:2455-2462). Фермент Р1А представляет собой рекомбинантную форму малой экзо бета-лактамазы Bacillus licheniformis 749/C (WO 2008065247), которая относится к классу А и подгруппе 2а, согласно функциональной классификации. Бета-лактамаза В. licheniformis и ее производное Р1А считаются пенициллиназами, обладающими высоким гидролизующим потенциалом в отношении, например, пенициллина, ампициллина, амоксициллина или пиперациллина (Таблица 1), при этом они, как правило, ингибируются сайт-направленными активными ингибиторами бета-лактамаз, такими, как клавулановая кислота, сульбактам или тазобакам (Bush K. et al., 1995, Antimicrob Agents Chemother 39: 121 1-1233).
Однако фермент Р1А обладает ограниченной способностью к инактивации бета-лактамных антибиотиков, которые относятся к группе цефалоспоринов или карбапенемов. Поскольку используемые бета-лактамазы обладают слабой активностью в отношении цефалоспоринов, они не могут применяться совместно с парентеральной терапией цефалоспоринами для инактивации неабсорбированных бета-лактамов в тонком кишечнике.
Следовательно, совершенно необходимы новые бета-лактамазы или производные Р1А с расширенным субстратным профилем, например, таким, который наблюдается у металло-бета-лактамаз.
Настоящее изобретение предлагает новые генетически созданные производные Р1А бета-лактамазы и более того, новые способы модификации и получения бета-лактамаз.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Новые рекомбинантные производные Р1А бета-лактамазы, заявленные в соответствии с настоящим изобретением, полностью удовлетворяют перечисленным выше трем требованиям, предъявляемым к бета-лактамазам (то есть обладают способностью сохранять ферментативную активность, эффективно гидролизировать бета-лактамы и выдерживать условия производства фармацевтических композиций) и, более того, обладают расширенным субстратным профилем. Бета-лактамазы, заявленные в соответствии с настоящим изобретением, также могут использоваться в сочетании с парентеральной терапией цефалоспоринами для инактивации элиминируемых с желчью бета-лактамов в тонком кишечнике.
Настоящее изобретение раскрывает предварительные и доклинические исследования нового Ipsat P3A фармацевтического белка (D276N замещенного производного Р1А) и предлагает единичную дозированную лекарственную форму на основе данного белка.
Настоящее изобретение относится к быстрым и эффективным способам модификации бета-лактамаз и способам получения модифицированных бета-лактамаз. Кроме того, благодаря настоящему изобретению станут доступны новые более эффективные и специфические способы лечения.
Ферменты, заявленные в соответствии с настоящим изобретением, подходят для широкомасштабного производства лекарственных препаратов, предназначенных для лечения или профилактики побочных эффектов, индуцированных различными группами бета-лактамных антибиотиков.
Задача настоящего изобретения заключается в том, чтобы предложить новые бета-лактамазы, в частности бета-лактамазы В. Licheniformis, а также продукты, способы получения и применения, касающиеся бета-лактамаз. Инструменты для новых разработок в фармацевтической индустрии также представлены в настоящем изобретении.
Настоящее изобретение относится к бета-лактамазе, имеющей аминокислотную последовательность, которая, по крайней мере, на 60% идентична SEQ ID NO:1 и включает гидрофильную аминокислоту в положении SED ID NO:1, соответствующем положению 276, согласно классификации Ambler, а также к вариантам и фрагментам указанной бета-лактамазы.
Изобретение также относится к фармацевтической композиции, содержащей бета-лактамазу, заявленную в соответствии с настоящим изобретением.
Настоящее изобретение также относится к способу модификации бета-лактамазы, имеющей аминокислотную последовательность, которая, по крайней мере, на 60% идентична SEQ ID NO:1, при этом аминокислота бета-лактамазы в положении SEQ ID NO:1, соответствующем положению 276, согласно классификации Ambler, замещена гидрофильной аминокислотой.
Кроме того, настоящее изобретение относится к способу получения бета-лактамазы, который включает следующие этапы:
а) получение гена, кодирующего бета-лактамазу, заявленную в соответствии с настоящим изобретением;
б) трансформацию клетки-хозяина указанным геном;
в) получение клетки-хозяина, продуцирующей бета-лактамазу;
г) восстановление бета-лактамазы.
Кроме того, настоящее изобретение относится к способу лечения или профилактики побочных эффектов со стороны желудочно-кишечного тракта, вызванных приемом бета-лактамных антибиотиков, который заключается во введении субъекту заявленной бета-лактамазы одновременно с бета-лактамным антибиотиком или после его приема.
Кроме того, настоящее изобретение относится к применению бета-лактамазы в качестве лекарственного средства.
Более того, настоящее изобретение относится к применению бета-лактамазы для производства лекарственного средства, предназначенного для лечения или профилактики побочных эффектов со стороны желудочно-кишечного тракта, вызванных приемом бета-лактамных антибиотиков.
Более того, настоящее изобретение относится к полинуклеотиду, который имеет любую из последовательностей SEQ ID NO:2 или 4, или его варианту, полученному на основе вырожденности генетического кода, или к полинуклеотиду, кодирующему бета-лактамазу, заявленную в соответствии с настоящим изобретением. Изобретение также относится к клетке-хозяину, содержащей указанный полинуклеотид.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 представлена 3D структура бета-лактамазы Bacillus licheniformis (малая экзо-форма PenP). Обозначены консервативные аминокислотные остатки и остатки боковых цепей R-244 и D-278. Диаграмма была создана при помощи программы MolSof-Browser.
На Фиг.2 показаны нуклеотидная последовательность и выведенная на ее основе аминокислотная последовательность гена бета-лактамазы D276N, Bacillus licheniformis (P1A производное). Аминокислотная последовательность соответствует SEQ ID NO:3, при этом Хаа представляет собой аспарагин (Asn).
Нуклеотидная последовательность соответствует последовательности SEQ ID NO:4, при этом нуклеотидный триплет nnn представляет собой aat. Открытая рамка считывания кодирует полипептид из 299 аминокислот, включающий длинную сигнальную последовательность из 31 аминокислоты (подчеркнута) гена amyQ, происходящего из вектора секреции рКТН141 (WO 2008/065247). Предполагаемый сайт расщепления сигнальной пептидазой находится после аланина (А) в положении -1. Сайт клонирования HindIII, кодирующий NH2-QAS удлинение, выделен жирным шрифтом. Зрелый D276N мутантный фермент начинается с глутамина (Q)b положении +1. Таким образом, зрелая D276N мутантная бета-лактамаза имеет 268 аминокислотных остатка, включая NH2-QAS удлинение, кодируемое HindIII. Единичное аминокислотное замещение аспарагиновой кислоты (D) аспарагином (N) находится в положении 280 (выделено жирным шрифтом), что соответствует положению 276, согласно классификационной системе Ambler, и положению 249 в последовательности SEQ ID NO:3.
NH2-терминальная последовательность очищенного мутантного фермента D276N была определена при помощи автоматической деградации Эдмана в белковом секвенаторе. Анализ показал, что мутантный фермент D276N лишен NH2-QASKT-пентапептида на своем расшифрованном N-конце, как и его родоначальный фермент Р1А (WO 2008/065247). Основная фракция очищенного мутантного фермента D276N, которая использовалась в примерах 4 и 6 данной заявки, начинается с глутаминовой кислоты в положении +6 и состоит из 263 аминокислотных остатков с молекулярной массой 29272.
На Фиг.3 представлены нуклеотидная последовательность и выведенная на ее основе аминокислотная последовательности гена D276R замещенной бета-лактамазы Р1А, выделенной из Bacillus licheniformis. Аминокислотная последовательность соответствует последовательности SEQ ID NO:3, при этом Хаа представляет собой аргинин (Arg). Нуклеотидная последовательность соответствует последовательности SEQ ID NO:4, при этом нуклеотидный триплет nnn представляет собой cgc.
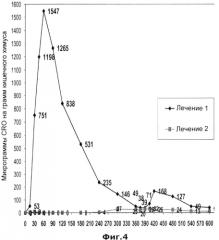
На Фиг.4 представлено влияние перорально вводимых пеллет, покрытых кишечнорастворимой оболочкой и содержащих D276N замещенную бета-лактамазу (Р3А), на концентрацию цефтриаксона в химусе тощей кишки у собак породы бигль (n=5) после внутривенного введения цефтриаксона (30 мг цефтриаксона на кг массы тела) (закрашенные квадраты). Пеллеты бета-лактамазы давали за 10 минут до введения цефтриаксона. Закрашенные ромбики соответствуют концентрации цефтриаксона в тощей кишке после введения единичной дозы цефтриаксона (в/в) без лечения бета-лактамазой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Бета-лактамазы использовались для инактивации неабсорбированных бета-лактамов в желудочно-кишечном тракте для предотвращения побочных эффектов, вызванных приемом бета-лактамов, включая изменения со стороны нормальной кишечной микрофлоры и избыточный рост устойчивых к бета-лактамам бактерий (WO 199313795, WO 2007065247, WO 2007147945). Настоящее изобретение предлагает новые модифицированные бета-лактамазы Bacillus licheniformis, которые неожиданно демонстрируют расширенный модифицированный субстратный профиль.
Используемый здесь термин бета-лактамаза относится к ферменту, который гидролизует бета-лактамы. Гидролиз амидной связи бета-лактамного кольца приводит к тому, что антимикробные агенты теряют свою биологическую активность. Используемый здесь термин бета-лактамазы класса А (классификация Ambler) относится к сериновым бета- лактамазам, у которых гидролиз бета-лактама опосредуется серином в активном сайте, обычно аминокислотой в положении 70 альфа спирали2. Бета-лактамазы класса А включают, без ограничений указанными, Len-1, SHV-1, ТЕМ-1, PSE-3/PSE-3. ROB1, Bacillus cereus, такие, как 5/В тип 1, 569/Н тип 1 и 569/Н тип 3, Bacillus anthrasis sp, Bacillus licheniformis, такие как PenP, Bacillus weihenstephanensis, Bacillus clausii, Staphylococcus aureus и бета-лактамазы типов РС1, Sme-1, NmcA, IMI-, PER-, VEB-, GES-, KPC-, CME- и СТХ-М.
Идентичность последовательностей пептидов и полинуклеотидов
Аминокислотные последовательности мутантной бета-лактамазы, заявленной в соответствии с настоящим изобретением (D276X, Р1А производное), обозначены в тексте как SEQ ID NO:1 и SEQ ID NO:3. Соответствующие нуклеотидные последовательности приведены в заявке под обозначениями SEQ ID NO:2 и SEQ ID NO:4. SEQ ID NO:1 описывает аминокислотную последовательность, участвующую в формировании вторичной структуры бета-лактамазы. SEQ ID NO:3 описывает полноразмерную аминокислотную последовательность белка, включая длинную сигнальную последовательность из 31 аминокислоты.
Бета-лактамаза, заявленная в соответствии с настоящим изобретением, может иметь аминокислотную последовательность, которая, по крайней мере, на 30, 35, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99, 8, 99,9 или 100% идентична последовательности SEQ ID NO:1 или 3.
Согласно специфическому варианту осуществления изобретения, пептид, по крайней мере, на 30, 35, 40, 51, 52, 53, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,8, 99,9 или 100% идентичен последовательности SEQ ID NO:1 или 3.
Согласно одному предпочтительному варианту осуществления изобретения, бета-лактамаза имеет аминокислотную последовательность, которая, по крайней мере, на 60% идентична SEQ ID NO:1. Согласно другому предпочтительному варианту осуществления изобретения, бета-лактамаза имеет аминокислотную последовательность, которая, по крайней мере, на 60% идентична SEQ ID NO:1 или 3.
Согласно одному варианту осуществления изобретения, бета-лактамаза, имеющая аминокислотную последовательность с указанной выше идентичностью с SEQ ID NO:1, содержит гидрофильную аминокислоту, выбранную из группы, включающей аргинин (R), гистидин (Н), лизин (К), аспарагин (N), глутамин (Q), серии (S) и треонин (Т) в положении SEQ ID NO:1, соответствующем положению 276 согласно классификации Ambler.
Согласно предпочтительному варианту осуществления изобретения, пептид имеет последовательность, представленную в SEQ ID NO:1 или 3. Согласно одному варианту осуществления изобретения, бета-лактамаза имеет последовательность, представленную в SEQ ID NO:1 или 3, при этом остаток гидрофильной аминокислоты в положении, соответствующем положению 276, согласно классификации Ambler (обозначенный как Хаа в SEQ ID NO:1 или 3), представлен аргинином (R, Arg). Согласно другому варианту осуществления изобретения, бета-лактамаза имеет последовательность, представленную в SEQ ID NO:1 или 3, при этом остаток гидрофильной аминокислоты в положении, соответствующем положению 276, согласно классификации Ambler (обозначенный какХаа в SEQ ID NO:1 или 3) представлен аспарагином (N, Asn).
Идентичность любой последовательности с последовательностью, представленной в настоящем изобретении, подразумевает идентичность с полной последовательностью согласно настоящему изобретению. Идентичность последовательности может определяться при помощи любого метода биоинформации, например, при помощи BLAST (Basic Alignment Search Tools) или FASTA (FASTA-AII).
Настоящее изобретение также относится к любым вариантам или фрагментам новых бета-лактамаз. Используемые здесь термины "фрагмент" или "вариант" бета-лактамазы относятся к любой части или варианту, который обладает биологической функцией, то есть является ферментативно активным. Вариант относится к пептиду, имеющему незначительные изменения в пептидной последовательности, например, мутации, небольшие делеции или вставки. Фрагменты или варианты должны включать гидрофильную аминокислоту в положении, соответствующем положению 276, согласно классификации Ambler. Гидрофильная аминокислота обычно представляет собой любую кислоту, кроме аспарагиновой кислоты (D).
Существуют различные короткие формы бета-лактамазы, которые можно получить на основе SEQ ID NO:3 и которые секретируются вне клетки. Они называются экзоформами. Экзоформы являются результатом гидролитической активности протеаз в клеточной стенке или культуральной среде.
Термины D276X, D276N, D276R, мутантная форма, R1A производные или РЗА, используемые здесь, относятся к любому активному фрагменту бета-лактамазы и/или варианту SEQ ID NO:3, или варианту, явным образом включающему представленную аминокислотную последовательность (SEQ ID NO:1). В частности, бета-лактамаза, заявленная в соответствии с настоящим изобретением, представляет собой NH2-yce4eHHyra форму, она может иметь одну или более дополнительную аминокислотную делецию, замещение и/или вставку, но при этом обладает бета-лактамазной активностью. Указанные модификации могут представлять собой как существующие в природе варианты, так и мутанты, полученные при помощи искусственной модификации, например, при помощи генных технологий.
Различные усеченные по N-концу экзоформы были выявлены в питательной среде В. licheniformis. Такие формы также включены в настоящее изобретение. Matagne и др. описали различные степени микрогетерогенности внеклеточных форм, продуцируемых естественным хозяином, В. licheniformis 749/С (Matagne A. et al., 1991. Biochem J. 273: 503-510). Были идентифицированы следующие пять различных секретируемых экзоформ с различными аминокислотными остатками на N-конце:
| SQPAEKNEKTEMKDD | …..KALNMNGK |
| EKTEMKDD | …..KALNMNGK |
| KTEMKDD | …..KALNMNGK |
| EMKDD | …..KALNMNGK |
| MKDD | …..KALNMNGK |
Первичные аминокислотные остатки выделены жирным шрифтом. С-концевые аминокислотные остатки приведены в правой колонке. Экзоформа, начинающаяся с серина (S), обозначается как "большая секретируемая форма" бета-лактамазы В. licheniformis, а форма, начинающаяся с лизина (К), обозначается как "малая секретируемая форма".
Первая альфа-спираль (α1-спираль) начинается с аспарагиновой кислоты (D) (выделено курсивом), а концевая аминокислота последней альфа-спирали (α11-спираль) представлена аспарагином (N) (выделено курсивом). Согласно одному варианту осуществления изобретения, бета-лактамаза включает, по крайней мере, аминокислоты 1-258 SEQ ID NO:1 или аминокислоты 7-264 SEQ ID NO:3, которые принимают участие в формировании вторичной структуры белка (Knox J.R. et al, 1999. J. Mol. Biol. 220:435-455). Согласно другому варианту осуществления изобретения одна или более из указанных аминокислот 1-258 SEQ ID NO:1 или аминокислот 7-264 SEQ ID NO:3 подвергалась замещению или делеции.
Согласно еще одному варианту осуществления изобретения N-конец бета-лактамазы начинается с NH2-KTEMKDD (аминокислоты 4-10 SEQ ID NO:3). Эта, так называемая ES-beta L экзоформа, может быть дополнительно лишена вплоть до 21 последовательных аминокислот, как описано у Gebhard и др. (Gebhard L.G. et al., 2006, J. Mol. Biol. 21:358(1) 280-288). Согласно другому варианту осуществления изобретения, N-конец начинается с глутаминовой кислоты (Е) SEQ ID NO:3, конкретно, он начинается с NH2-EMKDD (аминокислоты 6-10 SEQ ID NO:3), или, альтернативно, он начинается с NH2-MKDD (аминокислоты 7-10 SEQ ID NO:3 или аминокислоты 1-4 SEQ ID NO:1).
Вариабельный участок в N-концевой последовательности бета-лактамазы не обладает ригидной структурой, которая обеспечивает постоянство ферментативных параметров различных форм бета-лактамаз.
Четыре последние аминокислоты карбоксильного конца бета-лактамазы, MNGK-COOH (аминокислоты 265-268 SEQ ID NO:3), не являются частью вторичной структуры, и, следовательно, могут быть удалены без потери ферментативной активности. Согласно другому варианту осуществления изобретения, вплоть до девяти аминокислот С-конца могут быть удалены. С-усеченные формы белка были описаны Santos и соавт.(Santos J. et al., 2004, Biochemistry 43:1715-1723).
Все различные формы бета-лактамазы, приведенные выше, включены в настоящее изобретение, вместе с другими формами белков, обладающих бета-лактамазной активностью.
Полинуклеотид, заявленный в соответствии с настоящим изобретением, может включать или иметь любую из последовательностей SEQ ID NO:2 или SEQ ID NO:4, или представлять собой вариант указанных последовательностей, полученный на основе вырожденности генетического кода. Полинуклеотид, который представляет собой указанный вариант последовательности, представленной как SEQ ID NO:2 или 4, относится к полинуклеотиду, который имеет один или более отличающийся нуклеотид, по сравнению с SEQ ID NO:2 или SEQ ID NO:4, но кодирует ту же аминокислоту. Предпочтительно, нуклеотидный триплет nnn последовательности SEQ ID NO:2 или SEQ ID NO:4 кодирует гидрофильную аминокислоту, наиболее предпочтительно, N или R. Термин "полинуклеотид", используемый здесь, представляет собой последовательность нуклеотидов, такую, как ДНК или РНК последовательность, и может представлять собой как двухцепочечную, так и одноцепочечную нуклеиновую кислоту. Термин полинуклеотид объединяет геномную ДНК, кДНК и мРНК.
Согласно специфическому варианту осуществления изобретения, полинуклеотид, по крайней мере, на 30, 35, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 65, 70, 71, 72, 73, 74, 74, 76, 77, 78, 78, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,8 или 99,9% идентичен любой из нуклеотидных последовательностей SEQ ID NO:2 или SEQ ID NO:4 или их фрагментам.
Согласно одному специфическому варианту осуществления изобретения, полинуклеотид имеет последовательность, представленную в любой из последовательностей SEQ ID NO:2 или SEQ ID NO:4.
Аминокислоты в положении 276 (Ambler) у бета-лактамаз класса А
Аспарагин (Asn, N) в положении 276 присутствует у большого количества разнообразных бета-лактамаз класса А. Функция Asn276 интенсивно изучалась у ТЕМ и SHV бета-лактамаз, у которых Asn276 формирует углеводные связи с гуанидиновой группой аргинина (Arg, R) 244 и, таким образом, ограничивает мобильность Arg244 боковой цепи.
Было обнаружено, что замещение аспарагина (Asn, N) в ТЕМ или SHV ферментах играет ключевую роль в устойчивости к ингибиторам сериновых бета-лактамаз, таких, как клавулановая кислота, сульбактам или тазобактам. N276D (Asp) замещенные варианты ТЕМ-1 бета-лактамазы присутствуют у устойчивых к ингибиторам бета-лактамаз (IRT ферменты, такие, как ТЕМ-35 и ТЕМ-36). Вариант N276D является более устойчивым к клавулановой кислоте и тазобактаму, чем фермент дикого типа ТЕМ-1, однако одновременно каталитическая эффективность (Kcat/Km) варианта N276D по отношению к различным пенициллинам на 50% меньше, чем у фермента дикого типа ТЕМ-1. Каталитическая эффективность варианта N276D по отношению к цефалоспоринам уменьшается по сравнению с эффективностью фермента дикого типа ТЕМ-1 (Saves I et al., 1995, J Biol Chem. 270:18240-18245).
Аналогично ТЕМ-1, замещение N276D в SHV-1 или SHV-5 бета-лактамазах увеличивает устойчивость к ингибиторам сериновых бета-лактамаз, но уменьшает их гидролитическую эффективность по отношению к большинству бета-лактамов (Giakkoupi P. et al., 1999, J Antimicrobiol Chemother, 43: 23-29). Кроме того, замещение N276D в SHV-1 или SHV-5 ферментах умеренно повышает их способность разрушать "четвертое поколение" цефалоспоринов - цефпиром и цефепим.
Для бета-лактамаз типа SHV - ОНЮ-1, было показано, что мутант N276G (Gly) является высокоустойчивым к клавулановой кислоте, при этом мутант N276G на основе ТЕМ-1 бета-лактамаз обладает умеренной устойчивостью к клавулановой кислоте (Bonomo RA et al., 1995, Biochim Biophys Acta. 1247:121-125).
В семействе СТХ-М ферментов аргинин (Arg, R) обычно находится в положении 276 (Bonnet R., 2004, Antimicrob Agents Chemother, 48: 1-14), а мутации Arg276 влияют на продолжительность ферментативной активности. Относительные скорости гидролиза цефотаксима ферментами СТХ-М умеренно снижаются в результате замещения Arg276. Кроме того, мутации Arg276Trp, Arg276Cys, Arg276Ser и Arg276Gly в СТХ-М ферментах не влияют на уровень устойчивости к ингибиторам бета-лактамаз (Bonnet R., 2004, Antimicrob Agents Chemother, 48: 1-14; Perez-Llarena F.J. et al., 2008, J Antimicrobiol Chemother, 61: 792-797).
| Таблица 1 | |
| Аминокислотные остатки в положении 276 (классификация Ambler) у бета-лактамаз класса A (Matagne A et al., 1998, Biochem J 330:581-598; Tranier S. etal., 2000, J Biol Chem, 275: 28075-28082). | |
| Типичная бета-лактамаза | Типичный аминокислотный остаток в положении 276 |
| Len-1, SHV-1, TEM-1, PSE-3/PSE-3, ROB-1 Bacillus cereus 5/B type 1 Bacillus cereus 569/H type 1 Bacillus anthrasis sp | Asn (N) |
| Bacillus licheniformis PenP бета-лактамаза Bacillus cereus 569/H type 3 бета-лактамаза Bacillus weihenstephanensis бета-лактамаза Bacillus clausii бета-лактамаза Staphylococcus aureus PCI бета-лактамаза Sme-1 NmcAIMI-1 бета-лактамаза | Asp (D) |
| СТХ-М ферменты | Arg (R) |
| PER-1, VEB-1, CME-1 бета-лактамазы | Glu (E) |
В настоящем изобретении бета-лактамазы, имеющие аминокислотную последовательность, которая, по крайней мере, на 60% идентична последовательности SEQ ID NO:1 (Bacillus licheniformis PenP производное, то есть Р1А производное), и включающие гидрофильную аминокислоту в положении SEQ ID NO:1, соответствующем положению 276, согласно классификации Ambler, демонстрируют расширенный бета-лактамный спектр, а также улучшенную каталитическую активность в отношении бета-лактамов.
До настоящего времени влияние аминокислотных замен, таких, как замещение аспарагиновой кислоты (D) в положении 276, на устойчивость к ингибиторам сериновых бета-лактамаз среди бета-лактамаз Bacillus spp., в особенности, бета-лактамазы Б. licheniformis, не изучалась.
Как описано здесь аминокислотный остаток 276, согласно классификации Ambler, соответствует положению 243 в SEQ ID NO:1 и положению 249 в SEQ ID NO:3.
Обычно бета-лактамазы, заявленные в настоящем изобретении,