Способ определения токсичности среды по степени угнетения роста тест-культур микроорганизмов
Иллюстрации
Показать всеИзобретение относится к области биохимии. Способ определения токсичности среды включает определение показателей роста тест-культур в контроле и опыте. В качестве тест-культур используют микромицеты и предварительно определяют показатель степени угнетения роста тест-культур в опыте по отношению к контролю, %, по формуле:
.
Осуществляют определение интегрального показателя токсичности среды в баллах по общему количеству баллов у всех тест-культур за весь период инкубации, который сравнивают с пятью классами опасности среды, условно установленными в зависимости от балльной интегральной оценки токсичности исследуемой среды от 0 до 100 баллов. Изобретение позволяет повысить объективность оценки токсичности среды для растений, животных и человека. 8 з.п. ф-лы, 4 ил., 1 пр.
Реферат
Изобретение относится к области биохимии, к способам измерения или испытания, использующих микроорганизмы, касается способа определения токсичности среды по степени угнетения роста тест-культур микроорганизмов, который может найти применение при эколого-токсических исследованиях промышленных и строительных материалов, грунта, водоемов, технологических отходов, анализе пищевых продуктов, кормов сельскохозяйственных животных, при оценке токсичности биоцидов и дезинфицирующих средств и т.п.
В настоящее время для оценки токсичности среды все более широкое применение находят тест-культуры - биологические объекты (штаммы бактерий, растения, животные), реагирующие на наличие токсикантов в среде, в которую они помещены, например: US 2008200346 А1, 2008-08-21; ЕР 1302546 A2, 2003-04-16; KR 20030021091 A, 2003-03-12; WO 9218642 A1, 1992-10-29; WO 2009153074 A1, 2009-12-23; GB 2344106 A, 2000-05-31; RU 2245367 C2, 2005-01-27; RU 2342434 С1, 2008-12-27.
Известно также использование тест-культур плесневых грибов, таких как: Alternaria alternata, Aspergillus niger, Fusarium moniliforme, Penicillium chrysogenum; для определения бактерицидного действия химических препаратов, например: дезинфицирующего средства в патенте RU 2345794 C2, кл. A61L 2/16, опубл. 10.02.2009 г.; эпоксидного состава для покрытий в патенте RU 2282649 C1, кл. С09В 5/14, C09D 163/00, C09J 163/00, C08L 63/00, C08K 5/17, опубл. 10.02.2009 г.; мономерных и полимерных биоцидов в патенте RU 2343707 C1, кл. A1N 25/00, A61L 2/08, опубл. 20.01.2009 г.
В зависимости от типа тест-культуры ее реакция на токсичность среды выражается в изменении численности, скорости накопления биомассы, интенсивности выделения или поглощения энергии, (например, свечения для люминесцирующих бактерий) и т.п. Применение тест-культур все более вытесняет химический анализ, предусматривающий выявление в среде химических токсикантов с применением реагентов, специфичных для обнаружения конкретных химических веществ и соединений. Для выявления в исследуемой среде всех токсикантов химический анализ требует применения большого числа реагентов, что экономически не выгодно, поэтому реально химический анализ не позволяет оценить интегральную токсичность среды, определяемую наличием в среде всех токсикантов с учетом синергетического или антагонистического эффектов, выражающихся в усилении или ослаблении суммарного воздействия токсикантов на человека.
Одним из самых важных достоинств применения тест-культур является возможность определения интегрального влияния на жизнедеятельность человека и животных всех имеющихся в исследуемой среде веществ без определения их химического состава. Наиболее часто токсичность среды с применением биосенсоров характеризуется величинами 20% или 50% летальности (LD20, LD50) или подавления жизнедеятельности (ЕС20, ЕС50) у используемых биосенсоров (ФР. 1.39.2007.03222 «Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний»).
В то же время использование того или иного типа тест-культуры имеет свои недостатки. Например, применение животных, растений и микроорганизмов целесообразно для анализа только тех сред, в которых они проживают и размножаются (например, дафний и штамма Vibrio fischeri ВКПМ В-9579 - для анализа воды), а использование люминесцирующих бактерий требует применения специальной аппаратуры, позволяющей с высокой степенью точности оценить изменение интенсивности испускаемого ими излучения, поскольку уменьшение интенсивности пропорционально токсическому эффекту.
Так, например, известен способ биотестирования токсичности воздушной среды (RU 2063630 C1, кл. G01N 33/48, опубл. 07.10.1996 г.), оценивают эффект различных веществ на зимозан-стимулированную люминол-зависимую биолюминесценцию лейкоцитов из донорской крови. Тест-объект инкубируют в физиологически уравновешенной среде с водорастворимыми токсикантами воздушной среды, барботированной через физиологический раствор в стандартных условиях. Токсичность воздушной среды определяют по уменьшению максимума биолюминесценции по сравнению с контролем, не содержащим токсикантов. Известный способ осуществляется следующим образом. Лейкоциты периферической крови человека выделяют по стандартной схеме. Инкубационная среда для определения токсичности исследуемого образца содержит 50-100 мкл взвеси лейкоцитов в растворе Хенкса с цитратом натрия и глюкозой (конечная концентрация 1%) и люминол в конечной концентрации 1×10-5 Μ. Биолюминесценцию клеток вызывают добавлением 100 мкл суспензии опсонизированного зимозана (1 мг/мл). Конечный объем пробы 1 мл, температура 37°C. Контрольная и опытная пробы содержат физиологический раствор или материал исследуемого образца соответственно. Пробы переносят в кюветодержатель хемилюминометра и измеряют интенсивность биолюминесценции клеток, регистрируя показания прибора каждые 10 с. Максимум биолюминесценции достигается обычно через 15-20 мин. Величину максимума биолюминесценции в контрольной пробе принимают за 100%, а интенсивность биолюминесценции в опытных пробах выражают в процентах относительно максимума биолюминесценции в контрольной пробе. Найденные величины используют при расчете токсичности исследуемого образца. За условную единицу токсичности принимают такое количество водорастворенных токсикантов воздушной среды, которое вызывает 50% ингибирование биолюминесценции клеток. При определении токсичности исследуемого образца строят полулогарифмический график зависимости интенсивности биолюминесценции (% от контроля) от логарифма объема внесенного в аналитическую систему раствора токсикантов исследуемой среды. По графику определяют объем раствора токсикантов, вызывающий 50% ингибирование биолюминесценции.
Недостатками известного способа является то, что для его осуществления требуется свежая донорская кровь, не подлежащая длительному хранению, а также необходимость выполнения дополнительной процедуры по получению лейкоцитарной фракции. Кроме того, возможны колебания чувствительности и нестабильность количественных оценок при изменении функционального состояния клеток (повреждение клеток) и это обстоятельство требует принятия специальных мер для поддержания их в интактном состоянии.
Известен, также способ интегральной экспресс-оценки загрязнения окружающей среды (RU 2359036 С1, кл. C12Q 1/28, G01N 33/18, опубл. 20.06.09 г.), включающий инкубацию водорастворенных поллютантов с биологической тест-системой и количественную их оценку по вызываемому ими 50%-ному снижению величины максимальной люминолзависимой хемилюминесценции по сравнению с контролем. В качестве тест-системы используют комплексный полиферментный препарат из корня хрена, обладающий оксидазно-пероксидазной активностью, в комбинации с сульфгидрильным реагентом, который берут в конечной концентрации не менее 0,1 мкг/мл и не более 100 мкг/мл. Изобретение позволяет повысить чувствительность способа определения загрязнения окружающей среды, а также обеспечивает возможность интегральной и количественной оценки загрязненности объектов окружающей среды.
Недостатками данного способа являются использование при его осуществлении дорогостоящих коммерческих ферментативных препаратов, а также необходимость применения специальной дорогостоящей и сложной в эксплуатации аппаратуры для определения люминолзависимой хемилюминесценции.
Наиболее распространено использование в качестве тест-культур бактерий, жизнедеятельность которых зависит от токсичности среды, в которую они помещены.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является способ определения общей токсичности твердой, жидкой и газообразной сред, защищенный патентом RU 2202619 С2, кл. C12Q 1/18, C12Q 1/06, C12R 1/07, принятый за ближайший аналог (прототип).
Способ по прототипу применим для установления степени токсичности воды и водорастворимых компонентов продуктов питания, кормов, грунта, технологических отходов. Способ основан на применении в качестве тест-культур бактерий Bacillus и Sarcina lutea B-110. Из рода Bacillus выбирают чувствительные к предположительно содержащимся в тестируемой среде токсикантам, а общую токсичность среды определяют в виде интегрального критерия, слагаемого из показателей роста каждой тест-культуры, которые ранжированы по одному из, как минимум, трех критериев токсичности: нормальный рост, угнетенный рост, отсутствие роста.
Недостатком способа, общим с другими способами, основанными на применении в качестве тест-культур бактерий, является то, что тест-культуры относятся к прокариотическим организмам, имеющим ряд существенных отличий от растений и животных на клеточном уровне, - отсутствует оформленное ядро, рибосомы 80S типа, митоз. Бактерии в филогенетическом отношении далеко отстоят от растений и животных и результаты, полученные на них как на объектах токсикологических тестов, не могут быть с достаточной степенью объективности экстраполированы на другие объекты органического мира (растения, животные, человек).
Другим существенным недостатком данного способа является то, что результирующий индивидуальный показатель токсичности каждой тест-культуры определяется на основе визуальной оценки ее роста без использования инструментально измеряемых исчисляемых показателей, т.е. способ не является достаточно точным и зависит от индивидуальных особенностей человека, проводящего анализ.
В задачу изобретения положено создание нового способа для определения токсичности среды по степени угнетения роста тест-культур микроорганизмов.
Техническим результатом от использования изобретения, является повышение объективности оценки токсичности среды для растений, животных и человека.
Поставленная задача достигается тем, что в способе определения токсичности среды по степени угнетения роста тест-культур микроорганизмов, включающем определение показателей роста тест-культур в контроле и в опыте, определение интегрального показателя (критерия) токсичности среды в баллах, сравнение интегрального показателя (критерия) с условно установленными классами опасности среды, в качестве тест-культур используют микромицеты, предварительно определяют показатель степени угнетения роста тест-культур в опыте по отношению к контролю, %, по формуле:
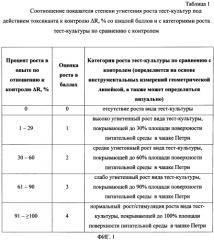
где d0 - диаметр колоний в контроле, d1 - диаметр колоний в опыте, на основании величины показателя ΔR дают интегральную оценку роста для каждой тест-культуры по сравнению с контролем в баллах с последующим ранжированием величины процента роста по одной из пяти категорий:
0% - 0 баллов - отсутствие роста,
1-29% - 1 балл - высоко угнетенный рост,
30-60% - 2 балла - средне угнетенный рост,
61-90% - 3 балла - слабо угнетенный рост,
91-≥100% - 4 балла - нормальный рост/стимуляция роста,
по общему количеству баллов у всех тест-культур за весь период инкубации определяют интегральный показатель (критерий) токсичности среды, который сравнивают с пятью классами опасности среды, условно установленными в зависимости от балльной интегральной оценки токсичности исследуемой среды:
I - очень высокая токсичность - 0-5 баллов;
II - высокая токсичность - 6-29 баллов;
III - средняя токсичность - 30-64 балла;
IV - слабая токсичность - 65-95 баллов;
V - отсутствие токсичности - 96-100 баллов; в качестве тест-культуры используют микромицеты из класса Deuteromycetes, порядка Moniliales, семейств Moniliaceae и Dematiaceae; в качестве тест-культуры используют микромицеты Alternaria alternata ВКМ F-1120; в качестве тест-культуры используют микромицеты Penicillium chrysogenum ВКМ F-245; в качестве тест-культуры используют микромицеты Aspergillus niger ВКМ F-1119; в качестве тест-культуры используют микромицеты Fusarium moniliforme ВКМ F-136; в качестве тест-культуры используют микромицеты из класса Ascomycetes, порядка Sphaerales, семейства Melanosporaceae; в качестве тест-культуры используют микромицеты Chaetomium globosum ВКМ F-109; определение показателей роста тест-культур осуществляют с помощью геометрической линейки.
На фиг. 1 представлена Таблица 1 «Соотношение показателя степени угнетения роста тест-культуры под действием токсиканта к контролю ΔR, % со шкалой баллов и с категориями роста тест-культуры по сравнению с контролем».
На фиг. 2 представлена Таблица 2 «Определение класса токсичности среды».
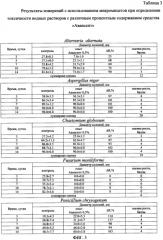
На фиг. 3 представлена Таблица 3 «Результаты измерений с использованием микромицетов при определении токсичности водных растворов с различным процентным содержанием средства «Авансепт».
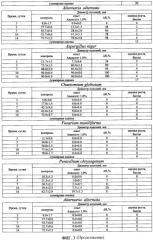
На фиг. 4 представлена Таблица 4 «Результаты измерений с использованием микромицетов при определении токсичности водных растворов с различным процентным содержанием гипохлорида натрия».
Предлагаемый способ определения токсичности среды по степени угнетения роста тест-культур микроорганизмов осуществляют следующим образом.
В биологических пробирках готовят взвесь тест-культуры. Для этого берут смыв культуры с агарового косяка значительной мутности (на глаз). Для более точного учета вносимого инфекта плотность взвеси определяют, например, по бактериальному стандарту, а для максимально высокой точности просчитывают грибковые элементы в счетной камере.
Для получения контроля при помощи микропипетки из пробирки отбирают по 5 мкл взвеси культуры и в виде капли высеивают в центр чашки Петри, содержащей 15-20 мл плотной питательной среды (агар Чапека).
Затем для приготовления опытных экземпляров из пробирки отбирают по 4 мл взвеси тест-культуры, которую переносят в другую биологическую пробирку, содержащую по 1 мл водного раствора вещества, токсичность которого определяют. Содержимое пробирки тщательно перемешивают, после чего микропипеткой отбирают по 5 мкл содержимого и аналогично контролю высеивают в центр чашки Петри.
Чашки с контрольным и опытным содержимым инкубируют в термостате при температуре 28±2°C в течение 14 суток. В период инкубации на 3, 5, 7, 10 и 14 сутки проводят измерения диаметра выросших в контроле и опыте колоний тест-культур, например, при помощи геометрической линейки.
На основании полученных данных определяют степень угнетения роста тест-культур под действием токсиканта в процентах к контролю (ΔR,%). Показатель AR определяют по формуле:
, где
d0 - диаметр колоний в контроле; d1 - диаметр колоний в опыте.
На основании величины показателя ΔR дают интегральную оценку роста для каждой тест-культуры по сравнению с контролем в баллах с последующим ранжированием величины процента роста по одной из пяти категорий в соответствии с Таблицей 1:
0% - 0 баллов - отсутствие роста;
1-29% - 1 балл - высоко угнетенный рост;
30-60% - 2 балла - средне угнетенный рост;
61 -90% - 3 балла - слабо угнетенный рост;
91-≥100% - 4 балла - нормальный рост/стимуляция роста.
Шаги ранжирования показателя ΔR, %, и интервалы его соотнесения со шкалой баллов и категорией роста тест-культуры по сравнению с контролем выведены эмпирически, путем проведения в лабораторных условиях модельных экспериментов по оценке влияния различных абиотических факторов внешней среды на рост мицелия микромицетов.
По общему количеству баллов у всех тест-культур за весь период инкубации определяют интегральный показатель (критерий) токсичности среды, который может колебаться от 0 до 100 баллов, который сравнивают с условно установленными классами опасности среды в соответствии с Таблицей 2.
Экспериментально условно установлены 5 классов опасности в зависимости от балльной интегральной оценки токсичности исследуемой среды:
I - очень высокая токсичность - 0-5 баллов;
II - высокая токсичность - 6-29 баллов;
III - средняя токсичность - 30-64 балла;
IV - слабая токсичность - 65-95 баллов;
V - отсутствие токсичности - 96-100 баллов.
Использование в качестве тест-культур микромицетов с клетками эукариотического типа, характеризующихся наличием в клетке истинного ядра, митотического деления и рибосом 80S типа, чьи клеточные мембраны содержат стеролы, обеспечивает повышение объективности оценки токсичности среды для растений, животных и человека.
Осуществление измерения диаметра выросших в контроле и опыте колоний тест-культур, а также определение степени угнетения роста тест-культур под действием токсиканта в процентах к контролю (ΔR,%) с последующим ранжированием величины процента роста по одной из пяти категорий повышает точность полученных данных, что также способствует повышению объективности оценки токсичности среды для растений, животных и человека.
Ниже приведены примеры определения токсичности известных дезинфицирующих средств с помощью заявленного способа, иллюстрирующие соответствие заявленного изобретения условию патентоспособности изобретений «промышленная применимость».
Пример 1. Оценка токсичности различных концентраций дезинфицирующего средства «Авансепт».
Средство дезинфицирующее с моющим эффектом «Авансепт» является высокотоксичным для представителей микрофлоры веществом, применяемым в качестве средства дезинфекции и предстерилизационной очистки медицинских инсрументов и принадлежностей в медицинских учреждениях. Средство содержит 6% полигексаметиленгуанидин гидрохлорид и 4,5% алкилдиметилбензиламмоний хлорид в качестве действующих веществ, а также вспомогательные компоненты: краситель, отдушку и воду. Производитель ООО «МК ВИТА-ПУЛ», Россия.
Результаты измерений с использованием конкретных микромицетов при определении токсичности водных и растворов с различным процентным содержанием средства «Авансепт» приведены в Таблице 3.
Проведенные исследования показывают, что водный раствор с 0,5% концентрацией «Авансепта» относится к категории слаботоксичных (71 балл, IV класс), водный раствор с 1,0% концентрацией «Авансепт» относится к категории среднетоксичных (34 балла, III класс), а водный раствор с 3,0% концентрацией «Авансепта» относится к категории очень высокотоксичных (5 баллов, I класс).
Пример 2. Оценка токсичности различных концентраций гипохлорида натрия (NaCIO).
Данное вещество применяется для обеззараживания поверхностей, посуды, белья, выделений больного, санитарно-технического оборудования, уборочного инвентаря. Также применяется для обеззараживания питьевой воды, воды в бассейнах, для отбелки тканей и целлюлозы, в качестве окислителя в химических производствах, для дезинфекции и обеззараживания сточных вод.
Результаты измерений с использованием конкретных микромицетов при определении токсичности водных растворов с различным процентным содержанием гипохлорида натрия приведены в Таблице 4.
Проведенные исследования показывают, что водный раствор гипохлорида натрия с 0.1% концентрацией относится к категории среднетоксичных (54 балла, III класс), водный раствор гипохлорида натрия с 15.0% концентрацией является очень высокотоксичным (0 баллов, I класс).
1. Способ определения токсичности среды по степени угнетения роста тест-культур микроорганизмов, включающий определение показателей роста тест-культур в контроле и опыте, определение интегрального показателя (критерия) токсичности среды в баллах, сравнение интегрального показателя (критерия) с условно установленными классами опасности среды, отличающийся тем, что в качестве тест-культур используют микромицеты, предварительно определяют показатель степени угнетения роста тест-культур в опыте по отношению к контролю, %, по формуле: где d0 - диаметр колоний в контроле, d1 - диаметр колоний в опыте, на основании величины показателя ΔR дают интегральную оценку роста для каждой тест-культуры по сравнению с контролем в баллах с последующим ранжированием величины процента роста по одной из пяти категорий:0% - 0 баллов - отсутствие роста,1-29% - 1 балл - высокоугнетенный рост,30-60% - 2 балла - среднеугнетенный рост,61 -90% - 3 балла - слабоугнетенный рост,91-≥100% - 4 балла - нормальный рост/стимуляция роста,по общему количеству баллов у всех тест-культур за весь период инкубации определяют интегральный показатель (критерий) токсичности среды, который сравнивают с пятью классами опасности среды, условно установленными в зависимости от балльной интегральной оценки токсичности исследуемой среды:I - очень высокая токсичность - 0-5 баллов;II - высокая токсичность - 6-29 баллов;III - средняя токсичность - 30-64 балла;IV - слабая токсичность - 65-95 баллов;V - отсутствие токсичности - 96-100 баллов.
2. Способ по п. 1, отличающийся тем, что в качестве тест-культуры используют микромицеты из класса Deuteromycetes, порядка Monilales, семейств Moniliaceae и Dematiaceae.
3. Способ по п. 2, отличающийся тем, что в качестве тест-культуры используют микромицеты Alternaria alternata ВКМ F-1120.
4. Способ по п. 2, отличающийся тем, что в качестве тест-культуры используют микромицеты Penicillium chrysogenum ВКМ F-245.
5. Способ по п. 2, отличающийся тем, что в качестве тест-культуры используют микромицеты Aspergillus niger ВКМ F-1119.
6. Способ по п. 2, отличающийся тем, что в качестве тест-культуры используют микромицеты Fusarium moniliforme ВКМ F-136.
7. Способ по п. 1, отличающийся тем, что в качестве тест-культуры используют микромицеты из класса Ascomycetes, порядка Sphaerales, семейства Melanosporaceae.
8. Способ по п. 7, отличающийся тем, что в качестве тест-культуры используют микромицеты Chaetomium globosum ВКМ F-109.
9. Способ по п. 1, отличающийся тем, что определение показателей роста тест-культур осуществляют с помощью геометрической линейки.