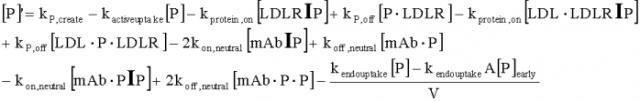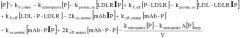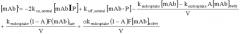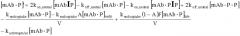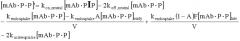Антитела с рн-зависимым связыванием антигена
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и фармакологии и касается выделенного антитела, которое специфически связывает человеческий PCSK9, содержащее: гипервариабельный участок вариабельной области тяжелой цепи 1 (VH CDR1) с аминокислотной последовательностью, показанной в SEQ ID NO: 6; VH CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 7; VH CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 8 или 9, и дополнительно содержащее: CDR1 вариабельной области легкой цепи (VL) с аминокислотной последовательностью, показанной в SEQ ID NO: 10; VL CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 11; и VL CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, а также антитела, кодируемого плазмидами, депонированными в Американской коллекции типовых культур (АТСС) и имеющими номер в АТСС No. РТА-10547 или РТА-10548 и РТА-10549, где указанное антитело специфически связывает человеческий PCSK9, и способа снижения уровня холестерина липопротеидов низкой плотности в крови субъекта, включающий введения антитела. Группа изобретений обеспечивает пролонгированное действие антител при лечении гиперхолестеринемии. 7 н. и 3 з.п. ф-лы, 5 пр., 9 табл., 15 ил.
Реферат
Область изобретения
Настоящее изобретение относится к антителам, например, полноразмерным антителам или их антиген-связывающим участкам, которые проявляют рН-зависимое связывание, так что отношение равновесных констант диссоциации (KD) и/или констант скорости диссоциации (koff) при эндосомальном рН/физиологическом рН (например, рН 5,5/рН 7,4 или рН 6,0/рН 7,4) составляет 2 или более.
Предшествующий уровень техники
Моноклональные антитела (mAb) приобрели важные терапевтические возможности для многих заболеваний (Brekke and Sandlie, Nat Rev Drug Discov 2: 52-62, 2003; Maggon, Curr Med Chem 14: 1978-1987, 2007). Большинство mAb, имеющихся в настоящее время на рынке, представляют собой антитела иммуноглобулины G (IgG). Их относительно длительное время полужизни опосредовано связыванием с неонатальным Fc-рецептором (FcRn). Захват IgG в клетку происходит посредством жидкофазного пиноцитоза, и этот IgG затем связывается с FcRn в подкисленном окружении (рН 6,0) эндосомального компартмента (Lobo et al., J Pharm Sci 93: 2645-2668, 2004). Считают, что FcRn-связанный IgG защищен от деградации рециклингом в клеточной поверхности, где нейтральный рН облегчает диссоциацию и высвобождение IgG в кровоток. Несвязанный IgG, напротив, как полагают, переходит в лизосомы и затем распадается (Lencer and Blumberg, Trends Cell Biol 15: 15: 5-9, 2005).
К настоящему времени применяли разные технологии для оптимизации функциональной активности IgG-антитела путем введения конкретных замен с целью снижения дозы и/или частоты приема доз и улучшения эффективности и безопасности (Presta, Curr. Opinion Immunol 20: 460-470, 2008). В общем, оптимизация IgG-антител может быть классифицирована на инженерию Fc константной области для воздействия на связывание антитела с FcRn, FcγR и системой комплемента и инженерию вариабельной области для воздействия на аффинность связывания.
Несколько работ описывают инженерию константной области для увеличения связывания с Fc γ-рецепторами и тем самым усиления эффекторной функции IgG1-антитела (Stavenhagen et al., Cancer Res 67: 8882-8890, 2007; Zaievsky et al., Blood 113: 3735-3743, 2009). Было показано, что замены, такие как S239D/I332E/A330L или F243L/R292P/Y300L/V305I/P396L, в IgG1 усиливают связывание Fc γ-рецептора Illa и проявляют превосходную антителозависимую клеточно-опосредованную цитотоксическую (ADCC) активность in vitro и превосходящую эффективность in vivo по сравнению с IgG1 дикого типа. Следовательно, ожидают, что по сравнению с антителами дикого типа антитела с такими заменами показывают превосходную эффективность в той же самой дозе или сравнимую эффективность в более низкой дозе и/или с меньшей частотой дозирования у человека.
Другой способ снижения дозы и/или частоты дозирования заключается в том, чтобы снизить элиминацию IgG-антитела. Сообщают, что длительное время полужизни IgG-антител зависит от его связывания с FcRn. Таким образом, широко исследуются замены, которые увеличивают аффинность связывания IgG с FcRn при рН 6,0, в то же время сохраняя рН-зависимость взаимодействия, путем инженерии константной области (Ghetie et al., Nature Biotech. 15: 637-640, 1997; Hinton et al., JBC 279: 6213-6216, 2004; Dall'Acqua et al., J Immunol 117: 1129-1138, 2006). Замены, такие как M428L/N434S, ведут к увеличенному времени полужизни и улучшенному фармакодинамическому эффекту в вариантах (Zaievsky et al., Nature Biotech. 28: 157-159, 2010). В некоторых работах сообщали об успешном увеличении времени полужизни путем введения замен, таких как T250Q/M428L или M252Y/S254T/T256E, для увеличения связывания с FcRn при кислом рН. В фармакокинетическом исследовании на приматах, не представляющих собой человека, замена T250Q/M428L в IgG1 показала время полужизни 35 суток, что является значительным увеличением в сравнении с временем полужизни 14 суток для IgG1 дикого типа (Hinton et al., J Immunol 176: 346-356, 2006).
Хотя замены в константной области способны значительно улучшить функции терапевтических IgG-антител, замены в строго консервативной области имеют риск иммуногенности у человека (Presta, supra, 2008; De Groot and Martin, Clin Immunol 131: 189-201, 2009), а замена в последовательности высоко вариабельной области может быть менее иммуногенной. Сообщения относительно вариабельной области включают инженерию остатков гипервариабельных участков (CDR) для улучшения аффинности связывания с антигеном (Rothe et al., Expert Opin Biol Ther 6: 177-187, 2006; Bostrom et al., Methods Mol Biol 525: 353-376, 2009; Thie et al., Methods Mol Biol 525: 309-322, 2009) и инженерию остатков CDR и каркасной области для улучшения стабильности (Wörn and Plückthun, J Mol Biol 305: 989-1010, 2001; Ewert et al., Methods 34: 184-199, 2004) и снижения риска иммуногенности (De Groot and Martin, выше, 2009; Jones et al., Methods Mol Bio 525: 405-423, xiv, 2009). Как сообщалось, улучшенная аффинность к антигену может быть достигнута путем созревания аффинности с использованием фагового или рибосомного дисплея рандомизированной библиотеки. Улучшенная стабильность может быть эффективно получена исходя из рационального дизайна на основе последовательности и структуры. Сниженного риска иммуногенности (деиммунизация) можно добиться разными методологиями гуманизации и удаления Т-клеточных эпитопов, что можно предсказать с использованием технологий in silico или определить анализами in vitro. Кроме того, были сконструированы вариабельные области для снижения pl. Более продолжительное время полужизни наблюдали для этих антител по сравнению с антителами дикого типа, несмотря на сравнимое FcRn-связывание (Igawa et al., PEDS, Advance Access, doi: 10.1093/protein/gzq009, 2010).
Настоящее изобретение относится к инженерии или селекции антител с рН-зависимым связыванием антигена для модификации времени полужизни антитела и/или антигена. Время полужизни антитела IgG2 может быть сокращено, если механизмы антиген-опосредованного клиренса нормально разрушают антитело при связывании с антигеном. Подобным образом, комплекс антиген: антитело может влиять на время полужизни антигена, либо пролонгируя время полужизни посредством защиты антигена от обычных процессов деградации, либо сокращая время полужизни посредством антитело-опосредованной деградации. Настоящее изобретение относится к антителам с более высокой аффинностью в отношении антигена при рН 7,4 по сравнению с эндосомальным рН (то есть, рН 5,5-6,0), так что отношение KD при рН 5,5/ рН 7,4 или при рН 6,0/ рН 7,4 составляет 2 или более.
Изобретение относится к антителу с таким рН-зависимым связыванием со своим антигеном и способам конструирования, получения и применения таких антител. Примеры полезных антител направлены на антигены, такие как пропротеин конвертаза субтилизин/кексин типа 9 (PCSK9), также известный как NARC-1, IgE, Dickkopf-родственный белок 1 (DKK1), Комплемент 5 (С5), склеростин (SOST) и рецептор гранулоцитарно-макрофагеального колониестимулирующего фактора (GMCSF).
PCSK9 был идентифицирован как белок с генетической мутацией при некоторых формах семейной гиперхолестеринемии. PCSK9 синтезируется как зимоген, который подвергается аутокаталитическому процессингу в конкретном мотиве в эндоплазматическом ретикулуме. Исследования популяций показали, что некоторые мутации PCSK9 представляют собой мутации, при которых белковый продукт экспрессии мутантного гена приобретает новые и патологические функции ("gain-of-function"), и обнаруживаются у индивидуумов с аутосомно-доминантной гиперхолестеринемией, в то время как другие мутации с потерей функции ("loss-of-function", LOF) связаны с пониженным уровнем холестерина в плазме крови. Исследования по заболеваемости и смертности в этой группе ясно продемонстрировали, что снижение функции PCSK9 значительно минимизировало риск возникновения сердечнососудистого заболевания.
Краткое изложение сущности изобретения
Настоящее изобретение относится к антителам с рН-зависимым связыванием со своим антигеном, так что аффинность в отношении связывания антигена при физиологическом рН (то есть, рН 7,4) выше чем при эндосомальном рН (то есть, рН 6,0 или 5,5). Другими словами, отношение KD или koff при рН 5,5/ рН 7,4 или при рН 6,0/ рН 7,4 составляет более чем 2, 3, 4, 8, 10, 16, 20, 30, 40 или 100 или более, или находится в интервале между 2, 3, 4, 8, 10, 16, 20, 30, 40 или 100 или более. Такие рН-зависимые антитела преимущественно диссоциируют от антигена в эндосоме. Это может увеличивать время полужизни антитела по сравнению с антителами с эквивалентными значениями KD при рН 7,4, но не проявляющими рН-зависимое связывание, когда антиген является таким, что подвергается антиген-опосредованному клиренсу (например, PCSK9). Антитела с рН-зависимым связыванием могут сокращать общее время полужизни антигена, когда антиген подвергается пониженному клиренсу при связывании с антителом (например, IL6). Антитела с рН-зависимым связыванием могут также пролонгировать это антитело-опосредованное снижение в антигене, который не связан с антителом. Это может быть важным при антагонизации антигена-мишени, обычно присутствующего в высоких уровнях (например, IgE, DKK1, С5 и SOST). Кроме того, такие антитела могут увеличивать время полужизни антигена, когда антиген представляет собой рецептор и этот рецептор имеет повышенный клиренс при связывании с антителом (например, рецептор GMCSF). В любом из воплощений изобретения, описанных ниже, KD и koff могут быть измерены при 25°С или 37°С.
В предпочтительном воплощении антитело с рН-зависимым связыванием, которое специфически связывает антиген с более высокой аффинностью при рН 7,4, чем при рН 6,0, где отношение KD и/или отношение koff при рН 6,0/рН 7,4 и при 25°С составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более, и где антитело имеет пониженный клиренс из плазмы in vivo при взаимодействии с указанным антигеном по сравнению с антителом, не проявляющим рН-зависимое связывание, которое имеет подобную аффинность в отношении данного антигена при рН 7,4, но имеет сравниваемое отношение KD и/или koff при рН 6,0/рН 7,4 менее чем 2. Предпочтительно, антиген не представляет собой рецептор интерлейкина-6 (IL6R), или предпочтительно, антитело не представляет собой антитело Fv3-m73, Fv4-m73 или H3pl/L73 против IL6R, как раскрыто в WO 2010/106812 или WO 2009/041621.
В другом предпочтительном воплощении антитело с рН-зависимым связыванием, которое специфически связывает антиген с более высокой аффинностью при рН 7,4, чем при рН 6,0, где отношение KD и/или отношение koff при рН 6,0/рН 7,4 и при 25°С составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более, и где антиген является как мембраносвязанным, так и растворимым in vivo, и где антитело опосредует повышенную локализацию в рецепторе клеточной мембраны по сравнению с антителом, которое имеет подобную аффинность в отношении данного антигена при рН 7,4, но имеет сравниваемое отношение KD и/или koff при рН 6,0/рН 7,4 менее чем 2. Предпочтительно, антиген не представляет собой рецептор интерлейкина-6 (IL6R), или предпочтительно, антитело не представляет собой антитело Fv3-m73, Fv4-m73 или H3pl/L73 против IL6R, как раскрыто в WO 2010/106812 или WO 2009/041621. В другом предпочтительном воплощении антиген представляет собой растворимый рецептор, который является несигнальным рецептором-ловушкой. В дополнительных предпочтительных воплощениях антитело с рН-зависимым связыванием представляет собой конъюгат антитела с лекарственным средством, опосредует антителозависимую клеточно-опосредованную цитотоксичность (ADCC) и/или комплементзависимую цитотоксичность (CDC).
Изобретение включает антитело с рН-зависимым связыванием, которое специфически связывает антиген с более высокой аффинностью при рН 7,4, чем при рН 6,0, где отношение KD и/или отношение koff при рН 6,0/рН 7,4 и при 25°С составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более, и где снижение in vivo количества не связанного с антителом антигена пролонгировано при взаимодействии с указанным антителом по сравнению с антителом, не проявляющим рН-зависимое связывание, которое имеет подобную аффинность в отношении данного антигена при рН 7,4, но имеет сравниваемое отношение KD и/или koff при рН 6,0/рН 7,4 менее чем 2.
В изобретении предложено антитело с рН-зависимым связыванием, которое специфически связывает антиген с более высокой аффинностью при рН 7,4, чем при рН 6,0, где отношение KD и/или отношение koff при рН 6,0/рН 7,4 и при 25°С составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более, и где имеется снижение in vivo количества связанного с антителом антигена по сравнению с антителом, не проявляющим рН-зависимое связывание, которое имеет подобную аффинность в отношении данного антигена при рН 7,4, но имеет сравниваемое отношение KD и/или koff при рН 6,0/рН 7,4 менее чем 2. В предпочтительном воплощении антиген представляет собой остеопонтин.
В изобретении также предложено агонистическое антитело с рН-зависимым связыванием, которое специфически связывает антиген с более высокой аффинностью при рН 7,4, чем при рН 6,0, где отношение KD и/или отношение koff при рН 6,0/рН 7,4 и при 25°С составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более, и где антиген представляет собой рецептор и этот рецептор имеет пониженный клиренс in vivo при взаимодействии с указанным антителом по сравнению с антителом, которое имеет подобную аффинность связывания в отношении данного рецептора при рН 7,4, но имеет сравниваемое отношение KD и/или koff при рН 6,0/рН 7,4 менее чем 2. В предпочтительном воплощении рецептор представляет собой рецептор GMCSF.
В других предпочтительных воплощениях любого из вышеописанных антител отношение KD или отношение koff при рН 6,0/рН 7,4 составляет более чем 20, 30, 40 или 100 или более, или находится в интервале между 20, 30, 40 или 100 или более. В других предпочтительных воплощениях предпочтительные отношения KD или koff при рН 6,0/рН 7,4 находятся в интервале между 2-3, 2-4, 2-8, 2-10, 2-16 или 2-20 или более, или 3-4, 3-8, 3-10, 3-16 или 3-20, или 4-8, 4-10, 4-16 или 4-20 или более, или 8-10, 8-16, 8-20 или более, 10-16, 10-20 или более, или 16-20 или более.
В других предпочтительных воплощениях вышеописанных антител связывание антитела с антигеном при рН 7,4 и при 25°С имеет KD от примерно 0,01 нМ до примерно 100 нМ, или более предпочтительно, от примерно 0,1 нМ до примерно 10 нМ.
В других предпочтительных воплощениях вышеописанных антител связывание антитела с антигеном при рН 7,4 имеет koff от примерно 1×10-4 сек-1 до примерно 1×10-1 сек-1, более предпочтительно от примерно 1×10-3 сек-1 до примерно 1×10-1 сек-1.
В еще одном предпочтительном воплощении вышеописанных антител антиген представляет собой PCSK9. В одном предпочтительном воплощении антитело против PCSK9 не представляет собой антитело H1M300N против PCSK9 (см. US 2010/0166768). В других предпочтительных воплощениях антиген представляет собой IgE, С5 или DKK1 и, в предпочтительных воплощениях, KD находится в интервале от 1,0 нМ до примерно 10 нМ или от 1,0 нМ до примерно 100 нМ.
В изобретении также предложен способ расширения интервала между приемом доз и/или снижения терапевтической дозы для лечения пациента терапевтическим антителом, включающий введение указанному пациенту терапевтически эффективного количества антитела из любых вышеописанных антител по изобретению, где фармакодинамический эффект и/или время полужизни указанного антитела пролонгированы по сравнению с антителом, которое имеет подобную аффинность при рН 7,4, но которое имеет отношение KD и/или отношение koff при рН 6,0/7,4 менее чем 2.
Кроме того, в изобретении предусмотрен способ получения антитела с пролонгированным временем полужизни и/или фармакодинамическим эффектом посредством регулирования аффинности связывания антитела рН-зависимым образом, включающий селекцию по гистидиновым остаткам или другим остаткам гипервариабельного участка (CDR) антитела, которые оптимизируют микроокружение, влияющее на рKа, так что связывание антитела с антигеном имеет отношение KD и/или отношение koff при рН 6,0/рН 7,4, которое составляет более чем 2, 3, 4, 8, 10, 16 или более, или находится в интервале между 2, 3, 4, 8, 10, 16 или более. В данном изобретении также предусмотрены антитела, полученные этим способом, включая антитела с 1, 2, 3, 4, 5 или более гистидиновыми заменами в остатках CDR, которые оптимизируют микроокружение, влияющее на рKа.
В предпочтительном воплощении вышеописанного способа способ дополнительно включает мутагенез антитела до достижения аффинности антитела с KD при рН 7,4 по меньшей мере 100 нМ, как измерено при 25°С. В другом воплощении данного изобретения предложена библиотека антител, богатых гистидиновыми остатками в CDR или другими остатками, которые оптимизируют микроокружение, влияющее на рKа.
В других предпочтительных воплощениях изобретения предложено выделенное антитело, которое специфически связывает PCSK9 и содержит гипервариабельный участок вариабельной области тяжелой цепи 1 (VH CDR1), VH CDR2 и VH CDR3 из аминокислотной последовательности VH, показанной в SEQ ID NO: 4 или 5, или ее варианта, имеющего одну, две, три или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3.
В предпочтительном воплощении антитело дополнительно содержит CDR1, CDR2 и CDR3 вариабельной области легкой цепи (VL) из аминокислотной последовательности VL, показанной в SEQ ID NO: 3, или ее варианта, имеющего одну, две, три или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3.
В изобретении также предложено выделенное антитело, которое специфически связывает PCSK9 и содержит гипервариабельный участок вариабельной области тяжелой цепи 1 (VH CDR1) с аминокислотной последовательностью, показанной в SEQ ID NO: 6, VH CDR2 с аминокислотной последовательностью, показанной в SEQ ID, NO: 7, и/или VH CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 8, или ее вариантом, имеющим одну или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3, а также выделенное антитело, которое специфически связывает PCSK9 и содержит VH CDR1 с аминокислотной последовательностью, показанной в SEQ ID NO: 6, VH CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 7, и/или VH CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 9, или ее вариантом, имеющим одну, две, три или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3.
В дополнительном воплощении изобретения предусмотрено выделенное антитело, содержащее гипервариабельный участок вариабельной области легкой цепи 1 (VL CDR1) с аминокислотной последовательностью, показанной в SEQ ID NO: 10, VL CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 11, и/или VL CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, или их вариантами, имеющими одну, две, три или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3.
В предпочтительных воплощениях из указанных выше антитело дополнительно содержит VL CDR 1 с аминокислотной последовательностью, показанной в SEQ ID NO: 10, VL CDR2 с аминокислотной последовательностью, показанной в SEQ ID NO: 11, и/или VL CDR3 с аминокислотной последовательностью, показанной в SEQ ID NO: 12, или их вариантами, имеющими одну, две, три или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3, предпочтительно, VH область содержит SEQ ID NO: 4 или SEQ ID NO: 5, и VL область содержит SEQ ID NO: 3, или их вариант, имеющий одну, две, три или более консервативных аминокислотных замен в SEQ ID NO: 4, SEQ ID NO: 5 и/или SEQ ID NO: 3.
В другом предпочтительном воплощении антител против PCSK9 по настоящему изобретению антитело имеет одну или более Fc мутаций, предпочтительно, N434S, N434H, M428L-N434H обратимый мутант, M428L-N434A обратимый мутант, T250Q-M428L обратимый мутант и M428L-N434S обратимый мутант.
В другом воплощении изобретения предложено антитело или его антиген-связывающий участок, кодируемые плазмидами, депонированными в Американской коллекции типовых культур (АТСС) и имеющими номер в АТСС No. РТА-10547, или РТА-10548, и/или РТА-10549.
Также в изобретении предусмотрены фармацевтические композиции, содержащие терапевтически эффективное количество любого из вышеописанных антител, клетка-хозяин, которая рекомбинантно продуцирует антитело из любых вышеописанных антител, выделенная нуклеиновая кислота, кодирующая любое из вышеописанных антител, и выделенная нуклеиновая кислота, кодирующая любое из вышеописанных антител.
Также в изобретении предусмотрен способ снижения уровня холестерина в липопротеидах низкой плотности (ЛПНП) в крови субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества любого из антител по изобретению, направленных на антиген PCSK9.
Краткое описание графических материалов
На Фиг.1 представлен график, показывающий увеличение концентрации антитела в зависимости от времени как функция отношения KD.
На Фиг.2 представлен график, показывающий уменьшение концентрации свободного лиганда (антигена) от времени как функция отношения KD.
На Фиг.3 представлен график, показывающий влияние изменения koff и kon на концентрацию антитела в зависимости от времени.
На Фиг.4 представлена тепловая карта, показывающая, на сколько суток дольше антитело с рН-зависимым связыванием будет снижать сывороточную концентрацию антигена, как функция KD (R), времени полужизни антигена в сыворотке и концентрации антигена в сыворотке. R эквивалентно отношению KD при эндосомальном рН против физиологического рН.
На Фиг.5 подтверждается прогнозируемость модели рН-зависимого антитела. Эта модель успешно прогнозировала общую концентрацию антитела 5А10 (Фиг.5А). На Фиг.5В представлен график, демонстрирующий эффект 5А10 в отношении LDL от времени.
На Фиг.6 также подтверждается прогнозируемость модели рН-зависимого антитела. Эта модель успешно прогнозировала общую концентрацию антитела 5L1721H23_6L3H3 (6L3H3) (Фиг.6А). На Фиг. 6В представлен график, демонстрирующий эффект 6L3H3 в отношении LDL от времени. Антитело с рН-зависимым связыванием 6L3H3 удлиняло интервал, в котором уровень LDL был снижен, по сравнению с 5А10.
На Фиг.7 показано влияние на общий холестерин от времени при введении разных антител против PCSK9. На Фиг.7А показан дозозависимый эффект 5А10 в отношении общего холестерина. На Фиг. 7В показан дозозависимый эффект рН-зависимого антитела 5L1721H23_6H3. Действие эффекта пролонгировано по сравнению с эффектом 5А10. [mpk означает мг/кг].
На Фиг.8 показан график, демонстрирующий, что антитела с рН-зависимым связыванием 5L1721H23_6H3 и 5L1721H23_6L3H3 имели пониженную деградацию антитела и пролонгированное время полужизни по сравнению с антителами, не проявляющими рН-зависимое связывание. На Фиг.8В показан график, демонстрирующий, что эффект, показанный на Фиг.8А, вызван мишень-опосредованной деградацией. Деградация антитела у мышей с выключенным геном PCSK9 резко повышалась после инъекции PCSK9. Примечания: *один удален из группы 5А10; **концентрации mAb ниже уровня обнаружения заменены значениями уровня обнаружения.
На Фиг.9 показан график, иллюстрирующий влияние рН-чувствительного антагонистического антитела против PCSK9 и не чувствительного к рН антагонистического антитела против PCSK9 на уровни холестерина у обезьян. Хотя никаких резких изменений в уровнях HDL не было обнаружено (Фиг.9А), рН-чувствительные антитела опосредовали более продолжительное снижение уровней LDL по сравнению с независимым от рН антителом L1L3.
На Фиг.10 показан график, демонстрирующий, что антитела против PCSK9 с рН-зависимым связыванием имели пролонгированное время полужизни in vivo по сравнению с независимыми от рН антителами.
На Фиг. 11 представлена тепловая карта, демонстрирующая общее моделирование для рН-зависимого связывания. Такие антитела, направленные против антигенов DKK1, IgE или С5, могут значительно увеличивать количество суток, при которых данный антиген испытывал пониженные антигенные уровни по сравнению с антителом без рН-зависимого связывания.
На Фиг.12 смоделирована динамика изменения концентрации антигена от времени после введения антитела с рН-зависимым связыванием, направленным против антигена IgE.
На Фиг.13 смоделирована динамика изменения концентрации антигена от времени после введения антитела с рН-зависимым связыванием, направленным против антигена DKK1.
На Фиг.14 смоделирована динамика изменения концентрации антигена от времени после введения антитела с рН-зависимым связыванием, направленным против антигена С5.
На Фиг.15 показана модель переноса для антител с рН-зависимым связыванием, используемых для моделирования.
Подробное описание изобретения
Настоящее изобретение относится к антителам с рН-зависимым связыванием со своим антигеном, так что аффинность связывания антигена при физиологическом рН (то есть, рН 7,4) выше чем при эндосомальном рН (то есть, рН 6,0 или 5,5). Другими словами, отношение KD или koff при рН 5,5/рН 7,4 или при рН 6,0/рН 7,4 составляет более чем 2, 3, 4, 8, 10, 16, 20, 30, 40 или 100 или более, или находится в интервале между 2, 3, 4, 8, 10, 16, 20, 30, 40 или 100 или более. Такие рН-зависимые антитела преимущественно диссоциируют от антигена в эндосоме. Это может увеличивать время полужизни антитела в кровотоке по сравнению с антителами с эквивалентными значениями KD при рН 7,4, но не проявляющими рН-зависимое связывание, когда антиген является таким, что подвергается антиген-опосредованному клиренсу (например, PCSK9). Антитела с рН-зависимым связыванием могут уменьшать общее время полужизни антигена, когда антиген подвергается пониженному клиренсу при связывании с антителом (например, IL6). Антитела с рН-зависимым связыванием могут также пролонгировать это снижение в антигене, который не связан с антителом. Это может быть важным при антагонизации антигена-мишени, обычно присутствующего в высоких уровнях (например, IgE, DKK1, С5 и SOST). Кроме того, такие антитела могут увеличивать время полужизни антигена, когда антиген представляет собой рецептор и этот рецептор имеет повышенный клиренс при связывании с антителом (например, рецептор GMCSF).
Если антиген опосредует мишень-опосредованную деградацию, то использование таких антител с рН-зависимым связыванием для достижения диссоциации в эндосоме может увеличивать фармакодинамический эффект антитела, например, когда антиген подвергается мишень-опосредованному клиренсу (например, PCSK9). Антитело с рН-зависимым связыванием диссоциирует от антигена, избегает антиген-опосредованной деградации, может подвергаться рециклингу из клетки посредством FcRn-связывания и будет иметь более продолжительное время полужизни, чем антитело с подобным Ко при рН 7,4, но не проявляющее рН-зависимое связывание.
Использование таких антител с рН-зависимым связыванием также терапевтически полезно, когда растворимый антиген присутствует в высокой концентрации (например, IgE, C5, DKK1 или SOST). При диссоциации от антигена в эндосоме и деградации антигена в лизосоме антитело может подвергаться рециклингу в плазме для связывания дополнительного свободного антигена, может пролонгировать снижение не связанного с антителом антигена и может уменьшать необходмую терапевтическую дозу по сравнению с антителом с подобным KD при рН 7,4, но не проявляющим рН-зависимое связывание.
Кроме того, использование антител с рН-зависимым связыванием может быть полезным, когда антиген присутствует в мембране в связанной, а также свободной форме, например, рецептор, и это желательно для усиления связывания с мембрано-связанной формой. Благодаря диссоциированию от растворимой формы, антитело обладает повышенной возможностью к повторному связыванию с мембранной формой, увеличивая близость антитела к клеточной мембране. При связывании с мембранной формой дивалентным образом эффективная аффинность может быть выше, или эффективная скорость диссоциации может быть медленнее, вследствие эффекта авидности.
Это применимо для использования конъюгатов антитела с лекарственным средством (ADC) при нацеливании на антиген, присутствующий как в мембрано-связанной, так и свободной форме. В FcRn-содержащих клетках эндотелия растворимый антиген будет выводиться при ADC-рециклинге в компартмент плазмы, давая возможность для связывания мембрано-связанного антигена. При использовании антител с рН-зависимым связыванием повышенное связывание с мембрано-связанной формой, дивалентным или моновалентным образом, будет вызывать повышенную интернализацию антитела с мембрано-связанным антигеном и клеточную гибель. При связывании с рецептором дивалентным образом авидность может увеличивать эффективную аффинность или замедлять эффективную скорость диссоциации.
Механизм для ADCC и комплемент-зависимой цитотоксичности (CDC) также может быть задействован при использовании антител с рН-зависимым связыванием. В FcRn-содержащих клетках эндотелия растворимый антиген будет выводиться при ADC-рециклинге в компартмент плазмы, давая возможность для связывания мембрано-связанного антигена. Высвобождение антител из растворимого рецептора будет повышать доступность свободного антитела, которое может затем связываться с мембрано-связанным антигеном и увеличивать клеточную гибель.
Общие методики
При осуществлении настоящего изобретения, если не указано иное, использованы традиционные методики молекулярной биологии (включая рекомбинантные технологии), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалисту в данной области техники. Такие методики всесторонне описаны в литературе, например, по молекулярному клонированию: A Laboratory Manual, второе издание (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J.Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E.Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P.Mather and P.E.Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A.Doyle, J.B.Griffiths, and D.G.Newell, eds., 1993-1998) J.Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M.Weir and C.C.Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M.Miller and M.P.Calos, eds., 1987); Current Protocols in Molecular Biology (F.M.Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E.Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A.Janeway and P.Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D.Catty, ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P.Shepherd and C.Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E.Harlow and D.Lane (Cold Spring Harbor Laboratory Press, 1999); The antibodies (M.Zanetti and J.D.Capra, eds., Harwood Academic Publishers, 1995).
Определения
Термин "антитело" означает молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и так далее, посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В определение данного термина, как он использован здесь, входят не только интактные поликлональные или моноклональные антитела, но также их любые антиген-связывающие фрагменты (например "антиген-связывающий участок") или одноцепочечные варианты, слитые белки, содержащие антитело, и любая другая модифицированная конфигурация молекулы иммуноглобулина, которая содержит сайт распознавания антигена, в том числе, например, одноцепочечные варианты (scFv) и однодоменные антитела (например, однодоменные антитела человека, семейства верблюдовых или акул), макситела, минитела, интратела, диатела, триатела, тетратела, vNAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotech 23: 1126-1136, 2005), но не ограничиваясь ими. Антитело включает антитело любого класса, например IgG, IgA или IgM (или их подклассы), и антитело, не относящееся к какому-либо определенному классу. В зависимости от аминокислотной последовательности константного домена тяжелой цепи антитела иммуноглобулины могут быть распределены в разные классы. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие разным классам иммуноглобулинов, соответственно называют альфа, дельта, эпсилон, гамма и мю. Структуры субъединиц и трехмерные конфигурации иммуноглобулинов разных классов хорошо известны.
Термин "антиген-связывающий участок" антитела, как он использован здесь, относится к одному или более чем одному фрагменту интактного антитела, который сохраняет способность специфически связывать данный антиген (например, мишень X). Антиген-связывающие функции антитела могут осуществляться фрагментами интактного антитела. Примеры связывающих фрагментов, охватываемых термином "антиген-связывающий участок" антитела, включают Fab, Fab', F(ab')2, Fd-фрагмент, состоящий из VH и СН1 доменов, Fv-фрагмент, состоящий из VL и VH доменов одного плеча антитела, фрагмент однодоменного антитела (dAb) (Ward et al., Nature 341: 544-546, 1989) и выделенный гипервариабельный участок (CDR).
Термин "CDR", как он использован здесь, может быть определен в соответствии с любым из определений Kabat, Chothia, расширенным, АbМ, контактным и/или конформационным определением. Идентичность аминокислотных остатков в конкретном антителе, которые составляют CDR, могут быть определены с использованием способов, хорошо известных в данной области техники. CDR антитела, как они определены здесь, могут быть идентифицированы как гипервариабельные участки, первоначально определенные по Kabat et al. См., например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C. Положения CDR также могут быть идентифицированы как петлевые структуры, первоначально описанные Chothia и другими. См., например, Chothia et al., Nature 342: 877-883, 1989. Другие подходы идентификации CDR включают "определение АВМ", которое является компромиссом между Kabat и Chothia и производится с использованием программного обеспечения моделирования АВМ антитела Oxford Molecular's (в настоящее время Accelrys®), или "контактное определение" CDR на основе наблюдаемых антигенных контактов, как изложено в MacCallum et al., J.Mol. Biol. 262: 732-745, 1996. В другом подходе, на который ссылаются здесь как на "конформационное определение" CDR, положения CDR могут быть идентифицированы как остатки, которые делают энтальпические вклады в связывание с антигеном. См., например, Makabe et al., Journal of Biological Chemistry, 283: 1156-1166, 2008. Еще дополнительные определения CDR связывания могут не точно следовать одному из вышеопределенных подходов, но будут тем не менее перекрываться с по меньшей мере частью из CDR Kabat, хотя они могут быть укороченными или удлиненными в свете предсказания или экспериментальных обнаружений, что конкретные остатки или группы остатков или даже целые CDR не влияют значительно на связывание с антигеном. CDR, как он использован здесь, может ссылаться на CDR, определенные по любому из подходов, известных в данной области техники, включая комбинации подходов.
Термин "моноклональное антитело", как он использован здесь, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, содержащие данную популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, направленно воздействуя на один антигенный сайт. Кроме того, в противоположность препаратам поликлональных антител, которые как правило включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональное" указывает на природу антитела как полученного из по существу гомогенной популяции антител и не должен трактоваться как требующее продуцирования антитела каким-либо конкретным способом. Например, моноклональные антитела, предназначенные для использования в соответствии с настоящим изобретением, могут быть получены гибридомным методом, первоначально описанным Kohler и Milstein, 1975, Nature 256:495, или могут быть получены методами рекомбинантной ДНК, такими как описано в патенте США 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, генерированных с использованием методик, описанных в McCafferty et al., 1990, Nature 348:552-554, например.
Термин "гуманизированное" антитело, как он использован здесь, относится к формам антител, не являющихся человеческими (например, мышиные), которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывающие последовательности антител), которые содержат минимальную последовательность, имеющую происхождение из иммуноглобулина, не являющегося человеческим. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельного участка (CDR) реципиента заменены остатками из CDR видов, не являющихся человеческими (донорное антитело), такими ка