Усиленный иммунный ответ у видов птиц
Иллюстрации
Показать всеГруппа изобретений относится к ветеринарии, а именно к способу иммунной активации для повышения вылупляемости оплодотворенного куриного яйца, зараженного Е. coli. Для этого вводят in ovo в яйцо от около 0,05 микрограмма до около 10 микрограммов композиции иммуномодулятора. Композиция иммуномодулятора содержит: катионное липосомальное средство доставки и молекулу нуклеиновой кислоты бактериального происхождения, не кодирующую иммуноген. Группа изобретений относится к способу снижения смертности цыпленка, вылупившегося из оплодотворенного куриного яйца, зараженного Е. coli, путем введения вышеуказанной композиции. Использование данной группы изобретений позволяет повысить вылупляемость оплодотворенного куриного яйца путем активации усиления иммунного ответа у птиц, зараженных Е. coli. 2 н. и 16 з.п. ф-лы, 8 пр., 8 табл., 42 ил.
Реферат
Данное изобретение относится к способу активации иммунной системы у видов птиц. В частности, данное изобретение включает способы вызывания респираторного и системного, неспецифического и антиген-специфического ответов, которые полезны для иммунизации, вакцинации и лечения животных от инфекционной болезни.
Вакцины используются для предотвращения инфекционной болезни и для лечения выявленных болезней. Инфекционные болезни вызываются инфекционными агентами, включающими такие агенты, как вирусы, бактерии, паразиты и грибы. Для профилактики и лечения инфекционных болезней было разработано множество активных веществ и способов для всех видов, включая млекопитающих, птиц, рыб и приматов.
Программы вакцинации особенно важны для выращиваемых в коммерческих целях животных, применяемых в пищевой промышленности. Птицы являются основными мишенями для многих типов инфекций. Племенных и промышленных кур, индеек и другую птицу обычно вакцинируют, чтобы защитить от патогенов из окружающей среды. Одним из наиболее экономически важных болезней в птицеводстве является болезнь Марека, которая представляет собой лимфопролиферативное заболевание, которое возникает в природе у кур. Болезнь вызывается высокозаразным вирусом герпеса, который распространяется горизонтально, и отвечает за основные экономические потери в птицеводстве. Симптомы болезни Марека значительно проявляются в нервах, гениталиях, внутренних органах, глазах и на коже инфицированных птиц, вызывая двигательный паралич, пониженное функционирование органов и хроническое недоедание, которое обязательно приводит к смерти.
Вылупившиеся птенцы подвергаются действию патогенных микроорганизмов сразу же после вылупления. Хотя птенцы изначально защищены от патогенов антителами, полученными от матери, эта защита является только временной, и собственная незрелая иммунная система птицы должна начать защищать птицу от патогенов. Часто является желательным предотвращать у молодых птиц инфекции, которым они наиболее восприимчивы. Также желательно предотвращать инфекции у более взрослых птиц, особенно когда птиц содержат в тесном соседстве, что приводит к быстрому распространению болезни.
В большинстве промышленных стад только что вылупившимся птенцам вводят определенные вакцины парентерально при вылуплении. Так как атака патогенов часто происходит в совсем юном возрасте, их необходимо вакцинировать перед тем, как их поместят в помещение для молодняка или брудер. Такая схема вакцинации требует обработки каждой птицы и включает возможный риск случайного самозаражения. Кроме того, эти вакцины не всегда эффективны. Молодые цыплята могут быть подвержены вирулентной форме болезни слишком быстро после вакцинации, еще перед тем, как у них появится возможность развить адекватный защитный иммунитет.
Некоторые живые вирусные вакцины могут быть введены в яйца перед вылуплением птиц. Эту методику называют "вакцинация in ovo". У вакцинированных in ovo птиц развивается резистентность к целевому заболеванию. Однако многие вакцины, применяемые для вылупившихся птиц, не могут применяться для вакцинации in ovo из-за эмбриональной патогенности агентов вакцины. Эмбрионы на поздней стадии высоко восприимчивы к заражению большинством исследованных вирусов в вакцинах. Не все вирусы в вакцинах, которые не патогенны для вылупившихся птенцов, также безопасны для эмбрионов на поздней стадии. Например, штаммы для вакцин вируса инфекционного бронхита (IBV) и вируса болезни Ньюкасла (NDV), которые обычно применяют в качестве вакцин для только что вылупившихся цыплят, являются летальными для эмбрионов после инокуляции in ovo. Эти вирусы были модифицированы для того, чтобы сделать их безопасными для применения in ovo. Модификация вирусов ослабляет вызываемый иммунный ответ, и, следовательно, такая вакцина является менее эффективным вакцинирующим агентом для защиты эмбрионов на поздней стадии.
Программа вакцинации, полученная из таких в корне отличных вакцин, необходимых для обеспечения защиты от инфекционных болезней и экономических потерь, является комплексной. Поэтому существует необходимость в способе вызывания антиген-неспецифического иммунного ответа, который усилит защиту птиц от инфекционных болезней и будет простым в применении. Кроме того, желательно иметь способ вызывания иммунного ответа, который обеспечивает защитную функцию от более чем одного инфекционного агента. Далее, существует необходимость в способе вызывания иммунного ответа, который является более длительным или не требует ревакцинации. В данном изобретении представлен способ вызывания антиген-неспецифического иммунного ответа у видов птиц, который также снижает заболеваемость стада, обеспечивает защитную функцию от более чем одного инфекционного агента и обеспечивает защиту в течение более длительного периода времени по сравнению с другими продуктами, известными из уровня техники.
Краткое описание фигур
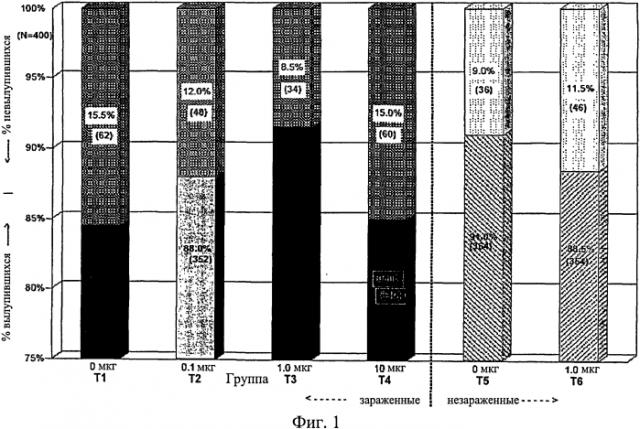
На фиг.1 графически изображена скорость вылупления цыплят между различно обработанными группами оплодотворенных куриных яиц. Анализируемые в исследовании группы включают Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
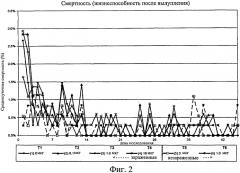
На фиг.2 графически изображена среднесуточная смертность после вылупления на отсек в день. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
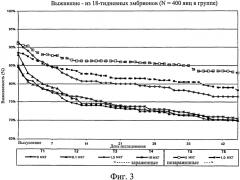
На фиг.3 графически изображено соотношение птиц, выживших на любой конкретный день на отсек, по отношению к исходному количеству оплодотворенных яиц. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
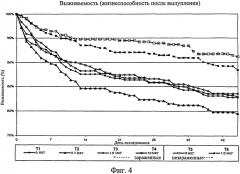
На фиг.4 графически изображена выживаемость птиц после вылупления. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; ТЗ, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.5 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3. 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.6 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 14-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3. 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.7 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 21-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.8 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 28-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.9 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 35-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.10 графически изображена выживаемость, смертность при вылуплении и смертность после вылупления по 45-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.11 показана суммарная смертность на группу 18-дневных эмбрионов по 45-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.12 показана суммарная смертность на группу после вылупления, с 0-го дня исследования по 45-й день. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.13 показан общий средний прирост массы тела, наблюдаемый с 0-го до 7-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.14 показан общий средний прирост массы тела, наблюдаемый с 0-го до 14-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.15 показан общий средний прирост массы тела, наблюдаемый с 0-го до 21-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.16 показан общий средний прирост массы тела, наблюдаемый с 0-го до 28-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.17 показан общий средний прирост массы тела, наблюдаемый с 0-го до 35-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.18 показан общий средний прирост массы тела, наблюдаемый с 0-го до 45-го дня исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 10,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.19 графически изображено количество цыплят, вылупившихся на исследуемую группу оплодотворенных куриных яиц. Анализируемые исследуемые группы включают Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.20 графически изображено количество живых цыплят на группу на 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; Т4.1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.21 показано сравнение живых цыплят и мертвых цыплят на группу на 7-й день исследования.
На фиг.22 показан процент смертности на исследуемую группу по 7-й день исследования. Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4. 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.23 графически показано количество птиц, выживших к концу исследования (7-й день) для каждой группы, включая мертвых эмбрионов, мертвых цыплят и живых цыплят (зеленый). Ключ: Т1, 0 мкг иммуномодулятора/яйцо и заражение Е. coli; T2, 0,1 мкг иммуномодулятора/яйцо и заражение Е. coli; Т3, 1,0 мкг иммуномодулятора/яйцо и заражение Е. coli; T4, 1,0 мкг иммуномодулятора/яйцо плюс 1 доза вакцины Марека и заражение Е. coli; Т5, 0 мкг иммуномодулятора/яйцо и без заражения; и Т6, 1,0 мкг иммуномодулятора/яйцо и без заражения.
На фиг.24 графически показан процент цыплят, вылупившихся на исследуемую группу оплодотворенных яиц. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.25 показан процент смертности для исследуемых групп, не зараженных Е. coli, после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.26 показан процент смертности для исследуемых групп, зараженных Е. coli, после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.27 графически показан процент смертности для каждой исследуемой группы после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.28 показан процент выживания для каждой исследуемой группы после вылупления по 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.29 показан процент выживания для каждой исследуемой группы на 7-й день исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.30 показана еженедельная смертность для каждой исследуемой группы по 7-й и 14-й день. Анализируемые группы изучения включают группы, перечисленные в таблице 4.
На фиг.31 графически показан эффект иммуномодулятора на репликацию HVT (вирус герпеса индейки) вакцины от болезни Марека в клетках селезенки на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.32 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.33 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.34 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на первой неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.35 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.36 графически показан эффект иммуномодулятора на репликацию HVT вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.37 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в клетках селезенки на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.38 графически показан эффект иммуномодулятора на репликацию SB-1 вакцины от болезни Марека в мононуклеарных клетках периферической крови на второй неделе исследования. Анализируемые группы изучения включают группы, перечисленные в таблице 5.
На фиг.39 графически изображено снижение аэросаккулита у цыплят, которые получали иммуномодулятор in ovo, были вакцинированы от болезни Ньюкасла и заражены. Анализируемые группы изучения включают группы, перечисленные в таблице 7.
На фиг.40 графически изображен анализ ELISA на 26-й день для исследуемых групп, перечисленных в таблице 7.
На фиг.41 графически изображена выживаемость цыплят в исследуемых группах, перечисленных в таблице 8.
На фиг.42 графически изображены случаи болезни Марека среди исследуемых групп, перечисленных в таблице 8.
Подробное описание изобретения
Способ вызывания иммунного ответа у представителя вида птиц согласно настоящему изобретению включает введение представителю вида птиц эффективного количества композиции иммуномодулятора для вызывания иммунного ответа у представителя вида птиц. Композиция иммуномодулятора включает липосомальное средство доставки и, по меньшей мере, одну молекулу нуклеиновой кислоты. В частности, иммуномодулятор вызывает антиген-неспецифический иммунный ответ, который далее усиливается при введении, по меньшей мере, одного биологического агента, такого как вакцина.
Способы представляют новые стратегии лечения для защиты видов птиц от инфекционных болезней и лечения популяций, имеющих инфекционную болезнь. Кроме того, при применении композиции иммуномодулятора согласно настоящему изобретению отсутствует снижение вылупляемости или степени выживания после вылупления, когда иммуномодулятор вводится in ovo, и отсутствует снижение вылупляемости или степени выживания при совместном введении с вакциной. Далее, предварительное введение иммуномодулятора до введения вакцины усиливает антиген-неспецифический иммунный ответ. Способы согласно настоящему изобретению также обеспечивают безопасное применение вакцин in ovo, ранее доступных только для введения после вылупления. Кроме того, способ согласно настоящему изобретению позволяет сочетать более чем одну вакцину с композицией иммуномодулятора. Наконец, способ согласно настоящему изобретению обеспечивает более длительную защиту от болезни, когда иммуномодулятор применяется в комбинации с вакциной.
I. Композиция
а. Иммуномодулятор
В одном варианте выполнения изобретения композиция иммуномодулятора включает липосомальное средство доставки и, по меньшей мере, одну молекулу нуклеиновой кислоты, как описано в патенте США №6693086, который включен сюда в качестве ссылки.
Подходящее липосомальное средство доставки включает липидную композицию, которая способна доставлять молекулы нуклеиновой кислоты в ткани обработанного субъекта. Липосомальное средство доставки предпочтительно способно оставаться стабильным в субъекте в течение достаточного количества времени для доставки молекулы нуклеиновой кислоты и/или биологического агента. В одном варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 30 минут. В другом варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 1 часа. В еще одном варианте выполнения изобретения липосомальное средство доставки остается стабильным в принимающем субъекте в течение, по меньшей мере, около 24 часов.
Липосомальное средство доставки согласно настоящему изобретению включает липидную композицию, которая способна сливаться с плазматической мембраной клетки для доставки молекулы нуклеиновой кислоты в клетку. В одном варианте выполнения изобретения при доставке комплекса нуклеиновая кислота: липосома согласно настоящему изобретению представляет собой, по меньшей мере, около 1 пикограмма (пг) экспрессированного белка на миллиграмм (мг) суммарного белка ткани на микрограмм (мкг) доставленной нуклеиновой кислоты. В другом варианте выполнения изобретения эффективность трансфекции комплексом нуклеиновая кислота: липосома представляет собой, по меньшей мере, около 10 пг экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты; и в еще одном варианте выполнения изобретения, по меньшей мере, около 50 пг экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты. Эффективность трансфекции комплекса может быть такой низкой, как 1 фемтограмм (фг) экспрессированного белка на мг суммарного белка ткани на мкг доставленной нуклеиновой кислоты, где указанные выше количества более предпочтительны.
Предпочтительное липосомальное средство доставки согласно настоящему изобретению в диаметре составляет между около 100 и 500 нанометров (нм), в другом варианте выполнения между около 150 и 450 нм, и в еще одном варианте выполнения между около 200 и 400 нм.
Подходящие липосомы включают любые липосомы, такие как широко применяемые, например, в способах доставки генов, известных специалистам в данной области техники. Предпочтительные липосомальные средства доставки включают липиды в виде мультиламеллярных везикул (МЛВ) и липиды, полученные экструзией. Способы получения МЛВ хорошо известны в данной области техники. Более предпочтительные липосомальные средства доставки включают липосомы, имеющие поликатионную липидную композицию (т.е. катионные липосомы), и/или липосомы, имеющие холестериновую основную цепь, конъюгированную с полиэтиленгликолем. Примеры катионных липосомальных композиций включают, но не ограничены ими, N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония хлорид (DOTMA) и холестерин, N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония хлорид (DOTAP) и холестерин, 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния хлорид (DOTIM) и холестерин, диметилдиоктадециламмония бромид (DDAB) и холестерин и их комбинации. Наиболее предпочтительной липосомальной композицией для применения в качестве средства доставки является DOTIM и холестерин.
Подходящая молекула нуклеиновой кислоты включает любую последовательность нуклеиновой кислоты, такую как кодирующая или некодирующая последовательность, и ДНК или РНК. Кодирующие последовательности нуклеиновой кислоты кодируют, по меньшей мере, часть белка или пептида, в то время как некодирующая последовательность не кодирует какую-либо часть белка или пептида. Согласно настоящему изобретению "некодирующие" нуклеиновые кислоты могут включать регуляторные участки транскрипционной единицы, такие как промоторный участок. Термин "пустой вектор" может применяться взаимозаменяемо с термином "некодирующий" и, в частности, относится к последовательности нуклеиновой кислоты, в которой отсутствует участок, кодирующий белок, как, например, плазмидный вектор без вставки гена. Экспрессия белка, закодированного молекулой нуклеиновой кислоты, не требуется для вызывания антиген-неспецифического иммунного ответа; поэтому молекула нуклеиновой кислоты не должна быть обязательно функциональна связана с последовательностью, контролирующей транскрипцию. Однако могут быть получены другие преимущества (т.е. антиген-специфический и усиленный иммунитет) посредством включения в композицию последовательности нуклеиновой кислоты (ДНК или РНК), которая кодирует иммуноген и/или цитокин.
Образование комплекса липосомы с молекулой нуклеиновой кислоты может быть достигнуто путем применения способов, стандартных в данной области техники или описанных в патенте США №6693086, включенном сюда в виде ссылки. Подходящая концентрация молекулы нуклеиновой кислоты для добавления к липосоме включает концентрацию, эффективную для доставки достаточного количества молекулы нуклеиновой кислоты субъекту, чтобы вызвать системный иммунный ответ. Если молекула нуклеиновой кислоты кодирует иммуноген или цитокин, подходящая концентрация молекулы нуклеиновой кислоты для добавления к липосоме включает концентрацию, эффективную для доставки достаточного количества молекулы нуклеиновой кислоты в клетку, так чтобы клетка могла вырабатывать достаточное количество иммуногена и/или цитокина для регулирования клеточно-опосредованного иммунитета желательным образом. В одном варианте выполнения изобретения от около 0,1 мкг до около 10 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом, в другом варианте выполнения от около 0,5 мкг до около 5 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом, и в еще одном варианте около 1,0 мкг молекулы нуклеиновой кислоты объединяют с около 8 нмоль липосом. В одном варианте выполнения изобретения соотношение нуклеиновых кислот к липидам (мкг нуклеиновой кислоты: нмоль липидов) в композиции составляет, по меньшей мере, около 1:1 нуклеиновая кислота: липид по массе (т.е. 1 мкг нуклеиновой кислоты: 1 нмоль липида), и в другом варианте выполнения, по меньшей мере, около 1:5, и в еще одном варианте выполнения, по меньшей мере, около 1:10, и в еще одном варианте выполнения, по меньшей мере, около 1:20. Указанные здесь соотношения основаны на количестве катионного липида в композиции, а не на общем количестве липида в композиции. В другом варианте выполнения изобретения, соотношение нуклеиновых кислот к липидам в композиции согласно настоящему изобретению составляет от около 1:1 до около 1:64 нуклеиновая кислота: липид по массе; и в другом варианте выполнения от около 1:5 до около 1:50 нуклеиновая кислота: липид по массе; и в еще одном варианте выполнения от около 1:10 до около 1:40 нуклеиновая кислота: липид по массе; и в еще одном варианте выполнения от около 1:15 до около 1:30 нуклеиновая кислота: липид по массе. Другое соотношение нуклеиновая кислота: липид составляет от около 1:8 до 1:16, при этом предпочтительным является соотношение от около 1:8 до 1:32.
b. Биологический агент
В другом варианте выполнения данного изобретения иммуномодулятор включает липосомальное средство доставки, молекулу нуклеиновой кислоты и, по меньшей мере, один биологический агент.
Подходящими биологическими агентами являются агенты, которые эффективны для предотвращения или лечения болезней птиц. Такие биологические агенты включают повышающие иммунитет белки, иммуногены, вакцины или любую их комбинацию. Подходящими повышающими иммунитет белками являются белки, известные в качестве повышающих иммунитет. Неограничивающим примером является цитокин, который представляет собой известное семейство белков, повышающих иммунитет. Подходящими иммуногенами являются белки, которые вызывают гуморальный и/или клеточный иммунный ответ такой, что введение иммуногена субъекту повышает иммуноген-специфический иммунный ответ против тех же или подобных белков, которые встречаются в тканях субъекта. Иммуноген может включать патогенный антиген, экспрессируемый бактерией, вирусом, паразитом или грибом. Предпочтительные антигены включают антигены, которые вызывают инфекционную болезнь у субъекта. Согласно настоящему изобретению иммуногеном может быть любая часть белка, природная или синтетическая, которая вызывает гуморальный и/или клеточный иммунный ответ. Как таковой размер антигена или иммуногена может быть таким малым, как около 5-12 аминокислот, и таким большим, как полная длина белка, включая размеры между указанными. Антигеном может быть мультимерный белок или слитой белок. Антигеном могут быть очищенные пептидные антигены, полученные из нативных или рекомбинантных клеток. Последовательности нуклеиновой кислоты улучшающих иммунитет белков и иммуногенов функционально связываются с последовательностью, контролирующей транскрипцию, так что иммуноген экспрессируется в ткани субъекта, тем самым вызывая иммуноген-специфический иммунный ответ у субъекта в дополнение к неспецифическому иммунному ответу.
В другом варианте выполнения изобретения биологическим агентом является вакцина. Вакцина может включать живую, инфекционную, вирусную вакцину или убитую инактивированную вирусную вакцину. В одном варианте выполнения изобретения одна или более вакцин, живые или убитые вирусные вакцины могут применяться в комбинации с композицией иммуномодулятора согласно настоящему изобретению. Подходящие вакцины включают вакцины, известные в данной области техники для видов птиц. Примеры вакцин без ограничений включают вакцины, применяемые в данной области техники для защиты от вируса болезни Марека (MDV), вируса болезни Ньюкасла (NDV), вируса анемии цыплят (CAV), вируса инфекционного бурсита (IBDV), вируса инфекционного бронхита (IBV), вируса герпеса индейки (HVT), вируса инфекционного ларинготрахеита (ILTV), вирус энцефаломиелита птиц (AEV), вируса оспы птиц (FPV), птичьей холеры, вируса птичьего гриппа (AIV), реовируса, вируса лейкоза птиц (ALV), вируса ретикулоэндотелиоза (REV), птичьего аденовируса и вируса геморрагического энтерита (HEV), кокцидий и других болезней, известных в данной области техники. В другом примере вакциной может быть вакцина, описанная в патентах США №5427791, 6048535 и 6406702. В варианте выполнения изобретения, представленном для примера, вакцина для защиты от болезни Марека может применяться в комбинации с композицией иммуномодулятора согласно настоящему изобретению.
II. Способы
а. Способы иммунной стимуляции
В одном варианте выполнения данного изобретения иммунный ответ вызывается у представителя вида птиц путем введения эффективного количества композиции иммуномодулятора представителю вида птиц.
Эффективное количество является достаточным для вызывания иммунного ответа у представителя вида птиц. Иммуномодулятор включает липосомальное средство доставки и молекулу нуклеиновой кислоты.
В одном варианте выполнения изобретения, эффективное количество иммуномодулятора составляет от около 0,05 микрограмма до около 10 микрограммов. В другом варианте эффективное количество иммуномодулятора составляет от около 0,1 микрограмма до около 5 микрограммов.
В другом варианте выполнения данного изобретения иммунный ответ вызывается у представителя вида птиц путем введения эффективного количества композиции иммуномодулятора, которая включает липосомальное средство доставки, выделенную молекулу нуклеиновой кислоты и биологический агент. Предполагается, что биологический агент может вводиться совместно с иммуномодулятором или независимо от него. Независимое введение может осуществляться до или после введения иммуномодулятора. Также предполагается, что можно использовать более одного введения иммуномодулятора или биологического агента для продления усиленного иммунитета. Кроме того, более одного биологического агента может вводиться совместно с иммуномодулятором, вводиться до иммуномодулятора или вводиться после введения иммуномодулятора, как описано в Примерах. В одном варианте выполнения изобретения эффективное количество иммуномодулятора составляет от около 0,05 микрограмма до около 5 микрограммов липосомального средства доставки и выделенной молекулы нуклеиновой кислоты и от около 300 до около 30000 TCID50 (доза, инфицирующая 50% культуры ткани) вирусного биологического агента. В другом варианте выполнения изобретения эффективное количество иммуномодулятора составляет от около 0,1 микрограмма до около 3 микрограммов липосомального средства доставки и выделенной молекулы нуклеиновой кислоты и от около 100 до около 1000 EID50 (доза, инфицирующая 50% эмбрионов) вирусного биологического агента.
b. Болезни
Способы согласно изобретению вызывают такой иммунный ответ у субъекта, что субъект становится защищенным от болезни, то есть восприимчивым к вызыванию иммунного ответа. В данном описании фраза "защищенный от болезни" относится к снижению симптомов болезни; снижению случаев наступления болезни и снижению тяжести болезни. Защита субъекта может относиться к способности терапевтической композиции согласно настоящему изобретению при введении пациенту предотвращать наступление болезни и/или лечить или облегчать симптомы, признаки или причины болезни. Как таковая защита представителя вида птиц от болезни включает предотвращение наступления болезни (профилактическое лечение) и лечение представителя вида птиц, который уже заболел (терапевтическое лечение). В частности, защита пациента от болезни достигается путем вызывания иммунного ответа у представителя вида птиц через вызывание благотворного или защитного иммунного ответа, который может в некоторых случаях дополнительно подавлять, снижать, ингибировать или блокировать сверхактивный или вредный иммунный ответ. Термин "болезнь" относится к любому отклонению от нормального состояния здоровья представителя вида птиц и включает состояние, когда присутствуют симптомы болезни, а также состояния, при которых уже имеется отклонение (например, инфекция, мутация гена, генетический дефект и т.д.), но симптомы еще не видны.
Способы согласно изобретению могут применяться для профилактики болезней, стимулирования клеточно-опосредованного иммунитета от болезни, устранения болезни, облегчения болезни и профилактики вторичной болезни, развивающейся из первичной болезни.
Способы согласно изобретению включают введение композиции для защиты от заражения широким спектром патогенов. Введенная композиция может включать или не включать специфический антиген для вызывания специфического к нему ответа. Предполагается, что способы согласно изобретению защищают субъекта от болезни, вызванной инфекционными микробными агентами, включающими, без ограничений, вирусы, бактерии, грибы и паразиты. Примеры вирусных инфекционных болезней, без ограничений, включают болезни, возникающие при заражении вирусом инфекционной анемии кур (CIAV), вирусом болезни Марека (MDV), вирусом герпеса кур (HCV), вирусом герпеса индейки (HTV), вирусом инфекционного бурсита (IBDV), вирусом болезни Ньюкасла (NDV), вирусом инфекционного бронхита (IBV), вирусом инфекционного ларинготрахеита (ILTV), парамиксовирусом типа 3, вирусом энцефаломиелита птиц (AEV), вирусом оспы птиц (FPV), птичьей холерой, вирусом птичьего гриппа (AIV), реовирусом, вирусом лейкоза птиц (ALV), вирусом ретикулоэндотелиоза (REV), птичьим аденовирусом, вирусом геморрагического энтерита (HEV), пневмовирусом, голубиным поксвирусом, их рекомбинантными формами и другими вирусами, известными в данной области техники. Примеры бактериальных инфекций без ограничений включают инфекции грамположительными или грамотрицательными бактериями и грибами, как, например, Eschen'chia coli, Mycoplasma gallisepticum, Mycoplasma meleagn'dis, Mycoplasma synoviae, Bordetella Sp, Pasteurella multocida, Clostridium perfn'ngens, Clostridium colinum, Campylobacter jejuni, Salmonella sp, Salmonella enteritidis, Salmonella pullorum, Salmonella gallinarum, Clostridium botulinum, Hemophilus gallinarum, Erysipelothrix insidiosa, riemerella anatipestifer (RA) и другими бактериями, известными в данной области техники. Примеры грибковых или плесневых инфекций без ограничения включают инфекции, которые вызваны Aspergillus fumigates, Aspergillus flavus, Candida albicans и другими инфекционными грибами или плесенью, известными в данной области техники. Примеры болезней без ограничений включают болезни, вызванные токсинами грамположительных или грамотрицательных бактерий и грибов, как, например, токсин Clostridium perfringens, токсин Clostridium botulinum, энтеротоксин Е. coli, токсины стафилококка, лейкотоксин pasteurella и микотоксины fusarium, и другими токсинами, известными в данной области техники. Примеры паразитов включают без