Производные 3-ациламинопиридин-2(1h)-она, применимые как ингибиторы серин-треониновой протеинкиназы gsk3b в качестве лекарственных препаратов для лечения диабета ii типа.
Иллюстрации
Показать всеИзобретение относится к 3-ациламинопиридин-2(1H)-ону и его новым производным, которые могут являться потенциальными лекарственными препаратами для лечения диабета II типа.
где X - -(СН2)n-n=0-2, -СН(ОСН3)-, -СН=СН-; Y - 1-адамантил, 4-изопропилфенил, 3-(метоксиметил)-4-метоксифенил, 3-(4-метил-1H-пиразол-1-ил)метил-4-метоксифенил, 4-(дифторметокси)фенил, 3,5-диметилизоксазол-4-ил, 3,5-диметил-4-нитро-1H-пиразол-1-ил, 3-трифторметил-1H-пиразол-1-ил, 1-этил-3-трифторметил-1H-пиразол-5-ил, 1-бензил-5-метил-1H-1,2,3-триазол-4-ил; Z - 4-пиридил, бром. 3 н. и 1 з.п. ф-лы, 2 ил., 3 табл., 21 пр.
Реферат
Изобретение относится к фармацевтической промышленности и включает в себя новые производные 3-ациламинопиридин-2(1Н)-она в качестве химиотерапевтических биологически активных веществ для получения лекарственных средств для лечения диабета II типа, а также способ их получения.
где X - -(СН2)n- n=0-2, -СН(ОСН3)-, -СН=СН-;
Y - 1-адамантил, фенил, 4-изопропилфенил, 4-метоксифенил, 3-(метоксиметил)-4-метоксифенил, 3-(4-метил-1H-пиразол-1-ил)метил-4-метоксифенил, 1-нафтил, 4-(дифторметокси)фенил, 2-фурил, 3,5-диметилизоксазол-4-ил, 3,5-диметил-4-нитро-1H-пиразол-1-ил, 3-трифторметил-1H-пиразол-1-ил, 1-этил-3-трифторметил-1H-пиразол-5-ил, 1-бензил-5-метил-1H-1,2,3-триазол-4-ил, 2-пиридил, 3-пиридил, 4-пиридил; Z - 4-пиридил, бром.
Уровень техники
Лечение сахарного диабета, особенно II типа, является глобальной проблемой здравоохранения. Диабет типа II (инсулин независимый сахарный диабет) является многофакторным заболеванием. Гипергликемия связана с инсулиновой резистентностью в печени, мышцах и других тканях в сочетании с нарушенной секрецией инсулина. Скелетные мышцы являются главным сайтом стимулируемого инсулином усвоения глюкозы, здесь она или удаляется из кровотока, или превращается в гликоген. Отложение гликогена в мышцах является главной детерминантой гомеостаза глюкозы, и при диабете II типа происходит дефектное депонирование гликогена в мышцах.
Ранее было показано, что при диабете II типа происходит сверхэкспрессия гликогенсинтазы 3β (GSK3β) в клетках мышц и что существует обратная корреляция между активностью GSK3 в скелетных мышцах и действием инсулина [Nikoulina, S.E., Ciaraldi, Т.Р., Mudaliar, S., Mohideen, P., Carter, L., Henry, R.R. // Diabetes, 2000, 49, 263].
GSK3B - серин-треониновая протеинкиназа - является ключевым ферментом в процессе фосфорилирования и ингибирования синтеза гликогена [Kim J.-S., Piao S., Lee E., Yoon B.-Y., Moon H.R., Lee J., Jung Y., Ha N.-C. Development of Akt-activated GSK3b inhibitory peptide. // Biochemical and Biophysical Research Communications 434 (2013) 735-739]. Фосфорилирование GSK3β-зависимого инсулин-рецепторного субстрата-1 способствует инсулинрезистентности. Ингибирование GSK3β может обеспечить альтернативную терапию, позволяющую регулировать инсулинорезистентность, обычно наблюдаемую при инсулиннезависимом сахарном диабете и ожирении. Таким образом, GSK3β является потенциальной терапевтической мишенью, а ингибиторы GSK3β могут обеспечить новый способ терапевтического воздействия на диабет 2 типа [Wada A. GSK-3 inhibitors and insulin receptor signaling in health, disease, and therapeutics. // Front Biosci (Landmark Ed). 2009 Jan 1; 14:1558-70].
В настоящее время известно более 40 потенциальных ингибиторов GSK3β, в том числе селективные ингибиторы SB216763 и SB415286. Семь из них были со-кристаллизованы с GSK-3beta, при этом все они были локализованы в пределах АТР-связывающего кармана фермента [Cohen Р, Goedert М. GSK3 inhibitors: development and therapeutic potential. //Nat Rev Drug Discov. 2004 Jun; 3(6):479-87].
Потенциальными ингибиторами протеинкиназы GSK3β являются:
1. Производные малеимида давно известны как ингибиторы GSK-3 киназы [Международный патент №03/076398 на имя ELI Lilly and Company (США), 2003 год; Международный патент №2007/106400 на имя Janssen Pharmaceutica (Бельгия), 2007 год; Патент США №2007/0213352 на имя Johnson and Johnson (США), 2006 год; Патент Канады №2673368 на имя The University of Illinois (США), 2006 год].
Проведены испытания полученных соединений на большой выборке различных киназ, которые подтвердили селективность некоторых из полученных веществ по отношению к GSK3 киназе. Некоторые из запатентованных соединений проявляют ингибирующую активность по отношению к GSK3β киназе в наномолярных концентрациях.
2. Производные 2-аминопиримидина [Международный патент №02/066480 на имя Astra Zeneca (Швейцария), 2002 год; Международный патент №2008/002244 на имя Astra Zeneca (Швейцария), 2008 год; Международный патент №2008/002245 на имя Astra Zeneca (Швейцария), 2008 год; Патент США №2003/0119856 на имя Vertex (США), 2003 год; Патент США №2005/0004152 на имя Vertex (США), 2005 год; Патент США №2007/0249645 на имя Vertex (США), 2007 год; Международный патент №02/096905 на имя Vertex (США), 2002 год; Международный патент №01/70726 на имя Sanofi-Synthelabo Inc. (США), 2001 год; Европейский патент №1136483 на имя Sanofi-Aventis (Франция), 2001 год; Европейский патент №1136489 на имя Sanofi-Aventis (Франция), 2001 год; Европейский патент №1136493 на имя Sanofi-Aventis (Франция), 2001 год; Европейский патент №1454908 на имя Sanofi-Aventis (Франция), 2004 год; Европейский патент №1454910 на имя Sanofi-Aventis (Франция), 2003 год; Европейский патент №2033963 на имя Sanofi-Aventis (Франция), 2004 год; Международный патент №02/096905 на имя Sanofi-Synthelabo Inc. (США), 2004 год].
3. Производные 2-гидрокси- и 2-оксоиндола. Были получены мезитилат, фосфат, фумарат и другие соли соединения, однако с точки зрения минимальной гигроскопичности и стабильности оптимальным оказался цитрат [Европейский патент №1458395 на имя Astra Zeneca (Швейцария), 2007 год; Международный патент №03/082853 на имя Astra Zeneca (Швейцария), 2003 год; Международный патент №2007/120102 на имя Astra Zeneca (Швейцария), 2007 год; Международный патент №2007/100282 на имя Astra Zeneca (Швейцария), 2007 год; Международный патент №2007/089191 на имя Astra Zeneca (Швейцария), 2007 год].
4. Производные цианоаминохиналона. Данные in vitro испытаний этих соединений можно найти в патентах [Международный патент №2009/035684 А1 на имя Activx Biosciences Inc (США), 2009 год] и [Патент Кореи №2010/0067668 на имя Activx Biosciences Inc (США), 2010 год], многие соединения этой группы проявляют ингибирующие свойства в наномолярных концентрациях, однако следует отметить, что биологическая активность приводится лишь для небольшой выборки синтезированных соединений.
5. Производные тиадиазолидина. Эти соединения синтетически доступны, однако активность большинства веществ данного класса относительно невысока (IC50=1-50 µМ) [Патент Словении №1586319 на имя Noscira S А (Испания), 2010 год; Патент США №2009/233971 на имя Noscira S А (Испания), 2009 год].
6. Производные 5-фтор пиразоло[3,4-b]пиридин-3-амина и пиразоло[3,4-с]пиридазина. Эти соединения интересны, в первую очередь, тем, что для их комплексов с киназой известны данные рентгеноструктурного анализа [Патент США №2010/184980 на имя Vertex Pharma (США), 2010 год; Патент США №2010/0227814 на имя Vertex Pharma (США), 2010 год].
7. Производные ариламид диазепинпиримидонов [Патент Мексики №2010008363 на имя Sanofi-Aventis, 2010 год].
8. Другие классы ингибиторов GSK3 киназы. Как отмечалось выше, большое количество фармацевтических компаний занимаются интенсивной разработкой новых ингибиторов GSK3, и количество классов химических соединений, запатентованных в качестве ингибиторов киназы, очень велико. Представляют интерес производные 2-амино и 4-аминопиримидина [Европейский патент №2198867 на имя Vertex Pharma (США), 2010 год; Международный патент №2009/145814 на имя Vertex Pharma (США), 2009 год]. Также следует отметить, что многие простые органические соединения, например, производные 1,3,4-оксадиазола [Патент США №2010/069381 на имя Wenderoth Lind & Ponack LLP (США), 2010 год], пиразола [Патент США №2010/160324 на имя Astex Therapeutics LTD (Великобритания), 2010 год], бензимидазола [Международный патент №2010/058512 на имя Oncothrerapy Science Inc (Япония), 2010 год] тоже представляют интерес как потенциальные ингибиторы GSK-3 киназы. Однако в литературе практически не содержится данных их биологической активности.
Все перечисленные выше ингибиторы киназы GSK-3 находятся на различных стадиях клинических исследований, кроме диабета II типа, они позиционируются для лечения ряда нейродегенеративных и онкологических заболеваний.
Однако относительно высокая токсичность этих соединений и вызываемые ими побочные эффекты не позволяют использовать их в клинической практике [Meijer L., Flajolet М., Greengard P. Pharmacological inhibitors of glycogen synthase kinase 3. IITrends in Pharmacological Sciences, 2004, Volume 25, Issue 9, Pages 471-480].
Большинство из перечисленных выше ингибиторов являются малоселективными и могут действовать на несколько разных протеинкиназ, что может приводить к побочным эффектам. В связи с этим необходимо отбирать селективные ингибиторы, которые будут являться потенциальными лекарственными препаратами только для лечения диабета II типа.
Раскрытие изобретения
Изобретение включает в себя способ получения новых производных 3-ациламинопиридин-2(1H)-она и отбор малотоксичных соединений, наиболее активных и селективных в отношении ингибирования протеинкиназы GSK3β.
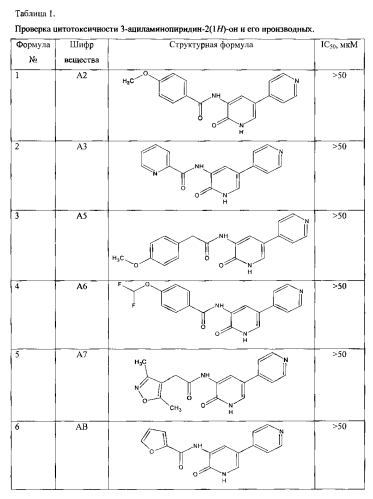
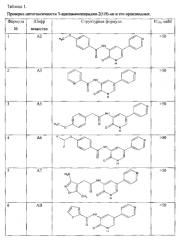
Проверка цитотоксичности 3-ациламинопиридин-2(1H)-он и его производных.
Тестируемые вещества получены методами, описанными в примерах 1-21 к настоящему Патенту.
Исследование проведено на клетках линии РС-3 (аденокарцинома простаты человека) в сравнении с неопухолевыми клетками (фибробласты кожи человека - HDF). Клетки культивировали в СО2-инкубаторе при 37°C с 5% СО2 в стерильных флаконах в питательной среде DMEM с глутамином, содержащей 10% бычьей сыворотки.
Для определения цитотоксичности был использован МТТ-тест. Данный тест основан на редукции 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолий бромида в митохондриях жизнедеятельных клеток. За счет этой редукции происходит восстановление желтой тетразолиевой соли до формазана, который осаждается в виде синих кристаллов. После растворения кристаллов раствором додецилсульфат натрия/диметилформамида фотометрическим путем измеряют интенсивность цвета. Высокая степень абсорбции в данном случае означает высокую жизнеспособность клеток.
В ходе проведенного эксперимента определяли жизнеспособность клеток при различных концентрациях вещества в сравнении с контролем при 72-часовой инкубации. На основании полученных результатов рассчитывали показатель IC50 (ингибирующую концентрацию 50), т.е. концентрацию вещества, при которой погибают 50% клеток.
Фотометрический анализ проводили на планшетном ридере DTX 880 Multimode Detector Beckman Coulter, определили интенсивность цвета в каждой лунке при использовании фильтра с длиной волны 540 нм. Полученные данные IC50 (таблица 1) подсчитаны относительно среднего значения показателей контрольной группы.
Проведенная проверка показала, что для всех проверяемых соединений IC50 составила >50, то есть данные вещества являются нетоксичными и могут являться потенциальными ингибиторами GSK3β и кандидатами в лекарственные препараты для лечения диабета II типа.
Примеры получения производных 3-ациламинопиридин-2(1H)-она по настоящему изобретению.
Пример 1
4-Метокси-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)бензамид (А2, формула 1)
Амринон (100 мг, 0,53 ммоль), 4-метоксибензойную кислоту (81 мг, 0,53 ммоль), гидрохлорид N-(3-диметиламинопропил)-N′-этилкарбодиимида (123 мг, 0,64 ммоль) и 1-гидроксибензотриазол гидрат (содержание 1-гидроксибензотриазола: 88%, 98 мг, 0,63 ммоль) растворили в 5 мл абсолютного ДМФА. К полученному раствору прибавили N,N-диизопропилэтиламин (0,233 мл, 1,34 ммоль). Реакцию вели при 90°C и интенсивном перемешивании. Контроль над ходом реакции осуществляли методом ТСХ (элюент -CHCl3-EtOH 5:1). Через 35 ч реакционную смесь охладили и вылили в 10 мл воды. Образовавшийся осадок отфильтровали, промыли водой и высушили на воздухе. Очистку проводили методом колоночной хроматографии на силикагеле (элюент - CHCl3-EtOH в соотношении 20:1). В результате было получено 110 мг (выход: 65%) продукта в виде оранжевого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 3,84 (с, 3Н); 7,09 (д, J=8,7 Гц, 2Н); 7,60 (д, J=6,0 Гц, 2Н); 7,79 (д, J=2,5 Гц, 1H); 7,93 (д, J=8,7 Гц, 2Н); 8,59 (д, J=6,0 Гц, 2Н); 8,75 (д, J=2,5 Гц, 1Н); 9,27 (с, 1Н); 12,59 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=322 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 331,1084. Вычислено: 331,1113.
Пример 2
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)пиридин-2-карбоксамид (A3, формула 2)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и пиридин-2-карбоновую кислоту (65 мг) в качестве исходных соединений. Было получено 110 мг (выход: 72%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 7,55 (д, J=6,1 Гц, 2Н); 7,64 (ддд, J=7,5; 4,7; 1,7 Гц, 1H); 7,70 (д, J=2,5 Гц, 1Н); 8,04 (ддд, J=7,8; 7,5; 1,5 Гц, 1Н); 8,18 (дд, J=7,8; 1,7 Гц, 1Н); 8,56 (д, J=6,1 Гц, 2Н); 8,72 (дд, J=4,7; 1,5 Гц, 1Н); 8,91 (д, J=2,5 Гц, 1H); 10,75 (с, 1Н); 12,54 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=293 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 292,0994. Вычислено: 292,09604.
Пример 3
2-(4-Метоксифенил)-N-(6-оксо-l,6-дигидро-3,4′-бипиридин-5-ил)ацетамид
(А5, формула 3)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и (4-метоксифенил)уксусную кислоту (89 мг) в качестве исходных соединений. Было получено 80 мг (выход: 45%) соединения в виде коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.):3,70 (с, 3Н); 3,72 (с, 2Н); 6,85 (д, J=8,5 Гц, 2Н); 7,24 (д, J=8,5 Гц, 2Н); 7,49 (д, J=6,0 Гц, 2Н); 7,67 (д, J=2,4 Гц, 1Н); 8,51 (д, J=6,0 Гц, 2Н); 8,67 (д, J=2,4 Гц, 1Н); 9,43 (с, 1H); 12,37 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=336 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 335,1334. Вычислено: 335,1270.
Пример 4
4-(Дифторметокси)-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)бензамид
(А6, формула 4)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 4-(дифторметокси)бензойную кислоту (100 мг) в качестве исходных соединений. Было получено 91 мг (выход: 48%)продукта в виде светло-коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 7,27-7,39 (м, 3Н); 7,60 (д, J=6,0 Гц, 2Н); 7,81 (д, J=2,3 Гц, 1Н); 8,03 (д, J=8,7 Гц, 2Н); 8,58 (д, J=6,0 Гц, 2Н); 8,73 (д, J=2,3 Гц, 1H); 9,43 (с, 1Н); 12,60 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=358 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 357,0897. Вычислено: 357,0925.
Пример 5
2-(3,5-Диметилизоксазол-4-ил)-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)ацетамид
(А7, формула 5)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 2-(3,5-диметилизоксазол-4-ил)уксусную кислоту (83 мг) в качестве исходных соединений. Было получено 108 мг (выход: 63%) продукта в виде светло-зеленого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 2,16 (с, 3Н); 2,33 (с, 3Н); 3,67 (с, 2Н); 7,53 (д, J=6,0 Гц, 2Н); 7,73 (д, J=2,4 Гц, 1H); 8,54 (д, J=6,0 Гц, 2Н); 8,70 (д, J=2,4 Гц, 1Н); 9,62 (с, 1H); 12,45 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=325 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 324,1256. Вычислено: 324,1222.
Пример 6
N-(6-Оксо-l,6-дигидро-3,4′-бипиридин-5-ил)-2-фуранамид (АВ, формула 6)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и фуран-2-карбоновую кислоту (60 мг) в качестве исходных соединений. Было получено 125 мг (выход: 84%) продукта в виде светло-коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.):6,74 (дд, J=3,3; 1.8, 1H); 7,35 (д, J=3,3 Гц, 1H); 7,59 (д, J=6,0 Гц, 2Н); 7,79 (д, J=2,3 Гц, 1H); 7,99 (д, J=1,8 Гц, 1Н); 8,58 (д, J=6,0 Гц, 2Н); 8,71 (д, J=2,3 Гц, 1Н); 9,21 (с, 1Н); 12,65 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=282 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 281,0778. Вычислено: 281,0800.
Пример 7
3-(3,5-диметил-4-нитро-1Н-пиразол-1-ил)-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)пропанамид (А8, формула 7)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 3-(3,5-диметил-4-нитро-1H-пиразол-1-ил)пропионовую кислоту (113 мг) в качестве исходных соединений. Было получено 125 мг (выход: 84%) продукта в виде светло-коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 12.41 (уш., 1Н), 9.62 (с, 1Н), 8.67 (д, J=2.3 Гц, 1Н), 8.56 (д, J=6.0 Гц, 2Н), 7.72 (д, J=2.3 Гц, 1Н), 7.52 (д, J=6.0 Гц, 2Н), 4.32 (т, J=6.6 Гц, 2Н), 3.07 (т, J=6.6 Гц, 2Н), 2.62 (с, 3Н), 2.37 (с, 3Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=383 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 382,1378. Вычислено: 382,1390.
Пример 8
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)пиридин-3-карбоксамид
(ММ-11А, формула 8)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и никотиновую кислоту (65 мг) в качестве исходных соединений. Было получено 114 г (выход: 73%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 7,51-7,61 (м, 3Н); 7,78 (д, J=2,4 Гц, 1Н); 8,26-8,28 (м, 1H); 8,57 (д, J=6,0 Гц, 2Н); 8,70-8,75 (м, 2Н); 9,07 (с, 1H); 9,61 (С, 1Н); 12,59 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=293 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 292,0978. Вычислено: 292,0960.
Пример 9
N-(6-Оксо-l,6-дигидро-3,4′-бипиридин-5-ил)пиридин-4-карбоксамид
(ММ-12А, формула 9)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и изоникотиновую кислоту (65 мг) в качестве исходных соединений. Было получено 121 мг (выход: 78%) продукта в виде коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 7,58 (д, J=5,8 Гц, 2Н); 7,80-7,85 (м, 3Н); 8,57 (д, J=5,8 Гц, 2Н); 8,69 (д, J=2,4 Гц, 1H); 8,77 (д, J=6,0 Гц, 2Н); 9,68 (С, 1H); 12,63 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=293 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 292,0944. Вычислено: 292,0960.
Пример 10
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)-1-нафтоиламид (ММ-14А, формула 10)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 1-нафталинкарбоновую кислоту (91 мг) в качестве исходных соединений. Было получено 98 мг (выход: 54%) продукта в виде светло-оранжевого порошка. 1Н-ЯМР (ДМСО-d6, м.д.):7,60-7,66 (м, 5Н); 7,85 (д, J=6,0 Гц, 2Н); 8,03-8,05 (м, 1H); 8,12 (д, J=8,1 Гц, 1Н); 8,32-8,35 (м, 1H); 8,60 (д, J=6,0 Гц, 2Н); 8,87 (д, J=2,5 Гц, 1Н); 9,45 (с, 1Н); 12,57 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=342 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 341,1198. Вычислено: 341,1164.
Пример 11
2-Метокси-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)-2-фенилацетамид
(ММ-15А, формула 11)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 2-метоксифенилуксусную кислоту (88 мг) в качестве исходных соединений. Было получено 94 мг (выход: 53%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 3,37 (с, 3Н); 5,00 (с, 1Н); 7,35-7,44 (м, 5Н); 7,52 (д, J=5,9 Гц, 2Н); 7,75 (д, J=2,5 Гц, 1Н); 8,53 (д, J=5,9 Гц, 2Н); 8,65 (д, J=2,5 Гц, 1H); 9,53 (с, 1H); 12,60 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=336 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 335,1278. Вычислено: 335,1270.
Пример 12
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)-3-фенилпропанамид (А1, формула 12)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 3-фенилпропановую кислоту (80 мг) в качестве исходных соединений. Было получено 92 мг (выход: 54%) продукта в виде светло-желтого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 2,70 (т, J=7,3 Гц, 2Н); 2,92 (т, J=7,3 Гц, 2Н); 7,20-7,25 (м, 3Н); 7,33-7,38 (м, 2Н); 7,58 (д, J=6,0 Гц, 2Н); 7,77 (д, J=2,5 Гц, 1Н); 8,56 (д, J=6,0 Гц, 2Н); 8,74 (д, J=2,5 Гц, 1Н); 9,30 (с, 1Н); 12,64 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=320 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 319,1362. Вычислено: 319,1321.
Пример 13
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)-3-трифторметил-1-этил-1H-пиразол-5-карбоксамид (А95, формула 13)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 3-трифторметил-1-этил-1H-пиразол-5-карбоновую кислоту (110 мг) в качестве исходных соединений. Было получено 72 мг (выход: 36%) продукта в виде светло-кремового порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 1,40 (т, J=7,3 Гц, 3Н); 4,54 (кв, J=7,3 Гц, 2Н); 7,41 (с, 1H); 7,58 (д, J=5,9 Гц, 2Н); 7,78 (д, J=2,5 Гц, 1H); 8,58 (д, J=5,9 Гц, 2Н); 8,75 (д, J=2,5 Гц, 1H); 9,29 (с, 1Н); 12,66 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=378 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 377,1148. Вычислено: 377,1100.
Пример 14
4-Метокси-3-метоксиметил-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)бензамид
(ACD1, формула 14)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 4-метокси-3-метоксиметилбензойную кислоту (104 мг) в качестве исходных соединений. Было получено 102 мг (выход: 52%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 3,29 (с, 3Н); 3,82 (с, 3Н); 4,90 (с, 2Н); 7,10 (д, J=8,7 Гц, 1H); 7,56-7,62 (м, 3Н); 7,78-7,84 (м, 2Н); 8,56 (д, J=5,8 Гц, 2Н); 8,73 (д, J=2,4 Гц, 1Н); 9,25 (с, 1H); 12,51 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=366 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 365,1368. Вычислено: 365,1376.
Пример 15
N-(6-Оксо-1,6-дигидро-3,4′-бипиридин-5-ил)адамантан-1-карбоксамид
(AAD, формула 15)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 1-адамантанкарбоновую кислоту (95 мг) в качестве исходных соединений. Было получено 127 мг (выход: 68%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 1,54-1,70 (м, 12Н); 2,21-2,28 (м, 3Н); 7,61 (д, J=6,0 Гц, 2Н); 7,80 (д, J=2,5 Гц, 1Н); 8,61 (д, J=6,0 Гц, 2Н); 8,77 (д, J=2,5 Гц, 1H); 9,26 (с, 1Н); 12,61 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=350 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 349,1777. Вычислено: 349,1790.
Пример 16
1-Бензил-5-метил-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)-1H-1,2,3-триазол-4-карбоксамид (ATRZ, формула 16)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 1-бензил-5-метил-1H-1,2,3-триазол-4-карбоновую кислоту (115 мг) в качестве исходных соединений. Было получено 130 мг (выход: 63%) продукта в виде светло-коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 2,34 (с, 3Н); 5,80 (с, 2Н); 7,10-7,18 (м, 2Н); 7,26-7,36 (м, 3Н); 7,58 (д, J=5,9 Гц, 2Н); 7,79 (д, J=2,5 Гц, 1Н); 8,58 (д, J=5,9 Гц, 2Н); 8,75 (д, J=2,5 Гц, 1H); 9,25 (с, 1Н); 12,55 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=387 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 386,1508. Вычислено: 386,1491.
Пример 17
N-(6-Оксо-l,6-дигидро-3,4′-бипиридин-5-ил)-2-(3-трифторметил-1H-пиразол-1-ил)ацетамид (А052, формула 17)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и (3-трифторметил-1H-пиразол-1-ил)уксусную кислоту (103 мг) в качестве исходных соединений. Было получено 83 мг (выход: 43%) продукта в виде светло-коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 5,24 (с, 2Н); 6,80 (д, J=2,2 Гц, 1H); 7,18 (д, J=2,2 Гц, 1Н); 7,63 (д, J=6,0 Гц, 2Н); 7,81 (д, J=2,5 Гц, 1Н); 8,62 (д, J=6,0 Гц, 2Н); 8,78 (д, J=2,5 Гц, 1H); 9,31 (с, 1Н); 12,63 (уш.с, 1Н). Масс-спектр (ВЭЖХ, электроспрей): m/z=364 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 363,0931. Вычислено: 363,0943.
Пример 18
(E)-3-{4-Метокси-3-[(4-метил-1H-пиразол-1-ил)метил]фенил}-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)акриламид (AVVT, формула 18)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и (Е)-3-{4-метокси-3-[(4-метил-1H-пиразол-1-ил)метил]фенил}акриловую кислоту (144 мг) в качестве исходных соединений. Было получено 97 мг (выход: 41%) продукта в виде коричневого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 1,98 (с, 3Н); 3,85 (с, 3Н); 5,41 (с, 2Н); 6,67 (д, J=15,5 Гц, 1H); 6,93 (с, 1Н); 7,20-7,43 (м, 4Н); 7,59 (д, J=5,9 Гц, 2Н); 7,76-7,81 (м, 2Н); 8,60 (д, J=5,9 Гц, 2Н); 8,77 (д, J=2,5 Гц, 1Н); 9,25 (с, 1H); 12,55 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=442 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 441,1789. Вычислено: 441,1801.
Пример 19
4-Изопропил-N-(6-оксо-1,6-дигидро-3,4′-бипиридин-5-ил)бензамид
(AIPR, формула 19)
Синтез проводили по методике, аналогичной получению соединения 1, используя амринон (100 мг) и 4-изопропилбензойную кислоту (87 мг) в качестве исходных соединений. Было получено 95 мг (выход: 53%) продукта в виде белого порошка. 1Н-ЯМР (ДМСО-d6, м.д.): 1,25 (д, J=6,8 Гц, 6Н); 3,01 (квин., J=6,8 Гц, 1Н); 7,21 (д, J=8,8 Гц, 2Н); 7,59 (д, J=6,0 Гц, 2Н); 7,77 (д, J=2,5 Гц, 1Н); 7,88 (д, J=8,8 Гц, 2Н); 8,58 (д, J=6,0 Гц, 2Н); 8,75 (д, J=2,5 Гц, 1Н); 9,29 (с, 1H); 12,56 (уш.с, 1H). Масс-спектр (ВЭЖХ, электроспрей): m/z=334 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 333,1475. Вычислено: 333,1477.
Пример 20
N-(5-бром-2-оксо-1,2-дигидропиридин-3-ил)-1-нафтоиламид
(ММ-30, формула 20)
Синтез проводили по методике, аналогичной получению соединения 1, используя 3-амино-5-бромпиридин-2(1Н)-он (1,24 г) и 1-нафталинкарбоновую кислоту (1,14 г) в качестве исходных соединений. Реакцию вели 42 ч при 90°C.После хроматографической очистки на силикагеле (элюент - CHCl3-EtOH в соотношении 20:1) было получено 1,3 г (выход: 58%) продукта в виде коричневого порошка. Спектр 1Н-ЯМР (ДМСО-d6, м.д.): 7,60-7,66 (м, 5Н); 8,03-8,05 (м, 1Н); 8,12 (д, J=8,1 Гц, 1Н); 8,32-8,35 (м, 1Н); 8,87 (д, J=2,5 Гц, 1H); 9,45 (с, 1H); 12,57 (уш.с, 1Н). Спектр 13С-ЯМР (ДМСО-d6, м.д.): 115,53; 120,19; 125,55; 126,28; 127,65; 128,90; 129,81; 130,10; 133,74; 133,87; 144,06; 150,72; 157,72; 168,00. ИК (KBr, см-1): 3369,03 3131,83 3077,83 3006,48 2898,49 1654,62 1596,77 1517,70 1405,85 1245,79 815,74 781,03 590,11. УФ (МеОН, нм): λмакс 221, 299, 316 (пл.). Масс-спектр (ВЭЖХ, электроспрей): m/z=343, 345 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 341,9998. Вычислено: 342,0004
Пример 21
2-Метокси-N-(5-бром-2-оксо-1,2-дигидропиридин-3-ил)-2-фенилацетамид
(ММ-215, формула 21)
Синтез проводили по методике, аналогичной получению соединения 1, используя
3-амино-5-бромпиридин-2(1Н)-он (1,0 г) и 2-метоксифенилуксусную кислоту (0,88 г) в качестве исходных соединений. Реакцию вели 35 ч при 90°C. После хроматографической очистки на силикагеле (элюент - CHCl3-EtOH в соотношении 20:1) было получено 94 мг (выход: 40%) продукта в виде белого порошка. Спектр 1Н-ЯМР (ДМСО-d6, м.д.): 3,37 (с, 3Н); 5,00 (с, 1Н); 7,35-7,44 (м, 5Н); 7,75 (д, J=2,5 Гц, 1Н); 8,65 (д, J=2,5 Гц, 1H); 9,53 (с, 1H); 12,60 (уш.с, 1Н). Спектр 13С-ЯМР (ДМСО-d6, м.д.): 57,35; 83,16; 114,69; 120,78; 127,63; 128,87; 143,91; 150,60; 157,33; 169,65. ИК (KBr, см-1): 3349,75 3025,76 1648,84 1594,84 1519,63 1407,78 1265,07 1095,37 817,67 700,03 586,25. УФ (МеОН, нм): λмакс 205, 235, 304. Масс-спектр (ВЭЖХ, электроспрей): m/z=337, 339 ([М+Н]+, 100%). Масс-спектр (MALDI): Найдено: 336,0153. Вычислено: 336,0110
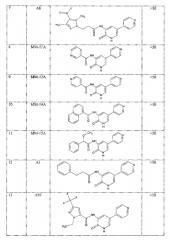
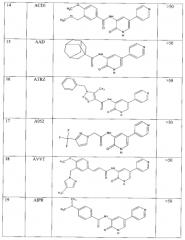
Тестирование производных 3-ациламинопиридин-2(1H)-она in vitro на активность протеинкиназы GSK3β.
Проведена проверка 31 соединения класса амринонов, в том числе приводимых в примерах 1-21, на активность протеинкиназы GSK3β. Анализ активности GSK3β проводился с помощью Kinase-Glor Plus Luminiscent Kinase Assey (Promega V3772), основанном на измерении степени фосфорилирования по уровню АТФ, оставшегося в ходе реакции. Реагент Kinase-Glo использует оставшийся АТФ как субстрат для Ultra-Glo™ Luciferase, катализируя монооксигенацию люциферина, с образованием фотона света. Активность протеинкиназы обратно пропорциональна интенсивности сигнала люминесценции.
В лунки 96-луночного планшета, используя автоматизированную рабочую станцию Biomek 3000 Beckman Coulter©, вносили 15 мкл раствора GSK3β (100 нг в реакционной смеси) в реакционном буфере (15 мМ HEPES pH 7,4; 20 мМ NaCl, 10 мМ MgCl2, 0,5 мМ EDTA, 0,02% Tween-20, 0,1 мг/мл BSA) или 15 мкл реакционного буфера (контроль без протеинкиназы). В каждую лунку добавляли 15 мкл исследуемого соединения в реакционном буфере до конечной концентрации 10 мкМ. Реакционную смесь инкубировали при комнатной температуре 40 мин, закрыв планшет крышкой для предотвращения испарения.
В каждую лунку добавляли 15 мкл смеси субстрат-АТФ, до конечной концентрации АТФ 10 мкМ и количеством субстрата 1 мкг в реакционную смесь. Реакционную смесь инкубировали при комнатной температуре 40 мин, закрыв планшет крышкой для предотвращения испарения.
Реакцию останавливали добавлением 30 мкл реагента Kinase-Glo. Для получения устойчивого сигнала инкубировали реакционную смесь в течение 10 мин при комнатной температуре. Замер люминесценции проводился на приборе Beckman Coulter© DTX 880 Multimode Detector.
Конечные концентрации веществ в ферментативной реакции:
GSK3β - 100 нг на точку
субстрат - 1 мкг на точку
исследуемое соединение - 10 мкМ
АТР 10 мкМ.
Объем реакционной смеси 45 мкл.
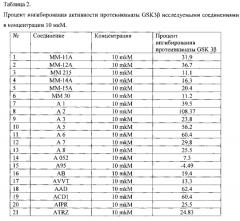
Полученные результаты представлены в таблице 2 и на графике (фиг. 1).
В таблице 2 представлен процент ингибирования активности протеинкиназы GSK3β исследуемыми соединениями в концентрации 10 мкМ.
Было показано, что наибольшую активность в отношении протеинкиназы GSK3β проявляют соединения А2, А5, А6, AAD, ACD1.
Определение половинной ингибирующей концентрации (IC50) соединения А2 в отношении протеинкиназы GSK3β.
Для соединения А2, показавшего наибольшую активность в отношении протеинкиназы GSK3β, был определен IC50. В лунки 96-луночного планшета, используя автоматизированную рабочую станцию Biomek 3000 Beckman Coulter©, вносили 15 мкл раствора GSK3β (100 нг в реакционной смеси) в реакционном буфере (15 мМ HEPES pH 7,4; 20 мМ NaCl, 10 мМ MgCl2, 0,5 мМ EDTA, 0,02% Tween-20, 0,1 мг/мл BSA) или 15 мкл реакционного буфера (контроль без протеинкиназы). В каждую лунку добавляли 15 мкл исследуемого соединения в реакционном буфере до конечной концентрации 10, 5, 1 и 0.1 мкМ. Реакционную смесь инкубировали при комнатной температуре 40 мин, закрыв планшет крышкой для предотвращения испарения.
В каждую лунку добавляли 15 мкл смеси субстрат-АТФ, до конечной концентрации АТФ 10 мкМ и количеством субстрата 1 мкг в реакционную смесь. Реакционную смесь инкубировали при комнатной температуре 40 мин, закрыв планшет крышкой для предотвращения испарения.
Реакцию останавливали добавлением 30 мкл реагента Kinase-Glo. Для получения устойчивого сигнала инкубировали реакционную смесь в течение 10 мин при комнатной температуре. Замер люминесценции проводился на приборе Beckman Coulter© DTX 880 Multimode Detector.
Полученные результаты представлены в таблице 3 и на графике (фиг. 2).
1. Производные 3-ациламинопиридин-2(1H)-она - ингибиторы протеинкиназы GSK3β, соответствующие формуле: где X - -(СН2)n-n=0-2, -СН(ОСН3)-, -СН=СН-;Y - 1-адамантил, 4-изопропилфенил, 3-(метоксиметил)-4-метоксифенил, 3-(4-метил-1H-пиразол-1-ил)метил-4-метоксифенил, 4-(дифторметокси)фенил, 3,5-диметилизоксазол-4-ил, 3,5-диметил-4-нитро-1H-пиразол-1-ил, 3-трифторметил-1H-пиразол-1-ил, 1-этил-3-трифторметил-1H-пиразол-5-ил, 1-бензил-5-метил-1H-1,2,3-триазол-4-ил;Z - 4-пиридил, бром.
2. Соединения по п. 1, обладающие ингибирующей активностью по отношению к киназе GSK3β.
3. Способ получения производных 3-ациламинопиридин-2(1H)-она, соответствующих формуле: где X - -(СН2)n-n=0-2, -СН(ОСН3)-, -СН=СН-;Y - 1-адамантил, фенил, 4-изопропилфенил, 4-метоксифенил, 3-(метоксиметил)-4-метоксифенил, 3-(4-метил-1H-пиразол-1-ил)метил-4-метоксифенил, 1-нафтил, 4-(дифторметокси)фенил, 2-фурил, 3,5-диметилизоксазол-4-ил, 3,5-диметил-4-нитро-1H-пиразол-1 -ил, 3-трифторметил-1H-пиразол-1-ил, 1-этил-3-трифторметил-1H-пиразол-5-ил, 1-бензил-5-метил-1H-1,2,3-триазол-4-ил, 2-пиридил, 3-пиридил, 4-пиридил;Z - 4-пиридил, бром,заключающийся в осуществлении следующего процесса: амринон или 3-амино-5-бромпиридин-2(1Н)-он (0,53 ммоль), соответствующую кислоту (0,53 ммоль), гидрохлорид N-(3-диметиламинопропил)-N′-этилкарбодиимида (0,64 ммоль) и 1-гидроксибензотриазол гидрат (содержание 1-гидроксибензотриазола: 88%, 0,63 ммоль) помещают в стеклянную колбу объемом 25 мл и растворяют в 5 мл абсолютного ДМФА, к полученному раствору прибавляют N,N-диизопропилэтиламин (1,34 ммоль); реакцию проводят при температуре 90°C и интенсивном перемешивании, контроль над ходом реакции осуществляют методом ТСХ (элюент - CHCl3-EtOH 5:1); по окончании реакции реакционную смесь охлаждают и выливают в 10 мл воды; образовавшийся осадок отфильтровывают, промывают водой и высушивают на воздухе; очистку проводят методом колоночной хроматографии на силикагеле (элюент - CHCl3-EtOH в соотношении 20:1).
4. Применение соединений по п. 3 в качестве химиотерапевтических биологически активных веществ для получения лекарственных средств для лечения диабета II типа.