Матрица для культивирования клеток
Иллюстрации
Показать всеИзобретение относится к биотехнологии, регенеративной медицине и может быть использовано в цитологии, гистологии, трансплантологии, микробиологии, биомедицинских исследованиях. Предложена матрица для культивирования клеток. Матрица содержит гиалуроновую кислоту, стабилизированную десмозином при УФ-фотополимеризации в условиях постепенной лиофилизации. Матрица также содержит коллаген I типа и адгезивный пептид Arg-Gly-Asp. Матрица обладает устойчивостью структуры во влажной среде более 7 суток, стимулирует клеточную адгезию и миграцию при клеточном культивировании. 12 ил., 1 пр.
Реферат
Область техники
Изобретение относится к биотехнологии, регенеративной медицине и может быть использовано в цитологии, гистологии, трансплантологии, микробиологии, биомедицинских исследованиях и разработках.
Предшествующий уровень техники
В настоящее время активно развиваются клеточные технологии, важным этапом которых является культивирование различных типов клеток в условиях ″in vitro″. Для культивирования клеток эукариот в основном используют гелевые или жидкие питательные среды, а клетки прокариот (бактерий) культивируют на плотных гелевых матриксах.
Известен способ культивирования клеток, разработанный на примере стволовых клеток человека (Патент РФ №2323252, опубл. 27.04.2008, БИ №12). Способ заключается в следующем. Стволовые клетки культивируют в ростовой среде RPMI в культуральном сосуде до образования сплошного монослоя, который извлекают из культурального сосуда путем обработки монослоя стволовых клеток раствором трипсина. В процессе каждого цикла культивирования регулярно определяют рН ростовой среды и заменяют ростовую среду на новую. Для обработки монослоя стволовых клеток используют 0,03-0,1%-ный раствор трипсина, причем перед и после указанной обработки стволовые клетки отмывают в изотоническом растворе, или растворе Хэнкса, не содержащий солей кальция и магния, от следов ростовой среды и следов трипсина соответственно. В качестве физиологически приемлемых условий, необходимых для жизнедеятельности стволовых клеток, используют атмосферу, содержащую от 4 до 7,5% углекислого газа, остальное - воздух, и температуру в интервале от 33 до 38°С.
Приведенный способ имеет существенные недостатки. В качестве ростовой среды используется среда RPMI, которая не всегда доступна. Использование трипсина может привести к нарушению целостности клеток, повреждению их цитоплазмы. Процесс замены ростовой среды значительно усложняет способ.
Прототипом настоящего изобретения стал патент РФ ″Способ культивирования клеток″ №2418067 от 03.12.2009 г. В данном способе клетки (фибробласты и бактерии Е. coli) культивируют на биоматериале (полимер нативной формы гиалуроновой кислоты). Клетки выделяют по стандартной схеме, высевают на увлажненную поверхность биоматериала, в течение 7 дней проводят культивирование при постоянной влажности 30-50%.
Используемый в прототипе для культивирования клеток биоматериал имеет существенные недостатки:
1) ограниченный период использования в течение 7 суток, поскольку полимер нативной формы гиалуроновой кислоты (основа данного биоматериала), находясь в условиях влажной среды, теряет свою структуру и становится гелеобразным;
2) гелеобразование данного материала приводит к изменению газохимической среды и накоплению цитотоксических веществ, в связи с чем культивирование клеток ограничено по времени (7 суток). Указанное обстоятельство не позволяет применять данный способ для получения клеточной биомассы и выделению ряда метаболитов, которые требуют более длительного по времени периода культивирования;
3) физико-химические трансформации материала не позволяют провести его замену по истечении 7 суток и продолжить культивирование клеток, т.к. в условиях формирования гидрогеля отделить клетки от матрицы без их повреждения и гибели невозможно.
Раскрытие изобретения
Перечисленные выше недостатки биоматериала для клеточного культивирования можно устранить путем изменения состава материала и стабилизацией его структуры.
Настоящее изобретение относится к матрице для клеточного культивирования на основе полимера гиалуроновой кислоты, где молекула гиалуроновой кислоты обработана ультрафиолетовым светом, стабилизирована полипептидом десмозина; дополнительно содержит коллаген I типа и адгезивный пептид Arg-Gly-Asp.
Технический результат изобретения достигается использованием стабилизированной формы гиалуроновой кислоты (ГК), а также включением белка внеклеточного матрикса (коллагена I типа) и адгезивного пептида Arg-Gly-Asp в состав материала для клеточного культивирования. Адгезивный пептид впервые использован Raeber G.P. с коллегами [1] для модификации ГК с целью стимулирования процессов адгезии и пролиферации клеток в гидрогелях гиалуроновой кислоты. Применение адгезивного пептида Arg-Gly-Asp в структуре пластинчатых полимерных матриц на основе гиалуроновой кислоты для клеточного культивирования в литературе не описано.
Стабилизация гиалуроновой кислоты, которая является структурной основой материала для клеточного культивирования, достигается за счет применения технологии ультрафиолетового фотосшивания водных растворов гиалуроновой кислоты. В отличие от традиционных методов формирования УФ-сшивок в разработанном способе используется водный раствор гиалуроновой кислоты с добавлением полипептида, состоящего только из аминокислоты десмозин - Desmosinen. Количество аминокислотных остатков может варьировать от 5. Десмозин - это уникальная аминокислота, одна молекула которой может образовывать сразу 4 пептидные связи [1].
В спектральных исследованиях нами было обнаружено, что активация пептидных связей в смеси, состоящей только из аминокислоты десмозин, происходит в результате УФ-экспонирования в условиях постепенной лиофилизации растворов.
Таким образом, использование технологии УФ-фотополимеризации водных растворов гиалуроновой кислоты с добавлением полипептида, состоящего только из аминокислоты десмозин, в условиях постепенной лиофилизации приводит к формированию пластинчатого фотополимера гиалуроновой кислоты с новым ключевым свойством матричной основы для клеточного культивирования - устойчивостью структуры во влажной среде более 7 суток. Данным качеством обычный пластический материал на основе гиалуроновой кислоты не обладает, что является главным препятствием для разработки матрицы для культивирования клеток, которое может быть реализовано только в условиях влажной среды.
Полученный таким образом биоматериал обозначен как матрица для клеточного культивирования, поскольку она обладает стабильными физико-химическими параметрами во влажной среде и наделена способностью стимулировать клеточную адгезию и миграцию за счет коллагена I типа и адгезивного пептида Arg-Gly-Asp.
Предлагаемая матрица для культивирования клеток способна способная формировать не просто монослой клеток, а целые клеточные комплексы, распределенные в трехмерном пространстве. При этом очень важно отметить, что данное распределение клеток соответствует структурному построению естественных тканей организма: эпителиальные клетки (кератиноциты) снаружи, а клетки соединительной ткани (фибробласты) - изнутри. Этот факт четко виден на Фиг.12.
В связи с этим для обозначения данного явления нами введен научный термин ″целлюлярно-матричный комплекс (CMComplex)″, который максимально точно характеризует итог культивирования клеток на предлагаемой матрице [2]. Тогда как на других матрицах (коллагеновых, желатиновых, синтетических) наблюдается общее ″смешивание″ разных типов клеток без их трехмерного распределения.
Краткое описание чертежей
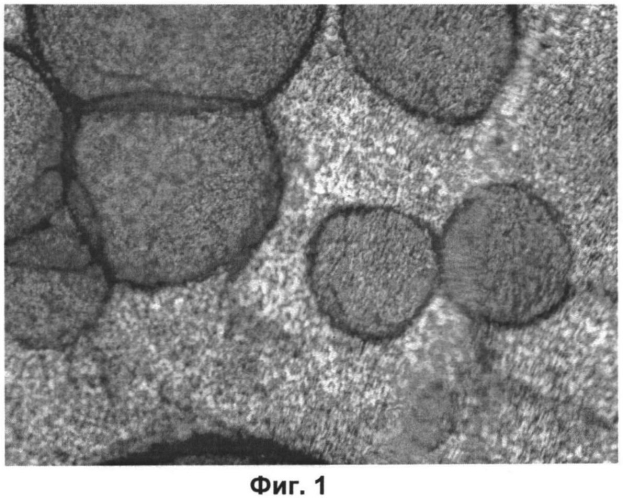
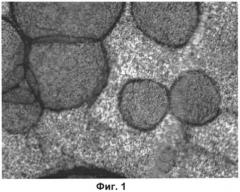
На Фиг.1 показана структура матрицы по изобретению.
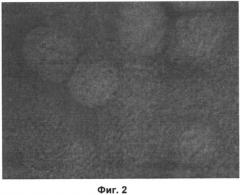
На Фиг.2 показаны фибробласты кожи человека на матрице без окраски МТТ, светооптическая микроскопия ×120.
На Фиг.3 показаны фибробласты кожи человека на матрице с окраской МТТ, светооптическая микроскопия ×120.
На Фиг.4 показаны фибробласты кожи человека на пластике (контроль), окраска МТТ, обХ 4.
На Фиг.5 показаны фибробласты кожи человека на матрице (опыт), окраска МТТ, обХ 4.
На Фиг.6 показан рост колоний кератиноцитов на матрице с фидером из фибробластов, окраска МТТ.
На Фиг.7 показан поперечный срез матрицы, распределение фибробластов по всей структуре матрицы, окраска гематоксилин-эозин.
На Фиг.8 показан фибриновый гель с фибробластами кожи, 19 сутки культивирования (поперечный срез, окраска гематоксилин - эозин), обХ20.
На Фиг.9 показаны клетки сразу после внесения на пластиковую посуду, ув. 50х.
На Фиг.10 показаны клетки сразу после внесения на матрицу, ув. 50х.
На Фиг.11 показана культура клеток на матрице.
На Фиг.12 показано формирование клеточного комплекса (эпителиальные клетки отмечены стрелками снаружи, а фибробласты - изнутри) (поперечный срез, окраска гематоксилин - эозин), обХ20.
Осуществление изобретения
Предлагаемая матрица представляет собой тонкую пергаментообразную полупрозрачную пленку беловатого цвета, которая хорошо смачивается жидкостями (физиологический раствор, жидкие питательные среды). Структура матрицы ячеисто-волокнистая (Фиг.1).
В целях обоснования использования разработанной матрицы в качестве пластинчатой основы для клеточного культивирования были проведены культуральные исследования ″in vitro″.
1. Получение, культивирование фибробластов и кератиноцитов на матрице
Нормальные фибробласты кожи человека были получены из кожи здоровых доноров, полученной в ходе проведения пластических операций. Фибробласты получали путем механического или ферментативного измельчения кожи с последующим стандартным культивированием в среде DMEM с 10% FBS. В эксперименте использовались фибробласты нескольких доноров в активной фазе роста на 4-6 пассажах.
Традиционно кератиноциты культивируют в среде с физиологическим содержанием Са2+ и в присутствии митогенов. Такие условия способствуют пролиферации и постепенной дифференцировке кератиноцитов с образованием многослойных пластов - аналогов эпидермиса (Терских В.В. и Васильев А.В., 1995). Среды с низким содержанием Са2+ способствуют пролиферации, но не дифференцировке кератиноцитов, что увеличивает продолжительность жизни клеток в культуре. Для нормального прикрепления и роста кератиноцитам в культуре необходим субстрат, который производится фидерными клетками. В качестве фидерных клеток используют фибробласты, предварительно облученные или обработанные митомицином С, в результате такой обработки фидерные клетки теряют способность к делению, но сохраняют жизнеспособность и синтетическую активность. Также в качестве субстрата используют матричные белки, в основном коллаген I типа.
Кератиноциты были выделены из кожи здоровых доноров, полученной в ходе проведения пластических операций. Кератиноциты выделяли ферментативным методом с использованием смеси ферментов диспазы/коллагеназы. Клетки культивировали в специализированной среде с низким содержанием кальция для активации роста, но не дифференцировки кератиноцитов (KGM, Invitrogen).
Для контроля роста кератиноцитов использовали фидерный слой фибробластов и/или покрытие культуральной посуды раствором коллагена 1 типа (Биолот). Для формирования фидерного слоя фибробласты за сутки до посева кератиноцитов высевали на чашку Петри в низкой плотности.
1.1. Оценка жизнеспособности клеток
Жизнеспособность клеток кожи на матрице оценивали на разных сроках культивирования по окраске на МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид). МТТ является субстратом для фермента митохондрий, которые в ферментативно-активных живых клетках переводят растворимый МТТ в нерастворимые кристаллы формазана фиолетового цвета, хорошо визуализируемые при микроскопии в светлом поле. Кристаллы растворимы в изопропаноле, что позволяет производить спектрофотометрическое измерение оптической плотности раствора.
1.2. Пролиферация клеток
Пролиферативную активность фибробластов оценивали по кривым роста. Клетки высевали на чашки Петри, в определенные сроки (1, 4 и 6 сут) снимали раствором 0,25% трипсина/ЭДТА и подсчитывали количество клеток. На каждую точку брали три повторности. Высчитывали такие показатели пролиферативной активности как:
количество удвоений популяции n=(log 10(N2)-log10(N1))/log10(2)
время удвоения популяции t=T2-T1/n,
где N2 и N1 - число клеток в конце и в начале эксперимента,
Т2 и Т1 - время окончания и начала эксперимента.
1.3. Результаты культуральной работы
Разработанная матрица для культивирования клеток представляет собой тонкую хрупкую полупрозрачную пленку беловатого цвета, стерильную, хорошо смачиваемую жидкостями (физиологический раствор, любые жидкие питательные среды). Структура матрицы (ячеистая, волокнистая), и ее свойства делают ее непрозрачной для микроскопии и делают практически невозможным визуализацию распластанных клеток без их предварительной окраски. Среди разных красителей мы выбрали МТТ, который позволяет одновременно оценивать жизнеспособность клеток и окрашивать клетки без окраски самой матрицы (см. Фиг.1).
Матрица имеет 2 разные поверхности: наружную (гладкую) и внутреннюю (шероховатую). Клетки высевали на шероховатую поверхность.
Перед посевом клеток мы провели сравнение двух вариантов использования матрицы: с предварительным вымачиванием в PBS и без вымачивания. Результаты показали, что предварительное вымачивание не сказывалось на жизнеспособности клеток, однако большая часть клеток при таком посеве подтекала под матрицу и адгезировала на культуральный пластик. Поэтому в дальнейшем мы высевали клетки непосредственно на сухую матрицу, уложенную в культуральные чашки Петри.
Как видно на представленных Фиг.2-3, окраска МТТ позволяет визуализировать живые клетки на поверхности матрицы.
Жизнеспособность клеток кожи на матрице оценивали на разных сроках культивирования по окраске на МТТ и визуализировали при помощи инвертированного микроскопа Leica. Результаты показали, что матрица обладает сопоставимыми с контролем (культуральный пластик) адгезивными свойствами. Распластывание фибробластов на пластике и на матрице происходит за 1 час, которое сохраняется на всем периоде культивирования более 7 суток (Фиг.4-5).
На всем периоде культивирования (26 сут) клетки сохраняли жизнеспособность и пролиферативную активность на матрице.
В исследованиях с кератиноцитами также был отмечен рост эпителиальных клеток кожи из агрегатов в виде клонов (колоний). Кератиноциты легко идентифицируются по округлой морфологии эпителиальных клеток, формирующих характерную ″булыжную мостовую″ (Фиг.6).
При гистологическом исследовании матрицы после длительного клеточного культивирования (26 сут.) установлено, что фибробласты не только распределяются по поверхности матрицы, но и проникают в ее толщу, при этом они живые, вытянутой формы, что характерно для распластанных клеток (Фиг.7).
В контроле фибробласты, посеянные на фибриновый гель, были распределены только по поверхности гелевой среды и не проникали в ее структуру, что, вероятно, связано с неблагоприятными условиями для жизнедеятельности клеток в толще фибринового геля (Фиг.8).
2. Получение и культивирование мультипотентных мезенхимальных стромальных стволовых клеток (ММСК) на матрице
В исследовании использовались мультипотентные мезенхимальные стромальные клетки, полученные из костного мозга взрослого человека (донора), после подписания информированного согласия на получение биологического материала.
Клетки были выделены на градиенте плотности, фиколл 1.033, имели следующий иммунофенотип:
- стромальные маркеры - CD73, 44, 90, 105 позитивны;
- гемопоэтические маркеры - CD14, 34, 45, HLA-DR, 106 негативны.
В контроле клетки вносили в питательную среду в концентрации 1362 клеток на 1 см2 (Фиг.9) культурального пластика. Через 2 часа наблюдалась частичная адгезия клеток к пластику.
В опыте перед внесением клеток на пластик в него помещали матрицу по размеру, совпадающему с длиной и шириной дна культурального пластика (например, 3×5 см). Клетки вносили на поверхность матрицы, смоченной жидкой питательной средой в концентрации 1362 клеток на 1 см2 матрицы (Фиг.10).
В результате 26-дневного культивирования отмечено активное увеличение плотности колоний за счет увеличения адгезивных клеток небольших размеров до 100% на периферии (Фиг.11).
Морфологическая картина хорошая, клетки малых размеров, с четкими и ровными краями, плотными межклеточными контактами, цитоплазма равномерная, без включений, ядра четкие с одним и более ядрышками. На 26 день клетки сняли раствором трипсин-версена, посчитали и проанализировали на проточном цитометре. Количество клеток с одной культуральной посуды (20,3 см2) составило 1, 500000 млн клеток. Количество удвоений 5,73 удвоений культуры, скорость удвоения 0,01 удв./час (0,220 удв./день).
На основании данных микроскопии установлено, что матрица не является токсичной для клеток, свойства ее поверхности обеспечивают прикрепление, распластывание клеток и способствуют активному их росту. Также было выявлено изменение морфологической картины - на первых этапах культивирования клетки имели более четкую структуру, однородную цитоплазму, ровные края и отростки, размеры клеток были несколько меньше клеток в контроле. На последних этапах культивирования различия в морфологической картине не визуализировались (16 сутки).
Матрица согласно изобретению может быть получена согласно следующей методике.
Пример получения матрицы для культивирования клеток.
Для достижения поставленной задачи авторами изобретения разработана следующая рецептура матрицы для культивирования клеток (на 100 мл смеси):
| 5% раствор гиалуроновой кислоты | 60-70 |
| 5% раствор аминокислоты десмозина | 5-10 |
| 3% раствор адгезивного пептида (Arg-Gly-Asp) | 5 |
| Коллаген I типа (сухое вещество) | 30-15 г |
Предварительно смешиваются водные растворы гиалуроновой кислоты и аминокислоты десмозина (либо смесь отдельных аминокислот, либо полипептида) в рецептурном соотношении. Полученная смесь подвергается гомогенизации на плунжерном гомогенизаторе клапанного типа в режиме 40 МПа в течение 30 минут, затем гомогенат размещается на кварцевых подложках (100 мл на 100 см2) и размещается в камеру низкотемпературной лиофильной сушки, в которой имеется источник ультрафиолетового излучения. В камере создается вакуум и понижается температура до минус 20 градусов Цельсия, в течение 6 часов гомогенат подвергается ультрафиолетовой обработке. По истечении указанного времени образуется пленка, которая извлекается и переносится в ламинарный шкаф, на полученную пленку аэрозольным способом равномерно на всю площадь наносится рецептурное количество водных растворов адгезивного пептида (Arg-Gly-Asp) и коллагена I типа. Затем пленку выдерживают в течение 5 часов в ламинарном шкафу и снимают готовый материал для культивирования клеток.
Для ультрафиолетовой обработки смеси, содержащей гиалуроновую кислоту, может применяться методика, раскрытая в документах "Биопластический материал на основе гиалуроновой кислоты: биофизические аспекты фармакологических свойств" Рахматуллин P.P., Фармация №4, 2011, стр. 37, левая колонка, второй абзац, и "Разработка инновационного наноструктурированного биоматериала для офтальмохирургии", Рахматуллин P.P. и соавторы, Вестник ОГУ №12 (148), декабрь 2012, стр. 165, правая колонка, второй абзац. В частности, может использоваться излучение с длиной волны λmax=230 нм.
Литература
1. Хабаров В.Н., Бойко П.Я., Селянин М.А. Гиалуроновая кислота: получение, свойства, применение в биологии и медицине. - М.: Практическая медицина, 2012.
2. Рахматуллин P.P., Бурцева Т.И., Бурлуцкая О.И., Спичкина О.Г., Калмыкова Н.В. Разработка целлюлярно-матричного комплекса на основе гиалуроновой кислоты для создания биологически активного раневого покрытия // Материалы 1-го Национального конгресса по регенеративной медицине. Сборник тезисов. Москва, 4-6 декабря 2013. - С. 213-214.
Матрица для культивирования клеток на основе полимера гиалуроновой кислоты, отличающаяся тем, что содержит гиалуроновую кислоту, которая стабилизирована полипептидом десмозином, коллаген I типа и адгезивный пептид Arg-Gly-Asp, получена при УФ-фотополимеризации в условиях постепенной лиофилизации.