Конъюгат мирнк и способ его получения
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии и раскрывает твердую подложку, к которой присоединено содержащее полиэтиленгликоль соединение (3'-ПЭГ-СКП), а также способ получения указанного соединения. Способ предусматривает реакцию СКП с 3-аминопропилтриэтоксисиланом с образованием длинноцепочеченого алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП), затем реакцию полиэтиленгликоля с 4,4'-диметокситритилхлоридом с образованием 2[бис-(4-диметокситритил)полиэтиленгликоля)] и еще ряд стадий. Настоящее изобретение позволяет получать 3'-ПЭГ-СКП с высоким выходом. 2 н. и 1 з.п. ф-лы, 1 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгату, в котором полимерное соединение, улучшающее доставку миРНК, используемой в генной терапии онкологических заболеваний и других инфекционных заболеваний, конъюгировано с миРНК посредством расщепляемой или нерасщепляемой связи, к способу получения указанного конъюгата и к способу доставки миРНК с использованием указанного конъюгата.
Уровень техники
Интерференция РНК означает механизм, который представляет собой посттранскрипционное подавление генов, индуцированное двухцепочечной РНК (дцРНК) специфичным для последовательности нуклеотидов способом в процессе экспрессии генов, и этот механизм впервые был обнаружен у круглого червя и обычно встречается у растений, плодовой мушки дрозофилы и позвоночных животных (Fire и др., Nature, 1998 г., т.391, с.806-811; Novina & Sharp, Nature, 2004 г., т.430, с.161-164). Как известно, интерференция РНК происходит таким образом, что дцРНК 19-25 п.о. при входе в клетку образует связь с РИКП (РНК-индуцированный комплекс подавления), и лишь антисмысловая (направляющая) цепь связана с мРНК так, что является комплементарной последовательности нуклеотидов мРНК, расщепляя тем самым мишеневую мРНК доменами эндонуклеазы, существующими в РИКП (Rana, T.M., Nat. Rev. Mol. Cell BioL, 2007 г., т.8, с.23-36; Tomari, Y. & Zamore, P.D., Genes Dev., 2005 г., т.19, с.517-529).
Когда дцРНК попадает в клетку, она образует специфическую связь с мишеневой последовательностью мРНК, чтобы разложить мРНК, и поэтому ее рассматривают в качестве нового инструмента, способного регулировать экспрессию генов. Однако в случае человека было трудно получить эффект интерференции РНК вследствие воздействия транспорта интерферона на введение дцРНК в клетки человека. В 2001 г. Elbashir, Tuschi и др. обнаружили, что введение малой дцРНК длиной в 21 нт.(нуклеотид) в клетки человека не привело к транспорту интерферона, но специфически разрушило целевую мРНК (Elbashir, S.M., Harborth, J, Lendeckel, W., Yalcin, A., Weber, K., Tuschi, Т., Nature, 2001 г., т.411, с.494-498; Elbashir, S.M., Lendeckel, W., Tuschi, Т., Genes & Dev., 2001 г., т.15, с.188-200; Elbashir, S.M., Martinez, J., Patkaniowska, A., Lendeckel, W., Tuschi, Т., EMBO J., 2001 г., т.20, с.6877-6888). Впоследствии дцРНК длиной в 21 нт. приняли как инструмент новой функциональной геномики и назвали термином «малая интерферирующая РНК» (миРНК).
Малая интерферирующая РНК представляет собой вещество, привлекающее большой интерес в качестве средства генной терапии с тех пор, как был показан ее поразительный эффект ингибирования экспрессии определенных генов в клетках животных. Фактически, вследствие ее высокой активности и точной генной селективности, ожидают, что миРНК станет лекарственным средством, альтернативным антисмысловому олигодеоксинуклеотиду (ОДН), который в настоящее время используют в качестве лекарственного средства, в результате двадцатилетних исследований (Dana J. Gary и др., Journal of Controlled Release, 2007 г., т.121, с.64-73,). Применение миРНК в методах лечения имеет большие преимущества, которые заключаются в ее легком конструировании по сравнению с другими лекарственными средствами, и высокой селективностью к мишени и свойством ингибирования экспрессии определенного гена. Кроме того, миРНК менее токсична, потому что интерференция РНК подавляет экспрессию генов с использованием механизма, который естественным образом существует в живой системе. Бевасираниб (Bevasiranib), недавно разработанный компанией ОРКО Inc. в качестве средства лечения влажной формы возрастной макулодистрофии, представляет собой миРНК, которая селективно воздействует на фактор роста эндотелия сосудов (ФРЭС), включая неоваскуляризацию, для ингибирования экспрессии ФРЭС, и в настоящее время проходит трехфазное клиническое исследование (DejnekaN.S. и др., Mol. Vis., 2008 г., т.28, №14, с.997-1005). Кроме того, недавно были разработаны лекарственные средства, включающие миРНК и нацеленные на различные гены (Ryan P. Million, Nature Reviews Drug Discovery, 2008, т.7, с.115-116).
Несмотря на разнообразные результаты, показывающие, что специфическое ингибирование экспрессии индуцируется в живом организме посредством интерференции РНК, в живом организме доставка миРНК требует решения многочисленных проблем, включая разрушение ферментами крови, взаимодействие с компонентами крови и неспецифическую доставку в клетки (Shigeru Kawakami & Mitsuru Hashida, Drug Metab. Pharmacokinet, 2007 г., т.22, №3, с.142-151). Предпринимаются попытки решения этих проблем, в частности, путем использования устойчивых к нуклеазе аналогов нуклеозидов или усовершенствованием способов доставки.
Примеры усовершенствованных способов доставки включают способы доставки генов с использованием вирусов, в том числе аденовирусов, ретровирусов и т.д., и способы доставки генов невирусными носителями с использованием липосом, катионных липидов и катионных полимерных соединений. Однако с вирусными носителями связана проблема безопасности, потому что доставленные гены могут внедриться в хромосомы хозяина и создать аномалии в нормальном функционировании генов хозяина и активации онкогенов, и кроме того, могут вызывать аутоиммунные заболевания вследствие последующей экспрессии вирусных генов в малых количествах или могут не приводить к эффективному защитному иммунитету в том случае, когда модифицированная вирусная инфекция вызвана вирусными носителями. При этом невирусные носители являются менее эффективными, чем вирусные носители, но имеют преимущества низкого уровня побочных эффектов и недорогого производства, принимая во внимание безопасность для живого организма и экономическую осуществимость (Lehrman S., Nature, 1999 г., т.401, №6753, с.517-518). Кроме того, невирусные способы доставки требуют эффективной защиты от ферментативного или неферментативного разложения, для того, чтобы доставлять молекулы РНК, включая миРНК, причем один из способов заключается в использовании экспрессионной плазмиды ДНК, кодирующей короткие образующие шпильки РНК (кшРНК). Преимущество системы с участием ДНК заключается в экспрессии миРНК только при наличии вектора экспрессии. Кроме того, в недавнем исследовании химической модификации миРНК был предложен способ повышения устойчивости к нуклеазам и снижения внутриклеточного поглощения (Shigeru Kawakami & Mitsuru Hashida, Drug Metab. Pharmacokinet, 2007 г., т.22, №3, с.142-151).
В одном из типов химической модификации миРНК фосфордиэфирную связь, которая представляет собой часть, разлагаемую нуклеазой, модифицировали фософоротиоатной связью или части 2′ пентозы модифицировали 2′-O-меРНК, 2′-деокси-2′-флуоридином или закрытой нуклеиновой кислотой (ЗНК), образованной связыванием части 2′ и части 4′, и в результате повысилась устойчивость сыворотки (Braasch D. А. и др., Bioorg. Med. Chem. Lett., 2003 г., т.14, с.1139-1143; Chiu Y.L. & Rana T.M., RNA, 2003 г., т.9, с.1034-1048; Amarzguioui M. и др., Nucleic Acid Res., 2003 г., т.31, с.589-595). При химической модификации другого типа функциональная группа связана с концевой областью З′-смысловой (с противоположным направлением) цепи, приводя у улучшению фармакокинетических характеристик по сравнению с контролем, и высокая эффективность индуцируется во время использования в живом организме посредством баланса гидрофильности и гидрофобности миРНК (Soutschek J. и др., Nature, 2004 г., т.432, с.173-178).
Однако приведенные выше способы все же оставляют желать лучшего в отношении защиты миРНК от нуклеаз и повышения эффективности проницаемости клеточной мембраны.
По этой причине авторы настоящего изобретения обнаружили, что конъюгат, в котором гидрофильное или гидрофобное полимерное соединение конъюгировано с миРНК с использованием расщепляемой или нерасщепляемой связи, повышает устойчивость в живом организме миРНК, и на этом основании было создано настоящее изобретение.
Описание
Техническая задача
Целью настоящего изобретения является конъюгат, в котором гидрофильное или гидрофобное полимерное соединение, которое представляет собой биосовместимое полимерное соединение, конъюгировано к концу смысловой цепи или антисмысловой цепи миРНК с использованием расщепляемой или нерасщепляемой связи, для улучшения эффективности внутриклеточной доставки миРНК.
Другой целью настоящего изобретения является твердая подложка, содержащая полимерное соединение, в частности, полимерное соединение, устойчивость которого доказана при введении в организм человека, например, полиэтиленгликоль (ПЭГ), и способ эффективного получение олигонуклеотида, включающего РНК, ДНК, химеру РНК-ДНК и их аналог, в котором ПЭГ связан с его концом 3′ с использованием подложки.
Еще одной целью настоящего изобретения является способ получения конъюгата миРНК и способ доставки миРНК с использованием конъюгата миРНК.
Техническое решение
Для достижения перечисленных выше задач, в первом пункте настоящего изобретения предложен конъюгат миРНК и полимерного соединения, имеющий следующую структуру:
A-X-R-Y-B
(где А и В независимо представляют собой гидрофильное полимерное или гидрофобное полимерное соединение; Х и Y независимо представляют собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК).
Во втором пункте настоящего изобретения предложен конъюгат миРНК и полимерного соединения, имеющий следующую структуру:
A-X-R
(где А представляет собой гидрофобное полимерное соединение; Х представляет собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК).
В третьем пункте настоящего изобретения предложен конъюгат, в котором одинарная цепь миРНК (R) включает от 19 до 31 нуклеотида.
В четвертом пункте настоящего изобретения предложен конъюгат, в котором гидрофобное полимерное соединение (А) имеет молекулярную массу от 250 до 1000.
В пятом пункте настоящего изобретения предложен конъюгат, в котором гидрофобное полимерное соединение (А) представляет собой углеводород C16-C50 или холестерин.
В шестом пункте настоящего изобретения предложен конъюгат, в котором ковалентная связь (X, Y) представляет собой нерасщепляемую связь или расщепляемую связь.
В седьмом пункте настоящего изобретения предложен конъюгат, в котором нерасщепляемая связь представляет собой амидную связь или фосфатную связь.
В восьмом пункте настоящего изобретения предложен конъюгат, в котором расщепляемая связь выбрана из дисульфидной связи, расщепляемой кислотой связи, сложноэфирной связи, ангидридной связи, биорасщепляемой связи и расщепляемой ферментом связи.
В девятом пункте настоящего изобретения предложен конъюгат, в котором гидрофильное полимерное соединение (А или В) представляет собой неионное полимерное соединение, имеющее молекулярную массу от 1000 до 10000.
В десятом пункте настоящего изобретения предложен конъюгат, в котором гидрофильное полимерное соединение выбрано из группы, в которую входят полиэтиленгликоль (ПЭГ), поливинилпирролидон и полиоксазолин.
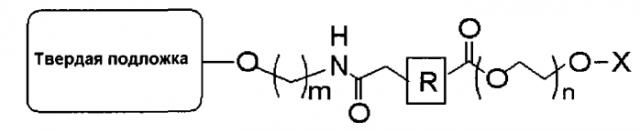
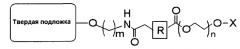
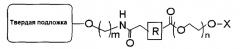
В одиннадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, имеющая следующую структуру:
(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; m представляет собой целое число от 2 до 18; n представляет собой целое число от 5 до 120; и Х представляет собой атом водорода, 4-монометокситритил, 4,4′-диметокситритил или 4,4′,4"-триметокситритил).
В двенадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, где твердая подложка представляет собой стекло с контролируемым размером пор (СКП).
В тринадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, в которой СКП имеет диаметр от 40 до 180 мкм и размер пор от 500 до 3000 А.
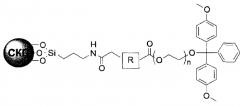
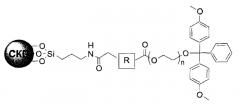
В четырнадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, в которой связанная с полиэтиленгликолем твердая подложка представляет собой соединение 3′-ПЭГ(полиэтиленгликоль)-СКП, имеющее следующую структурную формулу IV:
[Структурная формула IV]
В пятнадцатом пункте настоящего изобретения предложен способ получения соединения 3′-ПЭГ-СКП, имеющего следующую структурную формулу IV, причем способ предусматривает:
1) реакцию СКП с 3-аминопропилтриэтоксисиланом, в которой образуется соединение длинноцепного алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП);
2) реакцию полиэтиленгликоля с 4,4′-диметокситритилхлоридом, в которой образуется 2-[бис-(4-диметокситритил)полиэтиленгликоль];
3) реакцию соединения, полученного на стадии (2), с соединением, имеющим следующую химическую формулу 1, в которой образуется соединение, имеющее следующую структурную формулу I;
4) реакцию полученного соединения, имеющего следующую структурную формулу I, с 4-нитрофенилхлорформиатом, в которой образуется соединение, имеющее следующую структурную формулу II;
5) реакцию соединения, имеющего следующую структурную формулу I и полученного на стадии (3), с N-сукцинимидилтрифторуксусной кислотой, в которой образуется соединение, имеющее следующую структурную формулу III; и
6) реакцию соединения ДЦАА-СКП, полученного на стадии (1), с соединениями, имеющими следующие структурные формулы I, II и III, соответственно, и полученными на стадиях (3)-(5), соответственно.
[Химическая формула 1]
[Структурная формула I]
[Структурная формула II]
[Структурная формула III]
[Структурная формула IV]
(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; и n представляет собой целое число, составляющее не менее чем 5 и не более чем 120).
В шестнадцатом пункте настоящего изобретения предложен способ получения конъюгата миРНК, причем способ предусматривает:
1) получение миРНК против гена-мишени с использованием связанной с полиэтиленгликолем твердой подложки согласно одиннадцатому пункту настоящего изобретения; и
2) соединение концевой группы миРНК и полиэтиленгликоля ковалентной связью.
В семнадцатом пункте настоящего изобретения предложена наночастица, состоящая из конъюгатов миРНК согласно первому или второму пункту настоящего изобретения.
В восемнадцатом пункте настоящего изобретения предложен способ генной терапии, причем способ предусматривает:
1) получение наночастиц согласно семнадцатому пункту настоящего изобретения; и
2) введение наночастиц в организм животного.
В девятнадцатом пункте настоящего изобретения предложен способ генной терапии, в котором наночастицы вводят в организм путем перорального приема или внутривенной инъекции.
В двадцатом пункте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество конъюгатов миРНК согласно первому или второму пунктам настоящего изобретения.
В двадцать первом пункте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество наночастиц согласно семнадцатому пункту настоящего изобретения.
Далее настоящее изобретение будет описано подробно.
Настоящее изобретение относится к конъюгату миРНК и полимерного соединения, имеющему следующую структуру:
A-X-R-Y-B.
В описании заявки А и В независимо представляют собой гидрофильное полимерное или гидрофобное полимерное соединение; Х и Y независимо представляют собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК.
Кроме того, настоящее изобретение относится к конъюгату миРНК и полимерного соединения, имеющему следующую структуру:
A-X-R.
В описании заявки А представляет собой гидрофобное полимерное соединение; Х представляет собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК.
В конъюгате по настоящему изобретению олигонуклеотидная цепь миРНК может содержать от 19 до 31 нуклеотида. Любую миРНК, полученную из генов, которую используют или могут использовать для генной терапии или исследования, можно использовать в качестве миРНК, подходящей для настоящего изобретения.
Гидрофобное полимерное соединение может представлять собой гидрофобное полимерное соединение, имеющее молекулярную массу от 250 до 1000. Примеры гидрофобного полимерного соединения могут включать углеводород, предпочтительно, углеводород C16-C50, и холестерин. В данном документе гидрофобное полимерное соединение не ограничено только углеводородом и холестерином.
Гидрофобное полимерное соединение заставляет функционировать гидрофобное взаимодействие, в котором образуется мицелла, состоящая из конъюгатов миРНК и гидрофобного полимерного соединения. Среди гидрофобных полимерных соединений, в частности, насыщенный углеводород имеет преимущество в том, что он может быть легко конъюгирован к миРНК в процессе производства миРНК, и, таким образом, он является в высокой степени подходящим для получения конъюгатов по настоящему изобретению.
Кроме того, ковалентная связь (т.е. X, Y) может представлять собой одну из нерасщепляемой или расщепляемой связи. В данном случае может существовать амидная связь или фосфатная связь в качестве нерасщепляемой связи, и может существовать дисульфидная связь, расщепляемая кислотой связь, сложноэфирная связь, ангидридная связь, биорасщепляемая связь и расщепляемая ферментом связь в качестве расщепляемой связи. Однако нерасщепляемая или расщепляемая связь не ограничена перечисленными выше примерами.
Линкер, посредством которого образуется связь, ковалентно связывает гидрофильный полимер (или гидрофобный полимер) и конец остатка, полученного из миРНК, и не ограничен определенным образом при том условии, что он может обеспечивать расщепляемую связь в определенной среде по мере необходимости. Следовательно, линкер может включать любое соединение, которое может быть связано с миРНК и/или гидрофильным полимером (или гидрофобным полимером), для их активации в процессе получения конъюгата.
Кроме того, гидрофильное полимерное соединение может представлять собой неионное полимерное соединение, имеющее молекулярную массу от 1000 до 10000. Например, гидрофильное полимерное соединение может включать неионное гидрофильное полимерное соединение, в том числе полиэтиленгликоль, поливинилпирролидон, полиоксазолин и подобные соединения, но не ограничивается ими.
Функциональная группа гидрофильного полимерного соединения может быть замещена другой функциональной группой по мере необходимости. Среди гидрофильных полимерных соединений, в частности, ПЭГ является весьма подходящим для получения конъюгатов по настоящему изобретению, так как он имеет различные значения молекулярной массы, способен к концевому введению функциональных групп, обладает превосходной биосовместимостью, не вызывает иммунные реакции и повышает растворимость в воде, что улучшает эффективность доставки генов в живом организме.
Кроме того, настоящее изобретение относится к связанной с полиэтиленгликолем твердой подложке, имеющей следующую структуру:
В данном случае твердая подложка включает, например, СКП, полистирол, силикагель, целлюлозную бумагу и т.д., но не обязательно ограничивается этими материалами; R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; m представляет собой целое число от 2 до 18; n представляет собой целое число от 5 до 120 (молярная масса 282-5300); и Х представляет собой 4-монометокситритил, 4,4′-диметокситритил или 4,4′,4"-триметокситритил и удаляется после обработки кислотой с замещением атомом водорода. В том случае, если твердая подложка представляет собой СКП, она может иметь диаметр от 40 до 180 мкм и размер пор от 500 до 3000 А.
Кроме того, настоящее изобретение относится к связанной с полиэтиленгликолем твердой подложке, с которой связано соединение 3′-ПЭГ-СКП, имеющее следующую структурную формулу IV:
[Структурная формула IV]
Кроме того, настоящее изобретение относится к способу получения 3′-ПЭГ-СКП со следующей структурной формулой IV, имеющей следующую структурную формулу IV, причем способ предусматривает:
1) реакцию СКП с 3-аминопропилтриэтоксисиланом, в которой образуется соединение длинноцепного алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП);
2) реакцию полиэтиленгликоля с 4,4′-диметокситритилхлоридом, в которой образуется 2-[бис-(4-диметокситритил)полиэтиленгликоль];
3) реакцию соединения, полученного на стадии (2), с соединением, имеющим следующую химическую формулу 1, в которой образуется соединение, имеющее следующую структурную формулу I;
4) реакцию полученного соединения, имеющего следующую структурную формулу I, с 4-нитрофенилхлорформиатом, в которой образуется соединение, имеющее следующую структурную формулу II;
5) реакцию соединения, имеющего следующую структурную формулу I и полученного на стадии (3), с N-сукцинимидилтрифторуксусной кислотой, в которой образуется соединение, имеющее следующую структурную формулу III; и
6) реакцию соединения ДЦАА-СКП, полученного на стадии (1), с соединениями, имеющими следующие структурные формулы I, II и III, соответственно, и полученными на стадиях (3)-(5), соответственно.
[Формула 1]
[Структурная формула I]
[Структурная формула II]
[Структурная формула III]
[Структурная формула IV]
(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; и n представляет собой целое число, составляющее не менее чем 5 и не более чем 120).
Кроме того, настоящее изобретение относится к способу получения конъюгата, включающего миРНК и ПЭГ с использованием связанной с полиэтиленгликолем твердой подложки. Более конкретно, предложен способ получения конъюгата миРНК, который предусматривает:
1) получение миРНК против гена-мишени с использованием связанной с полиэтиленгликолем твердой подложки по одиннадцатому пункту настоящего изобретения;и
2) соединение концевой группы миРНК и полиэтиленгликоля ковалентной связью.
Таким способом можно эффективно получать олигонуклеотиды, включая РНК, ДНК, химеру РНК-ДНК и их аналог.
Согласно предпочтительному варианту осуществления настоящего изобретения, миРНК можно получать путем формирования фосфордиэфирных связей, строящих основную структуру РНК, с использованием β-цианоэтилфосфорамидита (Shina и др., Nucleic Acids Research, 1984 г., т.12, с.4539-4557). Например, ряд процедур, в число которых входят разблокирование, соединение, окисление и кэппирование, повторно проводили на твердой подложке, к которой был прикреплен нуклеотид, с использованием синтезатора РНК, чтобы получить реагент, содержащий РНК желательной длины. Однако настоящее изобретение не ограничено перечисленным выше.
Кроме того, настоящее изобретение относится к наночастице, состоящей из конъюгатов миРНК.
Конъюгаты миРНК и полимерного соединения по настоящему изобретению могут образовывать структуру из наночастиц посредством взаимодействия между собой, и конъюгат миРНК и полимерного соединения и наночастицы, состоящие из полученных таким образом конъюгатов миРНК и полимерного соединения, улучшают внутриклеточную доставку миРНК, и их можно использовать для лечения модельных заболеваний. Получение конъюгатов, а также характеристики и внутриклеточная эффективная доставка и действие наночастиц, состоящих из конъюгатов, будут подробно описаны в приведенных ниже примерах.
Кроме того, настоящее изобретение относится к способу генной терапии с использованием наночастиц.
Более конкретно, способ генной терапии включает получение наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения, и введение наночастиц в организм животного.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество наночастиц, каждая из которых состоит из конъюгатов миРНК.
Композицию по настоящему изобретению можно получить, включая один или более фармацевтически приемлемых носителей, помимо описанных выше активных компонентов, для приема. Фармацевтически приемлемый носитель должен быть совместимым с активными компонентами по настоящему изобретению. Фармацевтически приемлемый носитель можно использовать путем смешивания с физиологическим раствором, стерилизованной водой, раствором Рингера (Ringer), содержащим буфер физиологическим раствором, раствором декстрозы, раствором мальтодекстрина, глицерином и этанолом, и одним или более данных растворов, а также, по мере необходимости, можно вводить другие обычные добавки, в том числе антиоксиданты, буферные растворы, препятствующие размножению бактерий вещества или подобные вещества. Кроме того, можно дополнительно вводить разбавители, диспергаторы, поверхностно-активные вещества, связующие вещества и смазочные материалы, чтобы получать составы для инъекций, в том числе водные растворы, суспензии, эмульсии или подобные составы. Кроме того, композицию по настоящему изобретению можно предпочтительно составлять в зависимости от определенных заболеваний или компонентов, используя соответствующие способы, известные в технике, или способы, описанные в фармацевтическом справочнике Remington′s Pharmaceutical Science (издательство Mack, Истон, штат Пенсильвания).
Фармацевтическую композицию по настоящему изобретению могут определить специалисты в данной области техники на основании синдромов и тяжести заболеваний пациентов. Кроме того, фармацевтическую композицию по настоящему изобретению можно составлять в различных формах, включая порошки, таблетки, капсулы, жидкости, средства для инъекций, мази, сиропы и т.п., и можно выпускать в содержащем одну дозу или много доз контейнере, например, в запаянной ампуле, флаконе и т.п.
Фармацевтическая композиция по настоящему изобретению может быть предназначена для перорального или парентерального применения. Путь введения фармацевтической композиции по настоящему изобретению может включать, но не ограничивается этим, пероральное, внутривенное, внутримышечное, интрамедуллярное, внутриоболочечное, внутрисердечное, кожное, подкожное, внутрибрюшинное, энтеральное, подъязычное или местное применение.
Для клинического применения фармацевтическую композицию по настоящему изобретению можно составлять в соответствующих формах, используя известные в технике способы. Дозировка композиции по настоящему изобретению имеет различные пределы в зависимости от веса, возраста, пола, состояния здоровья, диеты, срока и способа приема, скорости выделения и степени заболевания пациента, и ее могут легко определять специалисты в данной области техники.
Полезные эффекты
Наночастица, состоящая из конъюгатов миРНК и полимерного соединения по настоящему изобретению, может повышать устойчивость миРНК в живом организме в целях эффективной доставки лечебной миРНК в клетки и может оказаться очень полезной в основном исследовании в области биотехнологии и медицинской промышленности в качестве нового типа системы доставки миРНК, а также в качестве носителя миРНК для лечения онкологических заболеваний и других инфекционных заболеваний, потому что она способна проявлять активность миРНК в относительно низкой концентрации дозировки даже без трансфекционных реагентов (трансформирующих клетки вирусной ДНК).
Описание чертежей
Фиг.1 представляет структурную формулу полученного соединения 3′-ПЭГ-СКП;
фиг.2 представляет данные ЯМР 1H соединения, полученного в примере 1;
фиг.3 представляет данные ЯМР 1Н соединения А, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
фиг.4 представляет данные ЯМР 1Н соединения В, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
фиг.5 представляет данные ЯМР 1H соединения С, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
фиг.6 представляет полученные методом масс-спектрометрии МАЛДИВП данные о молекулярной массе после получения соединения 3′-ПЭГ-СКП и олигонуклеотида (миРНК) в примере 1-3;
фиг.7 представляет полученные методом масс-спектрометрии МАЛДИВП данные о молекулярной массе после получения соединения 3′-ПЭГ-СКП и олигонуклеотида (миРНК) в примере 1-4;
фиг.8 представляет электрофоретическую фотографию неконъюгированной миРНК, в которой ни одно из полимерных соединений не конъюгировано, и конъюгатов миРНК и полимерного соединения, в которых гидрофильное или гидрофобное полимерное соединение конъюгировано (миРНК означает неконъюгированную миРНК, и соответствующие конъюгаты представляют конъюгаты миРНК и полимерного соединения, представленные в таблице 1; кроме того, 19 мер, 23 мер, 27 мер и 31 мер означают миРНК, состоящие из 19, 23, 27 и 31 нуклеотида, соответственно, и их использовали для получения конъюгатов миРНК и полимерного соединения в структуре конъюгата миРНК 4);
фиг.9 представляет электрофоретическую фотографию, отражающую степени разложения миРНК в зависимости от времени в присутствии сывороточного белка, чтобы оценить устойчивость в крови неконъюгированной миРНК, в которой не конъюгировано ни одно из полимерных соединений, и конъюгатов миРНК и полимерного соединения, в которых конъюгировано гидрофильное полимерное соединение, а именно ПЭГ;
фиг.10 представляет схематичное изображение наночастицы, образованной конъюгатами миРНК и полимерного соединения;
фиг.11 представляет распределение по размерам наночастиц, состоящих из неконъюгированных миРНК, в которых не конъюгированы полимерные соединения, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.12 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 9, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.13 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 10, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.14 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 11, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.15 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 12, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.16 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 13, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.17 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции вместе с осуществляющим трансфекцию реагентом, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и соответствующих конъюгатов миРНК и полимерного соединения, в которых конъюгировано гидрофильное полимерное соединение, а именно ПЭГ;
фиг.18 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции вместе с осуществляющим трансфекцию реагентом, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и соответствующих обладающих длинной последовательностью миРНК, преобразованных в конъюгат миРНК и полимерного соединения 4; и
фиг.19 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции при отсутствии осуществляющего трансфекцию реагента, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и конъюгатов миРНК и полимерного соединения 1-5 и 9-14.
Наилучший вариант осуществления
Далее будут подробно описаны примерные варианты осуществления настоящего изобретения. Однако следующие примерные варианты осуществления описывают настоящее изобретение лишь посредством примера, но не ограничивают его.
Пример 1. Получение твердой подложки для получения олигонуклеотида 3′-ПЭГ
Пример 1-1. Получение реагентов 3′-ПЭГ (соединения А, В и С) для соединения с ДЦАА-СКП
В следующем примере 3′-ПЭГ-СКП получали таким способом, как показывает следующая схема реакции.
Пример 1-1-1. Получение 2-[бис-(4-диметокситритил)полиэтиленгликоля]
Растворяли 30 г (15 ммоль) полиэтиленгликоля 2000 (Alfa Aesar GmbH & Co. KG, Германия) в качестве исходного материала в 270 мл пиридина (Sigma Aldrich, США), затем добавляли 3,55 мл (25,5 ммоль) триэтиламина (Sigma Aldrich, США) и 7,12 г (21 ммоль) 4,4′-диметокситритилхлорида (GL Biochem, Китай) и после этого полученное вещество реагировало при комнатной температуре в течение 20 часов. Реакционную смесь после завершения реакции концентрировали и экстрагировали 450 мл этилацетата и 450 мл воды, затем путем упаривания в вакууме с последующей вакуумной сушки получали 2-[бис-(4-диметокситритил)полиэтиленгликоль] в количестве 23 г (66%).
Данные ЯМР 1Н соединения приведены на фиг. 2,
ЯМР 1H (δ, CDCl3): 1,93 (ш, 1, ОН), 3,20-3,80 (м, 186, ПЭГ, ДМТ-ОСН3), 6,80-6,83 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-2. Получение соединения янтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоль] [соединение А]
Растворяли 3,9 г (1,672 ммоль) 2-[бис-(4-диметокситритил)полиэтиленгликоля], полученного в примере 1-1-1, в 20 мл пиридина и затем охлаждали до 0°C. К раствору реагента добавляли 351 мг (3,512 ммоль) ангидрида янтарной кислоты (Acros Organics, США) и 42,5 мг (0,334 ммоль) ДМАП (4-диметиламинопиридин, Sigma Aldrich, США) и перемешивали при 50°C в течение 3 суток, и тогда реакция завершалась. Реакционную смесь после завершения реакции упаривали в вакууме и получали соединение янтарной
кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение А] в виде белого твердого вещества в количестве 3,65 г (90%).
Данные ЯМР 1Н соединения приведены на фиг. 3.
ЯМР 1H (δ, CDCl3): 2,65 (м, 2, СН2СО), 3,20-3,88 (м, 186, ПЭГ, ДМТ-ОСН3), 4,25 (м, 2, СН2СО), 6,80-6,82 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-3. Получение соединения пара-нитрофенилянтарной кислоты и 2-[бис-(диметокситритил)полиэтиленгликоля] [соединение В]
Растворяли 1 г (0,411 ммоль) соединения, полученного в примере 1-1-2, в 20 мл метиленхлорида (DaeYeon Chemicals, Co. Ltd., Корея) и охлаждали до 0°C. К раствору реагента добавляли 143 мкл (1,03 ммоль) триэтиламина и 149 мг (0,740 ммоль) 4-нитрофенилхлорформиата. Затем температуру повышали до комнатной температуры и полученное вещество перемешивали в течение 4 часов, после чего реакция закончилась. Реакционную смесь после завершения реакции однократно промывали 20 мл насыщенного водного раствора NaHCO3 и 20 мл 1 М раствора лимонной кислоты (Sigma Aldrich, США), который охлаждали до 0-4°C, и после этого сушили над Na2SO4 (Samchum Chemical Co., Корея). Полученное вещество отфильтровывали, используя колбу для фильтрования, воронку Бюхнера (Buchner) или аспиратор, после чего путем упаривания в вакууме получали соединение пара-нитрофенилянтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение В] в виде кремового твердого вещества в количестве 1,0 г (94%. Данные ЯМР 1Н соединения приведены на фиг. 4. ЯМР 1Н (δ, CDCl3): 2,80-2,90 (м, 2, СН2СО), 3,20-3,87 (м, 186, ПЭГ, ДМТ-ОСН3), 4,25 (м, 2, СН2СО), 6,80-6,82 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-4. Получение соединения 2,5-диоксопирролидин-1-илэфира янтарной кислоты и 2-[бис-(4-диметокситритил)(полиэтиленгликоля] [соединение С]
Растворяли 500 мг (0,206 ммоль) соединения, полученного в примере 1-1-2, в 10 мл метиленхлорида и затем добавляли 83,14 мкл (1,03 ммоль) пиридина. К раствору ре