Вирусоподобные частицы, содержащие белки-мишени, слитые с белками оболочки растительных вирусов
Иллюстрации
Показать всеПредставленная группа изобретений касается вирусоподобной частицы и способов ее использования и получения. Предложенная вирусоподобная частица, по существу, не содержащая нуклеиновую кислоту вируса, сформирована из слитого белка, включающего белок оболочки растительного вируса и белок-мишень. Белок-мишень получен из полипептида клеточной поверхности внутриклеточного патогена, а белок оболочки растительного вируса выбирают из группы вируса мозаики люцерны, вируса мозаики сорго алеппского и Y-вируса картофеля. Иммуногенные составы, содержащие такие вирусоподобные частицы, могут быть введены в организмы пациентов для стимулирования защитных иммунных реакций. Способ создания вирусоподобных частиц включает операцию экспрессирования слитого белка в клетке-хозяине в условиях, которые обеспечивают возможность сборки вирусоподобной частицы из указанного слитого белка. Охарактеризованные изобретения позволяют воспроизводить желательную антигенную детерминанту или чужеродный пептид на поверхности вирусоподобной частицы, не содержащей нуклеиновую кислоту, для иммунизации. 6 н. и 18 з.п. ф-лы, 13 ил., 3 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке на патент испрашивается приоритет на основании предварительной заявки на патент США №61/243,774, поданной 18 сентября 2009 г. и предварительной заявки на патент США №61/348,069, поданной 25 мая 2010 г., содержание обоих из которых включено сюда в полном объеме путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Это изобретение относится, в общем, к области техники рекомбинантных вакцин. В частности, это изобретение относится к вирусоподобным частицам, содержащим белки-мишени, слитые с белками оболочки растительных вирусов, для использования в вакцинах, а также к способам создания вирусоподобных частиц.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Растительные вирусы могут являться эффективным средством для создания и доставки антигенов. Множество важных белковых антигенов было экспрессировано в трансгенных растениях, но уровень содержания созданного антигенного белка был относительно низким. В попытке преодолеть эту проблему были сконструированы белки оболочки растительных вирусов, действующие в качестве молекул-носителей для слитых антигенных пептидов, и использованы в системах транзиторной экспрессии. Потенциально может происходить самосборка белков оболочки, и они могут образовывать рекомбинантные вирусные частицы, которые отображают желательные антигенные детерминанты или чужеродные полипептиды на их поверхностях. Поскольку рекомбинантные вирусы реплицируются в цитоплазме, то желательные антигенные детерминанты или чужеродные полипептиды могут не быть представлены надлежащим образом собой вследствие неадекватной модификации на посттрансляционном уровне или неправильной укладки. Было продемонстрировано, что антигены, созданные в растениях в результате инфекции рекомбинантными вирусами табачной мозаики (TMV) или вирусами мозаики вигны китайской вызывают появление специфических антител, когда их вводят в организм мышей путем инъекции. Однако, в этих системах вирусы были неспособными образовывать сборку тогда, когда пептиды длиной более 25 аминокислот были слиты с белками их оболочки. В иной системе слияние полипептидов длиной до 4 7 аминокислот с белком оболочки вируса мозаики люцерны (A1MV) не подавлял вирусную сборку и результирующие вирусные частицы, содержащие нуклеиновые кислоты вируса, являлись эффективными иммуногенами. (Yusibov, V., et al., PNAS 94: 5784-5788, 1997). Совсем недавно был разработан способ присоединения функционального фрагмента белка А (133 аа) к С-концу белка оболочки TMV с использованием пептидного линкера 15-аа. Полученные в результате этого вирусные структуры были способны собираться в вирусные частицы, которые были способными инфицировать ткани листьев и перемещаться по всей этой ткани. (Werner, S., et al., PNAS 103: 17678-17683, 2006). Однако все эти системы создают инфекционные вирусные частицы, содержащие рибонуклеиновую кислоту (РНК) вируса. Использование таких частиц для стимулирования защитной иммунной реакции, то есть, в качестве вакцины, потребовало бы вакцинации пациента рибонуклеиновой кислотой (РНК) вируса, а также иммуногеном-мишенью.
Остается потребность в создании способов и материалов для воспроизведения желательной антигенной детерминанты или чужеродного полипептида на поверхности вирусоподобных частиц для иммунизации, где вирусоподобные частицы, по существу, не содержат нуклеиновую кислоту вируса.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В раскрытом предмете настоящего изобретения предложены вирусоподобные частицы, а также способы использования и получения вирусоподобных частиц.
Согласно одному из объектов настоящего изобретения, в нем предложена вирусоподобная частица. Вирусоподобная частица содержит слитый белок и, по существу, не содержит нуклеиновую кислоту, причем этот слитый белок содержит белок оболочки растительного вируса и белок-мишень. Вирусоподобная частица может быть создана в клетке-хозяине, выбранной из группы, состоящей из клеток бактерий, грибов, растений, насекомых, земноводных и млекопитающих. Белок-мишень может быть слит с N-концом белка оболочки растительного вируса.
Белок оболочки растительного вируса может быть получен из белка оболочки растительного вируса, выбранного из группы, состоящей из вируса мозаики люцерны, вируса мозаики сорго алеппского и Y-вируса картофеля.
Белок-мишень может быть получен из полипептида внутриклеточного патогена. Белок-мишень может быть получен из полипептида клеточной поверхности возбудителя тропической малярии Plasmodium falciparum, или полипептида гемагглютинина вируса гриппа. Вирусом гриппа может являться вирус гриппа А, выбранный из группы, состоящей из H1N1, H3N2, H5N1 и H7N7. Вирусом гриппа также может являться вирус гриппа В. Белок-мишень может содержать последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 4-11 и 4 9, и их антигенных фрагментов.
Согласно другому объекту настоящего изобретения, в нем предложен иммуногенный состав. Иммуногенный состав содержит вирусоподобную частицу. Иммуногенный состав может дополнительно содержать адъювант. Адъювант может быть выбран из группы, состоящей из солей алюминия, масляно-водяных эмульсий и адъювантов на основе сапонина. В некоторых вариантах осуществления изобретения белок оболочки растительного вируса получен из белка оболочки вируса мозаики люцерны, тогда как белок-мишень содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 4-11 и 4 9, и их антигенных фрагментов.
Предложен способ стимулирования защитной иммунной реакции на внутриклеточный патоген у пациента. Способ содержит следующую операцию: в организм пациента вводят иммунологически эффективное количество первого состава, содержащего первую вирусоподобную частицу, причем эта первая вирусоподобная частица содержит первый слитый белок и, по существу, не содержит нуклеиновую кислоту, а этот первый слитый белок содержит белок оболочки растительного вируса и первый белок-мишень, полученный из первого внутриклеточного патогена. В некоторых вариантах осуществления изобретения белок оболочки растительного вируса получен из белка оболочки вируса мозаики люцерны, тогда как первый белок-мишень содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 4-11 и 49, и их антигенных фрагментов. В каких-либо других вариантах осуществления изобретения этот состав дополнительно содержит адъювант.
Способ может содержать следующую дополнительную операцию: до введения в организм пациента первого состава в организм пациента вводят иммунологически эффективное количество второго состава, содержащего вторую вирусоподобную частицу, причем эта вторая вирусоподобная частица содержит второй слитый белок и, по существу, не содержит нуклеиновую кислоту, а этот второй слитый белок содержит белок оболочки растительного вируса и второй белок-мишень. Второй белок-мишень может быть получен из второго внутриклеточного патогена, который не является первым внутриклеточным патогеном. В некоторых вариантах осуществления изобретения первым внутриклеточным патогеном-мишенью может являться вирус гриппа, белок оболочки растительного вируса получен из белка оболочки вируса мозаики люцерны, первый белок-мишень содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 6-11, а второй белок-мишень содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 4, 5 и 49. В частности, первый и второй белки-мишени могут содержать последовательности аминокислот, соответственно, SEQ ID NOs: 6 и 4.
Также предложен способ создания вирусоподобной частицы в клетке-хозяине, содержащей нуклеотидную последовательность, кодирующую слитый белок, причем эта вирусоподобная частица содержит слитый белок и, по существу, не содержит нуклеиновую кислоту, а этот слитый белок содержит белок оболочки растительного вируса и белок-мишень. Способ содержит операцию экспрессирования слитого белка в клетке-хозяине в условиях, которые обеспечивают возможность сборки вирусоподобной частицы в клетке-хозяине. Способ может дополнительно содержать очистку вирусоподобной частицы от клетки-хозяина.
В некоторых вариантах осуществления изобретения клеткой-хозяином является клетка, выбранная из группы, состоящей из клеток бактерий, грибков, растений, насекомых, земноводных и млекопитающих. Когда клеткой-хозяином является растительная клетка, то способ может содержать следующую дополнительную операцию: растительную клетку инфицируют рекомбинантной бактерией, способной инфицировать растительную клетку, причем эта рекомбинантная бактерия содержит нуклеотидную последовательность, кодирующую слитый белок.
В некоторых других вариантах осуществления изобретения белок-мишень получен из внутриклеточного патогена.
В некоторых иных вариантах осуществления изобретения белок оболочки растительного вируса получен из белка оболочки вируса мозаики люцерны, и белок-мишень содержит последовательность аминокислот, выбранную из группы, состоящей из SEQ ID NOs: 4-11 и 4 9, и их антигенных фрагментов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
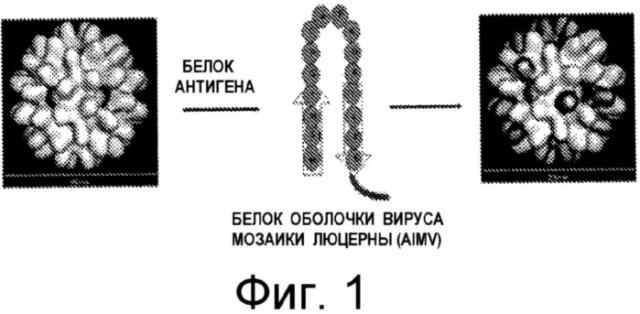
На Фиг.1 схематично проиллюстрировано слияние белка оболочки растительного вируса с белком-мишенью и проиллюстрирована самосборка слитого белка в вирусоподобную частицу.
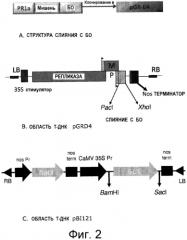
На Фиг.2 показано: (А) приведенная в качестве примера генная структура, содержащая слитый белок (структура слияния с белком оболочки (CP)) и сигнальная последовательность (PR1a); (В) клонирование структуры слияния с CP в вектор экспрессии pGR-D4; и (С) клонирование структуры слияния с CP в вектор экспрессии pBI121. RB и LB представляют собой правую и левую границы области, введенной в растительную клетку рекомбинантной агробактерией.
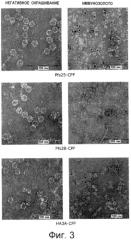
На Фиг.3 показаны полученные при помощи трансмиссионного электронного микроскопа микрофотографии вирусоподобных частиц, составленные из слитого белка, белка оболочки A1MV с белком-мишенью возбудителя тропической малярии Plasmodium falciparum Pfs25 (верхние изображения), Pfs28 (средние изображения) или вируса гриппа НА3А (нижние изображения). Вирусоподобные частицы были негативно окрашены (левые изображения) и помечены мечеными иммунозолотом антителами, характерными для каждого соответствующего белка-мишени (правые изображения). Масштабная шкала равна 100 нм или 200 нм, как помечено на микрофотографиях.
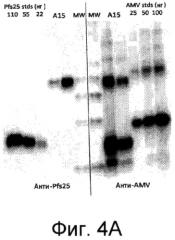
На Фиг.4А и Фиг.4В показаны иммуноблоты очищенных слитых белков белка оболочки A1MV, слитого с (A) Pfs25 или (В) НА3А. Правая половина каждого блота была инкубирована с антителом к A1MV. Левая половина каждого блота была инкубирована с моноклональным антителом к (A) Pfs25 или (В) НА3А. На Фиг.4С показан иммуноблот суммарного экстракта растительных белков, содержащих белок оболочки A1MV, слитый с непроцессированным гемагглютинином НАА, являющимся белком-мишенью, который экстрагирован при иных условиях для оценки растворимости. Блот реагировал с моноклональным антителом анти-НАА. TSP=общее количество растворимого белка; TSP-T=белок, экстрагированный при помощи вещества "Тритон"; TP=общее количество белка.
На Фиг.5А показаны иммунные ответы на вирус гриппа A/Anhui/1/05, сопровождающиеся выработкой иммуноглобулинов G (IgG), в образцах сыворотки мышей через 28 или 56 дней после иммунизации вирусоподобными частицами (ВПЧ), содержащими HA3A-CPF (аббревиатура "CPF" означает "слитый с белком оболочки", далее СБО) с адъювантом QUIL™ или ALHYDROGEL™ или без него, или НАА1 с QUIL™. На Фиг.5В показаны иммунные ответы, вызывающие торможение гемагглютинации (ТГ), в образцах сыворотки тех же самых мышей, что и на Фиг.5А.
На Фиг.6 показаны титры иммуноглобулинов G (IgG) в сыворотке мышей, собранной спустя 56 дней после иммунизации вирусоподобными частицами (ВПЧ), содержащими PfS25-CPF или Pfs28-CPF, с адъювантом QUIL А™ или ALHYDROGEL™ или без него.
На Фиг.7 показаны титры изотипа иммуноглобулинов G (IgG) против вируса гриппа A/Indonesia/5/05 в образцах сыворотки мышей, собранных спустя 35 дней после иммунизации вирусоподобными частицами (ВПЧ) HAI3-CPF или HAI1 с адъювантом ALHYDROGEL™ или без него, или только белком оболочки (БО).
На Фиг.8 показаны серологические иммунные ответы, вызывающие торможение гемагглютинации (ГА), в образцах сыворотки мышей после иммунизации вирусоподобными частицами (ВПЧ) HAI3-CPF или HAI1 с адъювантом ALHYDROGEL™ или без него, или только белком оболочки (БО).
На Фиг.9А и Фиг.9В показаны серологические иммунные ответы на вирус гриппа A/Anhui/1/05, вызывающие торможение гемагглютинации (ГА), в образцах сыворотки мышей после первичной вакцинации вирусоподобными частицами (ВПЧ) Pfs25-CPF или PBS с адъювантом ALHYDROGEL™ или без него, и вторичной вакцинации PBS или вирусоподобными частицами (ВПЧ) HA3A-CPF с адъювантом ALHYDROGEL™ или без него.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в общем, относится к вирусоподобным частицам (ВПЧ), содержащим слитый белок, который, по существу, не содержит нуклеиновой кислоты, и к способам использования и создания вирусоподобных частиц (ВПЧ).
Используемый здесь термин "вирусоподобная частица" или "ВПЧ", относится к нереплицирующейся оболочке вируса, полученной из вируса, например, из рассмотренного ниже растительного вируса. Вирусоподобные частицы (ВПЧ) обычно составлены, по меньшей мере, из одного вирусного белка (например, белка капсида, покрова, оболочки, поверхности или капсулы), который может спонтанно образовываться при экспрессии белка вируса во множество подходящих клеток-хозяев, например, в клетки бактерий, грибов, растений, насекомых, земноводных и млекопитающих. Наличие вирусоподобных частиц (ВПЧ) может быть обнаружено с использованием обычных способов, известных в данной области техники (например, электронной микроскопии, динамического рассеяния света и гель-хроматографии). Вирусоподобные частицы (ВПЧ) также могут быть выделены с использованием обычных способов, применяемых в данной области техники (например, центрифугирования в градиенте плотности, гель-хроматографии и аффинной хроматографии).
Термины "белок" и "полипептид" здесь используют как взаимозаменяемые, и они относятся к полимеру из аминокислотных остатков без ограничения по минимальной длине полимера. Определение включает в себя как непроцессированные белки, так и их фрагменты, а также их модификации (например, гликосилация, фосфориляция, удаления, добавления и замещения).
Используемый здесь термин "полученный из" относится к происхождению или к источнику и может включать в себя естественные, рекомбинантные, неочищенные или очищенные молекулы.
Используемый здесь термин "фрагмент" белка относится к полипептиду, имеющему ту же самую последовательность аминокислот, что и часть последовательности аминокислот белка, но не всю ее.
Используемый здесь термин "вариант" белка относится к полипептиду, имеющему ту же самую последовательность аминокислот, что и последовательность аминокислот белка, за исключением наличия, по меньшей мере, одной модифицированной аминокислоты, например, удаленной, введенной или замещенной. Этот вариант может иметь последовательность аминокислот, которая является, по меньшей мере, приблизительно, на 80%, 90%, 95%, или 99%, предпочтительно, по меньшей мере, приблизительно, на 90%, более предпочтительно, по меньшей мере, приблизительно, на 95% идентичной последовательности аминокислот белка.
Используемый здесь термин "антиген" относится к молекуле, содержащей один или большее количество эпитопов (линейных и/или конформационных), которые способны стимулировать иммунную систему пациента для создания гуморальной и/или клеточной антиген-специфической реакции. Термин "гуморальная иммунная реакция" относится к иммунной реакции, посредником которой являются антитела, созданные В-лимфоцитами, или В-клетками, тогда как термин "клеточная иммунная реакция" относится к иммунной реакции, посредником которой являются Т-лимфоциты, или Т-клетки, и/или иные белые кровяные тельца. В общем В-лимфоцитарный эпитоп содержит, по меньшей мере, около 5 аминокислот, но может содержать 3-4 аминокислоты, тогда как Т-лимфоцитарный эпитоп включает в себя, по меньшей мере, около 7-9 аминокислот, а эпитоп Т-клетки-помощника включает в себя, по меньшей мере, 12-20 аминокислот. Антиген может быть получен из белка (например, поверхностного белка) внутриклеточного патогенного организма или патогена.
Используемый здесь термин "иммуногенный состав" относится к составу, который содержит молекулу антигена и способен вызывать гуморальную и/или клеточную антиген-специфическую реакцию у пациента после введения состава в организм пациента.
Используемый здесь термин "пациент" относится к млекопитающему, предпочтительно человеку.
Подразумевают, что используемый здесь термин "около" ("приблизительно"), когда он относится к измеряемой величине, например, к количеству, процентному соотношению и т.п., охватывает собой отклонения от заданного значения на ±20% или на ±10%, более предпочтительно на ±5%, еще более предпочтительно на ±1%, а еще более предпочтительно на ±0,1%, когда такие отклонения являются уместными для выполнения раскрытых способов.
Согласно одному из объектов настоящего изобретения, в нем предложена вирусоподобная частица (ВПЧ). ВПЧ содержит слитый белок и, по существу, не содержит нуклеиновую кислоту, причем слитый белок содержит белок оболочки растительного вируса и белок-мишень. На Фиг.1 схематично продемонстрировано, что слияние белка-мишени с белком оболочки растительного вируса приводит к сборке ВПЧ, представляющей собой белок-мишень на поверхности ВПЧ. Белок оболочки растительного вируса может быть получен из белка оболочки любого вируса, способного к самосборке в частицы, по существу, не содержащие нуклеиновую кислоту. Белком оболочки растительного вируса может являться непроцессированный белок оболочки, функциональный фрагмент или вариант белка оболочки. Примерами пригодных белков оболочки растительных вирусов являются, в том числе, белки, полученные из белков оболочки вируса мозаики люцерны (A1MV-CP, CP (БО) или CPF (СБО)), Y-вируса картофеля (см. публикацию Stram, et al., Virus Research 28: 29-35, 2002) и вирус мозаики сорго алеппского (Jagadish, et al., J. Gen. Virol. 74: 893-896, 1993).
Последовательность аминокислот белка оболочки может быть генетически модифицирована для улучшения сборки частиц или иммуногенности. Аминокислоты белка оболочки могут быть удалены, вставлены или замещены, при условии, что результирующий вариант белка оболочки сохраняет способность организоваться в частицу в отсутствие нуклеиновой кислоты при его слиянии с белком-мишенью. Фрагмент или вариант белка оболочки является функциональным тогда, когда этот фрагмент или вариант способен самособираться в частицу, по существу, не содержащую нуклеиновую кислоту. Например, в белке, представленном как SEQ ID NО:1 отсутствует первый метионин (из инициирующего кодона) нативной последовательности A1MV-CP, и SEQ ID NO:2 является усеченным фрагментом последовательности A1MV-CP, в которой пропущены первые 25 аминокислот нативной последовательности белков.
Белки-мишени могут быть получены из любого желательного антигена или полипептида из любого источника. Они могут иметь, по меньшей мере, около 6, 10, 50, 100, 200, 300 или 500 аминокислот.
Предпочтительные белки-мишени получены из поверхностных белков внутриклеточных патогенных организмов, например, организмов бактерий, вирусов, грибов и паразитов, которые пригодны для использования в вакцинах. Примерами организмов-вирусов являются, в том числе, Plasmodium falciparum и вирусы гриппа. Вирусы гриппа включают в себя различные штаммы (например, H1N1, H3N2, H5N1, и H7N7) вирусов гриппа А и вирусов гриппа В. Белком-мишенью, полученным из поверхностного белка, может являться непроцессированный белок, его фрагмент или вариант. Например, белок-мишень может быть получен из полипептида клеточной поверхности Plasmodium falciparum или полипептида гемагглютинина вируса гриппа.
Для использования в вакцине предпочтительные фрагментами или вариантами являются те, которые являются антигенными, то есть, способными стимулировать защитную иммунную реакцию у пациента. Фрагменты или варианты имеют, по меньшей мере, около 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот по длине. В качестве белка-мишень может использоваться любой белок, фрагмент белка или вариант белка, при условии, что происходит самосборка частиц, по существу, не содержащих нуклеиновую кислоту, при их слиянии с белком оболочки растительного вируса. Некоторые примеры белков-мишеней описаны как SEQ ID NOs: 4-19 и 23-4 9 в перечне последовательностей.
Белок-мишень слияния может дополнительно содержать сигнальную последовательность для нацеливания слитого белка на конкретное место в клетке-хозяине (например, ER, хлоропласт) или для направления внеклеточной секреции слитого белка. Отсутствие сигнального пептида приводит к трансляции белков в цитоплазме. Может быть использована любая сигнальная последовательность, подходящая для клетки-хозяина, или сигнальная последовательность может быть опущена. Было установлено, что сигнальные последовательности сохраняются по типам и царствам, и, вообще говоря, может использоваться почти любая сигнальная последовательность. См. публикации Bennett and Scheller, PNAS 90: 2559-2563, 1993; Luirink and Sinning, Biochim. Biophys. Acta 1694: 17-35, 2005; Doudna and Batey, Ann. Rev. Biochem. 73: 539-557, 2004; Stern, et al., Trends in Cell and Mol. Biol. 2: 1-17, 2007. В одном из вариантов осуществления изобретения для экспрессии в растительной ткани предпочтительной сигнальной последовательностью является белок 1 (PR-1) (SEQ ID NО:3), связанный с патогенезом растения табак обыкновенный (Nicotiana tabacum).
Слитые белки могут быть созданы с использованием стандартных способов клонирования и молекулярной биологии, например, тех, которые описаны в примере 1. Приведенная в качестве примера структура, содержащая последовательности кодирования для белка оболочки растительного вируса и белка-мишени, может быть подготовлена и субклонирована в вектор экспрессии (см. Фиг.2). Белок-мишень может быть слит с белком оболочки растительного вируса непосредственно или косвенно (например, посредством пептидного линкера). Например, белок-мишень может быть слит с N-концом белка оболочки растительного вируса путем размещения последовательности кодирования для белка-мишени на конце 5' кодовой последовательности белка вируса растения (см. Фиг.2). Структура экспрессии может, но не обязательно, включать в себя сигнальную последовательность для направления локализации или секреции слитого белка. Вектор экспрессии может быть введен в подходящую систему экспрессии для экспрессии слитого белка в клетку-хозяина с использованием традиционных способов, известных в данной области техники (например, трансфекции, трансдукция, инфекции и электропорации). Может использоваться любая система экспрессии, подходящая для выбранной клетки-хозяина, включая штазмидные и вирусные векторы. Подходящими клетками-хозяевами могут являться, в том числе, клетки бактерий, млекопитающих, растений, грибов, земноводных и насекомых. Использование плазмидных и вирусных векторов для экспрессии слитых белков в растительных клетках описано в примерах 1-3. Для создания слитых белков также могут быть созданы трансгенные организмы. Подходящие векторы экспрессии и способы создания рекомбинантных белков и отделения и очистки рекомбинантных белков в этих системах-хозяевах являются известными в данной области техники и описаны, например, в серии изданий "Practical Approach", опубликованных издательством "Оксфорд Юниверсити Пресс" (Oxford University Press), которая включает в себя следующие публикации: Protein Expression, a Practical Approach, под редакцией S.J. Higgins и B.D. Hames, 1999; Molecular Plant Biology Vols. 1 and 2, под редакцией P.M. Gilmartin и С.Bowler, 2002; Protein Purification Techniques, A Practical Approach, под редакцией S. Roe, 2001; и в серии изданий "Methods in Molecular Biology/Medicine", опубликованных издательством "Хумана Пресс" (Humana Press), которая включает в себя следующие публикации: Transgenic Plants: Methods and Protocols, Leandro Pena, Ed., 2004; Baculovirus and Insect Cell Expression Protocols, под редакцией D.W. Murhammer, 2007; и Adenovirus Methods and Protocols, Vols. 1 and 2, под редакцией W.S.M. Wold и A.E. Tollefson, Eds., 2007. Под объем настоящего изобретения также подпадает изолированный полинуклеотид, который кодирует слитый белок, содержащий белок оболочки растительного вируса и белок-мишень. Полинуклеотиды могут быть получены любым соответствующим средством, известным в данной области техники. Например, нуклеотидная последовательность белка-мишени, его фрагмента или его варианта, или нуклеотидная последовательность белка оболочки, его фрагмента или его варианта может быть уже известной или может быть определена путем скрининга библиотеки и секвенирования потенциального белка-мишени или белка оболочки. В альтернативном варианте может быть выполнена обратная трансляция последовательности аминокислот конкретного слитого белка для получения надлежащих нуклеотидных последовательностей, и соответствующие нуклеотиды могут быть созданы синтетически.
Вирусоподобные частицы (ВПЧ) из настоящего изобретения являются особо полезными для представления антигена. Вирусоподобные частицы (ВПЧ) являются сильно иммуногенными. Кроме того, вирусоподобные частицы (ВПЧ), по существу, не содержат нуклеиновую кислоту. Например, эти частицы могут казаться пустыми при визуализации, например, методом трансмиссионной электронной микроскопии (ТЭМ) и методом негативного окрашивания. Эти частицы могут содержать менее чем, приблизительно, 10%, 5%, 1% или 0,1%, предпочтительно менее чем, приблизительно, 5%, более предпочтительно - менее чем, приблизительно, 1% нуклеиновой кислоты по массе. Соответственно, они обеспечивают безопасные и эффективные вакцины против вирусных, бактериальных, и эукариотических патогенов.
Предложен иммуногенный состав, содержащий вирусоподобные частицы (ВПЧ). Иммуногенный состав способен стимулировать иммунную реакцию (то есть, гуморальную и/или клеточную реакцию) на белок-мишень у пациента после введения состава в организм пациента. В некоторых вариантах осуществления изобретения белок-мишень получен из внутриклеточного патогена, и иммуногенный состав способен вызывать защитную иммунную реакцию на патоген после введения состава в организм пациента.
Иммуногенный состав может быть представлен в виде формулы как фармацевтические составы, содержащие эффективное количество вирусоподобных частиц (ВПЧ), фармацевтически приемлемый носитель, разжижитель и/или наполнитель. Термин "эффективное количество" относится к количеству вирусоподобных частиц (ВПЧ), необходимому для проявления поддающегося обнаружению иммуностимулирующего эффекта. Эффективное количество зависит от способа введения в организм, от свойств состава и от состояния пациента. Подходящим интервалом значений "эффективного количества" может являться интервал от, приблизительно, 0,001 до, приблизительно, 100 мкг (микрограмм) вирусоподобных частиц (или частиц слитого белка) на килограмм массы тела пациента. Подходящие носители, разжижители и наполнители являются известными в данной области техники и включают в себя солевой раствор, буферный солевой раствор, маннитол, L-гистидин, полисорбат 80, декстрозу, воду, глицерин, этанол и их сочетания, но эти примеры не являются ограничивающим признаком. Состав может содержать адъювант, но это не является обязательным условием. Подходящими адъювантами являются, в том числе, в себя соли алюминия (например, адъювант Alhydrogel™), масляно-водяные эмульсии и адъюванты на основе сапонина (адъювант Quil A™). Иммуногенный состав может быть составлен для орального, анального, трансдермального, назального, мукозального или парентерального введения в организм. Парентеральное введение включает в себя подкожную, внутримышечную, интраперитонеальную и внутривенную инъекцию.
Также предложен способ стимулирования защитной иммунной реакции на первый внутриклеточный патоген у пациента. Способ содержит следующую операцию: в организм пациента вводят первый иммуногенный состав, содержащий первую вирусоподобную частицу, причем эта первая вирусоподобная частица содержит первый слитый белок и, по существу, не содержит нуклеиновую кислоту, а первый слитый белок содержит белок оболочки растительного вируса и первый белок-мишень, полученный из первого внутриклеточного патогена. Этот состав может дополнительно содержать адъювант.
Этот способ может содержать следующую дополнительную операцию, которую выполняют до введения первого иммуногенного состава: в организм пациента вводят второй иммуногенный состав, содержащий вторую вирусоподобную частицу, причем эта вторая вирусоподобная частица содержит второй слитый белок и, по существу, не содержит нуклеиновую кислоту, а второй слитый белок содержит белок оболочки растительного вируса и второй белок-мишень. Второй белок-мишень может быть получен из второго внутриклеточного патогена, который не является первым внутриклеточным патогеном. В некоторых вариантах осуществления изобретения внутриклеточным патогеном-мишенью является штамм вируса гриппа, тогда как первый белок-мишень получен из иного внутриклеточного патогена (например, малярийного паразита Plasmodium falciparum) или иного штамма вируса гриппа. Например, патогеном-мишенью является вирус гриппа, белок оболочки растительного вируса получен из белка оболочки вируса мозаики люцерны, первый белок-мишень содержит последовательность аминокислот SEQ ID NО: 6, 7, 8, 9, 10 или 11, а второй белок-мишень содержит последовательность аминокислот SEQ ID NО: 4, 5 или 49.
Кроме того, предложен способ создания ВПЧ в клетке-хозяине. Способ содержит операцию включающую экспрессию слитого белка, который содержит белок оболочки растительного вируса и белок-мишень в клетке-хозяине, содержащий нуклеотидную последовательность, кодирующую слитый белок в тех условиях, которые обеспечивают возможность сборки вирусоподобной частицы (ВПЧ) в клетке-хозяине. Например, ВПЧ может быть собрана в растительной ткани через, приблизительно, 3-7 дней после того, как растение инфильтровано вектором экспрессии, несущим соответствующую структуру слияния. ВПЧ содержит слитый белок и, по существу, не содержит нуклеиновую кислоту. Способ может содержать дополнительную операцию очистки ВПЧ от клетки-хозяина. Подходящими клетками-хозяевами являются, в том числе, клетки бактерий, грибов, растений, насекомых, земноводных и млекопитающих. Нуклеотидная последовательность, кодирующая слитый белок, может быть интегрирована или может быть не интегрирована в геном клетки-хозяина. Когда клеткой-хозяином является растительная клетка, то способ может содержать дополнительную операцию инфицирования растительной клетки рекомбинантной бактерией, способной инфицировать растительную клетку (например, штаммами GV3101 опухолеобразующей агробактерии A. tumefaciens и другими инфекционныыми штаммами опухолеобразующей агробактерии A. tumefaciens, и инфекционными штаммами бактерии А. rhizogenes), где эта рекомбинантная бактерия содержит нуклеотидную последовательность, кодирующую слитый белок.
Подготовка и апробация приведенных в качестве примера слитых белков, содержащих белки-мишени, полученные из малярийного паразита Plasmodium falciparum, вируса гриппа A/Anhui/1/2005 (H5N1), и вируса гриппа A/Indonesia/5/2005 (H5N1), описаны в приведенных ниже примерах. Когда эти белки-мишени были слиты с белком оболочки A1MV, то сборка полученных в результате этого слитых белков происходила в очевидно пустые вирусоподобные частицы (ВПЧ). Эти частицы связывали антитела, специфические к A1MV и специфические к белкам-мишеням. Сыворотки мышей, иммунизированных вирусоподобными частицами (ВПЧ), содержащими белки-мишени малярии, создавали высокие титры антител, связанных с паразитом, и были способны предотвращать передачу паразита у комаров (см. таблицы 2 и 3). Мыши, иммунизированные вирусоподобными частицами (ВПЧ), содержащими белки гриппа, создавали защитные уровни титров антител, описанные в примерах 4 и 8, и показанные на Фиг.5, Фиг.7 и Фиг.8. Предсуществующий иммунитет к белку оболочки растительного вируса не являлся помехой для защитных уровней титров антител у мышей, иммунизированных вирусоподобными частицами (ВПЧ), содержащими тот же самый белок оболочки растительного вируса, который описан в примере 9 и показан на Фиг.9.
Пример 1. Построение гетерологичного вектора для экспрессии слитых белков A1MV-CP
Гены-мишени включали в себя белки клеточной поверхности, специфические для различных стадий полового развития малярийного паразита, P. falciparum, (Pfs25 (SEQ ID NO:4), Pfs28 (SEQ ID NO:5), и Pfs230 (SEQ ID NO: 49)), глобулярную область гемагглютинина (ГА) штамма (НА3А (SEQ ID NО:6)) вируса аньхойского (Anhui) гриппа, глобулярную область ГА штаммов (НА3С04 SEQ ID NO:7) и HA3C06 (SEQ ID NО:8)) вируса калифорнийского гриппа, глобулярную область ГА штаммов (HA3I (SEQ ID NО:11)) вируса индонезийского гриппа, непроцессированный ГА штамма (НАА или НАА1 (SEQ ID NО:9) аньхойского гриппа и непроцессированный ГА штамма (HAI или HAI1 (SEQ ID NО:10)) индонезийского гриппа. Каждый ген-мишень был клонирован с использованием стандартных методов молекулярной биологии как слияние N-конца с белком оболочки A1MV (A1MV-CP, CP (БО) или CPF (СБО)) или с оптимизированным белком оболочки (СРО, далее ОБО) A1MV, который закодирован кодирующей последовательностью, оптимизированной для экспрессии в растениях, в шаттл-вектор с рестрикционными ферментами Pad и BsmBI. На Фиг.2 показано приведенное в качестве примера построение структур слитых белков. Последовательности были проверены способом автоматизированного секвенирования.
Каждая последовательность БО-мишени была затем субклонирована в вектор экспрессии, который, возможно, но не обязательно, кодировал сигнальный пептид белка 1 (PR-1) (SEQ ID NО:3) растения, связанный с патогенезом. В частности, эта последовательность была субклонирована в сайты BamHI-SacI pBI121 (Clontech), или в сайты Pacl-Xhol pGRD4 (описанные в публикации Shoji, et al., Vaccine 27: 108701092, 2009). Стратегия клонирования показана на Фиг.2.
Пример 2. Инфильтрация растений векторами экспрессии, несущими структуры слияния
Векторы экспрессии, созданные в примере 1, затем были введены в штамм GV3101 опухолеобразующей агробактерии Agrobacterium tumefaciens, и результирующие бактерии были выращены за ночь на минимальной питательной среде. Была определена оптическая плотность культур, и штамм экспрессии белка был смешан со штаммом агробактерии, экспрессирующим супрессор р19 глушения белка в соотношении 4:1 до конечной оптической плотности (O.D.), равной 0,5. Раствор агробактерии был введен путем инфильтрации вручную в надземные части растений табак Бентхама (Nicotiana benthamiana) возрастом 6 недель, выращенных в почве, как описано ранее (в публикации Green, et al., Biotechnol. J. 4: 1-8, 2009).
Образцы растительной ткани были взяты через 3-7 дней постинфильтрации для определения уровней экспрессии и растворимости слитого белка. Образцы были взвешены, и общее количество растворимого белка было экстрагировано в трех объемах экстракционного буфера (100 миллимолей Na2HPO4, pH 7,1; 2,5 миллимоля этилендиаминтетрауксусной кислоты (EDTA), pH 8,0), экстракционного буфера плюс 0,5% вещества "Тритон-Х 100" (Triton-X 100) для экстрагирования суммарного растворимого белка с веществом "Тритон" или геля загрузочного буфера для экстрагирования суммарного белка. Белки были повторно растворены в 10%-ных для полиакриламидных гелях для электрофореза в присутствии додецилсульфата натрия (SDS-PAGE) и перенесены на PVDF-мембраны (мембраны из поливинилиденфторида). Уровни содержания слитого белка были оценены методом иммуноблот-анализа с поликлональным антителом кролика на A1MV путем сравнения со стандартом для AlMV или со специфическим антителом-мишенью и соответствующим стандартом. Репрезентативный иммуноблот показан на Фиг.4С. Были определены дни максимальной экспрессии и профили растворимости. В более крупном масштабе представляющие интерес структуры были инфильтрованы методом вакуум-инфильтрации в табак Бентхама (N. benthamiana), выращенный способом гидропоники, для экспрессии слитых белков.
Пример 3. Выделение и очистка вирусоподобных частиц
В день максимальной экспрессии листья были собраны и гомогенизированы в смесителе в трех объемах экстракционного фосфатного буфера с 0,5% вещества "Тритон Х-100" (Triton Х-100). Гомогенат размешивался в течение 30 минут при температуре 4°C, затем был подвергнут центрифугированию в течение 30 минут при 5000×g. Супернатант был отфильтрован через материал "мираклош" (miracloth) и подвергнут центрифугированию при 15000×g для 1 к 1,5 часам. Супернатант был осажден полиэтиленгликолем (ПЭГ), а затем снова был подвергнут центриф