Биолюминесцентный способ определения антиоксидантной активности вещества
Иллюстрации
Показать всеПредложен способ определения антиоксидантной активности вещества, предусматривающий приготовление контрольных проб, содержащих буферный раствор и биолюминесцентный сенсор, определения исходной интенсивности биолюминесценции. Добавляют в часть контрольных проб исследуемое вещество с получением рабочих проб. Уравнивают объемы контрольных и рабочих проб. Определяют интенсивность биолюминесценции контрольных и рабочих проб после их инкубации для определения токсичности исследуемого вещества. Добавляют в контрольные и рабочие пробы оксидант и определяют интенсивность биолюминесценции контрольных и рабочих проб с оксидантом после их инкубации для определения антиоксидантной активности исследуемого вещества. Изобретение позволяет определять антиоксидантную активность вещества с одновременным определением его токсичности с сокращением времени определения. 7 з.п. ф-лы, 1 ил., 1 пр.
Реферат
Изобретение относится к области медицины, пищевой промышленности и косметики, в частности к медицинской технологии и фармакологии, а именно к способам тестирования различных лечебных, пищевых и косметических препаратов антиоксидантного действия.
По растворимости антиоксиданты делятся на водорастворимые и жирорастворимые. Следует отметить, что до настоящего времени универсальные (т.е. позволяющие тестировать как водорастворимые, так и жирорастворимые антиоксиданты) способы определения антиоксидантной активности не получили распространения. Причем из существующих способов многие не позволяют определять токсичность антиоксидантов, что существенно для их применения в медицине и фармакологии.
Известен способ определения антиоксидантной активности веществ [1], при котором оценку антиоксидантной активности осуществляют по интенсивности хемилюминесценции реакции Фентона, путем спектральной оценки способности веществ подавлять появление OH-радикалов в реакции Фентона. Данный способ не позволяет определять токсичность исследуемого вещества, а также не позволяет тестировать жирорастворимые антиоксиданты, т.е. не универсален.
Известен хемилюминесцентный способ определения антиоксидантной активности вещества [2], состоящий из выделения макрофагов из животных, активации макрофагов, добавления люминола и исследуемого антиоксиданта, ингибирующего окисление люминола. Однако данный способ является трудоемким и дорогостоящим, а также не позволяет тестировать жирорастворимые антиоксиданты, т.е. не универсален.
Наиболее близким техническим решением является биолюминесцентный способ определения антиоксидантной активности вещества [3], состоящий из приготовления рабочей и контрольной биолюминесцентных проб, причем для приготовления контрольной пробы используют буферный раствор, а для приготовления рабочей пробы - буферный раствор с добавлением растворителя с исследуемым веществом, с последущим добавлением оксиданта в рабочую и контрольную пробы, регистрации интенсивности биолюминесценции и по ее интенсивности судят об антиоксидантной активности вещества. Однако этот способ предназначен для определения антиоксидантной активности только гуминовых веществ, что не позволяет ему быть универсальным, т.е. определять антиоксидантную активность, всех веществ как водорастворимых, так и жирорастворимых веществ, к тому же для осуществления данного способа требуются достаточно редкие, а значит дефицитные и дорогие вещества.
Задачей технического решения является расширение возможностей (универсализация) биолюминесцентного способа определения антиоксидантной активности различных веществ как водорастворимых, так и жирорастворимых и определения их токсичности, а также упрощения и удешевления измерений.
Технический результат состоит в том, что заявленный способ позволяет определять антиоксидантные свойства и токсичность широкого круга исследуемых веществ, т.е. позволяет быть универсальным, кроме того, он дешев и прост в применении.
Данное техническое решение обеспечивается тем, что в известном биолюминесцентном способе определения антиоксидантной активности веществ, включающем приготовление рабочей пробы, содержащей буферный раствор, биолюминесцентный сенсор и исследуемое вещество, растворенное в растворителе и контрольной пробы, содержащей буферный раствор и биолюминесцентный сенсор, причем для уравнивания объемов рабочей и контрольной проб в контрольную пробу добавляют растворитель в объеме, равном растворителю с исследуемым веществом, добавление в контрольную и рабочую пробы оксиданта и регистрацию интенсивности биолюминесценции проб, по которым судят об антиоксидантной активности вещества, согласно изобретению определяют токсичность исследуемого вещества, для чего дополнительно приготавливают контрольную и рабочую пробы, инкубируют их и регистрируют интенсивности биолюминесценции проб, по которым судят о токсичности вещества, а при определении антиоксидантной активности вещества после добавления оксиданта рабочую и контрольную пробы инкубируют, причем биолюминесцентные пробы содержат суспензию светящихся микроорганизмов, а в качестве оксиданта используют озонированное растительное масло.
Кроме того, антиоксидантную активность вещества и его токсичность определяют одновременно, что сокращает время измерения.
Кроме того, токсичность рассчитывают по формуле Τ=I30a/I30к, где I30a - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления рабочей пробы и I30к - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления контрольной пробы, что позволяет количественно оценить степень токсичности исследуемого вещества.
Кроме того, величину антиоксидантной активности рассчитывают по формуле А=Io 30a/Io 30к, где Io 30a - светимость рабочей пробы через 30 минут после добавления оксиданта, Io 30к - светимость контрольной пробы через 30 минут после добавления оксиданта, что позволяет количественно оценить степень антиоксидантной активности исследуемого вещества.
Кроме того, растительным маслом является льняное масло, которое из-за высокого содержания непредельных жирных кислот эффективно образует с озоном озониды и пероксиды, выступающие в роли оксиданта, а также является доступным и дешевым.
Кроме того, в качестве светящихся микроорганизмов берут светящийся штамм E.coli, что позволяет экспрессно исследовать антиоксидантную активность вещества и его токсичность в условиях, приближенных к физиологическим (pH=7,4, 0.9% NaCl).
Кроме того, растворителем исследуемого вещества является вода, что позволяет исследовать любые водорастворимые вещества.
Кроме того, растворителем исследуемого вещества является масло, что позволяет исследовать любые жирорастворимые вещества.
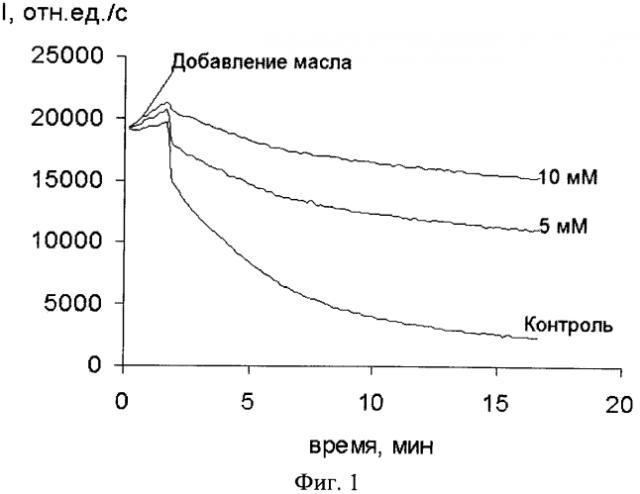
Изобретение иллюстрируется графиком (см. фигуру), где показано влияние аскорбиновой кислоты на биолюминесценцию суспензии светящихся бактерий E.coli после добавления льняного масла, озонированного 20 минут. По оси абсцисс отложено время в минутах, по оси ординат - светимость I, в относительных единицах в секунду. Представлено три кривые, из которых одна показывает светимость контрольной пробы, две другие - светимость рабочей пробы при различной концентрации (5 и 10 мМ). На графике представлены кинетики светимостей рабочих и контрольных проб, отражающие процесс взаимодействия оксиданта с водорастворимым антиоксидантом (аскорбиновая кислота) и биосенсором (E.coli). Из графика видно, что присутствие антиоксиданта в рабочей пробе уменьшает токсическое влияние оксиданта на светимость биосенсора (в зависимости от дозы антиоксиданта), так, при 10 мМ уменьшение светимости меньше, чем при 5 мМ. Очевидно, что добавление раствора жирорастворимого антиоксиданта в льняном масле к оксиданту - озонированному льняному маслу, также уменьшит его активность и, следовательно, влияние на светимость биосенсора.
Способ применяется следующим образом.
Для исследования токсичности выполняют следующие операции.
1). Готовят рабочую пробу, содержащую буферный раствор, биолюминесцентный сенсор, который состоит из суспензии микроорганизмов, например светящийся штамм бактерий E.coli, при этом добавляют некий объем раствора с исследуемым на антиоксидантную активность веществом, растворенным в растворителе, которым может быть как вода, так и масло (в зависимости от вида исследуемого вещества - водорастворимого или жирорастворимого). Также готовят контрольную пробу, содержащую буферный раствор и биолюминесцентный сенсор, в которую для уравнивания объемов рабочей и контрольной проб добавляют растворитель (воду или масло) в объеме, равном растворителю в котором растворено исследуемое вещество.
2). Рабочую и контрольную пробы инкубируют в течение 30 мин.
3). Измеряют светимость I30a рабочей пробы и светимость I30к контрольной пробы.
4). По отношению Τ=I30a/I30к рассчитывают токсичность, где I30a - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления рабочей пробы и I30к - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления контрольной пробы. В случае получения Τ<1, исследуемое вещество считается токсичным и дальнейшие исследования прекращаются. В случае Τ≥1 исследование продолжается для определения антиоксидантной активности исследуемого вещества.
Для исследования антиоксидантной активности выполняют следующие операции.
1). Готовят рабочую пробу, содержащую буферный раствор, биолюминесцентный сенсор, который состоит из суспензии микроорганизмов, например светящийся штамм бактерий E.coli, при этом добавляют некий объем раствора с исследуемым на антиоксидантную активность веществом, растворенным в растворителе, которым может быть как вода, так и масло (в зависимости от вида исследуемого вещества - водорастворимого или жирорастворимого). Также готовят контрольную пробу, содержащую буферный раствор и биолюминесцентный сенсор, в которую для уравнивания объемов рабочей и контрольной проб добавляют растворитель (воду или масло) в объеме, равном растворителю, в котором растворено исследуемое вещество. При этом в контрольную и рабочую пробы добавляют оксидант, которым является озонированное растительное масло, например льняное масло.
2). Рабочую и контрольную пробы инкубируют в течение 30 мин, т.к. этому времени соответствует цикл деления бактерий E.coli. При большем времени появившиеся новые бактерии внесут ошибку при определении светимости, а при меньшем светимость еще не достигнет постоянных значений, что и иллюстрируется на фигуре.
3). Измеряют светимость Io 30a рабочей пробы и светимость Io 30к контрольной пробы.
4). По отношению A=Io 30a/Io 30к судят об антиоксидантной активности вещества, которая тем больше, чем А>1, что отображают кривые, приведенные в прилагаемой фигуре. Из которой видно, что исследуемое вещество (аскорбиновая кислота) обладает антиоксидантной активностью, т.к. по сравнению с контролем рабочая проба (5 или 10 мМ аскорбиновой кислоты) имеет в несколько раз большую светимость, причем при большей концентрации антиоксиданта светимость выше. В данном исследовании все вещества, в том числе и оксидант, могут вноситься в пробы одновременно. Для ускорения исследований определение токсичности исследуемого вещества и определение антиоксидантной активности исследуемого вещества выполняются одновременно.
Пример конкретного применения
Перед исследованиями определяют исходную светимость биолюминесцентного сенсора Ιο, по которой с помощью прибора «Биотокс-7» судят о пригодности суспензии светящихся бактерий E.coli для дальнейших исследований. Для водорастворимых антиоксидантов предлагаемый способ состоит из последовательности следующих операций:
1). Перед опытом путем барботирования озонированного воздуха от бытового озонатора «Гроза» готовится оксидант путем озонирования льняного масла, т.к. оно содержит большое количество непредельных жирных кислот, а при их озонировании образуются озониды - продукты присоединения озона к непредельным углеводородам, которые при контакте с водой гидролизуются с образованием перекиси водорода и других активных форм кислорода, токсичных для бактерий и подавляющих их свечение.
2). Биолюминесцентный сенсор - суспензия светящихся бактерий E.coli готовится растворением лиофилизированных бактерий E.coli в фосфатно-солевом буферном растворе с pH=7,4 и температурой +10°C, выдерживанием полученной суспензии при +10°C в течение 30 минут и последующим выдерживании при комнатной температуре (20÷23°C) в течение 60 минут. В рабочую пробу входит суспензия светящихся бактерий E.coli в буферном растворе, к которой добавляется по 50 мкл раствора аскорбиновой кислоты в воде с концентрацией 5 мМ и 10 мМ. В контрольную пробу входит суспензия светящихся бактерий E.coli в буферном растворе, к которой добавляется 50 мкл воды и выдерживается одновременно с рабочей пробой. А для исследования жирорастворимого вещества, например α-токоферола, к контрольной пробе добавляется 200 мкл льняного масла, а к рабочей - 200 мкл льняного масла с исследуемым веществом, таким образом, растворителем для водорастворимого вещества является вода, а для жирорастворимого вещества растворителем является льняное масло.
3). Для проверки исследуемого водорастворимого вещества на токсичность в пластиковые пробирки объемом 1,5 мл наливают по 200 мкл биолюминесцентной пробы. Затем в контрольную пробу добавляют 50 мкл буферного раствора, а в рабочую пробу 50 мкл водного раствора исследуемого вещества и через 30 минут с помощью прибора «Биотокс-7» определяют интенсивность их биолюминесценции. Токсичность рассчитывается по формуле: Τ=I30a/I30к, где I30a - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления рабочей пробы и I30к - светимость суспензии светящихся микроорганизмов через 30 минут после приготовления контрольной пробы. Для жирорастворимого исследуемого вещества к контрольной пробе добавляется 200 мкл льняного масла, а к рабочей пробе добавляется 200 мкл льняного масла с исследуемым веществом (α-токоферолом). Через 30 минут с помощью прибора «Биотокс-7» определяют интенсивность их свечения. Токсичность рассчитывается по приведенной выше формуле. При светимости рабочей пробы ниже контрольной исследуемое вещество считается токсичным.
4). Для проверки водорастворимого исследуемого вещества на антиоксидантную активность повторяют п. 3) с добавлением 200 мкл оксиданта (озонированного льняного масла) в рабочую и контрольные пробы и через 30 минут с помощью прибора «Биотокс-7» определяют интенсивность их биолюминесценции. Измеряют светимость Io 30a рабочей пробы и светимость Io 30к контрольной пробы и по отношению A=Io 30a/Io 30к судят об антиоксидантной активности вещества. Для жирорастворимого исследуемого вещества к контрольной пробе добавляется 100 мкл льняного масла и 100 мкл оксиданта (озонированного льняного масла), а к рабочей пробе добавляется 100 мкл льняного масла с исследуемым веществом и 100 мкл оксиданта и через 30 минут с помощью прибора «Биотокс-7» определяют интенсивность их светимости. При светимости рабочей пробы выше контрольной исследуемое вещество считается антиоксидантом.
Таким образом, описанный способ позволяет определять токсичность и антиоксидантную активность как водорастворимых, так и жирорастворимых веществ. Кроме того, для определения антиоксидантной активности используется стандартное недорогое оборудование, доступные реактивы и препараты, а сами манипуляции просты и не требуют высокой квалификации персонала и больших временных затрат.
Литература
1. Патент России №2163021, G01N 33/483. Способ определения антиокислительной активности вещества.
2. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, под редакцией Хабриева Р.У., М., 2005.
3. Патент России №2376380, C12Q 1/00, Биолюминесцентный способ определения антиоксидантной активности гуминовых веществ.
1. Биолюминесцентный способ определения антиоксидантной активности вещества, состоящий из приготовления контрольных проб, содержащих буферный раствор и биолюминесцентный сенсор, определения исходной интенсивности биолюминесценции, добавления в часть контрольных проб исследуемого вещества с получением рабочих проб, уравнивания объемов контрольных и рабочих проб, определения интенсивностей биолюминесценции контрольных и рабочих проб после их инкубации для определения токсичности исследуемого вещества, добавления в контрольные и рабочие пробы оксиданта, определения интенсивностей биолюминесценции контрольных и рабочих проб с оксидантом после их инкубации для определения антиоксидантной активности исследуемого вещества.
2. Способ по п. 1, отличающийся тем, что биолюминесцентным сенсором является суспензия светящихся бактерий.
3. Способ по п. 1, отличающийся тем, что в качестве оксиданта используют озонированное растительное масло.
4. Способ по п. 1, отличающийся тем, что антиоксидантную активность исследуемого вещества и его токсичность определяют одновременно.
5. Способ по п. 1, отличающийся тем, что величину токсичности рассчитывают по формуле Т=(I0-I30а)/(I0-I30к), где I0 - исходная интенсивность биолюминесценции пробы, I30а - светимость рабочей пробы через 30 минут после ее приготовления и I30к - светимость контрольной пробы через 30 минут после ее приготовления.
6. Способ по п. 1, отличающийся тем, что величину антиоксидантной активности рассчитывают по формуле , где I0 - исходная интенсивность биолюминесценции пробы, - светимость рабочей пробы через 30 минут после добавления оксиданта, - светимость контрольной пробы через 30 минут после добавления оксиданта.
7. Способ по п. 2, отличающийся тем, что светящимися бактериями являются светящиеся бактерии E.coli.
8. Способ по п. 3, отличающийся тем, что растительным маслом является льняное масло.