Способ оценки биосовместимости скаффолдов
Иллюстрации
Показать всеИзобретение относится к медицине, биологии, ветеринарии, фармакологии и касается оценки биосовместимости скаффолдов в эксперименте. Проводят подкожную имплантацию скаффолда в межлопаточную область крысы. При этом перед имплантацией скаффолда крысе в качестве инструментального исследования проводят лазерную допплеровскую флоуметрию микрокровотока (ЛДФ), определяя показатель перфузии. Используя спектральный вейвлет-анализ, нормированные амплитуды эндотелиальных, нейрогенных и миогенных колебаний микрокровотока, принимают полученные результаты за исходный уровень. Имплантируют скаффолд в форме диска диаметром порядка 15 мм, толщиной порядка 0,1 мм. Затем трехкратно на 7, 14, 21 сутки после имплантации проводят ЛДФ микрокровотока кожи над областью имплантации с определением указанных показателей. Анализируют результаты, сравнивая их с показателями исходного уровня. Скаффолд считают биосовместимым, если повышение показателя перфузии сопровождается сдвигом нормированных амплитуд нейрогенных и миогенных колебаний кровотока на 7-е сутки после имплантации и показатели нормированных амплитуд полностью нормализуются к 14-м суткам, а полное восстановление показателя перфузии наблюдается к 21-м суткам после имплантации. Способ обеспечивает динамическую оценку биосовместимости скаффолдов в эксперименте при использовании малого числа лабораторных животных. 3 пр., 3 табл.
Реферат
Изобретение относится к медицине, биологии, ветеринарии, фармакологии и может быть использовано при оценке биосовместимости скаффолдов, используемых в тканевой инженерии при пластике или замещении дефектов тканей организма с обеспечением стимуляции их регенерации.
В настоящее время в связи с увеличивающимся объемом разработок новых материалов и скаффолдов из них, готовящихся к выходу на рынок, особое значение приобретает разработка методов оценки биосовместимости скаффолдов, на заселение клетками которых влияет множество факторов, в частности иммунологические и биомеханические свойства материала, пористость скаффолда и другие.
Известен способ определения биосовместимости таких материалов, как гемосорбенты [авторское свидетельство SU на изобретение №1176249], включающий инкубацию адсорбента со стандартной лейковзвесью донора с добавлением раствора нитросинеготетразолия в конечной концентрации 2-4 мг/мл, приготовление мазков и определение числа нейтрофилов, имеющих отложения диформазона. По соотношению числа нейтрофилов, имеющих отложения диформазона до и после инкубации с гемосорбентом, судят о его биосовместимости с кровью.
Однако технические особенности выполнения способа, а именно его проведение в условиях in vitro, не позволяет оценивать биосовместимость в динамике и с учетом иммунных реакций в условиях целого организма.
Известен также способ оценки биосовместимости материалов, в частности стоматологических полимерных пломбировочных [патент RU на изобретение №2477487]. До начала лечения у пациента осуществляют взятие ротовой жидкости в количестве не менее 6 мл, из которых 2 мл остаются в качестве контроля, оставшиеся 4 мл разделяют поровну на 2 порции по 2 мл и инкубируют в течение 30 мин с навесками по 30 мг, предварительно полимеризованных в течение 40 с изучаемых полимерных пломбировочных материалов. Затем исследуют все пробы ротовой жидкости, включая контрольную на спектрометре после извлечения навесок, определяя активность α-амилазы и лактатдегидрогеназы, и по степени изменения активности ферментов ротовой жидкости в сравнении с контролем судят о биосовместимости полимерного пломбировочного материала.
Однако данный способ ориентирован на оценку биосовместимости пломбировочных материалов, которые обладают специфичными характеристиками, в связи с чем применение его на других материалах, а именно имплантированных в ткани, ставится под сомнение.
Известен также способ определения биосовместимости инородного материала с организмом [патент RU на изобретение №2402773], включающий отбор исследуемого материала у индивидуума, добавление непосредственно в клеточную субстанцию инородного материала в виде порошка с размером частиц от 0,5 до 1 мм3 в количестве 500 мкг и определение цитохимических показателей ферментативной активности клеток до и после внесения в клеточную субстанцию инородного материала.
Однако все вышеуказанные способы и аналогичные им, основанные на использование клеточных культур, не предусматривают оценку иммунной реакции целого организма и динамики реакций на имплантацию.
Наиболее близким аналогом к заявляемому изобретению является способ оценки биосовместимости скаффолдов [Robocasting nanocomposite scaffolds of poly(caprolactone)/hydroxyapatite incorporating modified carbon nanotubes for hard tissue reconstruction. Dorj B, Won JE, Kim JH, Choi SJ, Shin US, Kim HW. J Biomed Mater Res A. 2013 Jun; 101(6):1670-81]. Производят гетеротопическую имплантацию скаффолда экспериментальным животным в подкожную клетчатку холки крыс. Оценивают биосовместимость скаффолда путем исследования гистологических препаратов биоптатов тканей, полученных из области имплантации скаффолдов у экспериментальных животных.
Однако при использовании данного способа для оценки динамики реакций организма на имплантированный скаффолд возникает необходимость в большом числе животных. Кроме того, морфологические методы оценки результатов имплантации являются полуколичественными, что затрудняет сравнение биосовместимости различных скаффолдов и требует стандартизации.
Задачей заявляемого изобретения является возможность выполнения динамической оценки биосовместимости скаффолдов при обеспечении использования малого количества лабораторных животных.
Сущность заявляемого изобретения характеризуется тем, что в способе оценки биосовместимости скаффолдов крысам проводят лазерную допплеровскую флоуметрию микрокровотока, обеспечивая закрепление световодного зонда на коже в межлопаточной области, определяют показатель перфузии и посредством спектрального вейвлет-анализа нормированные амплитуды эндотелиальных, нейрогенных и миогенных колебаний микрокровотока, принимают полученные результаты за исходный уровень, затем выполняют подкожную имплантацию в межлопаточную область крысы скаффолда в форме диска диаметром порядка 15 мм, толщиной порядка 0,1 мм; на 7, 14, 21 сутки после имплантации кратно проводят лазерную допплеровскую флоуметрию микрокровотока кожи над областью имплантации скаффолда с определением вышеуказанных параметров; анализируют полученные результаты, сравнивая их с исходным уровнем, и при повышении перфузионного показателя оценивают биосовместимость скаффолда обратно пропорционально изменению нормированной амплитуды миогенных колебаний микрокровотока.
Технический результат заявляемого способа заключается в решении вышеуказанной задачи. Такой технический прием, как использование для оценки биосовместимости скаффолдов лазерной допплеровской флоуметрии, позволяет проводить кратную оценку в различные сроки после имплантации скаффолда у одного животного, избежав увеличения их количества. В наиболее близком аналоге при осуществлении динамической оценки требуется умерщвление животных с целью забора морфологического материала в каждый период наблюдения, что также влияет и на результативность оценки биосовместимости, а именно снижение точности, из-за несопоставимости полученных данных у разных особей животных.
Применение для оценки биосовместимости совокупности исследуемых параметров, в частности изменение перфузионного показателя и величины изменения нормированной амплитуды миогенных колебаний микрокровотока, позволяет повысить точность полученных результатов.
Использование величины изменения нормированной амплитуды миогенных колебаний микрокровотока позволяет количественно охарактеризовать биосовместимость, что определяет преимущество заявляемого способа при необходимости сравнения биосовместимости различных скаффолдов.
Использование заявляемого способа не требует приготовления морфологических препаратов и позволяет избежать, в отличие от аналогов, значительных затрат на расходные материалы.
Способ оценки биосовместимости скаффолдов используют следующим образом.
Белым крысам проводят лазерную допплеровскую флоуметрию ЛДФ микрокровотока кожи с помощью компьютеризированного лазерного анализатора микроциркуляции крови, например «ЛАКК-ОП» (производство НПП «Лазма», Россия), в течение не менее 7 минут, обеспечивая закрепление световодного зонда на коже в межлопаточной области - в области холки. При этом определяют, например с помощью программы LDF 3.0.2.395, показатель перфузии M в перфузионных единицах (перф. ед.) и с помощью спектрального вейвлет-анализа нормированные амплитуды эндотелиальных (0.01-0.076 Гц), нейрогенных (0.076-0.2 Гц) и миогенных (0.2-0.74 Гц) колебаний микрокровотока. Принимают полученные результаты за исходный уровень. Выполняют подкожную имплантацию в межлопаточную область крысы скаффолда в форме диска диаметром порядка 15 мм и толщиной порядка 0,1 мм. На 7, 14, 21 сутки после имплантации кратно проводят лазерную допплеровскую флоуметрию микрокровотока кожи над областью имплантации скаффолда с определением вышеуказанных параметров в тех же диапазонах, являющихся для осуществления исследований на лабораторных животных - крысах - стандартными. Анализируют полученные результаты, сравнивая их с исходным уровнем. При повышении перфузионного показателя оценивают биосовместимость скаффолда обратно пропорционально изменению нормированной амплитуды миогенных колебаний микрокровотока. При отсутствии повышения перфузионного показателя скаффолд считают биосовместимым.
Заявляемый способ был апробирован при оценки биосовместимости скаффолдов на основе поликапролактона ПКЛ и гидроксиаппатита ГА на 30 лабораторных белых крысах-самцах массой 200-250 г. Животные были разделены на 3 группы: 1-я группа включала ложнооперированных крыс, 2-я группа - крысы, которым проводилась имплантация в рану скаффолда на основе поликапролактона с адсорбированным на нем чужеродным белком (скаффолд, не обладающий биосовместимостью), 3-я группа - крысы, которым проводилась подкожная имплантация комбинированного скаффолда на основе поликапролактона и гидроксиапатита (соотношение компонентов ПКЛ/ГА 78,2/22,8%). Регистрация ЛДФ-грамм, осуществлялась на 7, 14, 21 сутки после имплантации. В качестве контроля использовались записи ЛДФ-грамм выполненные у животных первой группы до хирургического вмешательства (интактные животные), т.е. до имплантации скаффолда.
При проведении экспериментов на животных соблюдались этические принципы в соответствии с Женевской конвенцией (Geneva, 1990). Всем животным за 5 минут до проведения манипуляций вводилась внутримышечно комбинация золетила («VirbacSanteAnimale», Франция) в дозе 0,1 мл/кг и ксилазина («lnterchemie», Нидерланды) в дозе 1 мг/кг для достижения наркоза.
Во второй и третьей группах белым крысам в межлопаточной области (в области холки) проводилась подкожная имплантация скаффолда в форме диска диаметром 15 мм, толщиной 0,1 мм по методике, аналогичной изложенной в работе Robocasting nanocomposite scaffolds of poly(caprolactone)/hydroxyapatite incorporating modified carbon nanotubes for hard tissue reconstruction. Dorj B, Won JE, Kim JH, Choi SJ, Shin US, Kim HW. J Biomed Mater Res A. 2013 Jun; 101(6):1670-81. У животных первой группы проводили хирургическое вмешательство с формированием подкожного кармана и последующим наложением кожных швов, но без имплантации скаффолда.
Крысам проводили лазерную допплеровскую флоуметрию (ЛДФ) с помощью компьютеризированного лазерного анализатора микроциркуляции крови «ЛАКК-ОП» (производство НПП «Лазма», Россия) с использованием программы LDF 3.0.2.395. Световодный зонд фиксировали на коже в межлопаточной области крысы. Длительность записи составляла 8 минут. На первом этапе исследования рассчитывали показатель перфузии (М) в перфузионных единицах (перф. ед.), на втором этапе с помощью спектрального вейвлет-анализа проводили определение нормированных амплитуд эндотелиальных (0.01-0.076 Гц), нейрогенных (0.076-0.2 Гц) и миогенных (0.2-0.74 Гц) колебаний микрокровотока (HumeauA., KoitkaA., AbrahamP. et. al. Time-frequency analysis of laser Doppler flowmetry signals recorded in response to a progressive pressure applied locally on anaesthetized healthy rats. Phys. Med. Biol. 2004. V. 49. №5. P. 843-857).
Для верификации использовали морфологические методы оценки состояния мягких тканей области имплантации на 21 сутки. Микропрепараты тканей области имплантации готовили по стандартной методике, окрашивали гематоксилином и эозином. Исследование препаратов проводили при помощи микроскопа AxioImager Z2 (производство CarlZeiss, Германия).
Статистическую обработку данных осуществляли средствами программ MS Excel 2013 и Statistica 10.0. Большинство наших данных имели распределение, отличное от нормального, поэтому при сравнении групп использовали U-критерий Мана-Уитни.
Пример 1. Использование заявляемого способа у животных, которым не проводилась имплантация скаффолда.
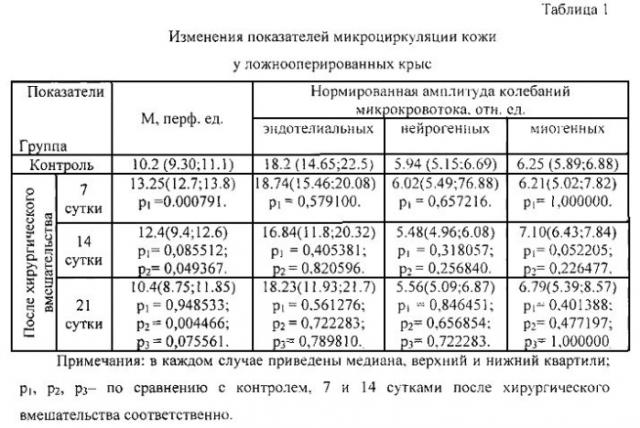
Полученные данные свидетельствуют о том, что у животных, подвергнутых хирургическому вмешательству без имплантации скаффолда, происходит умеренное (не более 30% от уровня контроля) повышение перфузионного показателя, максимально выраженное на 7 сутки эксперимента и сопровождающееся минимальными изменениями нормированных амплитуд эндотелиальных, нейрогенных и миогенных колебаний, которые не достигают статистической значимости (Таблица 1). Выявленные изменения исследуемых параметров у ложнооперированных животных обратимы полностью и исчезают к 14-му дню эксперимента.
Таким образом, данный пример иллюстрирует то, что у животных в ответ на хирургическое вмешательство возникают изменения перфузионного показателя. Это ограничивает возможность оценки биосовместимости только по перфузионному показателю.
Пример 2. Использование заявляемого способа при имплантации скаффолда, не обладающего биосовместимостью.
Обнаружено, что изменения кровотока кожи над областью имплантации скаффолда, содержащего чужеродный белок и не обладающего биосовместимостью, проявляются увеличением перфузионного показателя в 2 раза относительно контрольных данных в период с 7-х по 21-е сутки эксперимента (Таблица 2). Повышение перфузии сопровождается увеличением нормированных амплитуд миогенных и нейрогенных колебаний на фоне отсутствия изменений амплитуд эндотелиальных колебаний микрокровотока. Следовательно. изменения микроциркуляции кожи при подкожной имплантации скаффолдов, не обладающих биосовметимостью, проявляются выраженной и стойкой гиперемией, которая может быть зарегистрирована с помощью ЛДФ в период с 7 по 21 сутки.
Для верификации результатов исследования у животных проводилось морфологическое исследование тканей области имплантации, которые подтвердили, что скаффолд на основе ПКЛ, содержащий чужеродный белок, не обладает биосовместимостью.
Пример 3 Использование заявляемого способа при имплантации скаффолдана основе поликапролактона и гидроксиаппатита.
Показатель перфузии кожи над областью имплантации скаффолда на основе ПКЛ и ГА статистически значимо увеличен на 7-е и 14-е сутки эксперимента (Таблица 3). Однако, выраженность сдвигов перфузионного показателя не превышает таковые у ложнооперированных животных (см. Таблица 1). Повышение перфузионного показателя сопровождается сдвигом нормированных амплитуд нейрогенных и миогенных колебаний микрокровотока на 7-е сутки после имплантация скаффолда, что отражает снижение тонуса артериол и прекапилляров. При этом активная модуляция кровотока полностью нормализуется к 14-м суткам, а полное восстановление показателя перфузии наблюдается к 21-м суткам от начала эксперимента (Таблица 3). Следовательно, у животных отмечаются умеренно выраженные воспалительные изменения микроциркуляции кожи только на 7-е сутки после имплантации скаффолда на основе ПКЛ и ГА, а изменения показателя перфузии кожи не превышают сдвиги, являющиеся результатом травмы мягких тканей. На 21-е сутки эксперимента воспалительные изменения микроциркуляции у животных данной группы полностью нивелируются, что свидетельствует о хорошей биосовместимости скаффолдов на основе ПКЛ и ГА.
Для верификации результатов исследования у животных проводилось морфологическое исследование тканей области имплантации, которые подтвердили, что скаффолд на основе ПКЛ и ГА обладает биосовместимостью.
Таким образом, при подкожной имплантации животным скаффолда, не обладающего биосовместимостью, воспалительные изменения перфузии кожи проявляются увеличением перфузионного показателя, амплитуд миогенных колебаний микрокровотока и могут быть зарегистрированы методом ЛДФ в период с 7-х по 21-е сутки. При имплантации скаффолдов на основе ПКЛ и ГА воспалительные изменения микроциркуляции кожи выражены слабо, наиболее ярко проявляются на 7-е сутки и полностью нивелируются к 21-м суткам эксперимента, что позволяет сделать вывод о хорошей биосовместимости данных скаффолдов.
Способ оценки биосовместимости скаффолдов, включающий подкожную имплантацию в межлопаточную область крысы скаффолда и проведение инструментального исследования, отличающийся тем, что перед имплантацией скаффолда крысе в качестве инструментального исследования проводят лазерную допплеровскую флоуметрию микрокровотока (ЛДФ), определяя показатель перфузии и, используя спектральный вейвлет-анализ, нормированные амплитуды эндотелиальных, нейрогенных и миогенных колебаний микрокровотока, принимая полученные результаты за исходный уровень; имплантируют скаффолд в форме диска диаметром порядка 15 мм, толщиной порядка 0,1 мм; затем трехкратно на 7, 14, 21 сутки после имплантации проводят ЛДФ микрокровотока кожи над областью имплантации с определением указанных показателей; анализируют полученные результаты, сравнивая их с показателями исходного уровня; скаффолд считают биосовместимым, если повышение показателя перфузии сопровождается сдвигом нормированных амплитуд нейрогенных и миогенных колебаний кровотока на 7-е сутки после имплантации и показатели нормированных амплитуд полностью нормализуются к 14-м суткам, а полное восстановление показателя перфузии наблюдается к 21-м суткам после имплантации.