Способ получения растворимого фибриногена ex vivo
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа получения растворимого фибриногена, заключающегося в том, что свежезамороженную плазму размораживают и центрифугируют, полученный криопреципитат солюбилизируют и подвергают обработке гидроокисью алюминия, полученную суспензию центрифугируют, образовавшийся осадок, содержащий нецелевые белки, отбрасывают, супернатант подвергают обработке полиэтиленгликолем, суспензию центрифугируют, надосадочную жидкость отбрасывают, а осадок солюбилизируют и подвергают вирусной инактивации, освобождают от продуктов вирусной инактивации, встряхивая с вазелиновым маслом и переосаждая глицином, процедуру осаждения повторяют дважды, полученный раствор фибриногена разливают и лиофильно высушивают. Изобретение обеспечивает получение фибриногена, который обладает быстрой растворимостью. 2 пр., 2 ил., 3 табл.
Реферат
Область техники
Изобретение относится к области медицины, а именно - к хирургии. Изобретение основано на получении растворимого фибриногена, используемого в медицине с различными целями. Результат изобретения может применяться для приготовления специализированных растворов, надежного гемостаза при диффузных кровотечениях, герметизации швов и анастомозов, склеивания и фиксации тканей, ускорения заживления ран, в качестве компонента тест-систем, а также в качестве фармацевтической субстанции для производства лекарственных средств.
Уровень техники
Способ получения растворимого фибриногена как такового не известен из уровня техники. Известны способы получения гемостатических препаратов, многокомпонентных смесей, т.н. фибринового клея.
Так, известен способ получения порошкообразного материала для остановки кровотечений (Патент 2235539). Изобретение относится к способам получения гемостатических препаратов. Способ предполагает получение порошкообразного материала, предусматривает смешивание в водной среде основы - частично окисленной целлюлозы - с тромбином и фибриногеном, при этом к указанным веществам дополнительно прибавляют желатин, эпсилон-аминокапроновую кислоту и лизоцим, а в качестве частично окисленной целлюлозы используют диальдегидцеллюлозу, имеющую степень окисления.
Известен биогель, агент для формирования биогеля, набор для формирования биогеля, который включает множество носителей, причем каждый носитель включает множество связывающих фибриноген групп, иммобилизованных на носителе; и отдельно фибриноген, при этом каждая молекула фибриногена может связывать по меньшей мере две связывающие фибриноген группы. (Заявка 2009119257)
Известен гемостатический клей, представляющий собой водный раствор, содержащий 10-100 г целлюлозы, 1-30 мл уксусной кислоты и 1-150 г феракрила в 1 л дистиллированной воды. Изобретение обеспечивает остановку кровотечения и образование при соприкосновении с кровью и тканями пленки за 30 секунд (Патент RU 2262937).
Известен гемостатический клей, представляющий собой водный раствор, содержащий 1-10% альгината натрия, 0,1-3% уксусной кислоты и 0,1-15% феракрила. Изобретение обеспечивает остановку кровотечения, образуя при соприкосновении с кровью и тканями пленку до 30 секунд, может храниться при комнатной температуре в течение 3 лет (Патент RU 2256448).
Известен биологический адгезивный клей на основе VIII фактора (Патент RU 2224540). Сущность изобретения состоит в том, что предлагаемая композиция содержит криопреципитат, доза которого содержит VIII фактор, тромбин в изотоническом растворе хлорида натрия и хлорида кальция или глюконата кальция. Применение клеевой композиции позволяет останавливать кровотечения из капилляров, из сосудов малого и среднего калибра, обширных тканевых поверхностей.
Известен способ получения биологического клея, изготовленного из концентрированных коагулирующих факторов посредством "высаливания" (Патент RU 2130946). Изобретение относится к способу приготовления концентрата коагулирующих белков из цельной плазмы человека или животного, используемого в качестве биологического клея, который произвольно смешивают с тромбином. Концентрированные белки включают в себя в основном фибриноген, стабилизирующий фибрин фактор (Фактор XII) и фибронектин. После смешивания с тромбином и кальцием биологический клей обнаруживает превосходную адгезионную прочность и биосовместимость.
Известен гемостатический клей (Патент RU 22700I5), способный останавливать кровотечения и склеивать ткани, представляет собой водный раствор, содержащий 20-150 г цинка полиакрилата, 1-30 мл уксусной кислоты и 1-100 г целлюлозы в 1 л дистиллированной воды. Изобретение обеспечивает остановку кровотечения и образование при соприкосновении с кровью и тканями пленку за 60 секунд.
В рамках мировой новизны известны аппликативные композиции аппликативного нанесения, представляющие собой гемостатический текстиль с нанесенными биологически активными компонентами. Так, например, в виде текстиля могут быть такие волокна, как шелковые волокна, керамические, бамбуковые, хлопковые, льняные, джутовые, сизаля, сои, кукурузы, конопли, шерсти, полимерные и сополимерные волокна, а также их комбинации (патенты AU 2012205238, US 2012172776, CN 101389318).
Известна комбинация фибриногена и тромбина, воплощенная в биодеградируемые микросферы или гранулы и наносимая на рану с помощью специально разработанного прибора (патент WO 2010002435).
Известны т.н. фиброзные гемостатические заплатки для аппликативного применения, содержащие фибриноген и тромбин, источником которых также является плазма человека (патент CN 102178975, US 2006051340, US 2002156498). Аналогичная идея воплощена в патентах JP 2010115504, KR 20090028690, KR 20070092701, US 2006155234, с той разницей, что аппликативно наносится не заплатка, а т.н. «гемостатический сэндвич»: он состоит из нескольких слоев: 1 - фибриноген, 2 - тромбин, 3 - второй слой фибриногена.
Известны гемостатические многослойные повязки, содержащие слои: первый - поглощающий из нетканого материала, второй - из рассасывающейся ткани или трикотажа, содержащий тромбин и/или фибриноген (патент US 2009246238, US 2006257457, US 2006257458, WO 2007117237, CN 101084021, US 6762336, CN 2643866, CN 2621681).
Известно также множество других гемостатических композиций аппликативного нанесения, содержащих в своем составе компоненты свертывающей системы крови, выполненные во всевозможных сочетаниях таких компонентов, как тромбин, фибриноген, протромбин, факторы коагуляции V, VIII, IX, X, в виде липосом, гранул, отдельных растворов (патенты US 2008138387, US 6280727, FR 2894831, P 2082748, WO 0197826, EP 1053756).
Известны гемостатические композиции в виде фибринового клея (патенты US 2008003272, WO 0038752, DE 19928372, DE 19928371, CA 1264666).
Таким образом, способ получения растворимого фибриногена не известен из уровня техники.
Наиболее близким к заявляемому изобретению является получение фибриногена для его последующего использования в составе смеси - фибринового клея Тиссукол компании Бакстер (патент US 5716645, JP 11021249 - прототипы). Приготовление рабочего раствора Тиссукола предусматривает, в числе прочего, его нагревание для более лучшей растворимости. При этом нагревание должно проводиться не менее 10 минут при температуре 37°C. Недостатком этого способа является именно временной и температурный фактор: 10-минутное ожидание и необходимость наличия нагревательного оборудования (или водяной бани) создает препятствия для скорейшего приготовления растворов и нанесения гемостатической смеси. Описанный в прототипе способ получения растворимого фибриногена отличается от заявляемого.
Постановка задачи и раскрытие изобретения
Таким образом, с учетом вышесказанного, существует необходимость в разработке способа получения растворимого фибриногена, который бы способствовал более быстрому приготовлению рабочих растворов, применяемых для остановки кровотечения.
Задачей изобретения является разработка способа получения растворимого фибриногена, не требующего использования специализированных нагревательных приборов, ускоряющих растворимость рабочего раствора фибриногена с целью его дальнейшего применения.
Сведения, подтверждающие возможность осуществления изобретения
Фибриноген является естественной составной частью крови. Конверсия фибриногена в фибрин осуществляется под влиянием тромбина, что формирует конечную стадию образования сгустка. Фибриноген традиционно получают из плазмы крови доноров. Фибриноген широко используется как субстанция лекарственных средств, так и в качестве реагентов в тест-системах, либо гемостатических многокомпонентных системах, предназначенных для аппликативной остановки кровотечений.
Необходимым условием для его применения в вышеуказанных продуктах является приготовление растворов фибриногена ex tempore. Так, для введения раствора фибриногена в вену его сначала растворяют в воде для инъекций, подогретой до температуры от +25 до +35°C. Раствор используется не позднее, чем через 1 ч после его приготовления.
В гемостатических системах фибриноген обычно является частью одного из компонентов системы. Для ускорения процесса растворения фибриногена смешиваемые компоненты необходимо сначала подогреть для улучшения его растворимости, что требует наличия лабораторных нагревательных приборов либо водяной бани. В свою очередь, это является существенным ограничением в применении таких скоропомощных средств, как гемостатические средства.
Способ получения растворимого фибриногена не известен из уровня техники; неожиданный технический результат был достигнут уникальной комбинацией приемов, используемых при осаждении фибриллярных белков.
Способ получения растворимого фибриногена, а также данные сравнительной растворимости, подтверждающие преимущества заявляемого изобретения, описаны в Примерах.
Краткое описание фигур чертежей
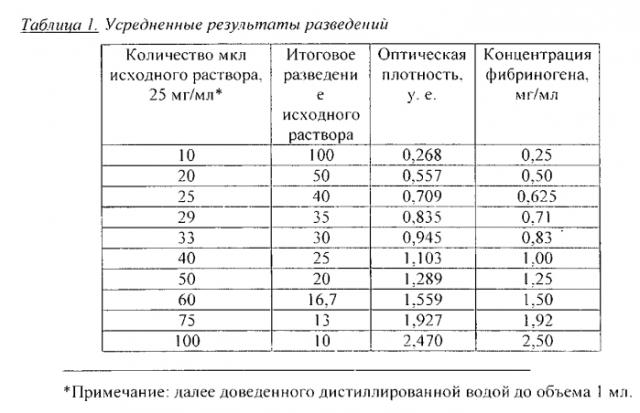
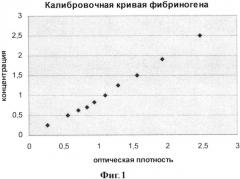
Фиг. 1. Калибровочная кривая растворения фибриногена.
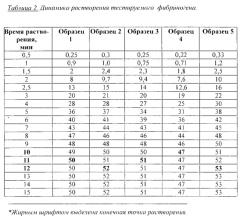
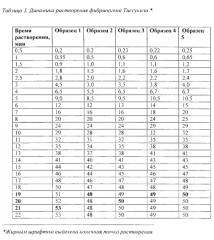
Фиг. 2. Сравнение динамики растворения фибриногенов: кружки - тестируемый фибриноген, ромбы - фибриноген сравнения (Тиссукол).
Примеры осуществления изобретения
Изобретение иллюстрируется (но не ограничивается) следующими примерами.
Пример 1. Получение растворимого фибриногена.
Берут 75 л свежезамороженной плазмы, содержащий 231 г фибриногена, размораживают и центрифугируют. Криосупернатант отбрасывают, а криопреципитат используют для дальнейшей работы.
Берут 675 г криопреципитата и заливают 3-кратным (по весу) водным раствором гепарина (2 МЕ/мл). Емкость помещают на столик магнитной мешалки, помещают магнит, змеевик термостатирующего устройства, термометр и электрод pH-метра. Суспензию перемешивают в течение 15 минут при температуре 25°C. Затем pH раствора корректируют 0,5 М уксусной кислотой до уровня pH 6,8±0,5 и инкубируют при тех же условиях еще 45 минут.
После этого добавляют 3%-ный раствор гидроокиси алюминия до конечной концентрации 0,3% и перемешивают при 25°C еще 15 минут.
Полученную суспензию центрифугируют. Осадок, содержащий нерастворимую часть криопреципитата, гидроокись алюминия и сорбированные на ней примеси белков протромбинового комплекса, отделяют и передают на обезвреживание и утилизацию.
К надосадочной жидкости добавляют 32%-ный полиэтиленгликоль-4000 в 10 мМ цитрате натрия до конечной концентрации 2%, доводят pH до 6,6±0,05 единиц 0,5 М уксусной кислотой и перемешивают 15 минут. Суспензию центрифугируют.
К образовавшимся 375 г осадка добавляют 3,4 л буфера, содержащего 10 мМ цитрат натрия, 0,15 М хлорид натрия, pH 8,0 (Буфер A) и перемешивают в течение 2 часов при температуре 30°C.
Для проведения вирусной инактивации добавляют раствор твина 80 до конечной концентрации 1% и три-н-бутилфосфат - до конечной концентрации 0,3%. Раствор тщательно перемешивают в течение 6 часов при комнатной температуре.
Для удаления продуктов вирусной инактивации к раствору добавляют вазелиновое масло в объеме 1/3 от объема вирус-инактивированного раствора и тщательно встряхивают в течение 30 минут. Полученную эмульсию разделяют центрифугированием. Водную фазу отбирают для дальнейшей работы, а масляную передают на дезактивацию.
К полученному на предыдущей стадии раствору добавляют глицин до конечной концентрации 2 М. Для этого при перемешивании вносят 567 г сухого глицина. Осаждение проводят при комнатной температуре в течение часа. После этого осадок отделяют центрифугированием. Супернатант передают на утилизацию, а к осадку добавляют 3.4 л буфера A и перемешивают в течение часа при комнатной температуре. Затем процедуру осаждения и последующую солюбилизацию повторяют второй раз.
После этого солюбилизированный осадок стерильно фильтруют через фильтр с диаметром пор 0,22 мкм, разливают по 5 мл по флаконам и лиофильно высушивают. Выход основного вещества составляет 131 г.
В результате получается фибриноген, который обладает быстрой растворимостью.
Пример 2. Сравнительное исследование динамики растворения тестируемой фракции фибриногена и фибриногена сравнения (Тиссукол®, Baxter).
Для построения калибровочной кривой лиофилизат обогащенной фракции, получаемой из криопреципитата плазмы, с известным средним значением содержания в ней фибриногена полностью растворяли в таком объеме дистиллированной воды, чтобы конечная концентрация фибриногена в растворе была равна 25 мг/мл. Конкретно в исследование была взята партия образцов со средним содержанием фибриногена 100 мг/флакон. Содержимое флакона растворяли в 4 мл дистиллированной воды. Так как оптическая плотность конечного раствора лежит за пределами возможностей любого спектрофотометра, то полученный раствор фибриногена с концентрацией 25 мг/мл продолжали разводить и мерить оптическую плотность в следующих разведениях: 1:100, 1:50, 1:40, 1:35, 1:30, 1:25, 1:20, 1:16,7, 1:13, 1:10. С учетом того, что исследовалась обогащенная фракция, а значит содержание фибриногена менялось от флакона к флакону, измерения повторяли на 5 образцах. Оптическую плотность измеряли на спектрофотометре SmartSpecTM3000 (Bio-Rad) при длине волны 280 нм. Концентрацию фибриногена, соответствующую каждому значению оптической плотности, определяли исходя из заданного разведения. Усредненные результаты измерений представлены в таблице 1 и калибровочная кривая - на Фиг. 1.
Сравниваемые образцы тестируемого фибриногена и фибриногена Тиссукол® (Baxter) разводили при комнатной температуре до предполагаемой средней концентрации 50 мг/мл; при данной концентрации фибриноген применяется как лекарственное средство. После внесения во флакон с лиофилизатом соответствующего объема воды делали забор проб сначала через каждые 0,5 минуты, а начиная с 3-й минуты - через каждую минуту до полного растворения лиофилизата. Перед каждым забором пробы раствор встряхивали. Каждую пробу вносили в отдельную пробирку Эппендорфа, пробирки маркировали в соответствии со временем забора пробы. Объем каждой пробы был минимален и равен 20 мкл с тем, чтобы несущественно снижать общий объем изучаемого образца к концу исследования. После окончания растворения каждую отобранную пробу разводили водой таким образом, чтобы оптическая плотность раствора попала в приемлемый диапазон калибровочной кривой. Искомую концентрацию в каждой точке вычисляли исходя из разведения. Исследование повторяли на 5 образцах. Результаты приведены в таблицах 2 и 3.
Как видно из таблиц, образцы тестируемого фибриногена достигали полной растворимости при комнатной температуре к 10-12 минуте. Конечная концентрация фибриногена в исследованных образцах оказалась в пределах 47-53 мг/мл. Тиссукол достигал полной растворимости при комнатной температуре к 19-21 минуте. Конечная концентрация фибриногена в исследованных образцах Тиссукола находилась в пределах 48-53 мг/мл.
Кривые растворения в сравнении приведены на Фиг. 2.
Способ получения растворимого фибриногена, заключающийся в том, что свежезамороженную плазму размораживают и центрифугируют, полученный криопреципитат солюбилизируют и подвергают обработке гидроокисью алюминия, полученную суспензию центрифугируют, образовавшийся осадок, содержащий нецелевые белки, отбрасывают, супернатант подвергают обработке полиэтиленгликолем-4000, суспензию центрифугируют, надосадочную жидкость отбрасывают, а осадок солюбилизируют и подвергают вирусной инактивации, используя твин 80 и три-н-бутилфосфат, освобождают от продуктов вирусной инактивации, встряхивая с вазелиновым маслом и переосаждая 2 M глицином, процедуру осаждения повторяют дважды, полученный раствор фибриногена разливают и лиофильно высушивают.