Подавление раковых метастазов
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к онкологии, и предназначена для подавления раковых метастазов. Фармацевтическая композиция для подавления раковых метастазов у индивидуума содержит фибриллярный белок и фармацевтически приемлемый эксципиент. Указанный фибриллярный белок выбирают из группы, состоящей из фибриллярного альбумина, фибриллярного сывороточного альбумина человека и фибриллярных капсидных белков вируса ящура. Для приготовления указанной композиции получают фибриллярный сывороточный альбумин человека и смешивают его в терапевтически эффективном количестве с фармацевтически приемлемым носителем. Использование группы изобретений позволяет повысить эффективность подавления раковых метастазов. 3 н. и 8 з.п. ф-лы, 1 табл., 33 ил., 12 пр.
Реферат
ВВЕДЕНИЕ
Раковый метастаз представляет собой процесс, включающий ряд последовательных этапов и требующий каскада взаимодействий между клетками хозяина и опухолевыми клетками (Steeg PS et al. (2007) Nature 449:671-3). Эти этапы включают отделение от первичной опухоли, инвазию и задержку в кровеносной системе, выход в паренхиму органов; и пролиферацию в сочетании с ангиогенезом (Sawyer TK et al. (2004) Expert Opin Investig Drugs 13:1-19). Существует растущий интерес к исследованию механизмов миграции и инвазии, которые считают критическими этапами процесса метастазирования. Вмешательство в любой из этих этапов для остановки метастатического каскада представляет собой хороший способ предотвращения метастатического роста опухолей.
Наши предшествующие данные показывают, что рекомбинантный капсидный белок VP1 (rVP1) вируса ящура (FMDV) индуцировал апоптоз у нескольких видов раковых клеток через интегриновый сигнальный путь (Peng JM et al. (2004) J. Biol. Chem. 279:52168-74). Показано, что с применением процесса, подобного рефолдингу rVP1 в водорастворимую форму, глобулярный бычий сывороточный альбумин (G-BSA) можно преобразовать в фибриллярный BSA (F-BSA), который, подобно rVP1, индуцирует апоптоз опухолевой клетки через интегриновый/FAK/Akt сигнальный путь (Huang et al. (2009) BMC Biotechnol. 9:2).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предоставляются способы подавления раковых метастазов. Раковые метастазы представляют собой самую распространенную причину неэффективности лечения и смерти у пациентов с раком. Инвазия и/или миграция опухолевых клеток значительно подавляется после взаимодействия опухолевых клеток с фибриллярными белками, где фибриллярные белки в качестве неограничивающих примеров включают rVP1, F-HSA, и F-BSA. Опухолевые клетки, представляющие интерес, включают карциномы, например, карциному молочной железы, эпителиальную аденокарциному яичника, аденокарциному предстательной железы и т.д.
В одном из аспектов изобретение относится к композиции, включающей терапевтически эффективное количество фибриллярного сывороточного альбумина человека и фармацевтически приемлемый носитель для применения в лечении млекопитающего с раком, например, для подавления раковых клеток, подавления метастазов и т.д.
В некоторых вариантах осуществления изобретения опухолевые клетки приводят в контакт in vivo с фибриллярными белками, где контактирование может быть местным, например, представлять собой внутриопухолевое введение или инъекцию, или системным. Например, в настоящем документе показано, что rVP1 значительно подавляет метастазирование рака молочной железы у мыши и человека и метастазирование рака предстательной железы и рака яичников у человека in vivo. Показано, что F-HSA значительно подавляет метастазирование рака молочной железы. В одном из вариантов осуществления изобретение относится к композициям, указанным выше, для применения в лечении рака у млекопитающего, где рак представляет собой, по меньшей мере, один из рака молочной железы, рака яичников, рака шейки матки, рака предстательной железы и рака легких.
В некоторых вариантах осуществления изобретения предоставлены композиции фибриллярных белков, выступающих в качестве лекарственных средств для борьбы с раковыми метастазами, где композицию для фармацевтического средства предоставляют в дозе, эффективно ингибирующей метастазирование. В другом аспекте изобретение относится к способу, включающему получение композиции для применения в лечении пациента, больного раком. Способ включает получение фибриллярного сывороточного альбумина человека и смешивание фибриллярного сывороточного альбумина человека с фармацевтически приемлемым носителем. В другом аспекте изобретение относится к способу, включающему растворение HSA в растворе SDS; помещение растворенного HSA в колонку для гель-фильтрации с диаметром пор, позволяющим разделять белки с молекулярной массой, составляющей 70 кДа и более; элюирование HSA из колонки; и диализ раствора против фосфатно-солевого буфера с удалением SDS.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
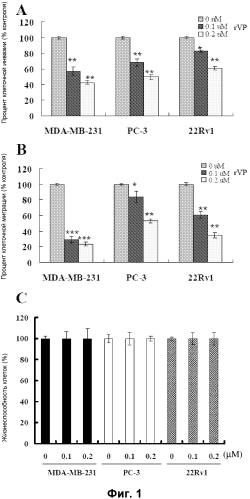
Фиг. 1. Воздействие rVP1 на инвазию/миграцию клеток и цитотоксичность для клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1. (A и B) Клеточную инвазию/миграцию клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1 при обработке rVP1 в течение 24 часов измеряли с применением камеры Бойдена. rVP1 значительно подавлял инвазию/миграцию опухолевых клеток. (C) Цитотоксичность клеток MDA-MB-231, клеток PC-3 и клеток 22Rv1 при обработке rVP1 в течение 24 часов измеряли с применением MTT-теста. 0,1 μΜ и 0,2 μΜ rVP1 не влияли на жизнеспособность опухолевых клеток. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05, **: P<0,01 и ***: P<0,001 относительно контроля (обработка 0 μΜ rVP).
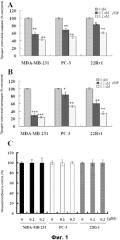
Фиг. 2. Воздействие rVP1 на клеточную инвазию и цитотоксичность для клеток SK-OV-3 и клеток CaSki. (A) Клеточную инвазию клеток SK-OV-3 и клеток CaSki при обработке rVP1 в течение 24 часов измеряли с применением камеры Бойдена. rVP1 значительно подавляли инвазию опухолевых клеток. (B) Клеточную цитотоксичность клеток SK-OV-3 и клеток CaSki при обработке rVP1 в течение 24 часов измеряли с применением MTT-теста. От 0,2 μΜ до 0,4 μΜ rVP1 в клетках SKOV-3 и от 0,2 μΜ до 0,6 μΜ rVP1 в клетках CaSki не влияли на жизнеспособность клеток. Белые столбики, клетки SKOV-3; черные столбики, клетки CaSki. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05; **: P<0,01; ***: P<0,001.
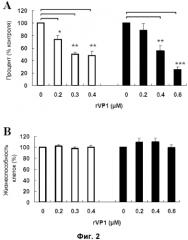
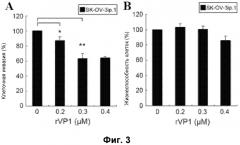
Фиг. 3. Воздействие rVP1 на клеточную инвазию и цитотоксичность для клеток SK-OV-3ip.1. (A) Клетки SK-OV-3ip.1 высевали на верхнюю камеру на 1 час с последующей обработкой rVP1 в течение 24 часов. После инкубации клетки с нижней поверхности мембраны разделяли и подсчитывали. (B) Клетки SK-OV-3ip.1 обрабатывали rVP1 в течение 24 часов, после чего проводили анализ WST-1. Коэффициенты выживаемости клеток определяли посредством измерения оптической плотности при 450 нм (опорная длина волны 690 нм). Процент выживаемости клеток рассчитывали как (O.Dобработка/O.Dконтроль)×100%. Данные представлены в виде средних значений ± S.D. (n=3). *, P<0,05 и **, P<0,01 относительно контроля.
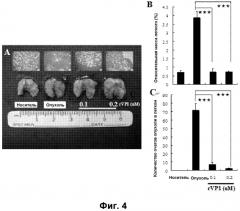
Фиг. 4. Метастатическая способность клеток MDA-MB-231 исчезала после обработки rVP1 in vivo. Клетки MDA-MB-231, обработанные 0,1 μΜ и 0,2 μΜ rVP1 in vitro в течение 24 часов, далее собирали и внутривенно вводили мышам в хвостовую вену. Через 14 суток мышей умерщвляли. Изучали макроскопическую картину (A) и проводили гистопатологическое исследование (B и C) легкого в трех разных группах мышей. rVP1 значительно подавлял метастатическую способность клеток MDA-MB-231. ***: P<0,001.
Фиг. 5. rVP1 подавлял клетки PC-3, дававшие метастазы в лимфоузлы, и ингибировал остеолиз в тазовых костях. (A) Лимфоузлы здоровой мыши и мыши с опухолью при наличии или отсутствии обработки rVP1. (B) Тазовые кости здоровых мышей и мышей с опухолью при наличии и отсутствии обработки rVP1 (стрелка).
Фиг. 6. Гистологическая картина in vivo метастазов рака печени у безтимусных мышей с имплантированными клетками SK-OV-3, предотвращенных с применением rVP1. Типичные участки печени с окраской H&E (гемотоксилин-эозин) от обработанных и не обработанных rVP1 мышей. Самкам безтимусных мышей BALB/cAnN-Foxn1 имплантировали 5×106 раковых клеток SK-OV-3 на мышь посредством интраперитонеальной инъекции, (a-b) через 60 суток печень обработанных PBS несущих SK-OV-3 мышей была окружена опухолевыми клетками, (c-d) через 340 суток после имплантации SK-OV-3 печень обработанных rVP1 мышей не демонстрировала признаков инвазии, (e-f) печень здоровой мыши (т.е., без имплантации SK-OV-3).
Фиг. 7. Воздействие F-HSA на клеточную миграцию, инвазию и цитотоксичность для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1 и клеток CaSki. Анализ миграции и инвазии in vitro, F-HSA значительно ингибировал клеточную инвазию (черный столбик) и миграцию (белый столбик) для клеток MDA-MB-231 (A), клеток PC-3 (C), клеток 22Rv1 (E) и клеток CaSki (G) с применением камеры Бойдена. Воздействие F-HSA на цитотоксичность для клеток MDA-MB-231, клеток PC-3, клеток 22Rv1 и клеток CaSki с применением MTT-теста. (B, D, F, и H). Миграция и инвазия представлены как соотношение числа обработанных клеток к числу необработанных клеток. Показаны средние значения ± S.D. для трех независимых экспериментов с тремя повторами для каждого. **: P<0,01 и ***: P<0,001 относительно необработанных клеток.
Фиг. 8. F-HSA подавлял метастазирование опухолевых клеток TS/A in vivo. (A) Макроскопическая картина и гистопатологическое исследование легкого мышей при наличии и отсутствии обработки F-HSA. (B и C) Относительная масса легкого и число очагов опухоли в легком мыши без обработки или с обработкой F-HSA. ***: P<0,001.
Фиг. 9. F-HSA подавлял метастазирование опухолевых клеток MDA-MB-231 in vivo. (A) Макроскопическая картина и гистопатологическое исследование легкого мышей при наличии и отсутствии обработки F-HSA. (B и C) Относительная масса легкого и число очагов опухоли в легком мыши без обработки или с обработкой F-HSA. ***: P<0,001.
Фиг. 10. Воздействие F-BSA на клеточную инвазию и цитотоксичность для клеток CaSki. (A) Клеточную инвазию клеток CaSki, обработанных F-BSA в течение 24 часов, измеряли с применением камеры Бойдена. F-HSA значительно подавлял инвазию опухолевых клеток. (B) Цитотоксичность клеток CaSki, обработанных F-BSA в течение 24 часов, измеряли посредством MTT-теста. F-HSA при концентрации 0,1 μΜ или 0,2 μΜ не оказывал эффекта на жизнеспособность клеток CaSki. Данные представлены в виде средних значений ± S.D. (n=3). *: P<0,05; **: P<0,01.
Фиг. 11. Схема имплантации опухоли при обработке rVP1.
Фиг. 12 представляет собой реализацию экспериментальных данных, где показано сравнение уровня флуоресценции при увеличивающихся концентрациях F-HSA, HSA и A β (1-42) после инкубации в присутствии 20 μΜ амилоид-специфичной краски ThT в течение 1 часа.
Фиг. 13 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака молочной железы.
Фиг. 14 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака молочной железы.
Фиг. 15 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака яичника.
Фиг. 16 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака шейки матки.
Фиг. 17 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака предстательной железы.
Фиг. 18 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака предстательной железы.
Фиг. 19 представляет собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на клетки рака легкого.
Фиг. 20A-20H представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление клеточной миграции и инвазии опухолевых клеток без влияния на жизнеспособность здоровых клеток.
Фиг. 21A-21C представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление метастазирования клеток рака молочной железы мыши TS/A в легкое.
Фиг. 22A-22C представляют собой реализацию экспериментальных данных, где показан цитотоксический эффект F-HSA на подавление метастазирования клеток рака молочной железы MDA-MB-231 мыши в легкое.
ОПРЕДЕЛЕНИЯ
В приведенном ниже описании ряд терминов, традиционно применяющихся в области клеточной культуры, используют в широком смысле. Для предоставления ясного и точного понимания заявки и формулы изобретения и объема, в котором следует понимать такие термины, приведены следующие определения.
Термины "субъект", "индивидуум" и "пациент" в настоящем документе используют взаимозаменяемо и относят к млекопитающему, которого определяют к лечению и/или лечат. В варианте осуществления млекопитающее представляет собой человека. Термины "субъект", "индивидуум" и "пациент", таким образом, охватывают индивидуумов, больных раком (например, колоректальный рак, аденокарциному яичника или предстательной железы, карциному молочной железы и т.д.), включая подвергшихся или являющихся кандидатами на резекцию (хирургическое вмешательство) для удаления раковой ткани (например, колоректальной раковой ткани). Субъекты могут представлять собой человека, но также включают других млекопитающих, особенно млекопитающих, применяемых в качестве лабораторных моделей заболеваний человека, например, мышей, крыс и т.д.
Как применяют в настоящем документе, термины "лечение" и т.п. относят к введению средства или проведению процедуры (например, облучения, хирургического вмешательства и т.д.) с целью получения эффекта. Эффект может быть профилактическим в отношении полного или частичного предотвращения заболевания или его симптомов и/или может быть терапевтическим в отношении предоставления частичного или полного излечения заболевания и/или симптомов заболевания. "Лечение", как применяют в настоящем документе, охватывает любое лечение любой метастатической опухоли у млекопитающего, особенно у человека, и включает: (a) предотвращение заболевания или симптомов заболевания, возникающего у индивидуума, который может быть предрасположен к заболеванию, но которому еще не ставили диагноз заболевания (например, включая заболевания, которые могут быть ассоциированы с или вызваны первичным заболеванием; (b) ингибирование заболевания, т.е., остановка его развития; и (c) облегчение заболевания, т.е., обеспечение ремиссии заболевания. При лечении опухолей (например, рака) терапевтическое средство может непосредственно сокращать раковые метастазы.
Термин "клеточная культура" или "культура" относится к поддержанию клеток в искусственной среде in vitro. Однако следует понимать, что термин "клеточная культура" представляет собой обобщенный термин, и его можно использовать для обозначения культивирования не только индивидуальных клеток, но также тканей или органов.
Как применяют в настоящем документе, термин "опухоль" относится к любому виду неопластического роста и пролиферации клеток, злокачественному или доброкачественному, и к любому виду предраковых и раковых клеток и тканей.
Термины "рак", "неоплазия" и "опухоль" в настоящем документе используют взаимозаменяемо и относят к клеткам, которые характеризуются автономным нерегулируемым ростом, при котором они проявляют патологический паттерн роста, которому свойственна значительная утрата контроля клеточной пролиферации. В основном, клетки, представляющие интерес для обнаружения, анализа, классификации или лечения, в настоящей заявке включают предраковые (например, доброкачественные), злокачественные, преметастатические, метастатические и неметастатические клетки. Примеры рака в качестве неограничивающих примеров включают рак молочной железы, рак толстого кишечника, рак легких, рак предстательной железы, гепатоцеллюлярную карциному, рак желудка, рак поджелудочной железы, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак мочевыводящих путей, рак щитовидной железы, рак почек, карциному, меланому, рак головы и шеи и рак головного мозга.
В зависимости от природы рака у пациента получают соответствующий образец. Как применяют в настоящем документе, фраза "образец раковой ткани" относится к любым клеткам, полученным из раковой опухоли. В случае солидных опухолей, не дающих метастазы, как правило, получают образец ткани из хирургически удаленной опухоли и готовят его к анализу общепринятыми способами. Альтернативно в качестве анализируемого образца можно брать и применять образец биологической жидкости, такой как лимфа, кровь или сыворотка, или образец экссудата, такого как экссудат органа, пораженного раком (например, экссудат молочной железы). В случае лейкозов получают и соответствующим образом подготавливают лимфоциты или лейкемические клетки. Так же, в случае любого дающего метастазы рака, клетки можно получать из биологической жидкости, такой как лимфа, кровь, сыворотка, или периферического пораженного органа или его экссудата.
Как применяют в настоящем документе, термин "метастазирование" относится к росту раковой опухоли в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью. Следует понимать, что метастазирование включает микрометастазирование, которое представляет собой наличие необнаруживаемого количества раковых клеток в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью. Метастазирование также можно определять как ряд этапов процесса, таких как выход раковых клеток из места первичной опухоли и миграция и/или инвазия раковых клеток в другие части организма. Таким образом, настоящее изобретение предоставляет способ определения риска дальнейшего роста одного или нескольких раков в органе или части тела, не соединенном непосредственно с органом, пораженным первичной раковой опухолью, и/или любых этапов процесса, приводящего к такому росту.
"Патология" рака включает все симптомы, нарушающие здоровье пациента. В качестве неограничивающих примеров они включают патологический или неконтролируемый рост клеток, метастазирование, воздействие на нормальное функционирование соседних клеток, высвобождение цитокинов или других секреторных веществ на патологическом уровне, подавление или ослабление воспалительного или иммунного ответа, неоплазию, предопухолевое состояние, рак, инвазию в соседние или отдаленные ткани или органы, такие как лимфоузлы, и т.д.
Как применяют в настоящем документе, термины "рецидив рака" и "рецидив опухоли" и их грамматических варианты относятся к дальнейшему росту неопластических или раковых клеток после постановки диагноза рака. В частности, рецидив может возникать при дальнейшем росте раковых клеток в пораженной раком ткани. Так же, "распространение опухоли" наблюдается, когда клетки опухоли расселяются в соседние или отдаленные ткани и органы; таким образом, распространение опухоли включает метастазирование опухоли.
Термин "диагноз" применяют в настоящем документе для обозначения идентификации молекулярного или патологического состояния, заболевания или состояния, такого как идентификация молекулярного подтипа рака молочной железы, рака предстательной железы или других типов рака.
Термин "прогноз" применяют в настоящем документе для обозначения предсказания вероятности обусловленной раком смерти или прогрессирования неопластического заболевания, такого как рак легкого, прямой кишки, кожи или пищевода, включая рецидив, метастазирование и устойчивость к лекарственному средству. Термин "предсказание" применяют в настоящем документе для обозначения предсказания или оценки, основанных на наблюдениях, опыте или научных выводов. В одном примере врач может предсказывать вероятность того, что пациент останется в живых после хирургического удаления первичной опухоли и/или химиотерапии в течение определенного периода времени без рецидива рака.
Как применяют в настоящем документе, фраза "безрецидивная выживаемость" относится к отсутствию рецидива и/или распространения опухоли и состоянию пациента после постановки диагноза в отношении влияния рака на продолжительность жизни пациента. Фраза "общая выживаемость" относится к состоянию пациента после постановки диагноза, несмотря на возможность того, что причина смерти пациента необязательно связана непосредственно с влиянием рака. Фразы "вероятность безрецидивной выживаемости", "риск рецидива" и их варианты относятся к вероятности рецидива или распространения опухоли у пациента после постановки диагноза рака, где вероятность определяют согласно способу по изобретению.
Как применяют в настоящем документе, термин "коррелирует" или "коррелирует с" и подобные термины относятся к статистической связи между двумя событиями, где события включают числа, наборы данных и т.п. Например, в случае, когда событие выражают числами, положительная корреляция (которую в настоящем документе также обозначают как "прямую корреляцию") означает, что при увеличении одной величины также увеличивается и другая. Отрицательная корреляция (которую в настоящем документе также обозначают как "обратную корреляцию") означает, что при увеличении одной величины другая уменьшается.
Термин "выделенный" предназначен для обозначения того, что соединение отделяют от всех или некоторых компонентов, сопутствующих ему в природе. "Выделенный" также относится к состоянию соединения (например, белка), отделенного от всех или некоторых компонентов, сопутствующих ему во время обработки (например, химический синтез, рекомбинантная экспрессия, среда для культивирования и т.п.).
"Биологический образец" охватывает ряд типов образцов, полученных от индивидуума. Определение охватывает кровь и другие жидкие образцы биологического происхождения, образцы твердых тканей, такие как биоптат или тканевые культуры или клетки, полученные от них и их потомков. Определение также включает образцы, с которыми проводили любые манипуляции после их получения, такие как обработка реагентами; промывка; или обогащение определенными популяциями клеток, таких как раковые клетки. Определение также включает образец, который обогащали определенными типами молекул, например, нуклеиновыми кислотами, полипептидами и т.д. Термин "биологический образец" охватывает клинический препарат и также включает ткань, полученную посредством хирургического удаления, ткань, полученную посредством биопсии, клетки в культуре, клеточные супернатанты, клеточные лизаты, образцы ткани, органы, костный мозг, кровь, плазму, сыворотку и т.п. "Биологический образец" включает образец, полученный из раковой клетки пациента, например, образец, содержащий полинуклеотиды и/или полипептиды, полученные из раковой клетки пациента (например, клеточный лизат или другой клеточный экстракт, содержащий полинуклеотиды и/или полипептиды); и образец, содержащий раковые клетки пациента. Биологический образец, содержащий раковую клетку пациента, также может включать не раковые клетки.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к способу получения фибриллярных белков и способам лечения с применением фибриллярных белков. Способ лечения включает подавление раковых метастазов.
Способ лечения
В настоящем документе описан способ ингибирования раковых метастазов. Способ включает введение терапевтически эффективного количества белка с фибриллярной структурой нуждающемуся в этом пациенту. Способ далее может включать этапы получения белка и изменения белка с приданием ему фибриллярной структуры перед введением фибриллярного белка. Введение фибриллярного белка ингибирует инвазию и/или миграцию опухолевых клеток (например, в окружающие ткани).
Настоящий способ находит применение в ряде раковых терапий опухолей (включая предотвращение рака и лечение рака после постановки диагноза) у млекопитающего, особенно у человека. Субъекты, имеющие опухоль, подозреваемые на наличие опухоли или характеризующиеся риском развития опухоли, подлежат лечению, описываемому в настоящем документе.
Способы лечения рака согласно рассматриваемому способу могут быть конкретно направлены на раковые клетки, которые представляют собой метастатические клетки или характеризуются высоким риском метастазирования. В связи с этим, фибриллярный белок можно использовать терапевтически для влияния на/предотвращения выхода и инвазии раковых клеток в другие ткани.
Например, раковые метастазы, которые можно ингибировать способом по настоящему изобретению, в качестве неограничивающих примеров включают карциномы, включая аденокарциномы, и особенно карциномы молочной железы, аденокарциному предстательной железы и аденокарциному яичника. Другие метастазы, которые можно лечить, включают метастазы, происходящие от раков в почке, легком, печени, коже (например, меланома), прямой кишке, поджелудочной железе или шейке матки.
Белок с фибриллярной структурой, применяемый для лечения рака, может представлять собой альбумин, фибронектин, rVP1, rVP2, rVP3, P1 или химерный белок, содержащий части VP1, VP2, VP3 и/или VP4. Альбуминовые белки можно получать от любого животного, представляющего интерес, например, сывороточный альбумин человека, бычий сывороточный альбумин и т.д. В определенных вариантах осуществления фибриллярный белок дополнительно индуцирует апоптоз раковой клетки посредством модулирования Akt-сигнального пути. В некоторых случаях фибриллярный белок модулирует интегрин α5β1 или αvβ3, что приводит к дезактивации Akt. В других случаях фибриллярный альбумин связывается с интегрином и вызывает клеточный апоптоз в основном через интегрин/FAK/Akt/GSK-3β/каспаза-3-сигнальный путь.
Как указано выше, настоящий способ включает введение фибриллярных белков индивидууму (например, пациенту, представляющему собой человека) с тем, чтобы, например, подавлять инвазию и миграцию раковых клеток. Это можно сопровождать введением фибриллярного белка индивидууму, как описано в настоящем документе, с предоставлением сокращения метастазирования рака по сравнению с субъектами, которым не вводили фибриллярный белок. Способы лечения согласно рассматриваемым способам можно также применять для предотвращения рецидивов, сокращения миграции раковых клеток, уменьшения размера опухоли, уменьшения массы опухоли и/или улучшения клинического исхода у пациентов.
Типы рака
Способы, относящиеся к раку и предоставленные в настоящем документе, включают, например, применение лечения фибриллярным белком в качестве борьбы с метастазированием рака. Способы пригодны в отношении лечения или предотвращения широкого спектра раков, таких как раки, которые могут давать метастазы (например, карциномы и саркомы).
Карциномы, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают карциному пищевода, печеночно-клеточную карциному, базально-клеточную карциному (форма рака кожи), плоскоклеточную карциному (различные ткани), карциному мочевого пузыря, включая переходноклеточную карциному (злокачественная неоплазия мочевого пузыря), бронхогенную карциному, карциному прямой кишки, колоректальную карциному, карциному желудка, карциному легкого, включая мелкоклеточную карциному и немелкоклеточную карциному легкого, адренокортикальную карциному, карциному щитовидной железы, карциному поджелудочной железы, карциному молочной железы, карциному яичника, карциному предстательной железы, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, почечноклеточную карциному, протоковую карциному in situ или карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильма, цервикальную карциному, карциному матки, карциному яичка, остеогенную карциному, эпителиальную карциному и носоглоточную карциному.
Саркомы, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают фибросаркому, миксосаркому, липосаркому, хондросаркому, хордому, остеогенную саркому, остеосаркому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому и саркомы других мягких тканей.
Другие солидные опухоли, подлежащие лечению способом, описываемым в настоящем документе, в качестве неограничивающих примеров включают глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, неврому слухового нерва, олигодендроглиому, менангиому, меланому, нейробластому и ретинобластому.
Другие раки, подлежащие лечению способом, описываемым в настоящем документе, включают атипичную менингиому (головной мозг), карциному островковых клеток (поджелудочная железа), медуллярную карциному (щитовидная железа), мезенхиому (кишечник), печеночноклеточную карциному (печень), гепатобластому (печень), светлоклеточную карциному (почка) и нейрофиброму средостения.
Дополнительные примеры раков, подлежащих лечению способами, описываемыми в настоящем документе, в качестве неограничивающих примеров включают раки нейроэктодермального и эпителиального происхождения. Примеры раков нейроэктодермального происхождения в качестве неограничивающих примеров включают саркому Юинга, опухоли спинного мозга, опухоли головного мозга, супратенториальные примитивные нейроэктодермальные опухоли у детей, тубулокистозную карциному, слизеобразующую тубулярную и веретеноклеточную карциному, опухоли почки, опухоли средостения, нейроглиомы, нейробластомы и саркомы у подростков и молодых людей. Примеры раков эпителиального происхождения в качестве неограничивающих примеров включают мелкоклеточный рак легких, раки молочной железы, хрусталика, прямой кишки, поджелудочной железы, почки, печени, яичника и бронхиального эпителия.
Сочетание с другими способами лечения раков
Терапевтическое введение фибриллярного белка может включать введение как часть схемы лечения, которое можно сочетать или не сочетать с дополнительными стандартными способами лечения раков, включая в качестве неограничивающих примеров иммунотерапию, химиотерапевтические средства и хирургические вмешательства (например, описанные далее ниже).
Кроме того, терапевтическое введение фибриллярного белка также может представлять собой пост-терапевтическое лечение субъекта, получавшего лечение рака, где лечение рака может представлять собой, например, хирургическое вмешательство, лучевую терапию, введение химиотерапевтических средств и т.п. Терапию рака с применением фибриллярных белков по настоящему изобретению также можно использовать в комбинации с иммунотерапией. В других примерах фибриллярные белки можно вводить в комбинации с одним или несколькими химиотерапевтическими средствами (например, циклофосфамид, доксорубицин, винкристин и преднизон (CHOP)) и/или в комбинации с лучевой терапией и/или в комбинации с хирургическим вмешательством (например, пре- или пост-хирургическое вмешательство для удаления опухоли). Если фибриллярные белки применяют в сочетании с хирургическим вмешательством, фибриллярный белок можно вводить до, во время или после хирургического вмешательства для удаления раковых клеток, и можно вводить системно или местно в область хирургического вмешательства. Фибриллярный белок отдельно или в комбинациях, описанных выше, можно вводить системно (например, посредством парентерального введения, например, внутривенным путем) или местно (например, в область опухоли, например, посредством внутриопухолевого введения (например, в солидную опухоль, в лимфоузел, поврежденный лимфомой или лейкозом), введением в кровеносный сосуд, питающий солидную опухоль, и т.д.).
Любой из широкого спектра способов лечения рака можно использовать в комбинации со способом лечения фибриллярным белком, описываемым в настоящем документе. Такие способы лечения рака включают хирургическое вмешательство (например, хирургическое удаление рака), лучевую терапию, пересадку костного мозга, химиотерапевтическое лечение, лечение модификаторами биологического ответа и определенные комбинации указанных выше способов.
Лучевая терапия в качестве неограничивающих примеров включает рентгеновское или гамма-излучение, которое предоставляют с применением внешнего источника излучения, такого как луч, или посредством имплантации небольшого источника радиоактивного излучения.
Химиотерапевтические средства представляют собой непептидные (т.е., небелковые) соединения, которые подавляют пролиферацию раковых клеток, и включают цитотоксические средства и цитостатические вещества. Неограничивающие примеры химиотерапевтических средств включают алкилирующие средства, нитрозомочевины, антиметаболиты, противоопухолевые антибиотики, растительные (барвинок) алкалоиды и стероидные гормоны.
Вещества, подавляющие клеточную пролиферацию, известны в данной области и широко применяются. Такие вещества включают алкилирующие средства, такие как азотистые иприты, нитрозомочевины, производные этиленимина, алкилсульфонаты и триазены, включая в качестве неограничивающих примеров мехлоретамин, циклофосфамид (CYTOXAN™), мелфалан (L-сарколизин), кармустин (BCNU), ломустин (CCNU), семустин (метил-CCNU), стрептозоцин, хлорзотоцин, урамустин, хролметин, ифосфамид, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, дакарбазин и темозоломид.
Антиметаболиты включают аналоги фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозин деаминазы, включая в качестве неограничивающих примеров цитарабин (ЦИТОЗАР-U), цитозинарабинозид, фторурацил (5-FU), флоксуридин (FudR), 6-тиогуанин, 6-меркаптопурин (6-MP), пентостатин, 5-фторурацил (5-FU), метотрексат, 10-пропаргил-5,8-дидеазафолат (PDDF, CB3717), 5,8-дидеазатетрагидрофолиевую кислоту (DDATHF), лейковорин, фосфат флударабина, пентостатин и гемцитабин.
Подходящие натуральные вещества и их производные (например, алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины, и эпиподофиллотоксины) в качестве неограничивающих примеров включают Ara-C, паклитаксел (ТАКСОЛ®), доцетаксел (ТАКСОТЕР®), дезоксисоформицин, митомицин-C, L-аспарагиназу, азатиоприн; бреквинар; алакалоиды, например, винкристин, винбластин, винорелбин, виндезин и т.д.; подофиллотоксины, например, этопозид, тенипозид и т.д.; антибиотики, например, антрациклин, даунорубицин гидрохлорид (дауномицин, рубидомицин, церубидин), идарубицин, доксорубицин, эпирубицин и морфолиновые производные и т.д.; феноксизон бисциклопептиды, например, дактиномицин; основные гликопептиды, например, блеомицин; антрахиноновые гликозиды, например, пликамицин (митрамицин); антрацендионы, например, митоксантрон; азиринопирроловые индолдионы, например, митомицин; макроциклические иммуносупрессоры, например, циклоспорин, FK-506 (такролимус, програф), рапамицин и т.д.; и т.п.
Другие антипролиферативные цитотоксические средства представляют собой навелбен, CPT-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифозамид и дролоксафин.
Воздействующие на микротрубочки средства с антипролиферативной активностью также пригодны для использования и в качестве неограничивающих примеров включают аллоколхицин (NSC 406042), галихондрин B (NSC 609395), колхицин (NSC 757), производные колхицина (например, NSC 33410), долстатин 10 (NSC 376128), майтанзин (NSC 153858), ризоксин (NSC 332598), паклитаксел (ТАКСОЛ®), производные ТАКСОЛ®, доцетаксел (ТАКСОТЕР®), тиоколхицин (NSC 361792), тритил цистерин, винбластина сульфат, винкристина сульфат, натуральные и синтетические эпотилоны, включая в качестве неограничивающих примеров эпотилон A, эпотилон B, дискодермолид; эстрамустин, нокодазол и т.п.
Модуляторы гормонов и стероиды (включая синтетические аналоги), пригодные для использования, в качестве неограничивающих примеров включают адренокортикостероиды, например, преднизон, дексаметазон и т.д.; эстрогены и прогестины, например, гидроксипрогестерона капроат, медроксипрогестерона ацетат, мегестрола ацетат, эстрадиол, кломифен, тамоксифен и т.д.; и суппрессанты адренокотропных гормонов, например, аминоглютетимид; 17α-этинилэстрадиол; диэтилстилбестрол, тестостерон, флюоксиместерон, дромостанолона пропионат, тестолактон, метилпреднизолон, метил-тестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид, эстрамустин, медроксипрогестерона ацетат, леупролид, Флутамид (Дрогенил), Торемифен (Фарестон) и ZOLADEX®. Эстрогены стимулируют пролиферацию и дифференцировку, таким образом, соединения, связывающиеся с рецепторами к эстрогену, применяют для блокировки их активности. Кортикостероиды могут ингибировать пролиферацию Т-клеток.
Другие химиотерапевтические средства включают комплексные соединения с металлами, например, цисплатин (цис-DDP), карбоплатин, и т.д.; мочевины, например, гидроксимочевину; и гидразины, например, N-метилгидразин; эпидофиллотоксин; ингибитор топоизомеразы; прокарбазин; митоксантрон; лейковорин; тегафур; и т.д. Другие антипролиферативные средства, представляющие интерес, включают иммуносу