Набор для определения вероятности терапевтического ответа на противораковую химиотерапию сердечным гликозидом
Иллюстрации
Показать всеНастоящее изобретение относится к набору для применения в in vitro прогностическом способе для определения или предсказания in vivo терапевтического ответа в пораженных клетках или тканях на лечение заболевания, имеющего этиологию, связанную с избыточной пролиферацией клеток, с использованием сердечного гликозида. Описанный набор используют для определения отношения изоформ α-субъединиц Na,K-ATФазы в пораженных клетках или тканях. Указанный набор может быть использован для предсказания чувствительности рака или опухоли у индивидуума на терапевтическое лечение сердечным гликозидом. Указанный набор может быть применен в способе лечения заболевания или расстройства, имеющего этиологию, связанную с избыточной пролиферацией клеток, с использованием композиции, содержащей сердечный гликозид. 49 з.п. ф-лы, 7 ил., 8 табл., 27 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к набору для прогнозирования результата противораковой химиотерапии сердечным гликозидом. В частности, настоящее изобретение относится к набору для определения вероятности терапевтического ответа in vitro или in vivo в ответ на лечение клеточного заболевания или расстройства, имеющего этиологию, связанную с избыточной пролиферацией клеток, сердечным гликозидом.
Предшествующий уровень техники
Многие заболевания и расстройства, имеющие этиологию, связанную с избыточной пролиферацией клеток, приводят к летальному исходу. Из таких заболеваний наиболее распространенными являются раковые и опухолевые заболевания. Однако нераковые пролиферативные заболевания также могут представлять угрозу для жизни или приводить к снижению качества жизни. Такими заболеваниями могут быть, например: 1) аутоиммунные заболевания, такие как индуцированный антигеном артрит и аллергический энцефаломиелит, 2) хронические воспалительные пролиферативные заболевания, такие как ревматоидный артрит, системный ювенильный хронический артрит, остеопороз и псориаз, 3) пролиферативные заболевания молочной железы, включая фиброкистозное заболевание, 4) пролиферативные заболевания предстательной железы, включая доброкачественную гиперплазию предстательной железы (ДГПЖ), 5) пролиферативные глазные болезни, включая пролиферативную диабетическую ретинопатию и 6) сосудистые пролиферативные заболевания, включая атеросклероз и стеноз коронарной артерии. Для лечения этих заболеваний было предпринято множество попыток разработать методы лечебной или симптоматической терапии, однако несмотря на появление множества химиотерапевтических средств, которые оказались эффективными для лечения различных раковых заболеваний, опухолей и пролиферативных заболеваний других типов, пока еще не было разработано какой-либо комплексной или универсальной лечебной терапии.
В попытке разработать специальные схемы лечения, подходящие для индивидуального лечения пациентов, врачи-клиницисты назначают химиотерапевтические средства, которые могут быть введены отдельно или в комбинации с другими средствами. И в этом случае основным препятствием в разработке индивидуальных схем лечения является непредсказуемость эффективности химиотерапевтических средств в лечении раковых или опухолевых заболеваний конкретного фенотипа. Для лечения этих опасных для жизни заболеваний, врачи-клиницисты вынуждены прибегать к методам «тыка». Они вынуждены полагаться на уже имеющиеся в литературе данные об известных конкретных химиотерапевтических средствах и их показаниях, а затем подумать или догадаться, будет ли данное отдельное химиотерапевтическое средство или комбинация химиотерапевтических средств эффективными в выбранной врачом-клиницистом терапии ракового заболевания или опухоли. Успех таких традиционных методов клинической терапии весьма ограничен.
Врачи-клиницисты сталкиваются с необходимостью проводить прогностический анализ, который позволяет с некоторым достаточным уровнем уверенности предсказать, является ли данное раковое или опухолевое заболевание терапевтически восприимчивым к отдельному конкретному химиотерапевтическому средству или к комбинации терапевтических средств. Прогностический анализ такого типа является крайне важным для выбора химиотерапевтических средств, которые ранее имели ограниченное применение, а именно тех средств, которые только начинают входить в клиническую практику. Было бы желательно разработать такой прогностический анализ, который позволил бы врачам-клиницистам проводить оценку действия одного или нескольких химиотерапевтических средств.
Данные, полученные в результате преклинического обследования и ранее проводимых осмотров пациента, позволяют сделать предположения о потенциальной эффективности сердечных гликозидов (например, буфалина, дигогсина, дигитоксина, убаина и олеандрина) для лечения различных раковых заболеваний, включая, например, рак молочной железы, рак легких, рак предстательной железы и лейкоз.
Один из фармакологических механизмов действия сердечных гликозидов заключается в их способности связываться с ионообменным насосом, Na,K-ATФазой, и ингибировать активность этого конкретного фермента. Na,K-ATФаза, то есть трансмембранный белок, который катализирует активный транспорт Na+ и K+ через плазматическую мембрану, представляет собой хорошо известный фармакологический рецептор для сердечных гликозидов. Этот фермент гидролизует АТФ и использует свободную энергию для инициации транспорта K+ в клетки и транспорта Na+ из клеток в соответствии с их электрохимическими градиентами (Hauptman, P. J., Garg, R., and Kelly, R. A. Cardiac glycosides in the next millieum. Prog. Cardiovasc. Dis. 41: 247-254, 1999).
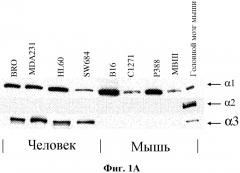
Na,K-АТФaза состоит из двух гетеродимерных субъединиц, то есть каталитической α-субъединицы и гликозилированной β-субъединицы. Существует также и γ-субъединица, но она пока еще подробно не изучена. α-субъединица имеет сайты связывания с АТФ, Na+, K+ и сердечными гликозидами. Функция β-субъединицы заключается в стабилизации каталитической α-субъединицы, и такая субъединица может также играть регуляторную роль. В клетках млекопитающих были идентифицированы четыре различных α-изоформы (α1, α2, α3, α4) и три различных β-изоформы (β1, β2 и β3). Относительная экспрессия субъединиц каждого типа при нормальных и патологических состояниях значительно отличается. Экспрессия α-изоформ является тканеспецифической и ее уровень в тканях грызунов и человека варьируется (Blanco, G. and Mercer, R. W. Isozymes of the Na,K-АТРase: heterogeneity in structure, diversity in function. Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998). Также сообщалось, что экспрессия изоформ Na,K- АТФaзы при раковых заболеваниях человека, таких как рак почек, рак легких, гепатоцеллюлярный рак и рак толстой кишки отличается от экспрессии таких изоформ в соответствующих нормальных тканях (Rajasekaran, S. A., Ball, W. J., Bander, N. H., Pardee, J. D. and Rajasekaran, A. K. Reduced expression of beta subunit of Na/K-APTase in human clear cell renal cell carcinoma. J. Urol. 162: 574- 580, 1999; Avila, J., Lecuona, E., Morales, M., Soriano, A., Alonso, T., and Martin-Vasallo, P. Opposite expression pattern of the human Na/K-АТФase beta-1 isoform in stomach and colon adenocarcinomas. Ann. N. Y. Acad. Sci. 834: 633-635, 1997; Espineda, C, Seligson, D. B., Ball, W. J., Rao, J., Palotie, A., Horvath, S., Huang, Y., Shi. T and Rajasekaran, A. K. Analysis of the Na,K-АТФase α- and β-subunit expression profiles of bladder cancer using tissue microarrays. Cancer 97: 1851868, 2003; Jung, M. H., Kim, S.C., Jeon, G. A., Kim, S. H., Kim, Y., Choi, K. S., Park, S. L, Joe, M. K., and Kimm, K. Identification of differentially expressed genes in normal and tumor human gastric tissue. Genomics 69: 281-286, 2000). Кроме того, кажущаяся аффинность сердечных гликозидов по отношению к различным α-изоформам абсолютно отличаются друг от друга. Уровень связывания сердечных гликозидов с αl-изоформой ниже уровня связывания с α2- и α3-изоформами, которые обладают в 250 раз большей или даже еще большей чувствительностью к ингибированию лекарственными средствами этого типа (Blanco, G. and Mercer, R. W. Isozymes of the Na, K-АТФase: heterogeneity in structure, diversity in function. Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998). В публикации Sakai et al. (FEBS Letters 563: 151- 154, 2004) сообщается, что уровень экспрессии α3-изоформы субъединицы в раковых клетках прямой и ободочной кишки человека превышает уровень ее экспрессии в нормальных клетках прямой и ободочной кишки.
Олеандрин и олеандригенин ингибируют пролиферацию раковых клеток человеческой предстательной железы посредством индуцирования апоптоза, который вызывается, по меньшей мере частично, повышением уровня внутриклеточного Ca2+ благодаря ингибированию Na,K-АТФазы (McConkey, D. J., Lin, Y.., Nutt, L. K., Ozel, H. Z., and Newman, R. A. Cardiac glycosides stimulate Ca2+ increases and apoptosis in androgen-independent, metastatic human prostate adenocarcinoma cells. Cancer Res. 60: 3807-3812, 2000). Олеандрин и олеандригенин также ингибируют экспорт фактора роста фибробластов-2 посредством взаимодействия с мембраной и ингибирования активности Na,K-АТФазы (Smith, J. A., Madden, T., Vijjeswarapu, M., and Newman, R. A. Inhibition of export of fibroblast growth factor-2 (EGF-I) from the prostate cancer cell lines PC3 and DU145 by Anvirzel and its cardiac glycoside component, oleandrin. Biochem. Pharmacol. 62: 469-472, 2001).
α1-субъединица Na,K-АТФазы присутствует во многих тканях благодаря комплексу α1β1, рассматриваемому как ген «домашнего хозяйства», а α3-субъединица детектируется преимущественно в возбуждаемых тканях, в корковом веществе почки, в костном мозге и в сосочках, а также в нервных тканях.
Nerium oleander представляет собой декоративное растение, широко распространенное в субтропической Азии, в юго-западных районах Соединенных Штатов и в странах Средиземноморья. Его лечебные и токсикологические свойства уже давно известны специалистам. Это растение было использовано, например, для лечения геморроя, язвы, лепры, змеиных укусов и даже для стимуляции выкидыша. Олеандрин, который является важным компонентом экстракта олеандра, представляет собой сильный ингибитор роста человеческих опухолевых клеток (Afaq F et al. Toxicol. Appl. Pharmacol. 195:361-369, 2004). Опосредуемая олеандрином гибель клеток ассоциируется с притоком кальция, высвобождением цитохрома С из митохондрий, протеолитическими процессами с участием каспаз 8 и 3, расщеплением под действием поли(АДФ-рибозо)полимеразы и фрагментацией ДНК.
Было продемонстрировано, что олеандрин представляет собой основной цитотоксический компонент Nerium oleander (Newman, et al., J. Herbal Pharmacotherapy, vol. 13, pp. 1-15, 2001). Олеандрин представляет собой сердечный гликозид, который является экзогенным и обычно не присутствует в организме. Олеандрин индуцирует апоптоз человеческих, но не мышиных опухолевых клеточных линий (Pathak et al., Anti-Cancer Drugs, vol. 11, pp. 455-463, 2000), ингибирует активацию NF-kB (Manna et al., Cancer Res., vol. 60, pp. 3838-3847, 2000) и опосредует клеточную гибель отчасти благодаря опосредуемому кальцием высвобождению цитохрома C (McConkey et al., Cancer Res., vol. 60, pp. 3807-3812, 2000). Недавно была завершена фаза I испытания экстракта олеандра в горячей воде (то есть Anvirzel™) (Mekhail et al., Am. Soc. Clin. Oncol., vol. 20, p. 82b, 2001). Было сделано заключение, что экстракты олеандра в дозах до 1,2 мл/м2/день являются безопасными для введения человеку. Какой-либо дозоограничивающей токсичности не наблюдалось.
Сообщалось, что убаин, сердечный гликозид, который является эндогенным для организма, усиливает in vitro чувствительность клеток человеческой аденокарциномы легких A549 к лучевой терапии, но является неэффективным для модификации чувствительности фибробластов здоровых легких человека к лучевой терапии (Lawrence, Int. J. Radiat. Oncol. Biol. Phys., vol. 15, pp. 953-958, 1988). Позже было показано, что убаин сообщает человеческим опухолевым клеткам различных гистологических типов, включая клетки плоскоклеточной карциномы и меланомы (Verheye-Dua et al., Strahlenther. Onkol, vol. 176, pp. 186-191, 2000), чувствительность к лучевой терапии. Сердечный гликозид олеандрин также обладает способностью повышать чувствительность клеток к цитотоксическому действию ионизирующего излучения (заявка на патент США рег. No. 10/957875, Newman, et al. и Nasu et al., Cancer Lett. Vol 185, pp.145-151, 2002). В публикации pre-grant заявки на патент США No. 20050112059, Newman et al., описана лучевая терапия усиленного действия, применяемая для лечения рака путем введения олеандрина.
Chen и др. (Breast Cancer Research and Treatment (2006), 96, 1-15) высказали предположение, что сердечные гликозиды, такие как убаин и наперстянка, могут быть использованы для разработки лекарственных средств против рака молочной железы, таких как ингибиторы Na+,K+-АТФaзы и антагонисты ER.
Smith и др. (Biochemical Pharmacology (2000), 62, 1-4) сообщают, что ANVIRZEL и его основной компонент, а именно, сердечный гликозид олеандрин, ингибирует экспорт фактора роста опухоли, фактора роста фибробластов-2 (FGF-2) из клеточных линий рака предстательной железы PC3 и DU145.
Newman и др. (J. Experimental Therapeutics and Oncology (2006), 5, 167-181) сообщают, что инкубирование клеток человеческой злокачественной меланомы BRO с олеандрином приводит к зависимому от времени образованию молекул реактивного кислорода, радикалов супероксид-аниона, которые опосредуют митохондриальные повреждения и потерю пулов клеточного глутатиона (GSH), что в конечном счете приводит к гибели опухолевых клеток.
После экстракции гликозидов из растений вида Nerium были получены фармакологически/терапевтически активные ингредиенты Nerium oleander. Такими компонентами, среди прочих, являются олеандрин, нерин и другие соединения сердечных гликозидов. Растительные экстракты могут быть использованы для лечения клеточно-пролиферативных заболеваний у животных. Экстракты олеандрина, получаемые путем экстракции гликозида Nerium oleander в горячей воде и выпускаемые под торговым знаком ANVIRZEL™, являются коммерчески доступными и содержат концентрированную форму или порошкообразную форму экстракта гликозида Nerium oleander в горячей воде.
Хуа-Чан-Су (Huachansu) представляет собой экстракт, полученный из кожи жабы и содержащий буфадиенолиды, такие как буфалин, сердечный гликозид. Хуа-Чан-Су представляет собой препарат, разрешенный для его применения при лечении рака в Китае. Этот препарат был использован для лечения различных раковых заболеваний, включая рак печени, рак желудка, рак легких, рак кожи и рак пищевода.
Если учесть особую ценность сердечных гликозидов для лечения заболеваний или расстройств, имеющих этиологию, связанную с пролиферацией клеток, то необходимость в разработке набора для предсказания терапевтического ответа на лечение данного заболевания или расстройства сердечным гликозидом является совершенно очевидной. Такой набор не был описан ранее, а также не существует упоминаний о каких-либо попытках его разработки.
Описание сущности изобретения
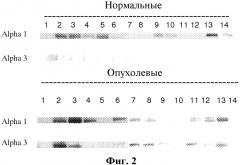
Настоящее изобретение относится к набору для предсказания эффективности сердечного гликозида или композиции, содержащей сердечный гликозид, в отношении конкретного фенотипа заболевания или расстройства, имеющего этиологию, связанную с избыточной пролиферацией клеток. Авторами настоящего изобретения было обнаружено, что восприимчивость или чувствительность такого заболевания или расстройства к лечению сердечным гликозидом зависит от отношения уровней экспрессии изоформы α3 к изоформе α1 субъединиц Na,K-АТФазы в клетках или тканях, пораженных заболеванием или пролиферативным расстройством. В общих чертах, чем выше отношение уровня экспрессии изоформы α3 Na,K-АТФазы к уровню экспрессии изоформы α1 Na,K-АТФазы в клетках или тканях, тем более чувствительными (терапевтически восприимчивыми) являются клетки к действию сердечных гликозидов. То есть чем выше отношение изоформы α3 (восприимчивой к действию лекарственного средства) к изоформе αl (не восприимчивой к действию лекарственного средства), тем более чувствительными являются клетки или ткани к ингибированию их пролиферации сердечными гликозидами.
В одном из своих аспектов настоящее изобретение относится к in vitro прогностическому анализу, который может быть использован для предсказания in vivo терапевтического ответа на заболевание или расстройство, имеющее этиологию, связанную с избыточной пролиферацией клеток, в целях проведения лечения с использованием сердечного гликозида или композиции, содержащей сердечный гликозид, где указанный анализ включает:
определение отношения α3-изоформы к αl-изоформе α-субъединиц Na, K-АТФазы в образце, выделенном непосредственно или опосредованно из пораженной клеточной ткани in vivo у индивидуума с заболеванием или расстройством, имеющим этиологию, связанную с избыточной пролиферацией клеток, где указанный образец содержит одну или несколько изоформ α-субъединицы Na, K-АТФазы; и
определение вероятности терапевтического ответа у индивидуума, подвергнутого лечению терапевтически релевантной дозой сердечного гликозида.
В некоторых вариантах изобретения: 1) указанный анализ также включает предсказание терапевтического ответа клеточной ткани на лечение сердечным гликозидом, если отношение превышает или равно по меньшей мере 1; 2) указанный анализ также включает предсказание по меньшей мере частичного терапевтического ответа клеточной ткани на лечение сердечным гликозидом, если отношение составляет в пределах от 0,5 до 1,0; 3) указанный анализ также включает предсказание, по существу, отсутствия терапевтического ответа клеточной ткани на лечение сердечным гликозидом, если отношение составляет менее 0,3; 4) указанный анализ также дополнительно включает предсказание того факта, что ткани, имеющие отношение субъединиц 1:100, будут давать больший ответ на терапевтическое лечение, чем ткани, имеющие отношение изоформ менее чем 1; 5) указанный анализ также включает предсказание того факта, что ткани, в которых детектируется лишь изоформа α3, но не изоформа α1, будут наиболее восприимчивыми к терапевтическому лечению сердечными гликозидами; и/или 6) указанный анализ также включает предсказание терапевтического ответа клеточной ткани на лечение сердечным гликозидом, если указанное отношение составляет ≥2, ≥3, ≥4, ≥5, ≥7, ≥9, ≥10, ≥15, ≥20, ≥25, ≥40, ≥50, ≥75 или ≥100.
В некоторых вариантах изобретения вероятность терапевтического ответа выражается как отношение α3-изоформы к α1-изоформе Na,K-АТФазы, представленное в нижеследующей таблице:
| Отношение | Вероятность терапевтического ответа у индивидуума |
| от 0,3 до менее чем 0,5 | от 20 до <30% |
| от 0,5 до менее чем 1 | от 30 до 50% |
| ≥1 | >50% |
| >10 | >75% |
В вышеуказанной таблице терапевтическим ответом может быть частичный или полный терапевтический ответ или замедление прогрессирования заболевания.
В некоторых вариантах изобретения: 1) стадия анализа включает количественную оценку уровня экспрессии каждой изоформы α3 субъединицы Na,K-AТФазы и изоформы α1 субъединицы Na,K-АТФазы в образце in vitro или в биоптате, и вычисление их отношения; 2) стадия анализа включает определение количества каждой изоформы α3 субъединицы Na,K-АТФазы по отношению к количеству изоформы α1 субъединицы Na,K-АТФазы в образце in vitro и вычисление их отношения; 3) указанный анализ также включает проведение статистического анализа на основе данных, по которым было определено указанное отношение; 4) указанным образцом является клеточная ткань, клеточная масса, клеточный лизат, мембранные препараты, приготовленные из этих компонентов, или их гистопатологические срезы, фиксированные на предметных стеклах; 5) указанным образцом является образец in vitro; 6) указанный образец содержит по меньшей мере две изоформы α-субъединицы Na, K-АТФазы; 7) указанный образец содержит по меньшей мере α1- и α3-изоформы α-субъединицы Na,K-AТФазы; 8) указанный способ также включает лизис или разрушение клеток или тканей, или взятие биоптатов, или фиксацию срезов ткани для гистопатологической оценки пораженной клеточной ткани in vivo с последующим получением образца; 9) указанный способ включает проведение вестерн-блот-анализа или анализа методом иммуногистохимического окрашивания образца для определения количества и относительного уровня экспрессии изоформы α3 субъединицы Na,K-AТФазы по отношению к изоформе α3 субъединицы Na,K-АТФазы в данном образце и вычисление их отношения; 10) указанный способ также включает проведение радиометрического или денситометрического анализа геля для определения содержания изоформы α3 субъединицы Na,K-АТФазы по отношению к содержанию изоформы αl-субъединицы Na,K-АТФазы в образце; 11) указанный способ также включает проведение радиометрического или денситометрического анализа геля для детектирования присутствия и для количественной оценки содержания изоформы α3 субъединицы Na,K-АТФазы и изоформы α1 субъединицы Na,K-АТФазы в образце; 12) проводят сравнение уровня содержания изоформы α3 субъединицы Na,K-АТФазы и изоформы α1 субъединицы Na,K-АТФазы в образце с уровнем содержания изоформы α3 субъединицы Na,K-AТфазы и/или изоформы α1 субъединицы Na,K- АТФазы в образце, используемом в качестве позитивного контроля и/или в образце, используемом в качестве негативного контроля; и/или 13) проводят сравнение уровня содержания изоформы α3 субъединицы Na,K-АТФазы и изоформы α1 субъединицы Na,K-АТФазы в образце ткани, где, как известно, в качестве контроля используется экспрессия только одной из изоформ α3 и α1 субъединиц.
В некоторых вариантах изобретения: 1) пораженную клеточную ткань берут у индивидуума, такого как млекопитающее; 2) пораженную клеточную ткань берут у человека, коров, собак, кошек, лошадей, свиней или других домашних животных, независимо от того, представляют ли они промышленную ценность или нет; 3) заболеванием или расстройством, имеющим этиологию, связанную с избыточной пролиферацией клеток, является раковое или опухолевое заболевание, или другие пролиферативные заболевания, оказывающие негативное влияние на качество жизни человека или животного; и/или 4) раковое или опухолевое заболевание выбрано из группы, состоящей из рака прямой и ободочной кишки, рака головы и шеи, рака коры надпочечника, рака заднего прохода, рака желчных протоков, рака мочевого пузыря, рака кости, метастазов в кости, саркомы кости, рака головного мозга, рака молочной железы, рака шейки матки, не-ходжкинской лимфомы, рака прямой кишки, рака пищевода, рака глаз, рака желчного пузыря, карциноидного рака желудочно-кишечного тракта, трофобластоза беременных, болезни Ходжкина, саркомы Капоши, рака почек, рака гортани и гортанной части глотки, рака печени, рака почек (немелкоклеточных и мелкоклеточных карцином), карциноидных опухолей легких, злокачественной мезотелиомы, рака, дающего метастазы, множественной миеломы, миелодиспластического синдрома, рака носовой полости и параназального рака, рака носоглотки, нейробластомы, новообразований в области центральной нервной системы, рака ротовой полости и ротоглотки, остеосаркомы, рака яичника, рака поджелудочной железы, рака пениса, рака гипофиза, рака предстательной железы, ретинобластомы, рака слюнных желез, саркомы, рака кожи, рака желудка, рака яичек, рака тимуса, рака щитовидной железы, рака мочеточника, саркомы матки, рака влагалища, рака вульвы или опухоли Вильмса.
В некоторых вариантах изобретения: 1) указанный способ также включает идентификацию индивидуума, страдающего заболеванием или расстройством, имеющим этиологию, связанную с избыточной пролиферацией клеток; 2) указанный способ также включает стадию взятия образца пораженных клеток у индивидуума; 3) указанный способ включает получение точной информации о проведении анализов на присутствие α3- и α1-изоформ α-субъединицы Na,K-АТФазы; и/или 4) указанный способ включает получение подробной информации по поводу интерпретации прогностических данных.
В некоторых вариантах изобретения пролиферативными заболеваниями являются, но не ограничиваются ими: 1) аутоиммунные заболевания, такие как индуцированный антигеном артрит и аллергический энцефаломиелит; 2) хронические воспалительные пролиферативные заболевания, такие как ревматоидный артрит, системный хронический ювенильный артрит, остеопороз и псориаз; 3) пролиферативные заболевания молочной железы, включая фиброкистоз; 4) пролиферативные заболевания предстательной железы, включая доброкачественную гиперплазию предстательной железы (BPH); 5) пролиферативные болезни глаз, включая пролиферативную диабетическую ретинопатию; и 6) сосудистые пролиферативные заболевания, включая атеросклероз и стеноз коронарной артерии. В некоторых вариантах изобретения лечение двух или более пролиферативных заболеваний осуществляют одновременно.
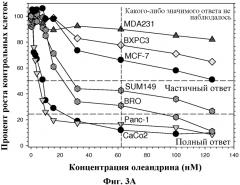
Раковыми заболеваниями, которые, как очевидно, являются особенно восприимчивыми к лечению сердечными гликозидами, на что указывают лабораторные исследования, проводимые с использованием человеческих опухолевых клеточных линий, являются рак предстательной железы, рак легких, рак молочной железы, рак мочевого пузыря, остеогенная саркома, рак головного мозга (полиморфная глиобластома) и рак толстой кишки. Раковыми опухолями могут быть опухоли, имеющиеся у человека, у индивидуума, не являющегося человеком, или у животного.
В некоторых вариантах изобретения: 1) сердечный гликозид выбран из группы, состоящей из олеандрина, убаина, буфалина, дигитоксина, дигоксина, цинобуфаталина, цинобуфагина и резибуфогенина; 2) сердечный гликозид присутствует в чистой форме независимо от того, был ли он получен путем экстракции из источника растительного или животного происхождения, или синтезирован или получен путем химической модификации (например, дериватизации) коммерчески доступного сердечного гликозида; 3) сердечный гликозид присутствует в экстракте; 4) сердечный гликозид присутствует в фармацевтическом препарате или в фармацевтической композиции; 5) сердечный гликозид был получен из растительной массы растения олеандра; 6) растения олеандра включают виды Nerium, такие как Nerium oleander, или виды Thevetia, такие как Thevetia nerifolia (также известные как желтый олеандр); и/или 7) экстракт сердечного гликозида был получен путем экстракции из надкритической жидкости (SCF), необязательно, в присутствии модификатора.
В некоторых вариантах изобретения: 1) SCF-экстракт также включает, помимо сердечного гликозида, по меньшей мере одно другое фармакологически приемлемое активное вещество; 2) указанное другое активное вещество может сообщать терапевтическую эффективность сердечному гликозиду при введении указанного экстракта индивидууму; 3) указанное другое активное вещество усиливает терапевтический эффект сердечного гликозида благодаря аддитивному или синергическому действию вместе с указанным сердечным гликозидом и/или 4) указанный экстракт был получен из кожи жабы или выделенного из нее секрета.
В другом своем аспекте настоящее изобретение относится к набору, подходящему для его применения при проведении прогностического анализа согласно изобретению. Указанный набор содержит: a) первое «первичное» антитело, обладающее аффинностью связывания с изоформой α3 субъединицы Na,K-АТФазы; и b) второе «первичное» антитело, обладающее аффинностью связывания с изоформой α1 субъединицы Na,K-АТФазы. Указанный набор может быть адаптирован для его применения при проведении вестерн-блот-анализа методом гель-электрофореза и/или анализа на иммуногистохимическое окрашивание.
Указанный набор может также включать, но необязательно: a) композицию для лизиса; b) образец, используемый в качестве позитивного контроля и содержащий изоформу α3 субъединицы Na,K-АТФазы; c) образец, используемый в качестве позитивного контроля и содержащий изоформу α3 субъединицы Na,K-АТФазы и изоформу α1 субъединицы Na,K-АТФазы; d) образец, используемый в качестве негативного контроля и содержащий изоформу α3 субъединицы Na,K-АТФазы и изоформу α1 субъединицы Na,K-АТФазы; e) «второе» антитело, то есть ПХ-конъюгированное козье антитело против мышиных IgG (которое может быть использовано, например, для визуализации представляющих интерес белков); f) гель-образующий материал, подходящий для проведения анализа методом гель-электрофорезы; g) радиоактивно меченные или окрашивающие маркеры молекулярной массы (хромогенные маркеры, способные продуцировать визуально или инструментально детектируемый сигнал); h) инструкции по применению набора и осуществлению прогностического анализа; i) денситометр или радиометр; j) водную жидкую среду; k) набор для приготовления геля/мембраны; l) блокирующий раствор; m) промывочный буфер; n) материалы, содержащиеся в наборе для вестерн-блот-анализа; или o) их комбинации.
В некоторых вариантах набора: a) первое «первичное» антитело обладает специфической аффинностью связывания с изоформой α3 субъединицы Na,K-АТФазы; b) второе «первичное» антитело обладает специфической аффинностью связывания с изоформой α1 субъединицы Na,K-АТФазы; c) «вторым» антителом является конъюгированное с пероксидазой хрена козье антитело против α-цепи мышиного IgG, либо другие, но не мышиные «вторые» антитела против мышиного IgG, связанные с соответствующим маркером, таким как пероксидаза хрена; и/или d) первичными антителами являются моноклональные антитела.
В некоторых вариантах изобретения набор для анализа на иммуногистохимическое окрашивание включает: a) раствор для обнаружения антигена (который может иметь высокий pH или может быть получен на основе лимонной кислоты); b) буфер; c) материал для гашения эндогенной пероксидной активности (который может содержать пероксид водорода, необязательно в метаноле); d) антитело против изоформы α3 субъединицы Na,K-АТФазы и/или антитело против изоформы α1 субъединицы Na,K-АТФазы; e) неиммунное антитело против мышиного IgGl; f) универсальный реагент-антитело, содержащий смесь реагентов-антител против кроличьих IgG и против мышиных IgG; g) первичный химический краситель, такой как диаминобензидин; h) общий химический краситель для контрастного окрашивания, такой как гематоксилин или эозин; i) специфический краситель для клеточных органелл, такой как краситель, используемый для окрашивания ядер (например, этидийбромид, бисбензимидазол или сульфат калия-алюминия) или митохондрий (например, красный краситель-метка для митохондрий, 10-нонилакридиновый оранжевый); j) материалы, содержащиеся в наборе для иммуногистологического окрашивания; или k) комбинацию из двух или более указанных компонентов. С использованием смежных срезов тканей или клеток, окрашивание изоформы α1 субъединицы может быть осуществлено методом, аналогичным методу, применяемому для окрашивания изоформы α3 субъединицы, где используются соответствующие специфические «первые» антитела против изоформы α1 субъединицы и изоформы α3 субъединицы. Используемый здесь специфический краситель для клеточных органелл представляет собой агент или комбинацию агентов, используемых для специфического окрашивания органелл конкретных типов (метахондрий, ядер, ядрышек, аппарата Гольджи, вакуолей и т.п.) в клетках (человеческих клетках, нечеловеческих клетках или в клетках животных).
В некоторых вариантах изобретения анализ на иммуногистохимическое окрашивание включает стадии: a) получения образца ткани млекопитающего; b) иммунохимического окрашивания α3-изоформы или α1-изоформы α-субъединицы Na,K-АТФазы, присутствующих в образце; c) определения содержания изоформы α3 субъединицы Na,K-АТФазы и содержания изоформы α1 субъединицы Na,K-АТФазы в образце; и d) определения отношения α3-изоформы к α1-изоформе, присутствующих в образце.
В некоторых вариантах изобретения анализ на иммуногистохимическое окрашивание включает стадии: a) получения образца ткани млекопитающего; b) осуществления процедуры восстановления антигена на ткани; c) гашения активности эндогенного пероксида в ткани; d) обработки инактивированной ткани «первыми» антителами против изоформы α3 субъединицы Na,K-АТФазы и/или изоформы α1 субъединицы Na,K-АТФазы; е) воздействия на обработанную антителом ткань «вторыми» антителами против кроличьих IgG, против мышиных IgG или их комбинациями; f) окрашивания IgG-обработанной ткани первичным красителем; g) обработки окрашенной ткани красителем для контрастного окрашивания в целях получения иммуногистохимически окрашенной ткани; h) анализа иммуногистохимически окрашенной ткани визуальными или фотометрическими методами; и i) оценки количества α3- и/или α1-изоформ, присутствующих в ткани млекопитающего. Количественная оценка окрашивания антителом против данной изоформы может быть осуществлена, например, в том случае, если «второе» антитело является биотинилированным. Затем может быть добавлен краситель вектастатин ABC с последующим инкубированием в течение 30 минут. После промывки окрашенных срезов, они могут быть инкубированы с диаминобензидиновым субстратом для достижения достаточного уровня окрашивания. Количественная оценка окрашенных тканей может быть затем осуществлена вручную путем определения интенсивности окрашивания или на электронном устройстве с использованием компьютеризированной фиксации изображения и цифрового сканирования представляющих интерес областей. Количественная оценка может быть также упрощена с использованием коммерчески доступной компьютерной программы обработки цифрового изображения. В некоторых вариантах изобретения данный анализ также включает стадии: j) промывки ткани, полученной в стадии a); k) промывки ткани, полученной в стадии c); l) получения срезов, используемых в качестве негативного контроля (не имеющих опухолевых или раковых клеток), то есть «непервичного» контроля; m) обработки срезов негативного контроля неиммунным антителом против мышиных IgG; n) промывки ткани, полученной в стадии e); o) промывки ткани, полученной в стадии f); и/или промывки ткани, полученной в стадии g). Промывка может быть осуществлена водой, забуференной водой и/или TBS (примерно 50 мМ трис-HCl, примерно 300 мМ NaCl, примерно 0,1% твин 20, pH примерно 7,6).
Образцом позитивного контроля может быть ткань, клеточная масса, клеточный лизат или приготовленные из них мембранные препараты, которые могут быть получены посредством биопсии или другими хирургическими способами. Образцом негативного контроля может быть ткань, клеточная масса, клеточный лизат или приготовленные из них мембранные препараты, которые, как известно из предварительных анализов, не содержат α3-изоформы α-субъединицы Na,K-АТФазы. В некоторых вариантах изобретения негативный контроль состоит из клеточной массы опухолевой ткани грызунов (мышей или крыс) или мышиных или крысиных клеток, культивированных in vitro.
Для определения отношения изоформы α3 к α1 могут быть применены аналитические методы, которые представляют собой альтернативные методы оценки относительного состава изоформ α-субъединицы Na,K-АТФазы и их отношений в соответствии с настоящим изобретением. Эти методы могут быть осуществлены, например, с использованием соответствующих антител в ELISA (твердофазном иммуноферментном анализе) или массивов белок-содержащих тканей или клеточных лизатов. Альтернативно, для определения мРНК, кодирующей различные изоформы α-субъединицы Na,K-АТФазы, могут быть осуществлены Нозерн-блот-анализы и родственные методы (например, rtPCR, полимеразная цепная реакция в реальном времени). Для оценки количества α3-изоформы и α1-изоформы α-субъединицы, присутствующей в образце, может быть также проведен анализ на иммуногистохимическое окрашивание.
В другом своем аспекте настоящее изобретение относится к способу лечения у индивидуума заболевания или расстройства, имеющего этиологию, связанную с избыточной пролиферацией клеток, с использованием композиции, содержащей сердечный гликозид, где указанный способ включает:
определение отношения α3-изоформы к αl-изоформе α-субъединиц Na,K-АТФазы в образце, выделенном непосредственно или опосредованно из пораженной клеточной ткани in vivo у индивидуума с заболеванием или расстройством, имеющим этиологию, связанную с избыточной пролиферацией клеток, где указанный образец содержит одну или несколько изоформ α-субъединицы Na, K-АТФазы; и
если данное отношение составляет ≥0,3, ≥0,5, ≥1, или ≥10, введение указанному индивидууму композиции, содержащей сердечный гликозид.
В еще одном своем аспекте настоящее изобретение относится к способу лечения у индивидуума заболевания или расстройства, имеющего этиологию, связанную с избыточной пролиферацией клеток, с использованием композиции, содержащей сердечный гликозид, где указанный способ включает:
взятие образца пораженной ткани у индивидуума, страдающего заболеванием, имеющим этиологию, связанную с избыточной пролиферацией клеток, и образца, содержащего одну или несколько изоформ α-субъединицы Na,K-АТФазы;
определение отношения α3-изоформы к αl-изоформе α-субъединиц Na,K-АТФазы в образце; и
если данное отношение составляет ≥0,3, ≥0,5, ≥1, или ≥10, введение указанному индивидууму композиции, содержащей сердечный гликозид.
Некоторыми вариантами настоящего изобретения являются варианты, в которых: 1) указанному индивидууму назначают и вводят терапевтически релевантную дозу композиции, содержащей сердечный гликозид; 2) указанному индивидууму вводят композицию, содержащую сердечный гликозид, в соответствии с назначенной схемой введения доз; 3) указанному индивидууму вводят композицию, содержащую экстракт, включающий сердечный гликозид; 4) указанный экстракт также содержит один или несколько других терапевтически эффективных агентов; 5) указанная композиция также содержит один или несколько других терапевтически эффективных агентов; 6) указанному индивидууму вводят приготовленный в горячей воде экстракт, взятый от растения или животного и содержащий сердечные гликозиды, в дозе от 2 мг до 22,5 мг в день; или 7) указанному индивидууму вводят концентрированный экстракт (например, экстрак