Способ оптимизации подбора антиангинальной терапии при ишемической болезни сердца и микрососудистой стенокардии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к кардиологии. Определяют исходные параметры ЛДФ и капилляроскопии. Затем поочередно принимают курсом 3 дня рекомендуемые антиангинальные препараты. При этом каждый последующий препарат - спустя 5 полупериодов выведения предыдущего и после каждого курса определяют параметры ЛДФ. При этом оценивают: реакцию сосудов микроциркуляции кожи, функциональное состояние тонусформирующих механизмов модуляции кровотока: эндотелиальный - Аэ, нейрогенный - Ан и миогенный - Ам, респираторно обусловленные колебания кровотока - Ав, пульсовые колебания кровотока - Ас, а также параметры капилляроскопии - величину перикапиллярной зоны - ПЗ. После чего сравнивают исходные показатели ЛДФ и капилляроскопии - ПЗ с этими же показателями, полученными после приема тестируемых препаратов, и выбирают наиболее оптимальный препарат, после терапии которым показатели Аэ, Ан, Ам и Ас приближаются к норме, Ав≤0,08, ПЗ=105±15, для длительной терапии. Способ позволяет повысить эффективность лечения и предупреждение рецидивов заболевания у больных ишемической болезнью сердца и микрососудистой стенокардией. 3 пр.
Реферат
Изобретение относится к медицине, в частности к кардиологии, и может быть использовано для подбора антиангинальной терапии больным с ишемической болезнью сердца (обусловленной атеросклерозом коронарных артерий), с микрососудистой стенокардией (при наличии интактных коронарных артерий и нарушенной регуляцией тонуса в основном коронарных прекапиллярных артериол) и их сочетанием.
Ишемическая болезнь сердца развивается вследствие несоответствия метаболической потребности миокарда в кислороде и его доставкой по коронарным артериям, что может быть обусловлено гемодинамическим препятствием в коронарных артериях (атеросклеротическая бляшка более 70%), нарушением тонуса коронарных сосудов и их сочетанием. Нарушение тонуса макро-микрососудов коронарного русла является причиной стенокардии и ишемии миокарда в отсутствие гемодинамически значимых стенозов в магистральных артериях.
Микрососудистая стенокардия (МСС) - особая форма ишемической болезни сердца, которая развивается в отсутствие гемодинамически значимых атеросклеротических бляшек в коронарных артериях. Распространенность ее достаточно велика - приблизительно у 50% женщин и 20% мужчин при наличии стенокардии коронароангиография (КАГ) не выявляет атеросклероза эпикардиальных артерий. Прогноз этого заболевания также неблагоприятен (у 15% пациентов в отдаленном периоде развиваются серьезные сердечно-сосудистые осложнения). Лечение МСС (направленное на устранение ишемии миокарда) представляет собой сложную задачу и определяется особенностями патогенеза этого заболевания.
В мировой и отечественной медицинской практике пациентам, например, с микрососудистой стенокардией проводят подбор тех или иных антиангинальных препаратов (β-адреноблокаторов, антагонистов кальция, нитратов, ксантинов, активаторов АТФ-зависимых калиевых каналов), ориентируясь на клинический эффект - уменьшение приступов стенокардии или их устранение. Результаты клинических исследований не поддаются обобщению в связи с отсутствием единых критериев селекции и немногочисленностью выборок больных, несовершенным дизайном исследования и недостижением эффективности лечения.
О состоянии микроциркуляции (МЦ) системы коронарного кровообращения можно судить по косвенным признакам, отражающим функциональное состояние, таким как резерв миокардиального кровотока и коронарный резерв. В последние годы появилось несколько визуализационных технологий, позволяющих неинвазивно оценивать коронарный резерв: радионуклидные методы (однофотонная эмиссионная компьютерная томография миокарда - ОЭКТ, позитронная эмиссионная томография - ПЭТ), методы высокочастотной трансторакальной эхокардиографии и магнитно-резонансной томографии. Однако эти методы достаточно дороги и трудоемки для использования оценки эффективности подбираемой терапии в рутинной клинической практике.
Генерализованный характер дисфункции микрососудов у больных ишемической болезнью сердца и микрососудистой стенокардией предполагает нарушение микроциркуляции (МЦ) не только в миокарде, но и в периферических тканях. В настоящее время с развитием оптики и компьютерного анализа стало возможным с помощью лазерной допплеровской флоуметрии (ЛДФ) и компьютерной капилляроскопии микрососудов кожи проведение точной количественной оценки изменений в МЦ, детальное изучение его морфологии и архитектоники.
Известен способ оценки воздействия гипотензивной терапии у больных гипертонической болезнью на параметры показателей микроциркуляции методом ЛДФ. В этом исследовании оценивались результаты применения различных вазоактивных препаратов (β-блокаторы, ингибиторы ангиотензинпревращающего фермента, диуретики, антагонисты Ca++ и др.) на показатели периферической микроциркуляции по данным ЛДФ с Фурье-анализом амплитудно-частотных параметров кровотока. Были получены данные об уменьшении частоты застойно-стазического и гиперемического типов микроциркуляции и увеличение частоты нормоциркуляторного типа, что свидетельствовало о нормализации микроциркуляции в процессе лечения.
(Микроциркуляция в кардиологии, под ред. член-корр. РАМН, проф. В.И. Маколкина, гл. 10. Состояние микроциркуляции при гипертонической болезни, 2004, с. 96-104).
Данный способ математического анализа подходит для стационарных, периодических процессов, а физиологические процессы, происходящие в организме, являются апериодическими. По данному способу не возможно изолированно оценить вазомоторную активность каждого из звеньев (эндотелиальный, нейрогенный, миогенный) модуляции тонуса гладкомышечных клеток прекапиллярных артериол и все три механизма были объединены в один низкочастотный диапазон - диапазон медленных колебаний. Кроме того, отсутствует контроль динамики функционирования фильтрационно-реабсрбционного механизма обмена веществ, который в процессе медикаментозной коррекции тонуса резистивных микрососудов неизбежно претерпевает существенные изменения. А также в данном способе отсутствует алгоритм подбора оптимальной терапии с учетом реакции тонусрегулирующих механизмов прекапиллярных артериол.
Наиболее близким к заявляемому способу является способ лазерной допплер-флуометрии (ЛДФ) в оценке расстройств микроциркуляции и антиишемической эффективности антиангинальных препаратов нового поколения. Проводилось открытое контролируемое рандомизированное исследование антиишемической эффективности трансдермальной формы нитроглицерина Депонита (Д), селективного пролонгированного b - адреноблокатора бисопролола фумарат - Конкора (К) и пролонгированного антагониста кальция Адалата SL (А) на клинико-функциональное состояние и микроциркуляцию соответственно у 20; 22 и 40 больных ишемической болезнью сердца (ИБС): стенокардией напряжения II-III функционального класса, перенесших ИМ. Возраст пациентов колебался от 36 до 60 лет (в среднем - 53,4±3,1 года). Подбор эффективной дозы исследуемых препаратов осуществлялся методом парных велоэргометрий. Курсовая монотерапия Д, К, А проводилась в течение 4 недель. Суточная доза Д составила 6,8±2,1 мг, К - 5,3±1,6 мг, А - 16,5±3,2 мг в 2 приема. Центральная гемодинамика оценивалась по динамике в условиях велоэргометрической нагрузочной пробы посредством тетраполярной грудной реографии. Тканевой кровоток исследовался с использованием одноканального лазерного допплеровского флоуметра BLF 21 фирмы "Transonic Sistems Inc." (США). Исследование проводилось после 15 минутной адаптации до лекарственного воздействия, в условиях острой фармпробы и после курсовой терапии. Накожный датчик "R" накладывался на дорсальную поверхность предплечья (в положении пациента сидя). Базальный кровоток регистрировался в течение трех минут с последующим проведением функциональных тестов. Системная микроциркуляция оценивалась методом конъюнктивальной биомикроскопии.
(Гарганеева А.А. и др. Диагностическая значимость лазерной допплер-флуометрии (ЛДФ) в оценке расстройств микроциркуляции и антиишемической эффективности антиангинальных препаратов нового поколения, Методология флоуметрии, 1999, с. 61-68).
Недостатком данного способа также является невозможность изолированно оценить вазомоторную активность каждого из звеньев (эндотелиальный, нейрогенный, миогенный) модуляции тонуса гладкомышечных клеток прекапиллярных артериол.
Задачей изобретения является создание эффективного способа оптимизации антиангинальной терапии при ишемической болезни сердца и микрососудистой стенокардии, позволяющего обеспечить оптимальный индивидуальный принцип подбора терапии, назначить патогенетически обоснованное лечение и предупредить в последующем рецидивы болезни у данной категории больных.
Технический результат изобретения заключается в повышении эффективности лечения и предупреждении рецидивов заболевания у больных ишемической болезнью сердца и микрососудистой стенокардией.
Это достигается тем, что в заявляемом способе оптимизации подбора антиангинальной терапии при ишемической болезни сердца и микрососудистой стенокардии путем оценки результатов тестирования рекомендуемых лекарственных препаратов на показатели периферической микроциркуляции по данным лазерной допплеровской флоуметрии (ЛДФ), согласно изобретению, определяют исходные параметры ЛДФ и капилляроскопии, затем поочередно принимают курсом 3 дня рекомендуемые антиангинальные препараты, при этом каждый последующий препарат - спустя 5 полупериодов выведения предыдущего, после каждого курса определяют параметры ЛДФ, оценивая: реакцию сосудов микроциркуляции кожи, функциональное состояние тонусформирующих механизмов модуляции кровотока: эндотелиальный - Аэ, нейрогенный - Ан и миогенный - Ам, респираторно обусловленные колебания кровотока - Ав, пульсовые колебания кровотока - Ас, а также параметры капилляроскопии - величина перикапиллярной зоны - ПЗ, сравнивают исходные показатели ЛДФ и капилляроскопии - ПЗ с этими же показателями, полученными после приема тестируемых препаратов, и выбирают наиболее оптимальный препарат, после терапии которым показатели Аэ, Ан, Ам и Ас приближаются к норме, Ав≤0,08, ПЗ=105±15, для длительной терапии.
Осуществление способа
Неинвазивное исследование микроциркуляторного кровотока выполняют одноканальным лазерным анализатором кровотока «ЛАКК-М» (НПП «ЛАЗМА», Россия) в ближней инфракрасной области спектра (длина волны - 800 нм), что позволяет проникать в кожу на глубину около 1 мм и анализировать характер кровотока в 1,0-1,5 мм3. Данный объем кожи в среднем содержит одну артериолу диаметром не более 30 мкм, которая делится на 5 прекапиллярных артериол, дающих суммарно от 40 до 80 капилляров, которые переходят в посткапиллярные венулы, сливающиеся в девять собирательных венул с последующим переходом в одну дренирующую венулу диаметром 40-50. Таким образом, микрососудистое русло кожи представляет собой типичный микроциркуляторный модуль, имеющий один приток, сеть обменных сосудов и один отток. В данном объеме гладкомышечный компонент содержат только прекапиллярные артериолы и капиллярные сфинктеры. Гладкомышечные клетки микрососудов обладают спонтанной сократительной активностью. Базальный тонус и вазомоторная активность миоцитов модулируется со стороны наружного просвета сосудов нейрогенными (симпатическими) факторами, а со стороны внутреннего просвета - эндотелиальными факторами. Суммарное действие всех трех (эндотелиальный, нейрогенный и миогенный) механизмов и определяет конечный тонус прекапиллярных артериол, которые, в свою очередь, регулируют поступления крови в капиллярное русло, формируя оптимальные для транскапиллярного обмена параметры капиллярной гемодинамики.
Для оценки функционального состояния тонусформирующих механизмов модуляции кровотока (эндотелиальный, нейрогенный и миогенный) исходные ЛДФ-граммы подвергают спектральному анализу с использованием адаптивного вейвлет-преобразования. В качестве материнской функции используют комплекснозначный вейвлет Морле. Усредненную по времени амплитуду колебаний кровотока оценивают по максимальным значениям (Amax) в соответствующем частотном диапазоне: 1) 0.0095-0.021 Гц - диапазон эндотелиальной активности (Аэ); 2) 0.021-0.052 Гц - диапазон нейрогенной (симпатической) активности (Ан); 3) 0.052-0.145 Гц - диапазон миогенной активности (Ам); 4) 0.145-0.6 Гц - диапазон респираторно обусловленных колебаний кровотока (Ав); 5) 0.6-2.0 Гц - диапазон пульсовых (Ас) колебаний кровотока.
ЛДФ с амплитудно-частотным вейвлет анализом производят у больного спустя 5 полупериодов выведения предыдущего лекарственного препарата исходно, затем назначают курсом на 3 дня поочередно рекомендуемые антиангинальные препараты, с соответствующей оценкой параметров ЛДФ на 3 день лечения. Эффективность фармпрепарата предлагаем оценивать по степени увеличения амплитуды тонусформирующих механизмов модуляции кровотока (Аэ, Ан, Ам).
Однако существенное снижение тонуса (увеличение амплитуды) любого из регуляторных механизмов может приводить к избыточному поступлению крови в капилляры с повышением давления в них и нарушением функционирования фильтрационно-реабсорбционного механизма обмена веществ. Поэтому следует выбирать препарат, который оказывает наиболее равномерное влияние на тонусформирующие механизмы прекапиллярных артериол и не приводит к существенным сдвигам в обмене жидкости. Нормы для показателей тонусформирующих механизмов модуляции кровотока: эндотелиальный (Аэ) - 0,284 пф; нейрогенный (Ан) - 0,305 пф; миогенный (Ам) - 0,246 пф. Амплитуда пульсовых колебаний кровотока (Ас) - 0,17 пф.
Контроль эффективности капиллярного кровотока и функционирования фильтрационно-реабсорбционного механизма обмена веществ проводим с помощью капилляроскопа «Капилляроскан-1» (ООО «Новые Энергетические Технологии», Россия) на уровне капиллярного русла ногтевого ложа в отраженном свете с применением иммерсионного масла. Все капилляроскопические исследования выполняют перед проведением ЛДФ в положении сидя, рука на уровне сердца. Об эффективности функционирования фильтрационно-реабсорбционного механизма обмена веществ судят по величине перикапиллярной зоны (ПЗ) - линейный размер от наиболее близкой точки переходного отдела капилляра до максимально удаленной точки кожного сосочка в микрометрах. ПЗ позволяет оценивать степень гидратации интерстициального пространства. В норме ПЗ составляет 105±15 мкм. Если на фоне терапии по данным ЛДФ амплитуда тонусформирующих механизмов модуляции кровотока (эндотелиальный, нейрогенный и миогенный) увеличивается, но отмечается и увеличение ПЗ, то данную ситуацию расцениваем как гиперфильтрацию с тенденцией к скрытой задержке жидкости в инстерстициальном пространстве, что в долгосрочной перспективе может иметь негативные последствия.
Сравнивают показатели результатов лазерной допплеровской флоуметрии (динамика амплитуды тонусформирующих механизмов модуляции кровотока) и капилляроскопии (размер перикапиллярной зоны), выбирают наиболее оптимальный препарат для длительной терапии. Наиболее оптимальный препарат выбирают при показателях Аэ, Ан, Ам и Ас, приближающихся к норме, Ав≤0,08, ПЗ=105±15.
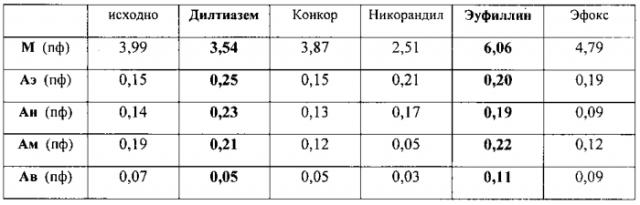
Клинический пример 1
Пациент А., диагноз: ИБС при неизмененных коронарных артериях. Микрососудистая стенокардия.
На данном клиническом примере видно, что наиболее выраженный эффект на тонусформирующие механизмы модуляции кровотока (эндотелиальный, нейрогенный, миогенный) оказали два препарата - Дилтиазем и Эуфиллин. Однако последний приводит не только к снижению тонуса прекапиллярных артериол, но и к венулярному полнокровию и сдвигу фильтрационно-реабсорбционного механизма обмена в сторону преобладания процессов фильтрации (увеличение ПЗ), что может приводить к скрытой задержке жидкости в интерстициальном пространстве. Исходя из совокупности данных параметров микроциркуляторного кровотока кожи для длительной антиангинальной терапии у данного пациента был выбран Дилтиазем. Клинически преимущество Дилтиазема над Эуфиллином в данном случае проявлялось более существенным увеличением длительности ВЭМ-нагрузки и уменьшением частоты приступов стенокардии за 3 дня. Так, прирост длительности ВЭМ-теста (до появления болевого приступа) на терапии эуфиллином составил 3 минуты, а на терапии Дилтиаземом - 7 минут. Количество приступов стенокардии на фоне эуфиллина уменьшилось на 5%, на фоне Дилтиазема - на 20%.
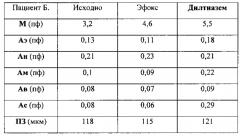
Клинический пример 2
Пациент Б., диагноз: ИБС. Атеросклероз коронарных артерий, состояние после ТБКА со стентированием коронарных артерий. Стенокардия напряжения II ФК.
Пациенту с доказанным ангиографически атеросклерозом коронарных артерий была выполнена ангиопластика со стентированием передней нисходящей артерии, но несмотря на устранение гемодинамически значимого стеноза у пациента сохранялись приступы стенокардии напряжения, что было расценено как следствие нарушений в системе микроциркуляции коронарных артерий (повышение тонуса прекапиллярных артериол) по аналогии с микрососудистой стенокардией. В связи с этим был произведен подбор антиангинальной терапии в данном клиническом случае с учетом результатов ЛДФ и капилляроскопии. В таблице 2 видно, что прием препарата Эфокс на протяжении 3-х суток не привел к увеличению амплитуды тонусформирующих механизмов (эндотелиальный, нейрогенный, миогенный), т.е. ожидаемого влияния на тонус прекапиллярных артериол нет. Пациент отмечал сохранение количества приступов стенокардии с незначительным снижением их интенсивности. Прием препарата другой фармакологической группы (Дилтиазем) привел к возникновению единственного слабо выраженного приступа стенокардии за четверо суток. Таким образом, снижение частоты приступов стенокардии на терапии Эфоксом в данном случае составило 0%, а на терапии дилтиаземом - 90%. С целью оценки эффективности проводимой терапии также проводился ВЭМ-тест: прирост длительности ВЭМ-теста (до появления болевого приступа) на терапии Эфоксом составил 0 минут, а на терапии Дилтиаземом - 5 минут. Клиническую эффективность препарата пациент оценивал как высокую. Из результатов амплитудно-частотного анализа видно, что в данном случае клиническая эффективность Дилтиазема обусловлена снижением (увеличение амплитуды) эндотелиального и миогенного компонентов тонуса прекапиллярных артериол. Причем снижение тонуса является наиболее оптимальным и не приводит к сдвигу фильтрационно-реабсорбционного равновесия, что следует из результатов капилляроскопии.
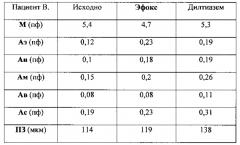
Клинический пример 3
Больной В., диагноз: ИБС, атеросклероз коронарных артерий (50% проксимальной трети огибающей артерии). Стенокардия напряжения ФК II. В подборе длительной антиангинальной терапии необходимо было сделать выбор между двумя препаратами.
Субъективно пациент оценивал клиническую эффективность обоих препаратов как высокую. Ключевым моментом в окончательном выборе препарата стали результаты капилляроскопии, которые показали, что дилатация прекапиллярных артериол под действием Дилтиазема в данном случае является избыточной, на что указывает более выраженный размер ПЗ. Смещение фильтрационно-реабсорбционного механизма обмена веществ в сторону преобладания процессов фильтрации приводит к скрытой задержке жидкости в интерстициальном пространстве, что в долгосрочной перспективе может неблагоприятно сказаться на метаболическом обеспечении тканей. Основываясь на результатах исследования микроциркуляции, в данном клиническом случае выбор был сделан в пользу препарата Эфокс. Клинически преимущество Эфокса проявилось в существенном приросте длительности ВЭМ-теста (8 минут на терапии Эфоксом против 5 минут на терапии Дилтиаземом). Снижение частоты приступов стенокардии также было более существенным на терапии Эфоксом (50% против 30% на терапии Дилтиаземом).
В 90% случаев препарат, выбранный по данным неинвазивного исследования микроциркуляторного кровотока в коже, субъективно оценивался пациентами как наиболее предпочтительный как по эффективности, так и по переносимости.
Таким образом, заявляемый способ с использованием данных ЛДФ и капилляроскопии в сочетании с фармакологической пробой антиангинальными препаратами позволяет преодолеть эмпирический подход к терапии ИБС и МСС, обеспечить оптимальный индивидуальный принцип подбора терапии, назначить патогенетически обоснованное лечение и предотвратить в последующем у этих больных рецидивы болезни, наступление нетрудоспособности, улучшить качество жизни и прогноз заболевания.
Способ оптимизации антиангинальной терапии при ишемической болезни сердца и микрососудистой стенокардии путем оценки результатов тестирования рекомендуемых лекарственных препаратов на показатели периферической микроциркуляции по данным лазерной допплеровской флоуметрии (ЛДФ), отличающийся тем, что определяют исходные параметры ЛДФ и капилляроскопии, затем поочередно принимают курсом 3 дня рекомендуемые антиангинальные препараты, при этом каждый последующий препарат - спустя 5 полупериодов выведения предыдущего, после каждого курса определяют параметры ЛДФ, оценивая: реакцию сосудов микроциркуляции кожи, функциональное состояние тонусформирующих механизмов модуляции кровотока: эндотелиальный - Аэ, нейрогенный - Ан и миогенный - Ам, респираторно обусловленные колебания кровотока - Ав, пульсовые колебания кровотока - Ас, а также параметры капилляроскопии - величину перикапиллярной зоны - ПЗ, сравнивают исходные показатели ЛДФ и капилляроскопии - ПЗ с этими же показателями, полученными после приема тестируемых препаратов, и выбирают наиболее оптимальный препарат, после терапии которым показатели Аэ, Ан, Ам и Ас приближаются к норме, Ав≤0,08, ПЗ=105±15, для длительной терапии.