Стабилизированные по отношению к протеазам ацилированные аналоги инсулина
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан ацилированный, стабилизированный по отношению к протеазам инсулин. Представлено применение описанного инсулина для изготовления фармацевтического состава для лечения или профилактики гипергликемии, сахарного диабета 2 типа, нарушенной толерантности к глюкозе и сахарного диабета 1 типа. Изобретение позволяет получать устойчивые к протеазам аналоги инсулина. 2 н. и 22 з.п. ф-лы, 11 ил., 1 табл., 184 пр.
Реферат
Область изобретения
Данное изобретение относится к новым ацилированным аналогам инсулина, демонстрирующим устойчивость к протеазам, к способу изготовления таких аналогов инсулина, к препаратам инсулина, содержащим инсулиновые аналоги изобретения, и к способу лечения сахарного диабета с помощью этих аналогов инсулина.
Уровень техники
Сахарный диабет является нарушением обмена веществ, при котором частично или полностью потеряна способность использовать глюкозу. Примерно 5% всех людей страдают от диабета, и это расстройство приобретает масштабы эпидемии. С момента введения инсулина в 1920-х годах предпринимались непрерывные усилия для улучшения лечения сахарного диабета. Т.к. люди, страдающие от диабета, подвергаются хроническому лечению в течение нескольких десятилетий, то существует острая потребность в безопасных, удобных и улучшающих качество жизни инсулиновых составах.
Пероральный путь на сегодняшний день является наиболее широко используемым путем введения препарата и в целом очень хорошо принимается пациентами, особенно при хронической терапии. Однако введение терапевтических пептидов или белков часто ограничено парентеральным путем, а не предпочтительным пероральным, из-за нескольких барьеров, таких как ферментативное расщепление в желудочно-кишечном тракте (ЖКТ) и слизистой оболочке кишечника, системы переноса лекарства, недостаточная и переменная абсорбция из слизистой оболочки кишечника, а также первичный метаболизм при прохождении через печень.
Как правило, инсулиновые составы вводят подкожно. Однако введение другими путями, например перорально или внутрилегочно, может иметь преимущества благодаря комплиентности пациентов, безопасности и удобству. Некоторые из коммерчески доступных инсулиновых составов характеризуются быстрым началом действия, другие составы характеризуются относительно медленным началом, но демонстрируют более или менее длительное действие. Для больных сахарным диабетом очень важно, что на рынке имеется большой ассортимент инсулинов с различной длительностью действия (профилями действий). Говоря кратко, инсулины можно классифицировать на инсулины короткого, среднего и длительного действия.
WO 2008/034881 относится к определенным аналогам инсулина, в которых по меньшей мере две гидрофобные аминокислоты были заменены гидрофильными аминокислотами, к аналогам инсулина, которые не ацилированы.
ЕР 2008/060733 и ЕР 2008/060733 относятся к определенным ацилированным аналогам инсулина, где аналог инсулина удлинен аминокислотным или пептидным остатком, связанным С-концом с аминокислотой А21.
ЕР 2008/060734 относится к определенным ацилированным инсулинам, в которых к родительскому инсулину присоединена ацильная группировка, и где указанная ацильная группировка состоит из повторяющихся звеньев аминокислот, содержащих алкиленгликоль.
Аспекты данного изобретения
Аспект данного изобретения относится к предоставлению аналогов инсулина, которые при пероральном введении могут обеспечить удовлетворительный контроль уровня глюкозы в крови.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, которые при пероральном введении могут обеспечить длительное снижение уровня глюкозы.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении могут обеспечить длительное снижение уровня глюкозы.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении три раза в сутки могут обеспечить удовлетворительный контроль уровня глюкозы в крови.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении два раза в сутки могут обеспечить удовлетворительный контроль уровня глюкозы в крови.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении один раз в сутки могут обеспечить удовлетворительный контроль уровня глюкозы в крови.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые являются гидрофильными.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые являются более гидрофильными, чем человеческий инсулин.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые являются менее гидрофобными, чем человеческий инсулин, в соответствии с относительной гидрофобностью (k'отн), описанной в данном документе.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые являются менее гидрофобными, чем подобные не стабилизированные по отношению к протеазам родительские инсулины, ацилированные такой же ацильной группировкой, в соответствии с относительной гидрофобностью (k'отн), описанной в данном документе.
K'отн аналогов базального инсулина изобретения составляет предпочтительно менее 5, более предпочтительно менее 3, более предпочтительно менее 2, более предпочтительно менее 1, более предпочтительно менее 0,8, более предпочтительно менее 0,6, более предпочтительно менее 0,5, более предпочтительно менее 0,4, более предпочтительно менее 0,3, более предпочтительно менее 0,2, более предпочтительно менее 0,1.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении имеют удовлетворительную биодоступность. По сравнению с биодоступностью аналогичных ацилированных инсулинов без стабилизирующих по отношению к протеазам мутаций, введенных в аналогичных дозах, биодоступность предпочтительных соединений данного изобретения по меньшей мере на 10% выше, предпочтительно на 20% выше, предпочтительно на 25% выше, предпочтительно на 30% выше, предпочтительно на 35% выше, предпочтительно на 40% выше, предпочтительно на 45% выше, предпочтительно на 50% выше, предпочтительно на 55% выше, предпочтительно на 60% выше, предпочтительно на 65% выше, предпочтительно на 70% выше, предпочтительно на 80% выше, предпочтительно на 90% выше, предпочтительно на 100% выше, предпочтительно более чем на 100% выше, чем у не стабилизированного по отношению к протеазам сравниваемого инсулина.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при пероральном введении имеют удовлетворительную биодоступность. Биодоступность предпочтительных соединений данного изобретения (по сравнению с внутривенном введением) составляет по меньшей мере 0,3%, предпочтительно более 0,5%, предпочтительно более 1%, предпочтительно более 1,5%, предпочтительно более 2%, предпочтительно более 2,5%, предпочтительно более 3%, предпочтительно более 3,5%, предпочтительно более 4%, предпочтительно более 5%, предпочтительно более 6%, предпочтительно более 7%, предпочтительно более 8%, предпочтительно более 9%, предпочтительно более 10%.
Другой аспект данного изобретения относится к предоставлению аналогов базального инсулина, которые при введении путем внутривенной инфузии имеют удовлетворительную активность. По сравнению с активностью человеческого инсулина, активность предпочтительных стабилизированных по отношению к протеазам аналогов инсулина изобретения составляет предпочтительно более 5%, предпочтительно более 10%, предпочтительно более 20%, предпочтительно более 30%, предпочтительно более 40%, предпочтительно более 50%, предпочтительно более 75% и предпочтительно более 100%.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, которые при внутрилегочном введении могут обеспечить удовлетворительный контроль уровня глюкозы в крови.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, которые при внутрилегочном введении могут обеспечить удовлетворительный контроль уровня глюкозы в крови с относительно медленным началом действия и/или более или менее длительным действием.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, которые при внутрилегочном введении имеют удовлетворительное длительное действие. По сравнению с подобным ацилированным инсулином без стабилизирующих по отношению к протеазам мутаций, введенным в аналогичных дозах, продолжительность действия предпочтительных соединений данного изобретения по меньшей мере на 10% больше, предпочтительно на 20% больше, предпочтительно на 25% больше, предпочтительно на 30% больше, предпочтительно на 35% больше, предпочтительно на 40% больше, предпочтительно на 45% больше, предпочтительно на 50% больше, предпочтительно на 55% больше, предпочтительно на 60% больше, предпочтительно на 65% больше, предпочтительно на 70% больше, предпочтительно на 80% больше, предпочтительно на 90% больше, предпочтительно на 100% больше, предпочтительно более чем на 100% больше, чем у сравниваемого инсулина. Продолжительность действия может измеряться по времени, в течение которого снижен уровень глюкозы, или по соответствующим фармакокинетическим свойствам, например t½ или MRT (среднее время удержания препарата в организме).
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, которые имеют удовлетворительную легочную биодоступность. По сравнению с биодоступностью человеческого инсулина или по сравнению с аналогичным ацилированным инсулином без стабилизирующих по отношению к протеазам мутаций, введенным в аналогичных дозах, биодоступность предпочтительных соединений данного изобретения по меньшей мере на 10% выше, предпочтительно на 20% выше, предпочтительно на 25% выше, предпочтительно на 30% выше, предпочтительно на 35% выше, предпочтительно на 40% выше, предпочтительно на 45% выше, предпочтительно на 50% выше, предпочтительно на 55% выше, предпочтительно на 60% выше, предпочтительно на 65% выше, предпочтительно на 70% выше, предпочтительно на 80% выше, предпочтительно на 90% выше, предпочтительно на 100% выше, предпочтительно более чем на 100% выше, чем у сравниваемого инсулина.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, имеющих увеличенную активность, проявляемую in vivo.
Другой аспект данного изобретения относится к предоставлению инсулинов длительного действия с пероральной биодоступностью.
Другой аспект данного изобретения относится к предоставлению аналогов инсулина, имеющих увеличенную протеолитическую стабильность по сравнению со стабильностью человеческого инсулина. По сравнению с человеческим инсулином протеолитическая стабильность предпочтительных соединений данного изобретения по меньшей мере в 2 раза выше, предпочтительно в 3 раза выше, предпочтительно в 4 раза выше, предпочтительно в 5 раз выше, предпочтительно в 6 раз выше, предпочтительно в 7 раз выше, предпочтительно в 8 раз выше, предпочтительно в 9 раз выше, предпочтительно в 10 раз выше, предпочтительно в 12 раз выше, предпочтительно в 14 раз выше, предпочтительно в 16 раз выше, предпочтительно в 18 раз выше, предпочтительно в 20 раза выше, предпочтительно в 25 раз выше, предпочтительно более чем 25 раз выше, чем у сравниваемого инсулина. Протеолитическую стабильность можно измерить, подвергая инсулин действию (смеси) протеолитических ферментов, например экстракта кишечных ферментов, описанного в данном документе.
Объектом изобретения является преодоление или уменьшение по меньшей мере одного из недостатков уровня техники или предоставление полезной альтернативы.
ОПРЕДЕЛЕНИЯ
В данном документе термин «инсулин» охватывает инсулины природного происхождения, например человеческий инсулин, а также аналоги инсулина. Человеческий инсулин состоит из двух полипептидных цепей, так называемых цепей А и В, которые содержат 21 и 30 аминокислотных остатков соответственно, и которые соединены между собой двумя цистиновыми дисульфидными мостиками.
В данном документе термин «аминокислотный остаток» охватывает аминокислоты, в которых из аминогруппы был удален атом водорода и/или из карбоксильной группы была удалена гидроксильная группа и/или из меркаптогруппы был удален атом водорода. Неточно аминокислотный остаток может означать аминокислоту.
В данном документе термин «гидрофобные аминокислоты» следует понимать как аминокислоты природного происхождения триптофан (Trp, W), фенилаланин (Phe, F), валин (Val, V), изолейцин (Ile, I), лейцин (Leu, L) и тирозин (Tyr, Y) (с трехбуквенной и однобуквенной аббревиатурой в скобках).
В данном документе термин «гидрофильные аминокислоты» следует понимать как природные аминокислоты, которые не являются гидрофобными аминокислотами в соответствии с определением выше. В одном воплощении гидрофильные кислоты в соответствии с изобретением выбраны из группы, состоящей из: глутаминовой кислоты (Glu, E), аспарагиновой кислоты (Asp, D), гистидина (His, Н), глутамина (Gln, Q), аспарагина (Asn, N), серина (Ser, S), треонина (Thr, Т), пролина (Pro, P), глицина (Gly, G), лизина (Lys, K) и аргинина (Arg, R). В другом воплощении гидрофильные аминокислоты в соответствии с изобретением выбраны из группы, состоящей из: глутаминовой кислоты (Glu, E), аспарагиновой кислоты (Asp, D), гистидина (His, Н), глутамина (Gln, Q), аспарагина (Asn, N), лизина (Lys, K) и аргинина (Arg, R).
В данном документе термин «аналог инсулина» охватывает полипептиды, которые имеют молекулярную структуру, которая формально может быть получена из структуры инсулина природного происхождения, например человеческого инсулина, путем удаления и/или замещения (замены) одного или более аминокислотного остатка, входящего в природный инсулин, и/или путем добавления одного или более аминокислотного остатка. Добавленные и/или замененные аминокислотные остатки могут быть либо кодируемыми аминокислотными остатками, либо другими аминокислотными остатками природного происхождения, либо чисто синтетическими аминокислотными остатками. В предпочтительном воплощении аналог инсулина имеет две или более мутации по сравнению с человеческим инсулином.
В данном документе термин «инсулин, стабилизированный по отношению к протеазам» обозначает инсулин без присоединенной ацильной группировки. Указанные инсулины, стабилизированные по отношению к протеазам, имеют повышенную устойчивость к деградации протеазами.
В данном документе термин «родительский инсулин» обозначает инсулин без присоединенной ацильной группировки и без мутаций для повышения устойчивости к деградации протеазами. Указанные родительские инсулины возможно имеют мутации по сравнению с человеческим инсулином. Родительские инсулины, таким образом, также являются аналогами инсулина, определенными выше. В данном документе термины «родительский инсулин» и «инсулин, не стабилизированный по отношению к протеазам» обозначают одни и те же соединения.
В данном документе термин «мутация» охватывает любое изменение в аминокислотной последовательности (замены и вставки кодируемых аминокислот, а также делеции).
В данном документе термины «аналоги цепи А» и «аналоги цепи В» человеческого инсулина охватывают соответственно А- и В-цепи человеческого инсулина, имеющие одну или более замену, удаление и/или удлинение (добавление) соответственно в аминокислотных А- и В-цепях по сравнению соответственно с А- и В-цепями человеческого инсулина.
В данном документе такие термины, как «А1», «А2», «A3» и т.д., указывают соответственно позиции 1, 2 и 3 в А-цепи инсулина (считая, с N-конца). Аналогичным образом такие термины, как «В1», «В2», «В3» и т.д., указывают соответственно позиции 1, 2 и 3 в В-цепи инсулина (считая с N-конца). При использовании однобуквенных кодов аминокислот такие термины, как «А21А», «A21G» и «A21Q» обозначают, что аминокислота в позиции А21 представляет собой A, G и Q соответственно. При использовании трехбуквенных кодов аминокислот соответствующие выражения представляют собой AlaA21, GlyA21 и GlnA21 соответственно.
В данном документе термины «А(0)» или «В(0)» указывают позиции N-концевых соседних А1- или В1-позиций соответственно, в А- или В-цепи соответственно. Термины «А(-1)» или «В(-1)» указывают на позиции первых аминокислот с N-конца от А(0) или В(0) соответственно. Таким образом, «А(-2)» и «В(-2)» указывают на N-концевые позиции по отношению к А(-1) и В(-1) соответственно, А(-3) и В(-3) указывают на N-концевые позиции по отношению к А(-2) и В(-2) соответственно и т.д.
В данном документе такие термины, как «desB29» и «desB30», обозначают аналог инсулина, потерявший аминокислотный остаток В29 или В30 соответственно.
В данном документе термин «быстро действующий инсулин» обозначает инсулин, имеющий более быстрое начало действия по сравнению с нормальным или обычным человеческим инсулином.
В данном документе термин «инсулин длительного действия» или термин «базальный инсулин» обозначает инсулин с более длительным действием по сравнению с нормальным или обычным человеческим инсулином. Предпочтительно время действия составляет более 5 или 8 часов, в частности по меньшей мере более 9 часов. Предпочтительно базальный инсулин имеет время действия по меньшей мере 10 часов. Базальный инсулин может, таким образом, иметь время действия в диапазоне от примерно 8 до 24 часов, предпочтительно в диапазоне от примерно 9 до примерно 15 часов.
Нумерация позиций в аналогах инсулина, инсулинах и А- и В-цепях производится таким образом, чтобы родительское соединение представляло собой человеческий инсулин с нумерацией, использованной для него.
В данном документе термин «ацилированный инсулин» обозначает инсулин, модифицированный путем присоединения одной или более ацильных группировок через линкер к стабилизированному по отношению к протеазам инсулину.
Под ацилированным инсулином, имеющим инсулиновую активность, понимается ацилированный инсулин либо со способностью снижать уровень глюкозы в крови млекопитающих, измеренный на подходящей животной модели, которой может быть, например, крыса, кролик или свинья, после подходящего введения, например внутривенного или подкожного, либо со связывающей аффинностью к инсулиновому рецептору.
В данном документе термин «алкил» обозначает насыщенную разветвленную или прямую углеводородную группу.
В данном документе термин «алкокси-» обозначает радикал «алкил-O-». Типичными примерами являются метокси-, этокси-, пропокси- (например, 1-пропокси- и 2-пропокси-), бутокси- (например, 1-бутокси-, 2-бутокси- и 2-метил-2-пропокси-), пентокси- (1-пентокси- и 2-пентокси-), гексокси- (1-гексокси и 3-гексокси) и т.п.
В данном документе термин «алкилен» обозначает насыщенную разветвленную или прямую двухвалентную углеводородную группу, имеющую от 1 до 12 атомов углерода. Типичные примеры включают, не ограничиваясь ими, метилен; 1,2-этилен; 1,3-пропилен; 1,2-пропилен; 1,3-бутилен; 1,4-бутилен; 1,4-пентилен; 1,5-пентилен; 1,5-гексилен; 1,6-гексилен и т.п.
В данном документе термин «нейтральная линейная аминокислота» обозначает. Неограничивающими примерами нейтральных линейных аминокислот являются.
В данном документе термин «циклическая аминокислота» обозначает. Неограничивающими примерами циклических линейных аминокислот являются.
В данном документе термин «кислая аминокислота» обозначает. Неограничивающими примерами кислых линейных аминокислот являются.
В данном документе термин «жирная кислота» обозначает линейные или разветвленные алифатические карбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Неограничивающими примерами жирных кислот являются миристиновая кислота, пальмитиновая кислота и стеариновая кислота.
В данном документе термин «жирная двухосновная кислота» обозначает линейные или разветвленные алифатические дикарбоновые кислоты, имеющие по меньшей мере два атома углерода и являющиеся насыщенными или ненасыщенными. Неограничивающими примерами жирных двухосновных кислот являются янтарная кислота, гександиовая кислота, октандиовая кислота, декандиовая кислота, додекандиовая кислота, тетрадекандиовая кислота, гексадекандиовая кислота, гептадекандиовая кислота, октадекандиовая кислота и эйкозандиовая кислота.
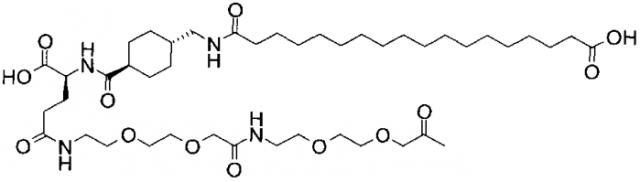
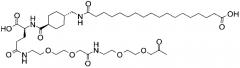
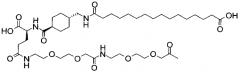
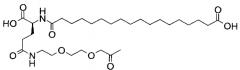
В данном документе инсулины называют в соответствии со следующими принципами: названия дают в соответствии с мутациями и модификациями (ацилированием) по сравнению с человеческим инсулином. Ацильной группировке название дают в соответствии с номенклатурой IUPAC, а в других случаях в соответствии с пептидной номенклатурой. Например ацильная группировка:
может быть названа, например, «октадекандиоил-γGlu-OEG-OEG», или «17-карбоксигептадеканоил-γGlu-OEG-OEG», где
OEG представляет собой краткое обозначение для аминокислоты NH2(СН2)2O(СН2)2OCH2CO2H,
γGlu представляет собой краткое обозначение для гамма-глутаминовой кислоты.
Другими краткими обозначениями для аминокислот являются, например:
ПЭГ3 для NH2((CH2)2O)4CH2CH2CO2H
ПЭГ7 для NH2((СН2)2O)8CH2CH2CO2H.
Например, инсулин примера 9 (с последовательностью/структурой, приведенной ниже) называется «А14Е, В25Н, B29K (Nεоктадекандиоил-γGlu-OEG-OEG), desB30 человеческий инсулин», что указывает, что аминокислота в позиции A14,Y в человеческом инсулине мутировала в Е, аминокислота в позиции B25,F в человеческом инсулине мутировала в Н, аминокислота в позиции В29,K в человеческом инсулине была модифицирована путем ацилирования эпсилон-азота в остатке лизина В29, обозначенного Nε, остатком октадекандиоил-γGlu-OEG-OEG, а аминокислота в позиции В30,Т в человеческом инсулине была удалена. Звездочки в приведенной ниже формуле обозначают, что остаток в данном случае отличается (т.е. мутирован) от человеческого инсулина. В данной заявке приведены обе формулы и названия предпочтительных инсулинов изобретения
В данном документе термины «химическая стабильность» и «высокая химическая стабильность» обозначают, что химически инсулины изобретения являются достаточно стабильными в нужном составе. Т.е. это означает, что продукты химической деградации формируются только в таких количествах, которые не подвергают риску срок годности окончательного лекарственного продукта. Продукты химической деградации включают продукты дезамидирования, изоаспартатные структуры, димерные структуры, продукты рацемизации, продукты, полученные в результате процессов дегидратации и пр. Химическую стабильность можно измерить с помощью ВЭЖХ образцов или составов определенного срока хранения.
В данном документе термин «высокая физическая стабильность» обозначает, что тенденция к образованию волокон составляет менее 50% от таковой тенденции человеческого инсулина. Тенденцию к образованию волокон можно описать посредством периода времени, после которого в данных условиях начнется образование волокон.
Полипептид с аффинностью к рецептору инсулина и рецептору IGF-1 представляет собой полипептид, который способен взаимодействовать с рецептором инсулина и рецептором человеческого IGF-1 в соответствующем анализе связывания. Такие анализы рецепторов хорошо известны в данной области и более подробно описаны в примерах. Данный ацилированный инсулин не будет связываться с рецептором IGF-1 или будет иметь довольно низкую аффинность к указанному рецептору. Говоря точнее, ацилированные инсулины данного изобретения будут иметь аффинность к рецептору IGF-1 по существу той же силы или меньшей, чем человеческий инсулин.
Термин «фармацевтически приемлемый», используемый в данном документе, обозначает подходящий в качестве обычных фармацевтических добавок, т.е. не дающий каких-либо серьезных побочных эффектов у пациентов и т.д.
Термин «лечение», используемый в данном документе, обозначает руководство и уход за пациентом с целью борьбы с заболеванием, расстройством или состоянием. Термин включает задержку прогрессирования заболевания, расстройства или состояния, смягчение или облегчение симптомов и осложнений и/или выздоровление или ликвидацию болезни, расстройства или состояния. Пациент, подвергающийся лечению, является предпочтительно млекопитающим, в частности человеком.
Термин «лечение заболевания», используемый в данном документе, обозначает руководство и уход за пациентом, у которого развивается заболевание, состояние или расстройство. Цель лечения заключается в борьбе с заболеванием, состоянием или расстройством. Лечение включает введение активных соединений для устранения или контроля за заболеванием, состоянием или расстройством, а также для смягчения симптомов или осложнений, связанных с болезнью, состоянием или расстройством.
Термин «профилактика заболевания», используемый в данном документе, обозначает руководство и уход за индивидуумом, имеющим риск развития заболевания, до клинического начала заболевания. Целью профилактики является борьба с развитием заболевания, состояния или расстройства, и включает введение активных соединений для предотвращения или замедления появления симптомов или осложнений и для предотвращения или замедления развития связанных заболеваний, состояний или расстройств.
Термин «эффективное количество», используемый в данном документе, обозначает дозу, достаточную для того, чтобы лечение пациентов было эффективным по сравнению с отсутствием лечения.
«РОТ» обозначает ген триозофосфатизомеразы Schizosaccharomyces pombe, а «TPI1» обозначает ген триозофосфатизомеразы S. cerevisiae.
Под «лидером» понимается аминокислотная последовательность, состоящая из препептида (сигнального пептида) и пропептида.
Термин «сигнальный пептид» используется для обозначения препептида, который присутствует в качестве N-концевой последовательности в предшественнике белка. Функция сигнального пептида состоит в облегчении перемещения гетерогенного белка в эндоплазматическую сеть. Сигнальный пептид обычно отщепляется в ходе этого процесса. Сигнальный пептид может быть гетерологичным или гомологичным дрожжевому организму, продуцирующему белок. Количество сигнальных пептидов, которые могут быть использованы с ДНК-конструкцией данного изобретения, в том числе сигнальный пептид дрожжевой аспарагиновой протеазы 3 (YAP3) или любой функциональный аналог (Egel-Mitani et al. (1990) YEAST 6:127-137 и патент США 5726038) и сигнал α-фактора гена MFα1 (Thorner (1981) в The Molecular Biology of the Yeast Saccharomyces cerevisiae, Strathern et al., eds., pp 143-180, Cold Spring Harbor Laboratory, NY и в патенте США 487000.
В данном документе термин «пропептид» обозначает полипептидную последовательность, функция которой состоит в разрешении экспрессированному полипептиду направиться из эндоплазматического ретикулума в аппарат Гольджи, а затем в секреторные везикулы для секреции в культуральную среду (например, экспорт полипептида через клеточную стенку или по меньшей мере через клеточную мембрану в периплазматическое пространство дрожжевой клетки). Пропептид также может быть дрожжевым α-факторным пропептидом, см. патенты США 4546082 и 4870008. Альтернативно пропептид может быть синтетическим пропептидом, т.е. пропептидом, который не встречается в природе. Подходящие синтетические пропептиды раскрыты в патентах США 5395922; 5795746; 5162498 и WO 98/32867. Пропептид предпочтительно на С-конце будет содержать сайт процессинга для эндопептидазы, такой как последовательность Lys-Arg или любой ее функциональный аналог.
Если явно не указано, то аминокислоты, упомянутые в данном документе, являются L-аминокислотами. Кроме того, левый и правый концы аминокислотной последовательности пептида являются соответственно N- и С-концами, если не указано обратное.
Сущность изобретения
Было обнаружено, что инсулины, стабилизированные по отношению к протеолитической деградации (путем специфических мутаций) и ацилированные на В29-лизине, являются эффективными и длительно действующими и обладают высоким потенциалом в качестве инсулинов длительного действия, которые могут быть введены внутрилегочно или перорально. Ацилирование обеспечивает связывание сывороточного альбумина и, следовательно, замедление действия. Кроме того, ацилированные инсулины изобретения демонстрируют существенное снижение аффинности к рецептору инсулина по сравнению с аналогичными ацилированными инсулинами, которые не стабилизированы по отношению к протеолитической деградации. Это снижение аффинности к инсулиновому рецептору альбумин-связывающих инсулинов изобретения способствует задержке ацилированного инсулина в кровотоке, так как инсулин интернализуется и деградирует при активации рецепторов. Таким образом, клиренс инсулина изобретения снижается. Снижение аффинности инсулинового рецептора, вероятно, не приводит к потере активности, например при измерении в гипергликемическом эугликемическом «клэмп»-тесте, описанном в данном документе. Сочетание высокой связывающей аффинности к альбумину и низкой аффинности к рецептору инсулина, таким образом, полезно для получения длительного действия инсулинов (базальные инсулины). Кроме того, после перорального введения эти ацилированные инсулины имеют более высокую степень биодоступности по сравнению с аналогичными известными ацилированными инсулинами, не стабилизированными по отношению к протеолитической деградации. Таким образом, эти ацилированные аналоги инсулина являются ценными для перорального введения. Аналогичным образом после внутрилегочного введения эти ацилированные инсулины, стабилизированные по отношению к протеазам, демонстрируют более высокую активность и/или биодоступность по сравнению с аналогичными известными ацилированными инсулинами, не стабилизированными по отношению к протеолитической деградации. Кроме того, эти ацилированные инсулины, стабилизированные по отношению к протеазам, демонстрируют увеличенное время действия при внутрилегочном введении у млекопитающих. Таким образом, эти ацилированные аналоги инсулина являются ценными для внутрилегочного введения.
Вышеупомянутые инсулины, стабилизированные по отношению к протеолитической деградации, являются обозначенными в данном документе инсулинами, стабилизированными по отношению к протеазам.
Инсулины, стабилизированные по отношению к протеазам, имеют ограниченное количество аминокислотных остатков природного происхождения, замененных другими аминокислотными остатками по сравнению с человеческим инсулином, как описано в части с подробным описанием.
В одном воплощении данное изобретение относится к ацилированному инсулину, где аналог инсулина, стабилизированный по отношению к протеазам, отличается от человеческого инсулина на одну или более из следующих делеций или замен: Q в позиции А18, A, G и Q в позиции А21, G или Q в позиции В1 или отсутствие аминокислотного остатка в позиции В1, Q, S или Т в позиции В3 или отсутствие аминокислотного остатка в позиции В3, Q в позиции В13, отсутствие аминокислотного остатка в позиции В27, D, Е или R в позиции В28 и отсутствие аминокислотного остатка в позиции В30.
В еще одном аспекте данное изобретение относится к фармацевтическим препаратам, содержащим ацилированный инсулин данного изобретения и подходящие адъюванты и добавки, такие как один или более агент, подходящий для стабилизации, хранения или достижения изотоничности, например ионы цинка, фенол, крезол, парабен, хлорид натрия, глицерин или маннит. Содержание цинка в данных составах может составлять от 0 до примерно 6 атомов цинка на 6 молекул инсулина. Значение рН фармацевтического препарата может находиться в пределах от примерно 4 до примерно 8,5, в пределах от примерно 4 до примерно 5 или в пределах от примерно 6,5 до примерно 7,5.
В другом воплощении данное изобретение относится к применению ацилированного инсулина в качестве фармацевтического средства для снижения уровней глюкозы в крови млекопитающих, в частности для лечения диабета.
В другом аспекте данное изобретение относится к применению ацилированного инсулина для изготовления фармацевтического препарата для снижения уровня глюкозы в крови млекопитающих, в частности для лечения сахарного диабета.
В другом воплощении данное изобретение относится к способу снижения уровня глюкозы в крови млекопитающих путем введения терапевтически активной дозы ацилированного инсулина данного изобретения пациенту, нуждающемуся в таком лечении.
В другом аспекте данного изобретения ацилированные инсулины вводят в сочетании с одним или более другим активным веществом в любых подходящих соотношениях. Такие другие активные агенты могут быть выбраны среди человеческого инсулина, быстро действующих аналогов инсулина, антидиабетических агентов, антигиперлипидемических агентов, агентов против ожирения, антигипертензивных агентов и агентов для лечения осложнений, возникающих в результате диабета или связанных с ним.
В одном воплощении два активных компонента вводят в виде смешанного фармацевтического препарата. В другом воплощении два компонента вводят раздельно либо одновременно, либо последовательно.
В одном воплощении ацилированные инсулины данного изобретения могут быть введены вместе с быстродействующим человеческим инсулином или с аналогами человеческого инсулина. Такой быстродействующий аналог инсулина может быть таким, в котором аминокислотный остаток в позиции В28 представляет собой Asp, Lys, Leu, Val или Ala, а аминокислотный остаток в позиции В29 представляет собой Lys или Pro, человеческий инсулин des(B28-B30), человеческий инсулин des(B27) или человеческий инсулин des(B30), а также таким аналогом, в котором аминокислотный остаток в позиции В3 представляет собой Lys, а аминокислотный остаток в позиции В29 представляет собой γGlu или Asp. Ацилированный инсулин данного изобретения и быстродействующий человеческий инсулин или аналог человеческого инсулина могут быть смешаны в соотношении от примерно 90% ацилированного инсулина до примерно 10% быстродействующего человеческого инсулина или аналога человеческого инсулина; предпочтительно от примерно 70% ацилированного инсулина до примерно 30% быстродействующего человеческого инсулина или аналога человеческого инсулина, и даже более предпочтительно от примерно 50% ацилированного инсулина до примерно 50% быстродействующего человеческого инсулина или аналога человеческого инсулина (% является процентом по весу).
Ацилированные инсулины данного изобретения могут быть также использованы для комбинированного лечения вместе с антидиабетическим агентом.
Антидиабетические агенты включают инсулин, GLP-1 (1-37) (глюкагон-подобный пептид-1), описанный в WO 98/08871, WO 99/43706, US 5424286, WO 00/09666, WO 2006/097537, PCT/EP2008/061755 и РСТ/ЕР2008/061830, GLP-2, эксендин-4 (1-39), их инсулинотропные фрагменты, инсулинотропные аналоги и инсулинотропные производные. Инсулинотропные фрагменты GLP-1 (1-37) представляют собой инсулинотропные пептиды, последовательность которых целиком может быть найдена в последовательности GLP-1 (1-37), и в которых хотя бы одна концевая аминокислота удалена.
Ацилированные инсулины данного изобретения также могут быть использованы для комбинированного лечения пероральными антидиабетическими средствами, такими как тиазолидиндион, метформин и другие фармацевтические препараты для перорального введения при диабете 2 типа.
Кроме того, ацилированный инсулин данного изобретения может быть введен в сочетании с одним или более агентом против ожирения или агентом, регулирующим аппетит.
В одном воплощении данное изобретение относится к фармацевтическому препарату для внутрилегочного введения, содержащему ацилированный инсулин данного изобретения и подходящие адъюванты и добавки, такие как один или более агент, подходящий для стабилизации, хранения или достижения изотоничности, например ионы цинка, фенол, крезол, парабен, хлорид натрия, глицерин или маннит.
Следует понимать, что в рамках данного изобретения находится любая подходящая комбинация ацилированных инсулинов с диетой и/или упражнением, одним или более из вышеуказанных соединений и возможно одним или более другим активным веществом.
Описание предпочтительных воплощений
Стабильность и растворимость инсулина являются серьезными основными аспектами имеющейся терапии и