Способ получения морфолилпропиламидов жирных кислот растительных масел
Иллюстрации
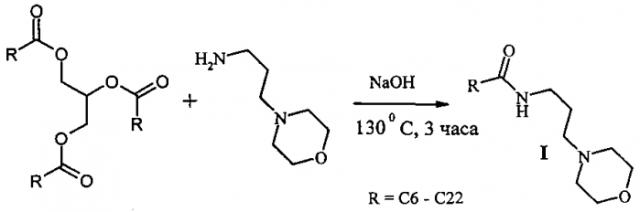
Показать всеИзобретение относится к области органической химии и химии поверхностно-активных веществ, а именно к получению морфолин-4-илпропиламидов жирных кислот растительных масел, которые могут быть применены в качестве антимикробных агентов в моющих композициях. Способ получения морфолин-4-илпропиламидов жирных кислот растительных масел формулы I, в которой R - остатки жирных кислот растительных масел, характеризуется тем, что осуществляют взаимодействие триглицеридов растительных масел и морфолин-4-илпропиламина при мольном соотношении реагентов растительное масло : морфолин-4-илпропиламин = 1 : 3 с добавлением 0,2 мас.% гидроксида натрия с выдерживанием реакционной массы при 130°C в течение 3-х часов и последующей очисткой промыванием насыщенным раствором хлорида натрия. Технический результат заключается в получении морфолин-4-илпропиламидов жирных кислот, обладающих антимикробными свойствами, простым и технологичным способом из триглицеридов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового масел) и морфолин-4-илпропиламина.
10 ил., 10 пр.
Реферат
Изобретение относится к области органической химии и химии поверхностно-активных веществ, к получению нового класса гетероциклических амидов жирных кислот растительных масел структуры I, которые проявляют антимикробные свойства и могут найти применение как компоненты моющих средств, шампуней, гелей для душа и т.д.
Известны различные способы получения амидов жирных кислот, как индивидуальных, так и смесей, в том числе входящих в состав растительных и животных жиров. Недостатками этого метода является проведение синтеза при высоких температурах и сложность технологического процесса. Алканоламиды можно получать амидированием природных триглицеридов [RU 2070878 (1996 г.), RU 2451666 (2011 г.)]. В качестве ацилирующего агента могут выступать также эфиры кислот [CN 102672138 (2012 г.), RU 2415125 (2009 г.)]. Так получают производные насыщенных и ненасыщенных жирных карбоновых кислот с различной длиной углеводородного радикала. К недостаткам данного метода можно отнести проведение дополнительной стадии получения эфиров жирных кислот из триглицеридов, проведение реакций при повышенном давлении.
Алканоламиды получают непосредственным взаимодействием жирных кислот с аминами [JPH 08301827 (1996 г.)]. Наиболее близким (прототип) является способ получения изостеариламидопропилморфолина реакцией изостеариновой кислоты и морфолин-4-илпропиламина, процесс проводят с азеотропной отгонкой образующейся воды [Final report on the assessment of isostearamidopropyl morpholine lactate / F.A. Andersen // International journal of toxicology. - 1999. - V. 18. - P. 51-56]. К недостаткам данного метода можно отнести использование растворителя и сложность аппаратурного оформления, связанная с отгонкой воды из реакционной массы.
Отличительными особенностями предлагаемого изобретения являются:
- использование триглицеридов жирных кислот растительных масел в качестве исходных реагентов;
- проведение реакции без растворителя;
- простой способ очистки продукта от глицерина и остатков амина - промывание насыщенным раствором хлорида натрия.
Задачей настоящего изобретения является разработка простого в исполнении способа получения морфолин-4-илпропиламидов жирных кислот растительных масел, позволяющего осуществить синтез целевых продуктов из триглицеридов жирных кислот природного происхождения, в том числе из подсолнечного, соевого, пальмового и кокосового масел и морфолин-4-илпропиламина при 130°C в течение 3-х часов.
Технический результат заключается в получении новых морфолин-4-илпропиламидов жирных кислот, обладающих антимикробными свойствами, простым и технологичным способом из триглицеридов жирных кислот растительных масел (подсолнечного, соевого, пальмового и кокосового масел) и морфолин-4-илпропиламина.
Технический результат достигается:
- проведением синтеза морфолин-4-илпропиламидов при взаимодействии триглицеридов жирных кислот растительных масел и морфолин-4-илпропиламина (мольное соотношение масло : морфолин-4-илпропиламин = 1:3) с добавлением 0,2 мас.% гидроксида натрия в качестве катализатора;
- выдерживанием реакционной массы при 130°C в течение 3-х часов,
- очисткой продуктов промыванием насыщенным раствором хлорида натрия;
- получением ранее неизученных смесей морфолин-4-илпропиламидов, содержащих остатки жирных кислот растительных масел (C6-C22).
Технический результат подтверждают проведенные исследования с выявлением антимикробного действия морфолин-4-илпропиламидов в отношении Streptococcus thermophilics, Escherichia coli, Bacillus, Saccaromyces, Penicillium.
Изобретение подтверждается проиллюстрированными чертежами, схемами, графиками,
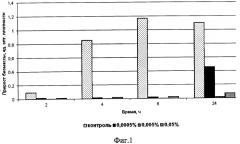
где на фиг. 1 показано влияние различных концентраций морфолилпропиламидов жирных кислот подсолнечного масла Ia на прирост биомассы термофильного стрептококка;
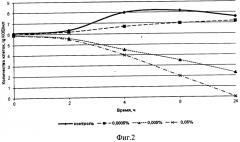
на фиг. 2 показано влияние различных концентраций морфолилпропиламидов жирных кислот подсолнечного масла Ia на рост термофильного стрептококка;
на фиг. 3 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на прирост биомассы Escherichia coli;
на фиг. 4 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на рост Escherichia coli;
на фиг. 5 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на прирост биомассы бацилл;
на фиг. 6 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на рост бацилл;
на фиг. 7 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на прирост биомассы дрожжей;
на фиг. 8 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на рост дрожжей;
на фиг. 9 показано влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на прирост биомассы плесневых грибов;
на фиг. 10 показано влияние Влияние различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на рост плесневых грибов.
Предлагаемый способ получения морфолилпропиламидов жирных кислот растительных масел осуществляется следующим образом.
Морфолин-4-илпропиламиды I образуются в результате реакции растительного масла (подсолнечного, соевого, пальмового и кокосового, содержащих от 6 до 22 атомов углерода и до 3 двойных связей) с морфолин-4-илпропиламином. Максимальная конверсия исходных реагентов достигается при проведении реакции при 130°C в течение 3-х часов в присутствии 0,2 мас.% гидроксида натрия. Очистка продуктов реакции заключается в промывании продуктов реакции насыщенным раствором хлорида натрия. Синтез осуществляют по следующей схеме:
Ниже представлены конкретные примеры осуществления предлагаемого изобретения.
ПРИМЕР 1.
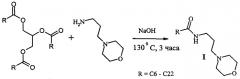
Синтез морфолин-4-илпропиламидов, содержащих остатки жирных кислот подсолнечного масла Ia протекает по следующей схеме:
где R - углеводородные фрагменты жирных кислот (C16-C22) подсолнечного масла.
В трехгорлую круглодонную колбу, снабженную верхнеприводной мешалкой с затвором, обратным холодильником и термометром помещают 292 г подсолнечного масла и 130 мл морфолин-4-илпропиламина. Нагревают до 100°C (скорость нагрева 1,3-1,4°C в минуту) и добавляют 0.79 г гидроксида натрия. Реакционную массу медленно нагревают до 130°C и выдерживают при этой температуре в течение 3-х часов. Полученные морфолин-4-илпропиламиды жирных кислот подсолнечного масла промывают насыщенным раствором хлорида натрия, отфильтровывают и высушивают. Выход 72%, Tпл.=46-48°C.
Результаты анализа антимикробного действия, приведены на фиг. 1-10.
ПРИМЕР 2.
Синтез морфолин-4-илпропиламидов, содержащих остатки жирных кислот соевого масла проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (C8-C18) соевого масла. Масса соевого масла, вводимого во взаимодействие, составляет 280 г. Выход 62%, Tпл.=56-58°C.
ПРИМЕР 3.
Синтез морфолин-4-илпропиламидов, содержащих остатки жирных кислот пальмового масла проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (C8-C18) пальмового масла. Масса пальмового масла, вводимого во взаимодействие, составляет 245 г. Выход 73%, Tпл.=60-62°C.
ПРИМЕР 4.
Синтез морфолин-4-илпропиламидов, содержащих остатки жирных кислот кокосового масла проводят согласно способу, описанному в примере 1, где R - углеводородные фрагменты жирных кислот (C6-C18) кокосового масла. Масса кокосового масла, вводимого во взаимодействие, составляет 226 г. Выход 76%, Tпл.=54-56°C.
ПРИМЕР 5.
Приготовление основного раствора и разведений морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia для дальнейших испытаний антимикробной активности.
5 г морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia растворяют в 95 см3 дистиллированной воды. Получают 5% основной раствор. Из основного раствора готовят два последовательных разведения морфолин-4-илпропиламидов жирных кислот подсолнечного масла. В пробирку первого разведения вносят 1 см3 основного раствора и 9 см3 дистиллированной воды. В пробирку второго разведения 1 см3 первого разведения и 9 см3 дистиллированной воды.
ПРИМЕР 6.
Порядок проведения испытаний с тест-культурой Streptococcus thermophilic
Термофильный стрептококк относится к гомоферментативным факультативно-анаэробным термофильным грамположительным коккам. Применяется в качестве тест-культуры для определения ингибирующих веществ по ГОСТ 23454-79 «Молоко. Методы определения ингибирующих веществ». Исследуемые концентрации морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia: 0,0005%; 0,005%; 0,05%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения соединений Ia для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора Ia. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры Streptococcus thermophilus. Колбы культивируют при (37±1)°C в течение 24 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 2, 4, 6, 24 ч путем посева культуральной жидкости на среду КМАФАнМ. Посевы инкубируют при (37±1)°C в течение 72 часов, после чего проводят подсчет КОЕ. Параллельно для подтверждения процессов развития тест-культуры проводят контроль за нарастанием биомассы клеток косвенным методом по изменению оптической плотности на спектрофотометре ПЭ-5300ВИ при длине волны λ=700 нм в 0, 2, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 2, 4, 6 и 24 часа культивирования.
На фиг. 1-2 приведены результаты исследований по влиянию различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на накопление бактериальной массы тест-культурой Streptococcus thermophilus за 2, 4, 6 и 24 часа развития. Из представленных данных видно, что степень и характер влияния испытуемых ПАВ на рост и развитие термофильного стрептококка различны. Соединения Ia начиная с концентрации 0,0005%, подавляют развитие термофильного стрептококка, рост которого при данной концентрации наблюдается только через 24 часа культивирования. При этом прирост биомассы составляет лишь 41% от контрольного варианта. Для концентраций 0,005% и 0,05% фиксируется практически полный бактерицидный эффект на протяжении всего периода наблюдений.
ПРИМЕР 7.
Порядок проведения испытаний с тест-культурой Escherichia coli.
Вид Escherichia coli относится к семейству Enterobacteriacea, группе лактозоположительных энтеробактерий или БГКП. БГКП иначе называют коли формы, т.е. закономерности роста и развития, установленные для тест-культуры Escherichia coli, с высокой степенью вероятности можно распространять на всю группу БГКП. Это грамотрицательные, неспорообразующие, каталазоположительные, оксидазоотрицательные, газообразующие, факультативно-анаэробные мезофильные палочки. Данная группа микроорганизмов крайне значима, при оценке санитарно-гигиенического состояния любого производства, готового продукта и личной гигиены работников, а также является значимой микрофлорой порчи продуктов, снижающей их качество и хранимоспособность. Исследуемые концентрации соединений Ia: 0,0005%; 0,005%; 0,05%; 0,1%; 0,5%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения Ia для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора, в четвертую - 4 см3 основного раствора, в пятую - 20 см3 основного раствора Ia. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры Escherichia coli. Колбы культивируют при (37±1)°C в течение 24 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 2, 4, 6 и 24 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Ρ 53430-2009. Посевы инкубируют при (37±1)°C в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 2, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 2, 4, 6 и 24 часа культивирования. На фиг. 3-4 приведены результаты исследований по влиянию различных концентраций морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia на накопление бактериальной массы тест-культурой E. coli за 2, 4, 6 и 24 часа развития. Из представленных данных видно, что степень и характер влияния испытуемых веществ на рост и развитие кишечной палочки различны. Соединения Ia проявляют ингибирующий эффект уже при концентрации более 0,05% в течение всего периода наблюдений, при этом чем выше концентрация, тем значительнее антимикробный эффект.
ПРИМЕР 8.
Порядок проведения испытаний с тест-культурой споровых аэробных микроорганизмов рода Bacillus.
Бациллы грамположительные, большинство подвижные, спорообразующие, каталазоположительные, аэробные и факультативно анаэробные палочки. В настоящее время данная группа споровых микроорганизмов является наиболее значимой микрофлорой порчи большинства пищевых продуктов. Для споровых аэробных микроорганизмов рода Bacillus взяты концентрации Ia: 0,005%, 0,05% и 0,1%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения соединения Ia для достижения заданных концентраций. В первую колбу вносят 2 см3 первого разведения, во вторую - 2 см3 основного раствора, в третью - 4 см3 основного раствора Ia. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры споровых аэробных микроорганизмов рода Bacillus. Колбы культивируют при (37±1)°C в течение 72 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 4, 6, и 24 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Ρ 53430-2009. Посевы инкубируют при (37±1)°C в течение 48 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 4, 6 и 24 ч. Рассчитывают прирост оптической плотности через 4, 6 и 24 часа культивирования. На фиг. 5-6 приведены результаты исследований по влиянию различных концентраций соединений Ia на накопление бактериальной массы тест-культурой споровых аэробных микроорганизмов рода Bacillus за 4, 6 и 24 часа развития. Из представленных данных видно, что степень и характер влияния испытуемых образцов на рост и развитие споровых аэробов различны. Во всех исследованных концентрациях и в течение всего периода наблюдения амиды Ia практически полностью подавляют развитие споровых аэробов.
ПРИМЕР 9.
Порядок проведения испытаний с тест-культурой дрожжей рода Saccharomyces.
Дрожжи - внетаксономическая группа одноклеточных грибов, утративших мицелиальное строение, эукариотические микроскопические организмы, способные или не способные к спорообразованию. Дрожжи растут и размножаются, вызывая при этом существенные изменения в окружающей среде, вызывая порчу продуктов. Дрожжевые клетки - факультативно анаэробные или аэробные организмы, которые, лучше растут при наличии кислорода. Наиболее известный и характерный для дрожжей процесс обмена веществ - спиртовое брожение. Однако дрожжи обладают также резко выраженным аэробным обменом веществ. Каждый из них характеризуется накоплением в среде специфических продуктов обмена. Большинство дрожжей являются ацидофильными организмами и способны расти при pH (5,5-4,0) и ниже. Оптимальная температура роста для большинства видов - 25-30°C, хотя многие хорошо развиваются при температурах ниже 5°C. Вегетативные клетки дрожжей погибают при низкотемпературной пастеризации, однако для гибели спор нужна температура выше 80°C. Исследуемые концентрации морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia: 0,0005%; 0,005%; 0,05%; 0,1%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения Ia для достижения заданных концентраций. В первую колбу вносят 2 см3 второго разведения, во вторую - 2 см3 первого разведения, в третью - 2 см3 основного раствора, в четвертую - 4 см3 основного раствора амидов Ia. Затем в каждую колбу, в том числе контрольную, вносят 1% (2 см3) активной культуры дрожжей рода Saccharomyces. Колбы культивируют при (30±1)°C в течение 48 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 6, 24 и 48 ч путем посева культуральной жидкости на среду КМАФАнМ по ГОСТ Ρ 53430-2009. Посевы инкубируют при (30±1)°C в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 24 и 48 ч. Рассчитывают прирост оптической плотности через 24 и 48 часов культивирования. На фиг. 7-8 приведены результаты исследований по влиянию различных концентраций соединений Ia на накопление бактериальной массы тест-культурой дрожжей за 24 и 48 часов развития. Морфолин-4-илпропиламиды жирных кислот подсолнечного масла Ia в концентрации 0,1% задерживают рост тест-культуры примерно на 50% в течение 48 часов.
ПРИМЕР 10.
Порядок проведения испытаний с тест-культурой плесневых грибов рода Penicillium.
Плесневые грибы эукариотические микроскопические многоклеточные организмы, образующие мицелий. Весьма велико биологическое и экологическое разнообразие грибов. Они присутствуют во всех биологических нишах - в воде, на суше и в воздухе. Плесневые грибы могут расти практически повсюду. Способность плесневых грибов быстро занимать и населять подходящие экологические ниши в закрытых помещениях и на открытом воздухе, продуцировать и рассеивать огромные массы спор, возможно, объясняет их эволюционный успех в природе. Грибы растут, умирают и распадаются, и люди почти всегда подвержены различным концентрациям частиц плесневых грибов дома, на работе или на открытом воздухе. В закрытых помещениях споры присутствуют в течение года. Все плесневые грибы - аэробы, ксерофилы (способны размножаться при значениях активности воды Aw - 0,6) и ацидофилы (способны размножаться в диапазоне pH от 1,5 до 9,0). Наличие воды является критическим требованием для роста грибов, хотя многие из них могут выдерживать длительное высушивание. Атмосферная влажность воздействует не только на рост и плодоношение грибов, но также и на рассеивание спор и их распространенность. Способность плесневых грибов размножаться при значениях pH ниже 4,0 лежит в основе способов их выявления в продуктах смешанного микробиального состава, так как при таких значениях pH большинство микроорганизмов не способны давать рост и образовывать видимые колонии на плотных питательных средах. Оптимальная температура развития большинства плесневых грибов 20-35°C, максимальная - 35-50°C, а минимальная - (-5+5)°C. Таким образом, плесневые грибы проявляют ярко выраженные психротрофные свойства и могут развиваться в условиях холодильного хранения. Температуры пастеризации уничтожают вегетативные клетки, для уничтожения спор необходима температура более 85°C. Ряд грибов являются причиной грибковых инфекций - микозов и микоаллергозов, а также микотоксикозов, опасных для здоровья, как человека, так и животных. Исследуемые концентрации морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia: 0,05%; 0,1%; 0,5%. В колбы с 200 см3 стерильного питательного бульона на основе гидролизата белков молока вносят разведения Ia для достижения заданных концентраций. В первую колбу вносят 2 см3 основного раствора, во вторую - 4 см3 основного раствора, в третью - 20 см3 основного раствора амидов Ia. Затем в каждую колбу, в том числе контрольную, вносят 0,1% (0,2 см3) активной культуры плесневых грибов рода Penicillium. Колбы культивируют при (30±1)°C в течение 48 часов. Количество жизнеспособных клеток контролируют в динамике через 0, 24 и 48 ч путем посева культуральцой жидкости на среду КМАФАнМ по ГОСТ Ρ 53430-2009. Посевы инкубируют при (30±1)°C в течение 72 часов. Контроль за нарастанием биомассы проводят по изменению оптической плотности на спектрофотометре в 0, 24 и 48 ч. Рассчитывают прирост оптической плотности через 24 и 48 часов культивирования. На фиг. 9-10 приведены результаты исследований по влиянию различных концентраций соединений Ia на накопление бактериальной массы тест-культурой плесневых грибов за 24 и 48 часов развития. Максимальный ингибирующий эффект наблюдается при добавлении в среду культивирования морфолин-4-илпропиламидов жирных кислот подсолнечного масла Ia в концентрации 0,1% за 48 часов.
Способ получения морфолин-4-илпропиламидов жирных кислот растительных масел формулы I где R - остатки жирных кислот растительных масел,характеризующийся тем, что осуществляют взаимодействие триглицеридов растительных масел и морфолин-4-илпропиламина при мольном соотношении реагентов растительное масло : морфолин-4-илпропиламин = 1 : 3 с добавлением 0,2 мас.% гидроксида натрия с выдерживанием реакционной массы при 130°C в течение 3-х часов и последующей очисткой промыванием насыщенным раствором хлорида натрия.