Органическое люминесцентное вещество на основе производных пирена и электролюминесцентное устройство, содержащее это вещество
Иллюстрации
Показать всеИзобретение относится к органическим люминесцентным веществам, а именно к электролюминесцентным материалам для органических светоизлучающих диодов. В качестве люминесцентного вещества предложены производные 1,8-диаминопирена с арильными заместителями при атомах азота, выбираемых из ряда: фенил, нафталин-1-ил, нафталин-2-ил, 4-трет.бутилфенил. Эти вещества характеризуются эффективной люминесценцией и высокой растворимостью в органических растворителях. Электролюминесцентное устройство на основе этих веществ содержит один органический люминесцентный слой, приготовленный методом полива из раствора. Технический результат - создание эффективного электролюминесцентного устройства, которое может быть приготовлено по «жидкой» технологии, в частности методом принтерной печати. 4 н. и 3 з.п. ф-лы, 8 пр.
Реферат
Изобретение относится к органическим люминесцентным веществам, а именно к электролюминесцентным материалам для органических светоизлучающих диодов.
В настоящее время электролюминесцентные устройства на основе органических материалов нашли практическое применение в области дисплейных технологий и как экономичные источники освещения. Тем не менее задача поиска и разработки новых органических веществ (материалов) с целью их применения в данной области до сих пор актуальна [S.R. Forrest, М.Е. Thompson. Chem. Reviews, v.107, p.923 (2007), Patent WO 2007/108666 A1 (2007)]. Эти материалы должны удовлетворять ряду требований, основные из которых - химическая и термическая их стойкость и высокая эффективность и большое время жизни устройств на их основе [S.R. Forrest, М.Е. Thompson. Chem. Reviews, v.107, p.923 (2007)].
Таким требованиям могут удовлетворять молекулы, содержащие фрагменты пирена Отмечено, что высокосопряженная структура пирена обладает значительной фотолюминесцентной эффективностью [Р.С. Bevilacqua et al., Science, v.258, p.1355 (1992), Y. Li et al. J. Luminescence, v.132, p.1010 (2012)], высокой подвижностью зарядов [W.L. Jua et al. J. Mater. Chem., v.14, p.3344 (2004)]. Такие молекулы уже используются в светодиодных устройствах [Т. Otsubo et al. J. Mater. Chem., v.12, p.2565 (2002); J. Ohshita et al. J. Organometal. Chem., v.678, p.33 (2003); W.L. Jia et al. J. Mfter. Chem., v.14, p.3344 (2004); S.L. Tao et al. Chem. Phys. Lett., v.397, p.1 (2004); K. Suzuki et al. Synth. Met., v.143, p.89 (2004); K. Danel et al. Chem. Mater., v.14, p.3860 (2005); K.R.J. Thomas et al. Chem. Mater., v.17, p.1860 (2005)].
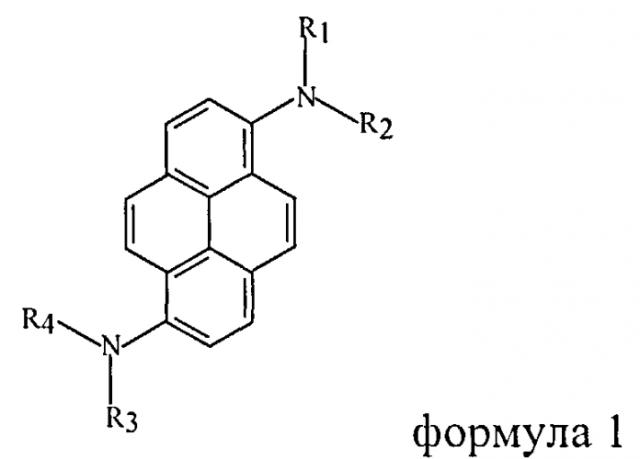
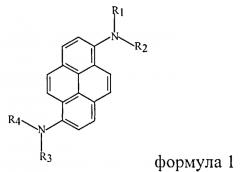
Ряд публикаций [R.R. Reghu et al. J. Phys. Chem., C, v.116, p.15878 (2012); Y.S. Hans. J. Nanjsci. Nanotechnol., v.11, N5, p.4351 (2011); J.-Y. Hu et al. J. Molec. Structure, v.1035, p.1926, (2013); J.-Y. Hu. "Selective synthesis and spectral properties of fluorescent compounds based on polycyclic aromatic hydrocarbons". Thesis, Saga University, 2009, Japan] и патентов [Patent WO 2007/108666 A1 (2007); European Patent 1533289 A1 (2005); US Patent 2012/0032152 A1 (2012); US Patent 2010/0155714 A1 (2010)] касаются серии 1,6-дизамещенных диариламино-группами пиренов (формула 1)
где R1-R4 - ароматические заместители.
Отмечается, что соединения этого ряда обладают высокими квантовыми выходами фотолюминесценции (0,84-0,96) как в растворе, так и в виде дисперсии в матрице, высокой термической стабильностью (более 400°C), способностью образовывать стабильные аморфные пленки. Был синтезирован ряд соединений формулы 1 (R1=R3=фенил, R2=R4=4-замещенный фенил), которые оказались эффективными люминофорами с максимумами излучения от 454 до 620 нм, в зависимости от природы заместителя [K.-R. Wee et al. J. Org. Chem., v.74, N21, p.8472-8475 (2009)].
В работе [Y.S. Hans. J. Nanjsci. Nanotechnol., v.11, N5, p.4351-4356 (2011)] описано электролюминесцентное устройство, содержащее люминофор на основе пирена (формула 1, R1-N-R2=R3-N-R4=карбазол-9-ил). В этом светодиоде данное вещество играет роль как люминофора, так и зарядо-транспортного слоя. Устройство излучало стабильный свет в области 488 им с максимальной яркостью 7560 cd/m2 при 15V. В патентной публикации [European Patent 1533289 A1 (2005)] описан светодиод, в котором используется люминофор формулы 1 (R1-R4=фенил). Он генерирует стабильное излучение синего света с эффективностью по току 5 cd/A как до, так и после выдерживания устройства при 120°C в течение 500 часов. Приведенные примеры иллюстрируют полезные свойства соединений формулы 1 при их использовании в оптоэлектронных устройствах.
В перечисленных выше примерах слои светодиодных устройств получали методом напыления (испарения вещества при повышенной температуре в вакууме). В последнее время все более широкое распространение получает способ образования слоев электролюминесцентных устройств поливом раствора вещества на поверхность с последующим испарением растворителя, в результате чего образуется тонкий аморфный слой данного материала. В идеале применение этого метода позволит конструировать пиксели дисплеев методом принтерной печати, что существенно упростит и удешевит их производство [D.-H. Lee et al. Korean J. Chem. Eng., v.25, p.176 (2008); L. Duan et al. J. Mater. Chem., v.20, p.6392 (2010); J. Kido et al. Appl. Phys. Lett. v.67, p.2281 (2010)]. Органические соединения, пригодные для данного способа, должны удовлетворять следующим требованиям: обладать высокой растворимостью в обычных органических растворителях и после их испарения образовывать аморфные и стабильные пленки.
В то же время люминесцентные вещества серии 1,6-дизамещенных диариламино-группами пиренов (формула 1) плохо растворяются в органических растворителях. Кроме того, при испарении растворов этих веществ образуются кристаллические, а не аморфные пленки.
Для проверки мы синтезировали один из представителей этого класса веществ - описанный в патентной литературе [Patent WO 2007/108666 A1 (2007); US Patent 2010/0155714 A1 (2010)] люминофор: 1-N,6-N-бис (нафталин-2-ил)-1-N,6-N-дифенилпирен-1,6-диамин (формула 1, R1=R3=нафталин-2-ил, R2=R4=фенил). Оказалось, что это соединение обладает невысокой растворимостью даже в горячем анилине (около 0,5 г на 100 мл растворителя), а в обычных органических растворителях эта величина существенно меньше. При испарении таких растворов самопроизвольно образуются кристаллы вышеназванного соединения.
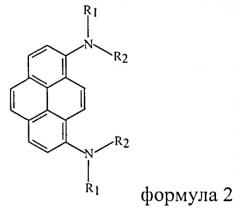
Мы предлагаем ряд новых люминесцентных веществ на основе пирена, свободных от этих недостатков, а именно 1,8-дизамещенных диариламино-группами пиренов формулы 2
где I, R1=фенил, R2=нафталин-2-ил; II, R1=R2=4-трет-бутил-фенил; III, R1=фенил, R2=нафталин-1-ил.
Данные соединения могут быть использованы как в качестве люминофоров, так и в качестве дырочно-транспортных и дырочноинжекционных слоев в органических электролюминесцентных устройствах.
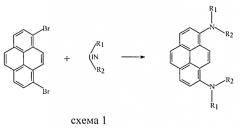
Синтез соединений такого рода основан на конденсации 1,8-дибромпирена с соответствующими диариламинами в условиях реакции Бухвальда-Хартвига [J.F. Hartwig. Angew. Chem. Inter. Ed., v.37, p.2046 (1998)] по схеме 1.
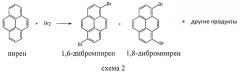
В свою очередь, 1,8-дибромпирен является основным продуктом двойного бромирования пирена бромом согласно схеме 2 [G. Lock. Chem. Ber., Bd.70, N5, s.926 (1937); J. Grimshaw, J. Trocha-Grimshaw. J. Chem. Soc. Perkin Trans. I, p.1622 (1972)]:
Согласно [J.F. Hartwig. Angew. Chem. Inter. Ed., v.37, p.2046 (1998)], 1,8-дибромпирен является основным продуктом (его выход 45%, тогда как выход 1,6-изомера - 21%). Неочищенный 1,8-изомер содержит в виде примесей монобромпирен и 1,3,6-трибромпирен [G. Lock. Chem. Ber., Bd.70, N5, s.926 (1937)]. Путем последовательной дробной кристаллизации и применения адсорбентов мы получили достаточно чистый 1,8-дибромпирен.
Одно из преимуществ заявляемых нами соединений I-III формулы 2 - их более высокая растворимость в органических растворителях и легкость образования стабильных аморфных пленок из раствора. Для сравнения нами был синтезирован описанный в литературе диамин формулы 1 (R1=R3=фенил, R2=R4=нафталин-ил). Его растворимость в горячем анилине составила около 0,5 г в 100 мл растворителя, тогда как у 1,8-изомера (соединение I формулы 2) она была существенно выше (около 20 г на 100 мл растворителя). Последний изомер (соединение I) достаточно хорошо растворяется в обычных органических растворителях (исключая гексан, метанол, этанол) и при комнатной температуре, тогда как в этих условиях растворимость 1,6-дизамещенного аналога близка к нулю.
Кроме того, соединения I-III формулы 2 устойчивы к высокой температуре и являются высокоэффективными люминофорами, излучающими в сине-зеленой области спектра (см. примеры 2-4).
Вышеописанные свойства веществ I-III данного класса делают их полезными при создании электролюминесцентных устройств способом образования слоев поливом раствора вещества на поверхность с последующим испарением растворителя.
Мы приготовили ряд электролюминесцентных устройств, содержащих в люминесцентном слое вещества формулы 2 способом полива раствора вещества на поверхность с последующим испарением растворителя. Известно, что в электролюминесцентных устройствах на основе производных пиренов светоизлучающий слой может состоять как из индивидуального люминесцентного вещества - производного пирена [B.R. Kaafarani et al. J. Mater. Chem. C, v. 1, p. 1638 (2013); W.L. Jua et al. J. Mater. Chem., v. 14, p. 3344 (2004); S. Jeong, J. Nanosci. Nanotech., v. 11, p. 4351 (2011)], так и смеси люминесцентного вещества - производного пирена с каким-либо проводящим (не обязательно люминесцентным) веществом [K.-R. Wee et al. J. Org. Chem., v. 74, p. 8472 (2009)]. В частности, для приготовления светоизлучающего слоя может быть использована смесь органического люминесцентного вещества и проводящего полимера, например, поливинилкарбазола (PVK) [J. Kido et al. Appl. Phys. Lett. 67, 2281 (2010)]. При этом для появления излучения не имеет принципиального значения соотношение между компонентами в такой смеси. Так, в работе [K.-R. Wee et al. J. Org. Chem., v. 74, p. 8472 (2009)] содержание производного пирена в излучающем слое составляло от 0 до 11%. В то же время светоизлучающий слой, состоящий из индивидуального производного пирена, можно рассматривать как смесь, содержащую 100% люминесцентного вещества.
Приготовленные нами устройства содержат в люминесцентном слое смесь PVK и одного из веществ формулы 2 при содержании производного пирена от 40% до 60%. Полученные электролюминесцентные устройства излучают синий свет при приложении прямого напряжения, порог появления света около 4 В, яркость 50-100 кд/м2 достигается при напряжении 7-16 В. Длина волны электролюминесценции близка к длине волны фотолюминесценции пленок соответствующих производных пирена. При этом нет существенной зависимости параметров излучения от соотношения компонентов в смеси РУК : пирен. Учитывая приведенные выше литературные данные о наблюдении электролюминесценции независимо от концентрации люминесцентного вещества в светоизлучающем слое, можно считать, что излучение будет возникать при любом соотношении компонентов.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Синтез 1,8-дибромпирена
Схема реакции:
К раствору 20,2 г (0,1 М) пирена в 500 мл безводного тетрахлорида углерода прибавляли по каплям раствор 10 мл брома (62,04 г, 0,388 М) в 500 мл безводного тетрахлорида углерода. Время прибавления - 6 часов. Температуру реакции поддерживали в интервале 20-25°C. По окончании прибавления брома смесь выдерживали при той же температуре еще 48 час. Выпавший осадок 1,6-дибромпирена отфильтровывали, промывали гексаном, метанолом. Сушили в вакууме над пентаоксидом фосфора. Получили 9,02 г 1,6-дибромпирена (выход 25,1% от теоретического). Из фильтратов полностью удаляли растворитель. Твердый остаток перекристаллизовывали из смеси толуол-гексан. Получили 17,9 г 1,8-дибромпирена. Выход 49,7% от теоретического.
Пример 2.
Синтез 1-N,8-N-бис(нафталин-2-ил)-1-N,8-N-дифенилпирен-1,8-диамина (I).
Схема реакции:
Смесь 5,4 г (0,015 М) 1,8-дибромпирена, 8,3 г (0,0375 М) N-фенил-2-нафтиламина, 80 мг палладия диацетата 280 мг трис(трет.бутил) фосфина, 3,8 г (0,04 М) трет-бутоксида натрия и 100 мл о-ксилола нагревали до 125-130°C. Реакционную массу перемешивали при этой температуре в инертной атмосфере (аргон) 3,5 часа. После охлаждения до комнатной температуры смесь разбавляли 100 мл гексана. Отфильтровывали твердый продукт, промывали его последовательно гексаном, метанолом, водой. Сушили в вакууме над пентаоксидом фосфора. Получили 9,35 г целевого продукта (I). Выход 98,0% от теоретического. Элементный анализ. Найдено, %: С 90,41; Н 5,31; N 3,67. Брутто-формула C48H32N2. Вычислено, %: C 90,54; H 5,07; N 4,40.
Растворимость (20°C) в толуоле 1 г/л, в хлороформе 3 г/л.
УФ спектр (пленка, высаженная из раствора в хлороформе): 226, 265, 324, 370, 450 нм.
Спектр ФЛ (λвозб=380 нм): 528 нм (порошок), 485, 540 (пл) нм (пленка).
Пример 3.
Синтез 1-N,1-N,8-N,8-N-тетракис(4-трет.бутилфеннл)пирен-1,8-диамина (II)
Схема реакции:
Смесь 5,4 г (0,015 М) 1,8-дибромпирена, 10,54 г (0,0375 М) 4,4′-ди-(трет-бутил)дифениламина, 80 мг палладия диацетата, 280 мг трис-(трет.бутил)фосфина, 3,8 г (0,04 М) трет-бутоксида натрия и 100 мл о-ксилола нагревали до 125-130°C. Реакционную массу перемешивали при этой температуре в инертной атмосфере (аргон) 3 часа. После охлаждения до комнатной температуры смесь разбавляли 100 мл бензола и отфильтровывали от осадка, который промывали на фильтре 50 мл бензола. Объединенные фильтраты упаривали досуха при пониженном давлении и к остатку прибавляли 50 мл метанола. Образовывался осадок, который отфильтровывали, сушили на воздухе и перекристаллизовывали из смеси бензол-гексан. Получили 11,14 г целевого продукта (II). Выход 97,7% от теоретического. Элементный анализ. Найдено, %: С 87,91; Н 7,79; N 3,57. Брутто-формула C56H60N2. Вычислено, %: С 88,37; Н 7.95; N 3,68.
Растворимость (20°C) в толуоле 3 г/л, в хлороформе 3 г/л.
УФ-спектр (пленка, высаженная из раствора в хлороформе): 200, 245, 253, 270 пл, 384, 445 нм.
Спектр ФЛ (λвозб=380 нм): 500 нм (порошок), 480, 550 нм (пленка).
Пример 4.
Синтез 1-N,8-N-бис(нафталин-1-ил)-1-N,8-N-дифенилпирен-1,8-диамина (III)
Схема реакции:
Смесь 5,4 г (0,015 М) 1,8-дибромпирена, 8,3 г (0,0375 М) N-фенил-1-нафтиламина, 80 мг палладия диацетата, 280 мг трис-(трет-бутил)фосфина, 3,8 г (0,04 М) трет-бутоксида натрия и 100 мл о-ксилола нагревали до 125-130°C. Реакционную массу перемешивали при этой температуре в инертной атмосфере (аргон) 3,5 часа. После охлаждения до комнатной температуры смесь разбавляли 100 мл гексана, отфильтровывали осадок (5,4 г, побочные продукты), фильтрат упаривали досуха. Остаток обрабатывали ацетоном и метанолом. Получили 3,81 г целевого продукта (III) с выходом 39,9% от теоретического. Элементный анализ. Найдено, %: С 89,69; Н 5,11; N 4,43. Брутто-формула C48H32N2. Вычислено, %: С 90,54; Н 5,07; N 4,40. Растворимость в толуоле >3 г/л, в хлороформе >3 г/л.
УФ-спектр (пленка, высаженная из раствора в хлороформе): 210, 254, 310, 370, 420 пл, 440 нм.
Спектр ФЛ (λвозб=380 нм): 505 нм (порошок), 475, 540 (пл) нм (пленка).
Пример 5 (сравнительный).
Синтез 1-N,6-N-бис(нафталин-2-ил)-1-N,6-N-дифенилпирен-1,6-диамина
Схема реакции
Смесь 5,4 г (0,015 М) 1,6-дибромпирена, 8,3 г (0,0375 М) N-фенил-2-нафтиламина, 80 мг палладия диацетата, 280 мг трис (трет-бутил)фосфина, 3,8 г (0,04 М) трет-бутоксида натрия и 100 мл о-ксилола нагревали до 125-130°C. Реакционную массу перемешивали при этой температуре в инертной атмосфере (аргон) 7,0 часов. После охлаждения отфильтровывали осадок, промывали его последовательно гексаном, метанолом, водой. Сушили в вакууме над пентаоксидом фосфора. Получили 7,35 г целевого соединения. Выход 77,0% от теоретического. Растворимость (20°C) в толуоле <0.2 г/л, в хлороформе <0.2 г/л.
Пример 6.
Электролюминесцентное устройство
Для изготовления электролюминесцентного устройства используют стеклянную подложку, покрытую прозрачным слоем смешанного оксида индия и олова (ITO) с сопротивлением 20-25 Ом/квадрат. На подложку наносят методом центрифугирования из водного раствора полимер полиэтилендиокситиофен, допированный полистиролсульфонатом (PEDOT:PSS). Слой ITO с покрытием PEDOT:PSS служит дырочно-инжектирующим слоем. На поверхность дырочно-инжектирующего слоя наносят органический люминесцентный слой методом центрифугирования из основного раствора в толуоле. Основной раствор содержит поливинилкарбазол (PVK) и 1-N,1-N,8-N,8-N-тетракис(4-трет-бутилфенил)-пирен-1,8-диамин (II) при содержании (II), равным 40, 50 или 60% по массе. Образец помещают в вакуумную установку, откачивают в динамическом режиме до вакуума 5·10-6 мм рт. ст. и напыляют металлический электрод (электронно-инжектирующий слой) путем испарения сплава алюминия с кальцием. Площадь светящейся поверхности 4 мм2. Полученное электролюминесцентное устройство излучает свет при приложении прямого напряжения. Длина волны в максимуме спектра электролюминесценции 483 нм. Порог появления света около 4 В. Для устройства с содержанием (II), равным 50%, яркость 100 кд/м2 достигается при напряжении 10 В и токе 7 мА. Для устройств с содержанием (II), равным 40% и 60%, соответствующие параметры составляют 70 кд/м2, 16 В, 13 мА и 100 кд/м2, 16 В, 13 мА.
Пример 7.
Электролюминесцентное устройство
Аналогично примеру 6, но вместо соединения (II) используется соединение 1-N,8-N-бис(нафталин-2-ил)-1-N,8-N-дифенилпирен-1,8-диамин (I). Длина волны в максимуме спектра электролюминесценции 486 нм. Порог появления света около 4 В. Для устройства с содержанием (I), равным 50%, яркость 100 кд/м2 достигается при напряжении 12 В и токе 8 мА. Для устройств с содержанием (I), равным 40% и 60%, соответствующие параметры составляют 70 кд/м2, 16 В, 5 мА и 50 кд/м2, 16 В, 13 мА.
Пример 8.
Электролюминесцентное устройство.
Аналогично примеру 6, но вместо соединения (II) используется соединение 1-N,8-N-бис(нафталин-1-ил)-1-N,8-N-дифенилпирен-1,8-диамин (III). Длина волны в максимуме спектра электролюминесценции 477 нм. Порог появления света около 4 В. Для устройства с содержанием (III), равным 50%, яркость 100 кд/м2 достигается при напряжении 16 В и токе 11 мА. Для устройств с содержанием (III), равным 40% и 60%, соответствующие параметры составляют 100 кд/м2, 16 В, 13 мА и 100 кд/м2, 16 В, 13 мА.
1. Органическое люминесцентное вещество на основе производных пирена, отличающееся тем, что оно представляет собой производное 1,8-диаминопирена общей формулы: ,где группы R1 и R2 могут быть одинаковыми или различными и выбираются из ряда: фенил, нафталин-1-ил, нафталин-2-ил, 4-трет-бутилфенил.
2. Органическое люминесцентное вещество по п. 1, отличающееся тем, что в нем группа R1 представляет собой фенил, а группа R2 представляет собой нафталин-2-ил.
3. Органическое люминесцентное вещество по п. 1, отличающееся тем, что в нем группы R1 и R2 одинаковы и представляют собой 4-трет-бутилфенил.
4. Органическое люминесцентное вещество по п. 1, отличающееся тем, что в нем группа R1 представляет собой фенил, а группа R2 представляет собой нафталин-1-ил.
5. Электролюминесцентное устройство, состоящее из электронного инжектирующего слоя, активного люминесцентного слоя и дырочного инжектирующего слоя, отличающееся тем, что в качестве активного люминесцентного слоя оно содержит смесь поливинилкарбазола и органического люминесцентного вещества по п. 1 или 2.
6. Электролюминесцентное устройство, состоящее из электронного инжектирующего слоя, активного люминесцентного слоя и дырочного инжектирующего слоя, отличающееся тем, что в качестве активного люминесцентного слоя оно содержит смесь поливинилкарбазола и органического люминесцентного вещества по п. 1 или 3.
7. Электролюминесцентное устройство, состоящее из электронного инжектирующего слоя, активного люминесцентного слоя и дырочного инжектирующего слоя, отличающееся тем, что в качестве активного люминесцентного слоя оно содержит смесь поливинилкарбазола и органического люминесцентного вещества по п. 1 или 4.