Способ лечения рака предстательной железы
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к онкологии, урологии. Воздействие осуществляют постоянным электрическим током посредством накожных пластинчатых электродов. При этом анод в виде двух удлиненных электродов прямоугольной формы размещают в надлонной области симметрично относительно проекции на кожу белой линии живота, так чтобы длинные стороны электродов были параллельны ей, а одна из коротких сторон располагалась в области нижней границы надлонной области. Катод в виде двух квадратных электродов размещают в промежности и области крестца. Предварительно выявляют первоначальный порог переносимости по отсутствию болевых ощущений и определяют начальные величины силы тока и напряжения. Затем в течение первых 10-15 минут сеанса увеличивают рабочее напряжение с шагом в 0,1 В, вновь выявляя порог переносимости по отсутствию болевых ощущений. Далее в процессе сеанса до его окончания регистрируют сопротивление тканей между анодом и катодом. При его значении, равном или ниже 250 кОм, дополнительно увеличивают рабочее напряжение с шагом 0,1 В до порога переносимости по отсутствию болевых ощущений. Проводят 3-5 сеансов с интервалом 2-4 недели между ними. Способ позволяет повысить эффективность лечения, что достигается за счет подбора индивидуального режима электровоздействия с учетом порога переносимости боли, а также за счет определения размеров и области приложения электродов с учетом анатомического расположения предстательной железы с обеспечением ее наиболее полного охвата. 2 з.п. ф-лы, 3 ил., 1 пр.
Реферат
Изобретение относится к медицине, а именно к онкологии, урологии, может быть использовано для лечения больных локализованным или местно-распространенным раком предстательной железы.
На сегодняшний день общепринятым стандартом лечения больных локализованным раком предстательной железы является радикальная простатэктомия, которая предусматривает доступ к предстательной железе, удаление предстательной железы вместе с капсулой, семенными пузырьками, простатической частью уретры, парапростатической клетчаткой и регионарными лимфатическими узлами (Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хирургия рака предстательной железы. М.: ГЭОТАР-Медиа; 2006).
Несмотря на постоянное совершенствование хирургической техники, неизменно сохраняется высокий риск осложнений в послеоперационном периоде, которые существенно снижающих качество жизни пациентов.
Из всех возможных осложнений наиболее часто встречаются кровотечения, стрессовое недержание мочи, эректильная дисфункция, стриктура везикоуретерального анастомоза.
Согласно результатам ряда исследований, боязнь возможных послеоперационных осложнений, и в первую очередь потерять потенцию, является одной из основных причин, заставляющих пациентов отказываться от выполнения радикальной простатэктомии в пользу других, менее агрессивных методов лечения.
Дистанционная лучевая терапия больных раком предстательной железы как самостоятельный метод радикального лечения, а также в качестве компонента комбинированного или комплексного лечения успешно применяется в течение длительного времени.
Сущность метода заключается в облучении предстательной железы с перипростатической клетчаткой, семенными пузырьками, шейкой мочевого пузыря и передней стенкой прямой кишки. В случае более распространенной стадии опухолевого процесса в объем облучения включаются регионарные лимфатические узлы малого таза. Суммарные очаговые дозы лучевой нагрузки на предстательную железу составляют от 60 до 125 Гр (Асатурян М.А., Коробкова И.М., Фролова З.М., Британчук М.М. Основы и клиническое применение лучевой терапии. В кн. Г.Е. Труфанова лучевая диагностика и лучевая терапия. СПб.: ВМедА; 2005; 106-134).
Отдаленные результаты лечения сопоставимы с таковыми после радикальной простатэктомии. Вместе с тем осложнения, возникающие после проведения лучевой терапии, обусловленные лучевым воздействием на здоровые ткани, так же снижают качество жизни пациентов. В зону облучения попадают прямая кишка, мочевой пузырь, мышцы и фасции малого таза. Лучевой цистит развивается у 2-5% пациентов, диарея - у 3-6%, проктит и кровотечения из прямой кишки - у 3%. Включение в зону облучения регионарных лимфатических узлов увеличивает количество больных с осложнениями на 10-15%.
С 1970-х годов для лечения больных локализованным раком предстательной железы применяется метод внутритканевой лучевой терапии - брахитерапия (Ciezki J.P., Klein Е.А. Brachytherapy or surgery. A composite review. Oncology (Williston Park). 2009; 23: 960-4).
Метод основан на размещении закрытых микроисточников 125I, 103Pd, 131Cs в ткани предстательной железы, способных создавать высокую локальную дозу облучения, вызывающую гибель злокачественных клеток. Суммарная очаговая доза лучевой нагрузки 125I составляет 140-160 Гр. Встречающиеся осложнения этого лечения могут носить серьезный, а иногда необратимый характер и возникают в большинстве случаев вследствие повреждения мочеиспускательного канала, мочевого пузыря и прямой кишки.
У 33-72% пациентов наблюдается развитие воспалительных осложнений; макрогематурия, возникающая в результате травматизации иглами мочевого пузыря или уретры, отмечается - у 6,7% больных; лучевые ректиты - у 5-21% больных; эректильная дисфункция - у 40% больных.
В литературе описаны случаи развития у больных стриктуры и некроза тканей уретры в послеоперационном периоде, потребовавшие хирургической коррекции.
Вышеописанные методы давно используются в клинической практике и обладают высокой эффективностью, неоднократно доказанной в различных клинических исследованиях, но при этом сопровождаются развитием осложнений, существенно снижающих качество жизни пациентов. Не является исключением развитие местных рецидивов заболевания у части пациентов после применения стандартного лечения, что значительно усложняет тактику дальнейшего ведения таких больных.
В последние годы возрос интерес к методам локального воздействия, среди которых известны криотерапия, воздействие высокоинтенсивным сфокусированным ультразвуком (High Intensity Focused Ultrasound; HIFU-терапия соответственно).
Под криотерапией понимают процесс локального замораживания и гибели тканей с формированием участка некроза заданной формы и размера для деструкции злокачественных клеток и прилежащих по краю здоровых тканей (Patel B.G., Parson C.L., Bidair М., et al. Cryoablation for carcinoma of the prostate. J. Surg. Oncol. 1996; 63: 256-64).
Замораживание ткани предстательной железы осуществляется при помощи криозондов, установленных чреспромежностным доступом под контролем трансректального ультразвукового исследования. В качестве криоагента в настоящее время используется аргон, реже жидкий азот. Проводят два цикла заморозки-оттаивания, позволяющих достигать температуры - 40°C в центре предстательной железы и области сосудисто-нервного пучка.
Из возможных осложнений криоабляции наиболее частым является эректильная дисфункция, возникающая у 80% больных. Недержание мочи отмечается у 4,8% больных, задержка мочеиспускания - у 3,6% больных, тазовые боли - у 1,4% больных.
В основе терапии с использованием воздействия высокоинтенсивного сфокусированного ультразвука (High Intensity Focused Ultrasound), (HIFU-терапия) лежит воздействие на ткань предстательной железы сфокусированной ультразвуковой волны высокой интенсивности, способной приводить к резкому повышению температуры в ткани предстательной железы до 70-100°C в течение нескольких секунд (Blana A., Walter В., Rogenhofer S., et al. High-intensity focused ultrasound for the treatment of localized prostate cancer: 5-year experience. Urology. 2004; 63: 297-300). При этом происходит повреждение биологических структур (денатурация белков, расплавление липидных мембран) с последующим развитием коагуляционного некроза. Через 3-6 месяцев некротизированная ткань предстательной железы вместе с капсулой замещается фиброзной тканью. Данный способ выбран нами в качестве прототипа.
Среди осложнений HIFU-терапии острая задержка мочеиспускания возникает почти у 100% больных, подвергшихся данному лечению. Воспалительные изменения уретры и мочевого пузыря отмечаются у 13% больных и всегда требуют назначения антибактериальной терапии. Рубцовая стриктура простатической части уретры, склероз шейки мочевого пузыря формируются в разные сроки после лечения у 8,9% больных и требуют хирургической коррекции. Недержание мочи наблюдается у 10-29% пациентов, эректильная дисфункция - у 62% больных. Одним из наиболее серьезных осложнений HIFU-терапии, описанных в литературе, является формирование уретроректального свища. Данное осложнение существенно снижает качество жизни и требует длительного многоэтапного лечения.
Таким образом, вышеописанные методы локального воздействия демонстрируют хорошие онкологические результаты. Однако осложнения, возникающие в интра- и послеоперационном периодах, а также высокая экономическая стоимость лечения ограничивают их широкое применение.
Разработка и внедрение в клиническую практику новых методов локального воздействия, позволяющих проводить адекватное лечение больных раком предстательной железы без нарушения качества их жизни, являются одним из актуальных направлений современной онкоурологии.
Одним из таких методов, на наш взгляд, является метод электрохимического лизиса (биоэлектротерапия). Избирательная деструкция клеток опухоли обусловлена их физико-химическими свойствами. В отличие от здоровых клеток, раковые клетки обладают повышенной электропроводностью, низким сопротивлением, большим отрицательным зарядом клеточных мембран. Под действием постоянного электромагнитного поля, возникающего благодаря разнополярным накожным электродам, подключенным к источнику постоянного тока со строго определенными характеристиками, в опухолевых клетках запускаются процессы окисления с последующим развитием некроза.
В нашей стране метод электрохимического лизиса уже применяется в онкологии.
Известны способы лечения метастазов в печени (патент РФ №2229904), внутриглазных новообразований (патент РФ №2485921), меланомы хориоидеи (патент РФ №2347547) с применением электрохимического лизиса. Сущность этих методов заключается во введении в ткань опухоли определенного числа игольчатых электродов под контролем зрения или ультразвуковым контролем и проведении воздействия постоянным электрическим током на опухоль. В качестве источника тока использовался аппарат ECU-300 (Söring, Германия).
Существенным недостатком данных методик лечения является введение электродов непосредственно в опухоль, что может нарушать целостность капсулы опухоли и способствовать диссеминации онкологического процесса, нарушая тем самым правила абластики в онкологии.
Кроме того, нельзя исключить травматизацию электродами крупных сосудов органа, который подвергается лечебному воздействию, включая патологические сосуды самой опухоли. Для исключения этих осложнений в процессе лечения необходима хорошая визуализация при помощи ультразвука. Необходимость ультразвуковой визуализации в процессе фиксации электродов и также применение анестезии при этом, усложняющих проведение лечебной процедуры, также можно отнести к недостаткам описанных способов лечения.
Известно также применение электрохимического лизиса в урологии для лечения больных доброкачественной гиперплазией предстательной железы (патент РФ №2278635). Метод заключается в следующем. Электрохимический лизис гипертрофированных узлов проводят биполярным электродом под ультразвуковым контролем, который вводится в уретру. Электрод используется как проводник постоянного тока. В процессе лечения электрод последовательно перемещают от мочевого пузыря к наружному сфинктеру. Формируется зона некроза по анатомическому ходу простатического отдела уретры цилиндрической формы, которая соответствует области доброкачественной гиперплазии предстательной железы, но не позволяет захватить все предстательную железу, что необходимо при раке, особенно при мультифокальном поражении органа.
Недостатком метода, на наш взгляд, является также необходимость трансуретрального введения электрода, что может сопровождаться повреждением тканей уретры, простаты и окружающих анатомических структур, а также развитием воспалительных осложнений, кровотечений, острой задержки мочеиспускания в послеоперационном периоде.
Кроме того, процедура лечения требует применения анестезиологического пособия, что не всегда возможно у пациентов с отягощенным соматическим статусом.
Нами поставлена задача разработать простой эффективный способ лечения больных с локализованным и местно-распространенным раком предстательной железы путем локального воздействия на опухоль; исключающий нарушение качества жизни пациентов, который может быть использован в амбулаторных условиях.
Технический результат, достигаемый при осуществлении изобретения, заключается в:
1) упрощении методики лечебного воздействия и снижении ее травматичности за счет исключения необходимости использования дополнительных средствах визуализации, специального анестезиологического пособия; травматизации ткани предстательной железы и соседних анатомических структур;
2) исключении послеоперационных осложнений со стороны органов мочеполовой сферы, ухудшающих качество жизни пациентов, при сохранении хороших онкологических результатов лечения;
3) оптимизации лечебного процесса за счет повышения его радикальности при сохранении простоты и доступности путем подбора индивидуального режима электровоздействия с учетом порога переносимости пациентом на всех его этапах, а также путем определения размеров и области наложения электродов с учетом анатомического расположения предстательной железы с обеспечением ее наиболее полного охвата электровоздействием.
Нами установлен оригинальный режим биоэлектротерапии (метода электрохимического лизиса) для лечения больных локализованным и местно-распространенным раком предстательной железы, который включает помимо диапазонов величин используемых силы тока, напряжения, продолжительности лечения и выбор размеров электродов, особенности их расположения на теле пациента, также учет порога переносимости электровоздействия пациентом во время всего периода лечебного воздействия, принимая во внимание «привыкание» к этому воздействию.
Предлагаемая нами методика биоэлектротерапии позволяет проводить лечение более высокими величинами напряжения и силы тока, что, в свою очередь, позволяет повысить радикальность воздействия при локализованном или местно-распространенном раке предстательной железы и улучшить тем самым результаты лечения данной категории больных.
Предлагаемое нами расположение электродов и их размеры обеспечивает минимальное расстояния между ними и тканью железы, а также позволяет включить в поле воздействия электрического тока всю железу с парапростатической клетчаткой и семенными пузырьками.
В области крестца с учетом низкой электропроводности костной ткани, как было установлено нами, достаточно фиксировать один электрод (катод), а второй электрод (катод) фиксировать в промежности.
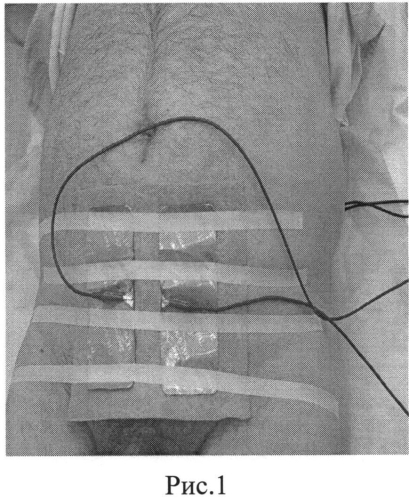
Сущность изобретения заключается в следующем. Способ лечения больных локализованным или местно-распространенным раком предстательной железы постоянным электрическим током посредством накожных пластинчатых электродов состоит в следующем. Анод выполняют в виде двух удлиненных электродов прямоугольной формы с размерами сторон 12,8 см и 5,6 см, которые размещают в надлонной области симметрично относительно проекции на кожу белой линии живота, так, чтобы длинные стороны электродов были параллельны ей, а одна из коротких сторон располагалась в области нижней границы надлонной области. Катод выполняют в виде двух квадратных электродов с размером, равным короткой стороне анода, которые размещают в промежности и области крестца.
Сеанс воздействия проводят следующим образом. Предварительно выявляют первоначальный порог переносимости по отсутствию болевых ощущений, определяя начальные величины силы тока и напряжения.
Затем в течение первых 10-15 минут сеанса увеличивают рабочее напряжение с шагом в 0,1 В по отношению к определенной начальной величине напряжения, вновь выявляя порог переносимости по отсутствию болевых ощущений. Далее в процессе сеанса до его окончания регистрируют сопротивление тканей между анодом и катодом. При его значении, равном или ниже 250 кОм, дополнительно увеличивают рабочее напряжение с шагом 0,1 В до порога переносимости по отсутствию болевых ощущений. Проводят 3-5 сеансов воздействия с интервалом 2-4 недели между ними.
В частном случае между кожей пациента и электродами помещают электропроводные прокладки, на 2-3 см превышающие размеры электродов.
В качестве источника постоянного тока может быть использован аппаратный комплекс ВЕТ-7.
Способ осуществляется следующим образом.
Лечение проводят в положении больного лежа на спине. Осуществляют фиксацию накожных пластинчатых разнозаряженных электродов: анод располагают на коже надлонной области, катод - на коже крестца и промежности.
В надлонной области располагают 2 пластинчатых электрода прямоугольной формы (анод) размером 12,8×5,6 см, один пластинчатый электрод (катод) размером 5,6×5,6 см располагают в промежностной области (при этом мошонка отводится вверх) и 4-й электрод (катод) размером 5,6×5,6 см - в области крестца.
Причем электроды, представляющие собой анод, размещают в надлонной области симметрично относительно проекции на кожу белой линии живота, так, чтобы длинные стороны электродов были параллельны ей, а одна из коротких сторон располагалась в области нижней границы надлонной области.
Для устранения сопротивления кожи и увеличения проводимости электрического тока нами применялись синтетические электропроводные прокладки, на 2-3 см превышающие размеры электродов, смоченные 0,9% раствором натрия хлорида. Данные прокладки помещают между кожей пациента и электродами. Мы определили, что для избегания контакта электрода с кожей пациента и развития ожогов, размеры используемых прокладок должны на 2-3 см превышать размеры электродов. Для максимального прилегания электродов к поверхности тела, их закрепляют с помощью лейкопластыря и отягощения в виде мешочков с песком весом 0,6 кг (26×8 см).
На рис. 1 представлено расположение электродов (анод) в надлонной области.
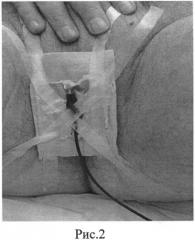
На рис. 2 представлено расположение электрода (катод) в промежности.
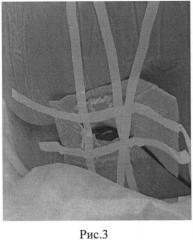
На рис. 3 представлено расположение электрода (катод) в области крестца.
После фиксации электродов соединяют электродные провода с электродной коробкой. Затем запускают лечебную программу ВЕТ-7 и проводят тестирование болевого порога пациента для определения начальных показателей силы тока и напряжения. Значение напряжения электрического тока в данный момент принимают как заданное напряжение.
Затем, после запуска программы лечения постепенно увеличивают напряжения электрического тока шагами в 0,1 вольта по отношению к начальной величине напряжения. Пошаговое увеличение напряжения необходимо проводить первые 10-15 минут лечения, что бы получить максимальные переносимые пациентом показатели силы тока, необходимые для адекватного воздействия на опухолевые клетки.
Таким образом, в течение первых 10-15 минут сеанса увеличивают рабочее напряжение с шагом в 0,1 В по отношению к определенной начальной величине напряжения, вновь выявляя порог переносимости по отсутствию болевых ощущений. При этом после каждого шага увеличения напряжения выясняют у больного его ощущения (наличие чувства жжения, боли). В случае появления жалоб на чувство жжения, болезненности, дискомфорта в проекции фиксированных электродов снижают напряжение до параметров, при которых пациент перестает отмечать вышеописанные жалобы.
В дальнейшем осуществляют контроль показателей напряжения, силы тока и сопротивления (в зоне воздействия между анодом и катодом), регистрируемые на мониторе прибора в течение всего времени лечебного воздействия.
При значении сопротивления в зоне воздействия (между анодом и катодом), равном или ниже 250 кОм, дополнительно увеличивают рабочее напряжение с шагом 0,1 В до порога переносимости по отсутствию болевых ощущений.
Напряжение увеличивают шагами в 0,1 В до значений, позволяющих пациенту комфортно переносить лечебный сеанс (пациент не должен испытывать каких-либо неприятных ощущений: чувство жжения, боли).
Проводят 3-5 сеансов воздействия с интервалом 2-4 недели между ними, что необходимо для формирования некроза в опухолевом узле с последующим фиброзированием и инкапсуляцией разрушенной опухолевой ткани.
В процессе проведения лечебного сеанса необходим тщательный контроль влажности используемых под электродами прокладок и надежностью их фиксации к коже пациента. При необходимости дополнительного смачивания прокладок, коррекции фиксации электродов, на это время возможно прекращение лечебного воздействия. Кроме того, необходим контроль показателей силы тока и напряжения на экране монитора, так как нами было отмечено, что при длительном воздействии сила тока способна падать в виду разрушения опухолевых клеток и снижения электропроводности этой зоны, что требует дополнительной пошаговой прибавки напряжения тока до порога переносимости пациента, как показано выше.
После окончания лечебного сеанса сохраняют графическое изображение в индивидуальной папке пациента, в котором отражены достигнутые параметры напряжения, силы тока, сопротивления. Электроды снимают, кожу в проекции фиксации электродов вытирают насухо, обрабатывают увлажняющими средствами.
Мы определили, что оптимальное количество лечебных сеансов, необходимое формирования некроза в опухолевом узле с последующим фиброзированием и инкапсуляцией разрушенной опухолевой ткани, должно быть 3-5.
В качестве источника постоянного тока может быть использован аппаратный комплекс ВЕТ-7 (Horst Poduschka, Германия). Класс защиты лечебной установки ВЕТ-7 соответствует требованиям интернациональных норм по эксплуатации медицинского оборудования IEC 60601-1.
Приводим доказательства возможности реализации заявленного назначения и достижения указанного технического результата.
Клинический пример
Больной У. 63 лет обратился с жалобами на затрудненное учащенное до 4-5 раз ночное мочеиспускание, вялую струю мочи. При пальцевом ректальном исследовании выявлено: предстательная железа увеличена в 2 раза, плотно-эластической консистенции, бугристая, с нечеткими контурами, безболезненная, срединная бороздка сохранена. В левой доле в верхнем полюсе определяется опухолевый узел, выходящий за пределы железы, размером 2,5×2,5 см. Значение общего простатического специфического антигена крови составило 32,8 нг/мл. По данным трансректального ультразвукового исследования: предстательная железа объемом 74 см3, с неровным контуром, неправильной формы, неоднородная, смешанной эхогенности. На границе периферической и центральной зон левой доли определяется округлое неоднородной солидное образование 30×25 мм, с патологическим интенсивным внутренним кровотоком. Семенные пузырьки не увеличены, симметричные, заполнены однородным гипоэхогенным содержимым. Выполнена биопсия предстательной железы. Гистологическое исследование: в 2-х из 14 исследованных микропрепаратах определяются разрастания умеренно дифференцированной аденокарциномы. Степень дифференцировки по классификации Глисона - 5 баллов. По результатам проведенного стандартного обследования данных за наличие отдаленных метастазов не получено. Таким образом, установлен диагноз рака предстательной железы T3aN0M0G2. Сопутствующие заболевания: ИБС: Стенокардия напряжения II ФК. Атеросклеротический кардиосклероз. Недостаточность кровообращения II ст. Нарушения ритма. От традиционных методов лечения пациент категорически оказался, после чего ему было предложено лечение методом электрохимического лизиса. После подписания информированного согласия пациенту проведено 5 сеансов с использованием аппарата ВЕТ-7 по предложенному способу, с интервалом между сеансами 2 недели. Лечение проводилось амбулаторно, без нарушения образа жизни пациента.
Каждый лечебный сеанс начинался с укладки больного и фиксации накожных пластинчатых электродов, как описано нами выше, проводилось тестирование индивидуального болевого порога пациента и устанавливались лечебные значения силы тока и напряжения. Параметры лечебного воздействия были следующими в ходе проведенных 5 лечебных сеансов составили: напряжение - 9-13 В; сила тока - 16-20 мА; экспозиция - 180 мин. Никаких осложнений лечения в ходе сеансов и по их окончании зарегистрировано не было. После проведения каждого сеанса пациент отмечал субъективное улучшение мочеиспускания. Через 2 недели по окончании лечебных сеансов больному проводилось контрольное обследование. По данным трансректального ультразвукового исследования наблюдалось уменьшение объема предстательной железы до 54 см3, четко опухолевый узел не определялся, очагов патологического кровотока не выявлялось. Значение общего простатического специфического антигена составило 17,74 нг/мл. Субъективно пациент доволен качеством мочеиспускания. По результатам трансректального ультразвукового исследования, выполненного через 3 месяца после завершения лечения, отмечено дальнейшее уменьшение объема предстательной железы до 48 см3, отсутствие очагов патологического кровотока в предстательной железе. Уровень простатического специфического антигена - 6,68 нг/мл.
Через год после окончания лечения больному выполнена контрольная биопсия предстательной железы. Гистологическое исследование: на фоне гиперплазированной ткани простаты определяется участок фиброза. Уровень общего простатического специфического антигена 1,22 нг/мл.
Из приведенного клинического примера видно, что предлагаемый нами метод электрохимического лизиса, включающий подбор и фиксацию электродов, диапазон лечебных значений силы тока и напряжения, длительность и кратность сеансов позволяет проводить лечение больных раком предстательный железы без риска развития осложнений лечения и нарушения качества их жизни.
Всего предлагаемый способ был использован у 34 больных с локализованным и местно-распространенным раком предстательной железы. У 11 пациентов достигнут полный ответ на противоопухолевое лечение. У 18 пациентов получен частичный ответ в виде уменьшения опухоли на 50% от первоначального размера, а также стабилизация уровня простатического специфического антигена в пределах от 0,5 до 2 нг/мл. У 5 пациентов получен умеренный ответ (уменьшение размера опухолевого очага на 25% от первоначального) и стабилизация уровня простатического специфического антигена от 2,0 до 3,5 нг/мл. При оценке эффективности результатов лечения использовались критерии ВОЗ для оценки эффективности лечения.
Таким образом, преимущества лечения больных локализованным и местно-распространенным раком предстательной железы предлагаемым нами способом следующие:
1. Применение метода электрохимического лизиса позволяет проводить эффективное лечение больных локализованным и местно-распространенным раком предстательной железы, подтверждаемое морфологическими и биохимическими изменениями.
2. Использование накожных пластинчатых электродов исключает травматизацию ткани предстательной железы и соседних анатомических структур.
3. Неинвазивность способа позволяет избежать воспалительных осложнений, кровотечений, нарушений функции мочеиспускания и эректильной функции.
4. Отсутствует необходимость применения анестезиологического пособия, так как во время лечебного процесса пациент не испытывает каких-либо болевых ощущений.
5. Лечение проводится в амбулаторных условиях, не требует госпитализации больного нарушения его образа жизни.
6. Лечение проводится на оборудовании, позволяющем контролировать процесс лечения в режиме реального времени, фиксировать и сохранять графическое изображение параметров лечебного воздействия.
1. Способ лечения больных локализованным или местно-распространенным раком предстательной железы постоянным электрическим током посредством накожных пластинчатых электродов, при котором: анод выполняют в виде двух удлиненных электродов прямоугольной формы с размерами сторон 12,8 см и 5,6 см, которые размещают в надлонной области симметрично относительно проекции на кожу белой линии живота, так, чтобы длинные стороны электродов были параллельны ей, а одна из коротких сторон располагалась в области нижней границы надлонной области; катод выполняют в виде двух квадратных электродов с размером, равным короткой стороне анода, которые размещают в промежности и области крестца; сеанс воздействия проводят следующим образом: предварительно выявляют первоначальный порог переносимости по отсутствию болевых ощущений, определяя начальные величины силы тока и напряжения, затем в течение первых 10-15 минут сеанса увеличивают рабочее напряжение с шагом в 0,1 В по отношению к определенной начальной величине напряжения, вновь выявляя порог переносимости по отсутствию болевых ощущений; далее в процессе сеанса до его окончания регистрируют сопротивление тканей между анодом и катодом и при его значении, равном или ниже 250 кОм, дополнительно увеличивают рабочее напряжение с шагом 0,1 В до порога переносимости по отсутствию болевых ощущений; проводят 3-5 сеансов воздействия с интервалом 2-4 недели между ними.
2. Способ по п. 1, отличающийся тем, что между кожей пациента и электродами помещают электропроводные прокладки, на 2-3 см превышающие размеры электродов.
3. Способ по п. 1, отличающийся тем, что в качестве источника постоянного тока используют аппаратный комплекс ВЕТ-7.