Новые дигидро-оксазолобензодиазепиновые соединения, способ их получения и содержащие их фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (I) или их фармацевтически приемлемым кислотно-аддитивным солям, где R1 представляет собой атом водорода или линейную или разветвленную (C1-С4)алкильную группу; R2 представляет собой линейную или разветвленную (С1-С4)алкильную группу; R3 представляет собой арильную или гетероарильную группу; где арильная группа представляет собой нафтильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена; линейной или разветвленной (С1-С6)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена; линейной или разветвленной (C1-С6)алкоксигруппы; цианогруппы; или аминогруппы, которая является незамещенной или замещена одной или двумя линейными или разветвленными (С1-С6)алкильными группами; и гетероарильная группа представляет собой бициклическую или трициклическую группу, в которой по меньшей мере одно из колец является ароматическим, которая содержит от 1 до 3, идентичных или различных, гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена; линейной или разветвленной (С1-С6)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена; линейной или разветвленной (С1-С6)алкоксигруппы; цианогруппы; или аминогруппы, которая является незамещенной или замещена одной или двумя линейными или разветвленными (С1-С6)алкильными группами. Также изобретение относится к способам получения соединений формулы (I), фармацевтической композиции, содержащей в качестве активного ингредиента соединение формулы (I), и применению соединений формулы (I) для приготовления лекарственных средств. Технический результат - соединения формулы (I), обладающие селективной активностью в отношении α5 подъединицы рецептора ГАМКА. 5 н. и 11 з.п. ф-лы, 5 ил., 56 пр.
Реферат
Настоящее изобретение относится к новым соединениям 1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-она, к способу их получения и фармацевтическим композициям, которые их содержат.
γ-Аминомасляная кислота (или ГАМК) является преобладающим подавляющим нейротрансмиттером в центральной нервной системе млекопитающих. В прозенцефалоне ГАМК главным образом синтезируется промежуточными нейронами, которые координируют комплексные нейронные цепи посредством рецепторов ГАМКА и ГАМКВ. Рецепторы ГАМКА являются ионотропными гетеропентамерными хлоридными каналами, которые включают белковые подъединицы α (6 генов), β (3 гена) и γ (3 гена) в соотношении 2:2:1.
Бензодиазепины усиливают действие ГАМК на рецепторы ГАМКА путем влияния на сайты связывания модуляторов. Неселективные бензодиазепиновые агонисты вызывают седативное, снотворное, успокаивающее, противосудорожное, амнестическое, антиноцицептивное и миорелаксирующее действие.
Нокин-генетические эксперименты продемонстрировали, что α1 подъединица отвечает за седативные эффекты, в то время как α2 и, возможно, α3 подъединицы отвечают за успокаивающее действие бензодиазепиновых агонистов. Лиганды бензодиазепиновых сайтов связывания, которые имеют противоположное действие посредством снижения активации рецептора ГАМКА, обусловленного ГАМК, называются "обратными агонистами". Такие соединения проявляют благоприятную активность против когнитивных расстройств; однако нежелательные проконвульсивные и анксиогенные эффекты предотвратили проведение дальнейших более детальных клинических исследований в отношении этих соединений.
Функции рецептора ГАМКА, который содержит α5 подъединицу, менее хорошо определены. У мыши уничтожение или уменьшение количества рецепторов ГАМКА, которые содержат α5 подъединицу, связаны с улучшением когнитивных функций. Кроме того, лечение селективным α5 обратным агонистом производит улучшенное прокогнитивное действие у некоторых моделей грызунов, в то время как у людей наблюдалось прокогнитивное действие на нарушение памяти, вызванное алкоголем.
Существует большая, неудовлетворенная потребность в лечении когнитивных расстройств, связанных с различными возрастными расстройствами, нейродегенеративными или сосудистыми расстройствами, а также шизофренией. Современные методы лечения болезни Альцгеймера, патологий с широким распространением, основываются на либо ингибировании холинэстеразы (например, донепезил) или на NMDA-антагонизме (мемантин). Однако ингибиторы холинэстеразы имеют большое количество нежелательных эффектов, связанных с их механизмом действия, в то время как настоящая эффективность мемантина является ограниченной. Следовательно, появление новых терапий, имеющих большую эффективность и лучшую переносимость, было бы особенно ценным.
Кроме того, что они являются новыми, соединения данного изобретения обладают особенно ценными свойствами вследствие селективного связывания с подтипом рецептора ГАМКА и уменьшения действия ГАМК.
Более конкретно, настоящее изобретение относится к соединениям формулы (I):
,
где:
- R1 представляет собой атом водорода или линейную или разветвленную (C1-С4)алкильную группу;
- R2 представляет собой линейную или разветвленную (С1-С4)алкильную группу;
- R3 представляет собой арильную или гетероарильную группу;
их позиционным изомерам, их энантиомерам, их диастереоизомерам, а также их фармацевтически приемлемым кислотно-аддитивным солям, их сольватам, их комплексам и их аддуктам.
Среди фармацевтически приемлемых кислот можно указать, без предположения какого-либо ограничения, соляную кислоту, бромистоводородную кислоту, серную кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, малоновую кислоту, янтарную кислоту, глютаминовую кислоту, фумаровую кислоту, малеиновую кислоту, фосфорную кислоту, лимонную кислоту, щавелевую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, пара-толуолсульфоновую кислоту, камфорную кислоту и т.д.
Под арильной группой следует понимать нафтильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена; линейной или разветвленной (С1-С6)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена; линейной или разветвленной (С1-С6)алкоксигруппы; линейной или разветвленной (С1-С6)алкилкарбонильной группы; карбоксигруппы; линейной или разветвленной (С1-С6)алкоксикарбонильной группы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонильной группы, которая является незамещенной или замещена одной или несколькими линейными или разветвленными (С1-С6)алкильными группами; или аминогруппы, которая является незамещенной или замещена одной или двумя линейными или разветвленными (С1-С6)алкильными группами.
Под гетероарильной группой следует понимать бициклическую или трициклическую группу, в которой по меньшей мере одно из колец является ароматическим, которая содержит от 1 до 3 идентичных или различных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена; линейной или разветвленной (С1-С6)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена; линейной или разветвленной (C1-С6)алкоксигруппы; линейной или разветвленной (С1-С6)алкилкарбонильной группы; карбоксигруппы; линейной или разветвленной (С1-С6)алкоксикарбонильной группы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонильной группы, которая является незамещенной или замещена одной или несколькими линейными или разветвленными (С1-С6)алкильными группами; или аминогруппы, которая является незамещенной или замещена одной или двумя линейными или разветвленными (C1-С6)алкильными группами.
В соединениях формулы (I) R1 предпочтительно представляет собой атом водорода.
Преимущественно, соединениями формулы (I) являются соединения, где R2 представляет собой метальную группу.
Группа R3 предпочтительно представляет собой гетероарильную группу.
В особенности, соединениями формулы (I), которые являются предпочтительными, являются соединения, где R3 представляет собой бициклическую ароматическую группу, которая содержит от 1 до 3 идентичных или различных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена; линейной или разветвленной (С1-С6)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена; линейной или разветвленной (С1-С6)алкоксигруппы; линейной или разветвленной (С1-С6)алкилкарбонильной группы; карбоксигруппы; линейной или разветвленной (C1-С6)алкоксикарбонильной группы; гидроксигруппы; цианогруппы; нитрогруппы; аминокарбонильной группы, которая является незамещенной или замещена одной или несколькими линейными или разветвленными (С1-С6)алкильными группами; аминогруппы, которая является незамещенной или замещена одной или двумя линейными или разветвленными (С1-С6)алкильными группами.
Соединениями формулы (I), которые являются предпочтительными, являются соединения, где R3 представляет собой бензотиенильную, бензофурильную или хинолильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена и линейной или разветвленной (С1-С4)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена.
Другими соединениями изобретения, которые являются предпочтительными, являются те, в которых R3 представляет собой 1-бензотиенильную или 6-хинолильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена и линейной или разветвленной (С1-C4)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена.
Другими преимущественными вариантами являются те, где R3 представляет собой 1-бензотиенильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена и линейной или разветвленной (С1С4)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена.
Группа R3 представляет собой 1-бензотиен-2-ильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из атомов галогена и линейной или разветвленной (С1-С4)алкильной группы, которая является незамещенной или замещена одним или несколькими атомами галогена.
Заместителями гетероарильной группы, которые являются предпочтительными, являются атом галогена, такой как фтор, хлор, бром или йод, в особенности фтор или хлор; трифторметильная группа; или метильная группа.
Предпочтительные соединения изобретения представляют собой:
- 5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 8-метил-5-(6-хинолил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 5-(1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 5-(5-хлор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 5-[3-хлор-4-(трифторметил)-1-бензотиен-2-ил]-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 8-метил-5-[4-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 5-(6-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он;
- 5-(7-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он.
Фармацевтически приемлемые кислотно-аддитивные соли, а также сольваты, комплексы и аддукты предпочтительных соединений изобретения образуют существенную часть изобретения.
Изобретение также относится к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используется соединение формулы (II):
где R1 и R2 имеют значения, указанные для формулы (I),
где соединение формулы (II), в свободной форме или в виде соли, подвергают реакции циклизации в присутствии 1,1′-карбонилдиимидазола с получением соединения формулы (III):
где R1 и R2 имеют значения, указанные для формулы (I),
которое вводят в реакцию с восстанавливающим агентом с получением соединения формулы (IV):
где R1 и R2 имеют значения, указанные для формулы (I), которое затем подвергают действию соединения формулы (V):
где R3 имеет значение, указанное для формулы (I),
с получением соединения формулы (VI):
где R1, R2 и R3 имеют значения, указанные для формулы (I),
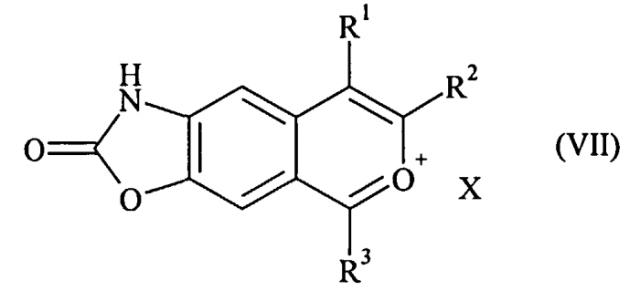
которое затем подвергают действию окислителя с последующим образованием соли с получением соединения формулы (VII):
где R1, R2 и R3 имеют значения, указанные для формулы (I), и X представляет собой противоион, такой как ClO4 -, Cl-, Br-, HSO4 -,
которое затем подвергают действию гидразина с получением соединения формулы (I),
причем соединение формулы (I) может быть очищено в соответствии с общепринятым методом разделения, и которое превращают, при желании, в его фармацевтически приемлемые кислотно-аддитивные соли и разделяют, при необходимости, на его изомеры, если они существуют, в соответствии с общепринятым методом разделения.
Преимущественный вариант относится к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используют соединение формулы (III):
где R1 и R2 имеют значения, указанные для формулы (I),
которое подвергают реакции бромирования с получением соединения формулы (VIII):
где R1 и R2 имеют значения, указанные для формулы (I),
которое подвергают стадии защиты карбонильной группы с получением соединения формулы (IX):
где R1 и R2 имеют значения, указанные для формулы (I),
которое затем подвергают действию соединения формулы (X):
где R3 имеет значение, указанное для формулы (I),
с получением соединения формулы (XI):
где R1, R2 и R3 имеют значения, указанные для формулы (I),
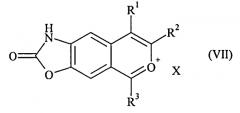
которое затем подвергают реакции циклизации с получением соединения формулы (VII):
где R1, R2 и R3 имеют значения, указанные для формулы (I), и Х представляет собой противоион, такой как ClO 4 - , Cl-, Br-, HSO 4 - ,
которое затем подвергают действию гидразина с получением соединения формулы (I),
причем соединение формулы (I) может быть очищено в соответствии с общепринятым методом разделения, и которое превращают, при желании, в его фармацевтически приемлемые кислотно-аддитивные соли и разделяют, при необходимости, на его изомеры, если они существуют, в соответствии с общепринятым методом разделения.
Соединения формул (II), (V) и (X) являются коммерчески доступными или легко получаемыми специалистом в данной области при использовании общепринятых химических реакций или химических реакций, описанных в литературе.
Соединения настоящего изобретения являются селективными в отношении α5 подъединицы рецептора ГАМКА и уменьшают действие нейротрансмиттера ГАМК, что делает их применимыми для лечения или предотвращения психиатрических и неврологических расстройств, характеризующихся нарушением познавательной способности, таких как шизофрения, униполярная депрессия, болезнь Альцгеймера, сосудистая деменция, расстройства аутистического спектра, синдром Дауна, синдром фрагильной Х-хромосомы, болезнь Паркинсона, болезнь Хантингтона. Другие возможные показания к применению относятся к различным состояниям тревоги, таким как общее тревожное расстройство, паническое расстройство с или без агорафобии, обсессивно-компульсивное расстройство, синдром посттравматического стресса и биполярные расстройства. Соединения изобретения можно применять для лечения последствия острого нарушения мозгового кровообращения и последствия травмы головного мозга, ости или медуллярной травмы.
Соединения предпочтительно используют для лечения или предотвращения болезни Альцгеймера, сосудистой деменции, такой как слабоумие из-за последствий острого нарушения мозгового кровообращения, болезни Хантингтона и синдрома Дауна.
Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного ингредиента по меньшей мере одно соединение формулы (I) само по себе или в комбинации с одним или несколькими инертными, нетоксичными вспомогательными веществами или носителями. Среди фармацевтических композиций в соответствии с изобретением можно указать в особенности те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблеток или драже, подъязычных таблеток, капсул, лепешек, суппозиториев, кремов, мазей, кожных гелей, инъецируемых препаратов и питьевых суспензий.
Применимые дозы варьируются в зависимости от возраста и веса пациента и природы и тяжести расстройства, а также пути введения, которое может быть назальным, ректальным, парентеральным или пероральным. Как правило, разовая доза находится в диапазоне от 0.1 до 1000 мг на 24 часа для лечения в 1-3 введения.
Следующие Примеры иллюстрируют изобретение, но никоим образом не ограничивают его. Структуры описанных соединений были подтверждены обычными методиками спектроскопии (включающие протон ЯМР: ls = большой синглет; s = синглет; d = дублет; t = триплет; dd = дублет дублетов; m = мультиплет).
Методы получения, описанные ниже, дают исходные соединения, которые используют в синтезе соединений изобретения.
Метод получения 1: 5-(2-гидроксипропил)-1,3-бензоксазол-2(3H)-он
Стадия А: 5-(2-оксопропил)-1,3-бензоксазол-2(3Н)-он
К раствору (3-амино-4-гидроксифенил)ацетона гидрохлорида (полученный в соответствии с ЕР 101223; Chemistry Letters 1980, 1, 85-88; или J. Org. Chem. 1951, 16, 221-224) (250 ммоль) в тетрагидрофуране (509 мл) добавляют 1,1′-карбонилдиимидазол (48.25 г; 290 ммоль) и смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения до температуры окружающей среды осадок отфильтровывают и фильтрат упаривают в вакууме. Остаток растворяют в этилацетате (400 мл), раствор промывают 5% водным HCl раствором (2×200 мл) и соляным раствором (2×200 мл) и затем органическую фазу концентрируют в вакууме с получением указанного в заголовке продукта в виде твердого вещества.
Температура плавления: 115-116°C
Стадия В: 5-(2-гидроксипропил)-1,3-бензоксазол-2(3H)-он
К раствору продукта Стадии, указанной выше (180 ммоль), в этилацетате (352 мл) и воде (120 мл) добавляют несколько раз борогидрид натрия (2.1 г; 550 ммоль) в течение 20 минут при 0-10°C. Реакционную смесь перемешивают при температуре окружающей среды до завершения реакции. Затем смесь обрабатывают 10% водным HCl раствором до значения pH 2 и после разделения фаз водную фазу экстрагируют этилацетатом (3×90 мл). Органические фазы собирают, сушат над сульфат натрия и концентрируют в вакууме. Твердый остаток суспендируют в диизопропиловом эфире и затем отфильтровывают с получением указанного в заголовке продукта в виде твердого вещества.
Температура плавления: 133-134°C
Метод получения 2: 5-(1-этил-2-гидроксипропил)-1,3-бензоксазол-2(3H)-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Получении 1, с использованием в качестве исходного реактива 3-(3-амино-4-гидроксифенил)-2-пентанона гидрохлорида вместо 1-(3-амино-4-гидроксифенил)ацетона гидрохлорида.
Температура плавления: 107-109°C
Метод получения 3: 5-[1-(1-гидроксиэтил)бутил]-1,3-бензоксазол-2(3H)-он
Указанный в заголовке продукт получают в виде масла в соответствии с методикой, описанной в Получении 1, с использованием в качестве исходного реактива 2-амино-4-[1-(1-гидроксиэтил)бутил]фенола гидрохлорида вместо 1-(3-амино-4-гидроксифенил)ацетона гидрохлорида.
Метод получения 4: 5-(2-гидроксибутил)-1,3-бензоксазол-2(3H)-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Получении 1, с использованием в качестве исходного реактива 1-(3-амино-4-гидроксифенил)-2-бутанона гидрохлорида вместо 1-(3-амино-4-гидроксифенил)ацетона гидрохлорида.
Температура плавления: 117-119°C
ПРИМЕР 1: 8-метил-5-(2-нафтил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Стадия А: 7-метил-5-(2-нафтил)-1,5,7,8-тетрагидро-2Н-изохромено[6,7-d][1,3]оксазол-2-он
К суспензии соединения Метода получения 1 (97.0 ммоль) и 2-нафтальдегида (94.3 ммоль) в этилацетате (180 мл) добавляют 15% безводный HCl раствор в этилацетате (90 мл). Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Наблюдается осаждение и ожидаемый продукт в виде порошка собирают путем фильтрации.
Температура плавления: 220-222°C
Стадия В: 7-метил-5-(2-нафтил)-2-оксо-1H,2Н-изохромено[6,7-d][1,3]оксазол-6-ия перхлорат
К раствору продукта Стадии, описаной выше (67.5 ммоль), в ацетоне (490 мл) добавляют, по каплям, реактив Джонса (88.63 мл; 236 ммоль) при 0-10°C в течение 40 минут. Смесь перемешивают при температуре окружающей среды до прекращении реакции и затем выливают в ледяную воду (2200 мл). Осадок отфильтровывают, промывают водой (5×50 мл), сушат и затем непосредственно вводят в реакцию на следующей стадии.
К суспензии сухого продукта в этилацетате (460 мл) при нагревании с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Нагревание с обратным холодильником поддерживают в течение еще 60 минут, энергично перемешивая. После охлаждения до температуры окружающей среды полученные кристаллы отфильтровывают и сушат с получением ожидаемого продукта.
Температура плавления: 304-307°C
Стадия С: 8-метил-5-(2-нафтил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К раствору продукта Стадии, указанной выше (51 ммоль), в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают в ацетонитриле при нагревании с обратным холодильником.
Температура плавления: 304-306°C
ПРИМЕР 2: 5-(1-бензофуран-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Стадия А: 6-бром-5-(2-оксопропил)-1,3-бензоксазол-2(3Н)-он
К раствору соединений Получения 1 (52 ммоль) в метаноле (150 мл) добавляют N-бромсукцинимид (9.8 г; 55 ммоль) малыми порциями при 0-10°C. Смесь перемешивают в течение еще одного часа и затем упаривают в вакууме. Полученный остаток растворяют в этилацетате (250 мл), и органическую фазу промывают 5% водным раствором гидрокарбоната натрия (4×50 мл), сушат над MgSO4 и упаривают в вакууме с получением ожидаемого продукта в виде твердого вещества.
Температура плавления: 160-162°C
Стадия В: 6-бром-5-[(2-метил-1,3-диоксолан-2-ил)метил]-1,3-бензоксазол-2(3Н)-он
Смесь продукта Стадии, описанной выше (14.7 г; 54 ммоль), этиленгликоля (13.6 мл; 243 ммоль), пара-толуолсульфоновой кислоты (1 г; 5 ммоль) и толуола (300 мл) нагревают с обратным холодильником с использованием прибора Дина-Старка, в течение 6 часов. Раствор охлаждают до температуры окружающей среды и затем выливают в этилацетат (300 мл). Органическую фазу промывают 5% водным раствором гидрокарбоната натрия (100 мл), соляным раствором (100 мл) и затем сушат над MgSO4 и упаривают в вакууме. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/этилацетат) с получением указанного в заголовке продукта в виде твердого вещества.
Температура плавления: 117-119°C
Стадия С: 6-(1-бензофуран-2-илкарбонил)-5-[(2-метил-1,3-диоксолан-2-ил)метил]-1,3-бензоксазол-2(3H)-он
2.5М раствор н-бутиллитий в гексане (10.5 мл; 2.6 ммоль) добавляют по каплям к раствору продукта Стадии, описанной выше (3.1 г; 10 ммоль) в тетрагидрофуране (120 мл) при -78°C. Затем реакционную смесь нагревают до -35°C, перемешивают в течение 30 минут и затем добавляют N-метокси-N-метил-1-бензофуран-2-карбоксамид (16.5 ммоль). Затем реакционную смесь перемешивают при -35°C в течение еще 1.5 часов и затем выливают в насыщенный раствор хлорида аммония (150 мл). После добавления этилацетата (150 мл) органическую фазу промывают соляным раствором (100 мл), сушат над MgSO4 и упаривают в вакууме. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюант: гексан/этилацетат) с получением указанного в заголовке продукта.
Температура плавления: 213-215°C
Стадия D: 5-(1-бензофуран-2-ил)-7-метил-2-оксо-1Н,2Н-изохромено[6,7-d][1,3]оксазол-6-ия перхлорат
К суспензии продукта Стадии, описанной выше, в этилацетате (460 мл) при нагревании с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Нагревание с обратным холодильником поддерживают в течение еще 60 минут, энергично перемешивая. После охлаждения до температуры окружающей среды полученные кристаллы отфильтровывают и сушат с получением ожидаемого продукта.
Температура плавления: 318-320°C
Стадия Е: 5-(1-бензофуран-2-ил)-8-метил-1,9-дигидро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К раствору продукта Стадии, описанной выше (51 ммоль), в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают в ацетонитриле при нагревании с обратным холодильником.
Температура плавления: 290-292°C
ПРИМЕР 3: 5-(5-хлор-3-метил-1-бензофуран-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 2, с использованием 5-хлор-N-метокси-N,3-диметил-1-бензофуран-2-карбоксамида вместо N-метокси-N-метил-1-бензофуран-2-карбоксамида.
Температура плавления: 297-298°C
ПРИМЕР 4: 8-метил-5-(2-хинолил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К раствору 7-метил-2-оксо-5-(2-хинолил)-1H,2H-изохромено[6,7-d][1,3]оксазол-6-ия перхлорат (51 ммоль) (полученный на Стадиях А-D, описанных в Примере 2, с использованием N-метокси-N-метил-2-хинолинкарбоксамида вместо N-метокси-N-метил-1-бензофуран-2-карбоксамида) в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол) с получением указанного в заголовке продукта.
Температура плавления: 304-306°C
ПРИМЕР 5: 8-метил-5-(6-хинолил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К суспензии 7-метил-2-оксо-5-(6-хинолил)-1H,2H-изохромено[6,7-d][1,3]оксазол-6-ия перхлората (51 ммоль) (полученного в соответствии со Стадиями А-D, описанными в Примере 2, с использованием N-метокси-N-метил-6-хинолинкарбоксамида вместо N-метокси-N-метил-1-бензофуран-2-карбоксамида) в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают путем кристаллизации из смеси диметилформамид/метанол.
Температура плавления: 302-304°C
1H ЯМР-спектроскопический анализ (500 МГц, ДМСО, δ в м.д.): 12.05 (ls, 1H); 8.95 (dd, 1H, J=4.2 и 1.7 Гц); 8.44 (dd, 1H, J=8.3 и 1.7 Гц); 8.09 (m, 3Н); 7.57 (dd, 1H, J=8.3 и 4.2 Гц); 7.29 (s, 1H); 7.24 (s, 1H); 3.64 (d, 1H, J=12.3 Гц); 2.89 (d, 1H, J=12.2 Гц); 2.10 (s, 3H).
ПРИМЕР 6: 5-(1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К раствору 5-(1-бензотиен-2-ил)-7-метил-1,5,7,8-тетрагидро-2H-изохромено[6,7-d][1,3]оксазол-2-она (67.5 ммоль), полученного в соответствии со Стадией А, описанной в Примере 1, с использованием 1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида, в ацетоне (490 мл) добавляют по каплям реактив Джонса (88.63 мл; 236 ммоль) при 0-10°C в течение 40 минут. Смесь перемешивают при температуре окружающей среды до прекращения реакции и затем выливают в ледяную воду (2200 мл). Осадок отфильтровывают, промывают водой (5×50 мл), сушат и затем непосредственно вводят в реакцию на следующей стадии. К суспензии сухого продукта в этилацетате (460 мл) при нагревании с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Нагревание с обратным холодильником поддерживают в течение еще 60 минут, энергично перемешивая. После охлаждения до температуры окружающей среды сырой продукт выделяют, и затем суспендируют в 2-пропаноле (434 мл), и затем добавляют гидразин-гидрат (6.17 мл; 127 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество нагревают с обратным холодильником в ацетонитриле в течение 30 минут. После выделения и сушки получают указанный в заголовке продукт.
Температура плавления: 338-340°C
1H ЯМР-спектроскопический анализ (500 МГц, ДМСО, δ в м.д.): 12.10 (ls, 1H); 7.99 (m, 1Н); 7.86 (m, 1H); 7.69 (s, 1H); 7.53 (s, 1H); 7.39 (m, 2Н); 7.28 (s, 1H); 3.61 (d, 1H, J=12.3 Гц); 2.86 (d, 1H, J=12.2 Гц); 2.08 (s, 3H).
ПРИМЕР 7: 5-(3-хлор-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-хлор-4-фтор-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 295-297°C
ПРИМЕР 8: 5-(3-хлор-6-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К суспензии 5-(3-хлор-6-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1Н,2Н-изохромено[6,7-d][1,3]оксазол-6-ия перхлората (51 ммоль) (полученного в соответствии со Стадиями А и В, описанными в Примере 1, с использованием 3-хлор-6-фтор-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида) в 2-пропаноле (468 мл) добавляют гидразин гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают путем кристаллизации из смеси диметилформамид/метанол.
Температура плавления: 276-278°C
ПРИМЕР 9: 5-[3-хлор-4-(трифторметил)-1-бензотиен-2-ил]-8-метил-1,9-дигидро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-хлор-4-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 322-323°C
1H ЯМР-спектроскопический анализ (500 МГц, ДМСО, δ в м.д.): 12.02 (ls, 1H); 8.52 (d, 1H, J=8.1 Гц); 7.99 (d, 1H, J=7.5 Гц); 7.72 (t, 1H, J=7.9 Гц); 7.31 (s, 1H); 7.30 (s, 1H); 3.77 (d, 1H, J=12.5 Гц); 2.85 (d, 1H, J=12.2 Гц); 2.13 (s, 3H).
ПРИМЕР 10: 8-метил-5-(3-метил-1-бензотиен-2-ил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-метил-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 301-303°C
ПРИМЕР 11: 8-метил-5-[3-метил-4-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-метил-4-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 313-315°C
ПРИМЕР 12: 8-метил-5-[3-метил-5-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-метил-5-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 301-303°C
ПРИМЕР 13: 8-метил-5-[3-метил-6-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-метил-6-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 303-305°C
ПРИМЕР 14: 8-метил-5-[3-метил-7-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-метил-7-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 292-294°C
ПРИМЕР 15: 5-(3-этил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-этил-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 293-295°C
ПРИМЕР 16: 5-(3-этил-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К суспензии 5-(3-этил-4-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1Н,2Н-изохромено[6,7-d][1,3]оксазол-6-ия перхлората (51 ммоль) (полученного в соответствии со Стадиями А и В, описанными в Примере 1, с использованием 3-этил-4-фтор-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида) в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/ацетонитрил) с получением указанного в заголовке продукта.
Температура плавления: 297-299°C
ПРИМЕР 17: 5-(3-этил-4,7-дифтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 8, с использованием 3-этил-4,7-дифтор-1-бензотиофен-2-карбальдегида вместо 3-хлор-6-фтор-1-бензотиофен-2-карбальдегида.
Температура плавления: 270-272°C
ПРИМЕР 18: 8-метил-5-(3-пропил-1-бензотиен-2-ил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
К суспензии 5-(3-пропил-1-бензотиен-2-ил)-7-метил-2-оксо-1H,2H-изохромено[6,7-d][1,3]оксазол-6-ия перхлората (51 ммоль) (полученного в соответствии со Стадиями А и В, описанными в Примере 1, с использованием 3-пропил-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида) в 2-пропаноле (468 мл) добавляют гидразин-гидрат (6.68 мл; 133 ммоль), энергично перемешивая, при температуре окружающей среды. Реакционную смесь перемешивают в течение 20 часов при температуре окружающей среды. Затем полученные кристаллы отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 минут. После фильтрации и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/этилацетат) с получением указанного в заголовке продукта.
Температура плавления: 307-308°C
ПРИМЕР 19: 5-(3-бутил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 18, с использованием 3-бутил-1-бензотиофен-2-карбальдегида вместо 3-пропил-1-бензотиофен-2-карбальдегида.
Температура плавления: 278-280°C
ПРИМЕР 20: 8-метил-5-[3-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Указанный в заголовке продукт получают в соответствии с методикой, описанной в Примере 1, с использованием 3-(трифторметил)-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида.
Температура плавления: 260-262°C
ПРИМЕР 21: 5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Стадия А: 5-(4-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1Н,2Н-изохромено[6,7-d][1,3]оксазол-6-ия перхлорат
Ожидаемый продукт получают в соответствии с методикой, описанной в Стадиях А и В Примера 1, с использованием 4-фтор-1-бензотиофен-2-карбальдегида вместо 2-нафтальдегида, или в соответствии с методикой, описанной в Стадиях А-D Примера 2, с использованием 4-фтор-N-метокси-N-метил-1-бензотиофен-2-карбоксамида вместо N-метокси-N-метил-1-бензофуран-2-карбоксамида.
Температура плавления: 278-280°C
Стадия В: 5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он
Ожидаемый продукт получают, исходя из соединения Стадии, описанной выше, в соответствии с методикой, описанной в Стадии С Примера 1.
Температура плавления: 394-396°C
1H ЯМР-спектроскопический анализ (500 МГц, ДМСО, δ в м.д.): 12.06 (ls, 1H); 7.86 (d, 1H, J=8.1 Гц); 7.74 (s, 1H); 7.45 (m, 1H