Способ получения подкожных ксенографтов клеточной линии меланомы кожи человека mel cher с мутацией v600e braf для доклинического изучения противоопухолевых таргетных средств
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной онкологии, и касается создания подкожных ксенографтов меланомы кожи человека для доклинического изучения противоопухолевых таргетных средств. Способ получения подкожных ксенографтов клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения противоопухолевых таргетных средств включает адаптацию клеточной линии меланомы кожи человека mel Cher к росту у иммунодефицитных мышей Balb/c nude путем многократного пассирования до девяти пассажей взвеси опухолевых клеток по 50-60 мг на мышь со стабильной кинетикой роста и тестирование на наличие мутации V600E BRAF. Получены подкожные ксенографты клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения противоопухолевых таргетных средств. 3 ил., 4 табл.
Реферат
Изобретение относится к медицине, а именно к экспериментальной онкологии, и касается создания подкожных ксенографтов меланомы кожи человека для доклинического изучения противоопухолевых средств.
Диссеминированная меланома кожи человека отличается чрезвычайно низкой чувствительностью к различным видам терапии [Демидов Л.В., Орлова К.В. Индивидуализация лекарственного лечения меланомы кожи // Практическая онкология, 2013, Т.14, №4, С. 239-246].
Известно, что мутация V600E в экзоне 15 гена BRAF приводит к гиперактивации серинтреониновой BRAF-киназы с последующей аномальной пролиферацией клеток и быстрой прогрессией меланомы [Graeme J. Walker, et al. Modeling melanoma in mice // Pigment Cell Melanoma Res., 2011, 24, P. 1158-1176; Davies H., et al. Mutations of the BRAF gene in human cancer // Nature, 2002, 417, P. 949-954; Tsai J. et al. Discovery of a selective inhibitor of oncogenic B-Raf kinase with potent antimelanoma activity // Proc. Natl. Acad. Sci. USA, 2008, 10, P. 3041-3046].
Избирательное блокирование BRAF-киназы определило создание противоопухолевых таргетных средств, среди которых наиболее эффективным в лечении диссеминированной меланомы является вемурафениб [Ribas A., et al. BRIM-2: an open label, multicenter phase II study of vemurafenib in previously treated patients with BRAFV600E mutation positive melanoma // J. Clin. Oncol., 2011, 29, P. 8509].
Задачей изобретения является получение подкожных ксенографтов клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения противоопухолевых таргетных средств.
Поставленная задача решается тем, что для получения подкожных ксенографтов использована клеточная линия меланомы кожи человека mel Cher, адаптированная к росту у иммунодефицитных мышей Balb/c nude со стабильной кинетикой роста, тестированная на наличие мутации V600E BRAF и использованная для доклинического изучения противоопухолевых таргетных средств.
Для доклинического изучения противоопухолевых таргетных средств была использована клеточная линия меланомы кожи человека mel Cher, депонированная в Коллекции клеточных культур института цитологии РАН РККК (П) 704Д. Клеточная линия меланомы кожи человека mel Cher имеет стабильные культуральные, морфологические и индивидуальные фенотипические характеристики и высокий митотический потенциал [патент РФ №2364624].
В клеточной линии меланомы кожи человека mel Cher определена мутация V600E в экзоне 15 гена BRAF.
Технический результат изобретения.
Получены подкожные ксенографты клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения противоопухолевых таргетных средств.
Способ осуществляли следующим образом.
Адаптацию клеточной линии меланомы кожи человека mel Cher к росту у иммунодефицитных мышей Balb/c nude осуществляли многократным пассированием мышам различных прививочных доз клеток. В стабильных пассажах подкожных ксенографтов определяли мутацию V600E BRAF с последующим применением вемурафениба.
Контролем состоявшейся адаптации клеточной линии меланомы кожи человека mel Cher к росту in vivo служили следующие трансплантационные характеристики: прививочная доза клеток для 100% получения подкожных ксенографтов, цитологически идентичных клеточной линии меланомы кожи человека mel Cher после имплантации у мышей (первый пассаж); устойчивая многократная трансплантация до девятого пассажа взвесью опухолевой ткани; устойчивая кинетика роста меланомы кожи человека mel Cher у мышей на поздних пассажах; гистологическая верификация меланомы.
Критерием к применению подкожных ксенографтов меланомы кожи человека mel Cher для доклинического изучения противоопухолевых таргетных средств считали наличие мутации V600E BRAF и высокую чувствительность к вемурафенибу.
Трансплантационные характеристики клеточной линии меланомы кожи человека mel Cher получали следующим образом.
Инокулятом для имплантации служила культивированная в CO2 клеточная линия меланомы кожи человека mel Cher. Отмытые физиологическим раствором от культуральной среды клетки помещали в питательную среду 199 и имплантировали подкожно в дозах 0,1×107; 0,5×107; 1,0×107 клеток на мышь в 0,2 мл питательной среды 199. В исследовании использовали 12 иммунодефицитных мышей Balb/c nude по 4 мыши на каждую дозу клеток. Контроль прививаемости клеток осуществляли по наличию пальпируемых опухолей у мышей с регистрацией длительности латентного периода в течение 21 дня. По окончании исследования определили оптимальную прививочную дозу 1,0×107 клеток на мышь, обеспечивающую 100% прививаемость.
Получение подкожных ксенографтов клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF.
Подкожные ксенографты меланомы кожи человека mel Cher получали на 10 мышах Balb/c nude. Многократные пассажи выполняли взвесью опухолевой ткани по 50-60 мг на мышь в разведении 1:20 питательной средой 199. Наличие трансплантированных опухолей у мышей в одни и те же сроки при многократном пассировании свидетельствовали о достижении стабильных кинетических характеристик подкожных ксенографтов in vivo.
Кинетику роста подкожных ксенографтов определяли по среднему объему опухолей, начиная от появления всех пальпируемых опухолей с учетом латентной фазы роста. Период увеличения среднего объема опухоли (Vcp=a×b×c) в два и более раз определял длительность экспоненциальной фазы роста, а стабилизация роста опухоли на уровне менее двукратного увеличения - длительность стационарной фазы роста. О кратности роста опухоли судили по соотношению последующего среднего объема к предыдущему (Vt/Vt-1) при измерении опухоли каждые 3-4 дня в течение 2-4 недель.
Статистический анализ параметров роста четвертого пассажа выполняли с помощью стандартного метода Фишера. Отсутствие значимых различий кривых роста опухоли двух пассажей в полулогарифмической системе координат подтверждало устойчивость кинетических характеристик роста подкожных ксенографтов меланомы кожи человека mel Cher у мышей Balb/c nude.
Гистологическую верификацию подкожных ксенографтов меланомы кожи для сравнения клеточного состава с исходной клеточной линией меланомы кожи человека mel Cher выполняли в девятом пассаже с устойчивой кинетикой роста с помощью световой микроскопии срезов опухоли, окрашенных гематоксилином и эозином.
Изобретение иллюстрируется таблицами (1-4) и фигурами (1-3).
Табл. 1. Выбор оптимальной прививочной дозы клеток меланомы кожи человека mel Cher для получения подкожных ксенографтов у мышей Balb/c nude.
Табл. 2. Динамика роста опухоли после имплантации 1,0×107 клеток меланомы кожи человека mel Cher у мышей Balb/c nude (первый пассаж).
Табл. 3. Средний объем опухоли меланомы кожи человека mel Cher у мышей Balb/c nude (четвертый пассаж).
Табл. 4. Средний объем опухоли меланомы кожи человека mel Cher у мышей Balb/c nude (девятый пассаж).
Фиг. 1. Гистологическая картина подкожного ксенографта меланомы кожи человека mel Cher на 14 сутки роста опухоли (девятый пассаж).
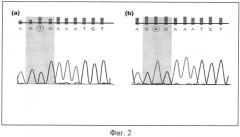
Фиг. 2. Выявление мутации V600E BRAF в подкожных ксенографтах меланомы кожи человека mel Cher у мышей Balb/c nude (девятый пассаж).
Фиг. 3. Противоопухолевая активность вемурафениба у мышей с подкожными ксенографтами меланомы кожи человека mel Cher.
В табл. 1 показана зависимость роста опухоли после подкожной имплантации клеток меланомы кожи человека mel Cher от прививочной дозы клеток. Оптимальной была прививочная доза 1,0×107 клеток на мышь. При применении оптимальной прививочной дозы 1,0×107 клеток на мышь на 10 сутки (латентная фаза) у 100% мышей определяли пальпируемые опухоли.
В табл. 2 показано, что кинетика роста опухолей первого пассажа была относительно медленной (21 день), объем опухоли не достиг 1,0 см, а фаза экспоненциального роста практически отсутствовала. Кратность увеличения опухоли в течение этого периода была менее 2,0. Средний объем опухоли составил: на 10 сутки 42,2±10,5 мм3, на 15 сутки 112,0±35,1 мм3. Далее к 21 суткам объем опухоли достиг 133,0±27,8 мм3, превышая в 3,2 раза исходный объем.
В табл. 3 показано, что кинетика роста опухолей прогрессивно изменялась на четвертом пассаже. Латентная фаза сократилась до 8 дней, средний объем опухоли составил 68,0±25,0 мм3, почти в 1,6 раз превышающий объем опухоли первого пассажа. На 11 сутки средний объем опухоли составил 200±67,0 мм3 при кратности роста опухоли 2,9. На 14, 17 и 21 сутки, соответствующие стационарной фазе, кратность роста опухоли варьировала между 1,9; 2,1 и 1,8. Средний объем опухоли на 21сутки достиг 1526,3±496,0 мм3, в 10 раз превышая средний объем опухоли первого пассажа.
Устойчивая кинетика роста опухоли, достигнутая к четвертому пассажу, сохранялась до девятого пассажа с одинаковыми временными характеристиками: латентной фазой до 8 дней, экспоненциальной фазой до 14 дней и стационарной фазой до 21 дня после трансплантации (табл. 4).
При гистологическом исследовании подкожных ксенографтов меланомы кожи человека mel Cher девятого пассажа выявлено наличие крупных полиморфных клеток, идентичных цитологической характеристике культуры клеток меланомы кожи человека mel Cher (фиг. 1).
Мутацию V600E BRAF определяли в клетках опухоли меланомы кожи человека mel Cher девятого пассажа на пике экспоненциальной фазы роста.
На фиг. 2 представлена мутация V600E BRAF в подкожных ксенографтах меланомы кожи человека Mel Cher у мышей (а - дикий тип, b - мутация 1799Т>А, приводящая к замене валина на глутаминовую кислоту в позиции 600 (V600E), триплет GTG (GAG выделен серой полосой).
Для оценки чувствительности к ингибитору BRAF-киназы вемурафениб в разовой дозе 75 мг/кг вводили в желудок 10 мышам ежедневно с 4 по 19 сутки после трансплантации опухоли. Контрольная группа мышей не получала вемурафениб. Динамику роста опухоли в обеих группах оценивали во время и после применения вемурафениба каждые 4-5 дней в течение 20 дней.
На фиг. 3 показано непрерывное прогрессивное увеличение объема опухоли у мышей контрольной группы, в то время как вемурафениб полностью ингибировал рост опухоли в течение 7 дней с последующим ростом опухоли (серая кривая - контрольная группа, черная кривая - опытная группа).
Способ получения подкожных ксенографтов клеточной линии меланомы кожи человека mel Cher с мутацией V600E BRAF для доклинического изучения противоопухолевых таргетных средств, включающий адаптацию клеточной линии меланомы кожи человека mel Cher к росту путем многократного пассирования до девяти пассажей взвеси опухолевых клеток по 50-60 мг на мышь со стабильной кинетикой роста и тестирование на наличие мутации V600E BRAF.