Производные фенилоксадиазола в качестве ингибиторов pgds
Иллюстрации
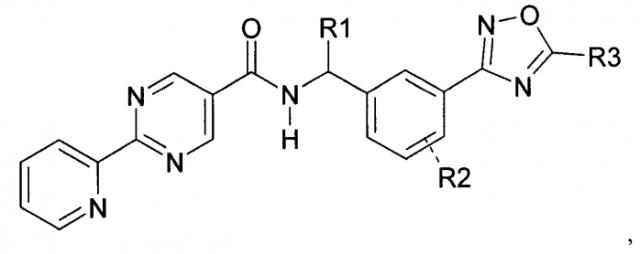
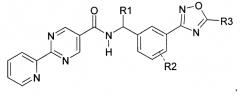
Показать всеИзобретение относится к соединениям формулы (I), где R1 представляет собой водород или C1-C6алкил; R2 представляет собой водород и R3 представляет собой гидрокси(C1-C6)алкил; или их фармацевтически приемлемым солям. Также изобретение относится к способам получения соединений формулы (I), промежуточным соединениям, указанным в пп.14-19 формулы изобретения, и способу получения промежуточного соединения по п.17 формулы изобретения. Технический результат - соединения формулы (I) в качестве ингибиторов PGD2-синтазы и промежуточные соединения для их получения. 9 н. и 11 з.п. ф-лы, 3 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на фенилоксадиазольные соединения, их получение, фармацевтические композиции, содержащие данные соединения, и их фармацевтическое применение при лечении болезненных состояний, которые можно модулировать путем ингибирования простагландин D-синтазы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аллергический ринит, наиболее часто встречающееся атопическое заболевание, имеет расчетное распространение, варьирующее в диапазоне от приблизительно 5 до приблизительно 22 процентов от общей популяции человека и характеризуется симптомами чихания, выделениями из носа и заложенностью носа. Эти симптомы, как полагают, запускаются множественными медиаторами, высвобождаемыми из тучных клеток и других клеток воспаления. Существующие в настоящее время терапии, такие как антигистамины, эффективно справляются с чиханием и выделениями из носа, но обладают слабым эффектом на заложенность, которая является ключевым симптомом, влияющим на качество жизни пациентов.
Местная стимуляция аллергеном у пациентов с аллергическим ринитом, бронхиальной астмой, аллергическим конъюнктивитом и атопическим дерматитом, как было показано, приводит к быстрому повышению уровней простагландина D2 «(PGD2)» в назальных и бронхиальных промывных жидкостях, слезах и жидкостях кожного пузыря. PGD2 обладает многочисленными воспалительными действиями, такими как повышение проницаемости сосудов в конъюнктиве и коже, повышение сопротивления носовых дыхательных путей, сужение дыхательных путей и эозинофильная инфильтрация в конъюнктиву и трахею. PGD2 представляет собой основной циклооксигеназный продукт арахидоновой кислоты, продуцируемый из тучных клеток при иммунологической стимуляции [Lewis, RA, Soter NA, Diamond PT, Austen KF, Oates JA, Roberts LJ II, Prostaglandin D2 generation after activation of rat and human mast cells with anti-IgE, J. Immunol. 129, 1627-1631, 1982]. Активированные тучные клетки, основной источник PGD2, являются одной из основных фигур в управлении аллергическим ответом при состояниях, таких как астма, аллергический ринит, аллергический конъюнктивит, аллергический дерматит и другие заболевания [Brightling CE, Bradding P, Pavord ID, Wardlaw AJ, New Insights into the role of the mast cell in asthma, Clin. Exp. Allergy 33, 550-556, 2003].
В присутствии сульфгидриловых соединений PGD2 образуется путем изомеризации PGH2, обычного предшественника простаноидов, при каталитическом воздействии простагландин D-синтазы «(PGDS)». Существуют две изоформы фермента PGDS: L-PGDS; и H-PGDS. H-PGDS представляет собой цитозольный фермент, который распределен в периферических тканях, и который локализируется в антиген-презентирующих клетках, тучных клетках, мегакариоцитах и Th2-лимфоцитах. Действие продукта PGD2 опосредуется рецепторами, сопряженными с G-белком: D простагландин «(DP)» и crTH2. См. (1) Prostaglandin D Synthase: Structure and Function. T. Urade and O. Hayaishi, Vitamin and Hormones, 2000, 58, 89-120, (2) J. J. Murray, N. Engl. J. Med., 1986 Sept. 25; 315(13):800, и (3) Urade et al., J. Immunology 168: 443-449, 2002.
Не желая привязываться к теории, ингибирование образования PGD2 должно оказывать эффект на заложенность носа и, следовательно, обладать терапевтической полезностью при аллергическом рините. К тому же авторы полагают, что ингибитор PGDS должен обладать терапевтической полезностью при ряде других показаний, таких как бронхиальная астма, возрастная дегенерация макулы (AMD) и/или хроническое обструктивное заболевание легких (COPD).
Возрастная дегенерация макулы (AMD) представляет собой дегенеративное и прогрессирующее заболевание глаз, которое приводит к потере четкого центрального зрения вследствие дегенерации макулы. AMD является наиболее распространенной причиной слепоты в Европе и Соединенных Штатах у лиц старше 50 лет.
Хроническое обструктивное заболевание легких (COPD) представляет собой прогрессирующее воспалительное заболевание, которое включает хронический бронхит и эмфизему. Симптомы включают ограничение потока воздуха, избыточную продукцию слизи, кашель, сниженную способность к нагрузке и ухудшенное качество жизни.
Сообщалось об ингибиторах PGDS. Соединение HQL-79, как сообщалось, является слабым ингибитором PGDS и является противоастматическим в моделях на морских свинках и крысах (Matsusshita, et al., Jpn. J. Pharamcol. 78: 11, 1998). Соединение Траниласт описано как ингибитор PGDS. (Inhibitory Effect of Tranilast on Prostaglandin D Synthesase. K. Ikai, M. Jihara, K. Fujii, and Y. Urade. Biochemical Pharmacology, 1989, 28, 2773-2676). Следующие опубликованные патентные заявки также раскрывают ингибиторы PGDS:
US 2008/0207651A1 и US 2008/0146569A1 - пиридиновые и пиримидиновые карбоксамиды;
JP 2007-51121 - пиримидиновые карбоксамиды;
WO 2007/007778 - бензимидазольные производные;
WO 2008/122787 - пиперазин(тио)карбоксамиды; и
WO 2005/094805 - иминовые и амидные производные.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на соединение формулы (I):
где:
R1 представляет собой водород или C1-C6алкил;
R2 представляет собой водород, галоген или C1-C3алкил; и
R3 представляет собой гидроксиалкил;
или его фармацевтически приемлемую соль.
Другим аспектом данного изобретения является фармацевтическая композиция, содержащая фармацевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель.
Другой аспект данного изобретения направлен на способ лечения аллергического и/или воспалительного расстройства, в частности расстройства, такого как аллергический ринит, астма, хроническое обструктивное заболевание легких (COPD) и/или возрастная дегенерация макулы (AMD), у пациента, нуждающегося в этом, путем введения пациенту соединения формулы (I). Другим аспектом данного изобретения является способ получения соединения формулы (I).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определение терминов
Если не указано иное, то используемые ранее и далее в описании данного изобретения следующие термины следует понимать, как имеющие следующие значения:
«Алкил» означает прямой или разветвленный алифатический углеводород, имеющий от 1 до приблизительно 20 атомов углерода. Конкретно, алкил имеет от 1 до приблизительно 12 атомов углерода. Более конкретно, алкил представляет собой низший алкил. Разветвленный означает, что одна или несколько низших алкильных групп, таких как метил, этил или пропил, прикреплены к линейной алкильной цепи. «Низший алкил» означает от 1 до приблизительно 4 атомов углерода в линейной алкильной цепи, которая может быть прямой или разветвленной.
«Гидроксиалкил» означает OH-алкил-. Конкретно, гидроксиалкил представляет собой гидрокси(C1-C6)алкил-. Иллюстративный гидроксиалкил включает 1-гидрокси-1-метил-этил.
«Соединения данного изобретения» и эквивалентные выражения предназначены для охвата соединений Формулы (I), которая описана ранее в данном документе. Ссылка на промежуточные продукты, независимо от того, заявляются они или нет, предназначена для охвата их солей, N-оксидов и сольватов, если это позволяет контекст.
«Галоид» или «галоген» означает фтор, хлор, бром или йод. Конкретно, галоид или галоген представляют собой фтор или хлор.
«Пациент» включает человека и других млекопитающих.
«Фармацевтически приемлемые соли» относится к нетоксичным солям присоединения неорганической и органической кислоты и солям присоединения основания соединений данного изобретения. Эти соли можно получить in situ во время окончательного выделения и очистки соединений или путем отдельного введения в реакцию очищенного соединения в его свободной основной форме с подходящей органической или неорганической кислотой и выделения образованной таким образом соли. В некоторых случаях соединения сами по себе способны к самопротонированию основных центров на молекуле и образованию внутренней амфотерной соли.
«Подходящий связывающий реагент» относится к реагенту, подходящему для реакции амина с карбоновой кислотой. Подходящие связывающие реагенты включают, но без ограничений, DMTMM, карбонилдиимидазол (CDI) и TBTU, DCC, соли фосфония и соли урония.
Иллюстративные соли присоединения кислоты включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-p-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, p-толуолсульфонаты, циклогексилсульфаматы и лаурилсульфонатные соли. См., например, S.M. Berge, et al., «Farmaceutical Salts», J. Pharm. Sci., 66, 1-19 (1977), которая включена в данный документ в качестве ссылки. Соли присоединения основания также можно получить путем раздельной реакции очищенного соединения в его кислой форме с подходящим органическим или неорганическим основанием и выделения образованной таким образом соли. Соли присоединения основания включают фармацевтически приемлемые соли металлов и аминов. Подходящие соли металлов включают соли натрия, калия, кальция, бария, цинка, магния и алюминия. Конкретной солью присоединения основания является соль натрия или соль калия. Подходящие соли присоединения неорганического основания получают из оснований металлов, которые включают гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния и гидроксид цинка. Подходящие соли присоединения аминового основания получают из аминов, которые имеют достаточную основность для образования стабильной соли и, в частности, включают такие амины, которые часто применяют в медицинской химии из-за их низкой токсичности и пригодности для медицинского применения. Аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенэтиламин, диэтиламин, пиперазин, трис(гидроксиметил)-аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дигидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например, лизин и аргинин, и дициклогексиламин.
Конкретным вариантом осуществления данного изобретения является соединение формулы (I), где:
R1 представляет собой водород;
R2 представляет собой водород; и
R3 представляет собой гидроксиалкил;
или его фармацевтически приемлемая соль.
Другим конкретным вариантом осуществления данного изобретения является соединение формулы (I), где:
R1 представляет собой C1-C6алкил;
R2 представляет собой водород; и
R3 представляет собой гидроксиалкил;
или его фармацевтически приемлемая соль.
Другим конкретным вариантом осуществления данного изобретения является соединение формулы (I), которое представляет собой:
3-5-(1-гидрокси-1-метил-этил)[1,2,4]оксадиазол-3-ил]бензиламид 2-пиридин-2-ил-пиримидин-5-карбоновой кислоты;
((S)-1-{3-[5-(1-гидрокси-1-метил-этил)-1,2,4-оксадиазол-3-ил]-фенил}-этил)-амид 2-пиридин-2-ил-пиримидин-5-карбоновой кислоты; или
((R)-1-{3-[5-(1-гидрокси-1-метил-этил)-1,2,4-оксадиазол-3-ил]-фенил}-этил)-амид 2-пиридин-2-ил-пиримидин-5-карбоновой кислоты;
или его фармацевтически приемлемая соль.
Следует понимать, что данное изобретение охватывает все подходящие комбинации конкретных вариантов осуществления, которые имеют к ним отношение.
Данное изобретение также включает в своем объеме фармацевтическую композицию, содержащую фармацевтически эффективное количество соединения данного изобретения в смеси с фармацевтически приемлемым носителем.
Соединения данного изобретения являются ингибиторами PGDS и, таким образом, применимы для лечения аллергических и/или воспалительных расстройств, в частности расстройств, таких как аллергический ринит, астма, хроническое обструктивное заболевание легких (COPD), хронический риносинусит (CRS) и возрастная дегенерация макулы (AMD). Соответственно, другое изобретение данного документа направлено на способ лечения пациента, страдающего от аллергического ринита, астмы, хронического обструктивного заболевания легких (COPD) и/или возрастной дегенерации макулы (AMD), включающий введение пациенту фармацевтически эффективного количества соединения формулы (I).
Кроме показаний и расстройств, упомянутых выше, ингибиторы PGDS, включая соединения формулы I, применимы для лечения заболеваний, опосредованных PGD2, включая заболевания, ассоциированные с DP1, DP2, TP и PPAR гамма. Такие заболевания и расстройства включают следующее:
1) Кожные заболевания, включая атопический дерматит, хроническую крапивницу, гиперемию Proc Natl Acad Sci U.S.A. 2006 Apr. 25; 103(17):6682-7);
2) Аллергические заболевания пищеварительной системы, такие как эозинофильный эзофагит;
3) Нейродегенеративные заболевания, такие как болезнь Альцгеймера и глобоидно-клеточная лейкодистрофия Краббе (The Journal of Neuroscience, April 19, 2006, 26(16):4383-4393);
4) Мышечные заболевания, такие как мышечная дистрофия Дюшенна и полимиозит (American Journal of Pathology. 2009;174:1735-1744);
5) Состояния, связанные с повышенными эозинофилами, или эозинофильный синдром;
6) Заболевания глаза, такие как увеит, офтальмопатия Грейвса, аллергический конъюнктивит и глаукома;
7) Сосудистое повреждение, связанное с диабетом, такое как диабетическая ретинопатия, или с метаболическим синдромом (Diabetes Res Clin Pract. 2007 Jun;76(3):358-67); и
8) Заболевания костей, такие как ревматоидный артрит и остеоартрит (J Rheumatol 2006;33:1167-75).
Ссылки в данном документе, направленные на лечение, следует понимать как включающие профилактическую терапию для ингибирования PGDS, а также для лечения установленных острых или хронических или физиологических состояний, связанных с PGDS, с тем, чтобы, по сути, излечить страдающего от них пациента или облегчить физиологические состояния, связанные с ними. Физиологические состояния, обсуждаемые в данном документе, включают некоторые, но не все, из возможных клинических ситуаций, где требуется лечение против аллергического ринита и/или астмы. Специалисты в данной области хорошо знакомы с обстоятельствами, при которых требуется лечение.
На практике соединение данного изобретения можно вводить в фармацевтически приемлемой лекарственной форме людям или другим млекопитающим путем местного применения или системного введения, включая пероральный, ингаляционный, ректальный, назальный, трансбуккальный, подъязычный, вагинальный, толстокишечный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутрикожный, внутриоболочечный и эпидуральный), интрацистернальный и интраперитонеальный. Будет понятно, что конкретный путь может меняться в зависимости, например, от физиологического состояния пациента, получающего соединение.
«Фармацевтически приемлемые дозированные формы» относятся к дозированным формам соединения данного изобретения, и включают, например, таблетки, драже, порошки, эликсиры, сиропы, жидкие препараты, включая суспензии, аэрозоли, лекарственные формы для ингаляции таблетки, лепешки, эмульсии, растворы, гранулы, капсулы и суппозитории, а также жидкие препараты для инъекций, включая препараты на основе липосом. Техники и составы в целом можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, последнее издание.
Конкретный аспект данного изобретения обеспечивает соединение данного изобретения для введения в форме фармацевтической композиции.
Фармацевтически приемлемые носители включают, по меньшей мере, один компонент, выбранный из группы, включающей фармацевтически приемлемые носители, разбавители, покрытия, вспомогательные вещества, эксципиенты или среды, такие как консерванты, наполнители, дезинтегрирующие средства, смачивающие средства, эмульгирующие средства, средства, стабилизирующие эмульсии, суспендирующие средства, изотонизирующие средства, подсластители, вкусовые вещества, ароматизирующие средства, красящие средства, противобактериальные средства, противогрибковые средства, другие терапевтические средства, лубриканты, средства, задерживающие адсорбцию или способствующие ей, и средства, способствующие распределению, в зависимости от природы способа введения и дозированных форм.
Иллюстративные суспендирующие средства включают этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и полиоксиэтиленсорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ.
Иллюстративные противобактериальные и противогрибковые средства для предупреждения воздействия микроорганизмов включают парабены, хлорбутанол, фенол, сорбиновую кислоту и т.п.
Иллюстративные изотонизирующие средства включают сахара, хлорид натрия и т.п.
Иллюстративные средства, задерживающие адсорбцию, для пролонгирования адсорбции включают моностеарат алюминия и желатин.
Иллюстративные средства, способствующие адсорбции, для усиления адсорбции включают диметилсульфоксид и родственные аналоги.
Иллюстративные разбавители, растворители, среды, солюбилизирующие средства, эмульгаторы и стабилизаторы эмульсий включают воду, хлороформ, сахарозу, этанол, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, тетрагидрофуриловый спирт, бензилбензоат, полиолы, пропиленгликоль, 1,3-бутиленгликоль, глицерин, полиэтиленгликоли, диметилформамид, Tween® 60, Span® 60, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия, сложные эфиры жирной кислоты и сорбитана, растительные масла (такие как хлопковое масло, арахисовое масло, оливковое масло, касторовое масло и кунжутное масло) и инъецируемые органические сложные эфиры, такие как этилолеат и т.п., или подходящие смеси этих веществ.
Иллюстративные эксципиенты включают лактозу, молочный сахар, цитрат натрия, карбонат кальция и дикальция фосфат.
Иллюстративные дезинтегрирующие средства включают крахмал, альгиновые кислоты и определенные комплексные силикаты.
Иллюстративные лубриканты включают стеарат магния, лаурилсульфат натрия, тальк, а также высокомолекулярные полиэтиленгликоли.
Выбор фармацевтического приемлемого носителя обычно обусловлен в соответствии с химическими свойствами активного соединения, такими как растворимость, конкретный способ введения и положениями, которые необходимо соблюдать в фармацевтической практике.
Фармацевтические композиции данного изобретения, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как твердая дозированная форма, такая как капсулы, крахмальные облатки или таблетки, при этом каждая содержит предопределенное количество активного ингредиента, или в виде порошка или гранул; в виде жидкой дозированной формы, такой как раствор или суспензия в водной жидкости или неводной жидкости, или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент также может быть представлен в виде болюса, электуария или пасты.
«Твердая дозированная форма» означает, что дозированная форма соединения данного изобретения находится в твердой форме, например, капсулах, таблетках, пилюлях, порошках, драже или гранулах. В таких твердых дозированных формах соединение данного изобретения смешано, по меньшей мере, с одним инертным традиционным эксципиентом (или носителем), таким как цитрат натрия или дикальция фосфат или: (a) наполнителями или разбавителями, как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (b) связующими веществами, как, например, карбоксиметилцеллюлозой, альгинатами, желатином, поливинилпирролидоном, сахарозой и гуммиарабиком, (c) увлажнителями, как, например, глицерином, (d) дезинтегрирующими средствами, как, например, агар-агаром, карбонатом кальция, крахмалом из картофеля или тапиоки, альгиновой кислотой, определенными комплексными силикатами и карбонатом натрия, (e) замедлителями растворения, как, например, парафином, (f) ускорителями абсорбции, как, например, четвертичными аммониевыми соединениями, (g) смачивающими средствами, как, например, цетиловым спиртом и глицеролмоностеаратом, (h) адсорбентами, как, например, каолином и бентонитом, (i) лубрикантами, как, например, тальком, стеаратом кальция, стеаратом магния, твердыми полиэтиленгликолями, лаурилсульфатом натрия, (j) замутняющими средствами, (k) буферными средствами и средствами, которые высвобождают соединение данного изобретения в определенной части кишечника замедленным образом.
Таблетку можно изготовить прессованием или формованием, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получить прессованием в подходящем аппарате активного ингредиента в свободносыпучей форме, такой как порошок или гранулы, необязательно смешанной со связующим, лубрикантом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим средством. Можно использовать эксципиенты, такие как лактоза, цитрат натрия, карбонат кальция, дикальция фосфат, и дезинтегрирующие средства, такие как крахмал, альгиновые кислоты и определенные комплексные силикаты, в сочетании с лубрикантами, такими как стеарат магния, лаурилсульфат натрия и тальк. Для изготовления формованных таблеток смесь порошкообразного соединения, увлажненную инертным жидким разбавителем, можно сформовать в подходящем аппарате. На таблетки необязательно можно нанести покрытие или сделать надрез и их можно составить так, чтобы обеспечить медленное или контролируемое высвобождение находящегося в них активного ингредиента.
Твердые композиции также можно использовать в качестве наполнителей в мягких или твердых наполняемых желатиновых капсулах с применением таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
При необходимости и для более эффективного распределения соединение можно микроинкапсулировать в или прикрепить к системам медленного высвобождения или целенаправленной доставки, таким как биосовместимые биоразлагаемые полимерные матрицы (например, сополимер(д, l-лактида и гликолида)), липосомы и микросферы, и подкожно или внутримышечно ввести инъекцией посредством техники, называемой подкожное или внутримышечное депо для обеспечения непрерывного медленного высвобождения соединения(-ий) в течение периода 2 недели или дольше. Соединения можно простерилизовать, например, посредством фильтрации через удерживающий бактерии фильтр или посредством введения стерилизующих средств в форме стерильных твердых композиций, которые можно растворить в стерильной воде или некоторых других инъекционных средах непосредственно перед применением.
«Жидкая дозированная форма» означает, что доза активного соединения, которую необходимо ввести пациенту, находится в жидкой форме, например, фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активного соединения жидкие дозированные формы могут содержать инертные разбавители, традиционно применяемые в данной области техники, определенные растворители, солюбилизирующие средства и эмульгаторы.
При применении водных суспензий они могут содержать эмульгирующие средства или средства, которые способствуют суспендированию.
Фармацевтические композиции, подходящие для местного применения, означают составы, которые находятся в форме, подходящей для применения пациентом местно. Состав может быть представлен в виде местных мазей, целебных мазей, порошков, аэрозолей и дозированных форм для ингаляции, гелей (на основе воды или спирта), кремов, как в целом известно в данной области техники, или включен в матричную основу для нанесения в пластыре, что сделает возможным контролируемое высвобождение соединения через трансдермальный барьер. При составлении в мазь активные ингредиенты можно использовать либо с парафиновой, либо с водорастворимой мазевой основой. Альтернативно, активные ингредиенты можно составить в крем с кремовой основой масло-в-воде. Составы, подходящие для местного внутриглазного введения, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности водном растворителе для активного ингредиента. Составы, подходящие для местного перорального введения, включают лепешки, содержащие активный ингредиент в ароматизированной основе, обычно сахарозе и гуммиарабике или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик; и ополаскиватели для рта, содержащие активный ингредиент в подходящем жидком носителе.
Масляная фаза эмульсионной фармацевтической композиции может быть составлена из известных ингредиентов известным способом. Хотя фаза может включать лишь эмульгатор (иначе известный как эмульгирующее вещество), она предпочтительно включает смесь из, по меньшей мере, одного эмульгатора с жиром, или маслом, или как с жиром, так и маслом. В конкретном варианте осуществления гидрофильный эмульгатор включают вместе с липофильным эмульгатором, который действует в качестве стабилизатора. Вместе эмульгатор(-ы) с или без стабилизатора(-ов) составляют эмульгирующий воск и вместе с маслом и жиром составляют эмульгирующуюся мазевую основу, которая образует масляную диспергированную фазу кремовых составов.
При необходимости водная фаза кремовой основы может включать, например, по меньшей мере, 30% в весовом соотношении многоатомного спирта, т.е. спирта, имеющего две или более гидроксильных групп, такого как пропиленгликоль, бутан 1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая PEG 400), и их смеси. Местные составы могут, предпочтительно, включать соединение, которое усиливает абсорпцию или проникновение активного ингредиента через кожу или другие пораженные зоны.
Выбор подходящих масел или жиров для композиции основывается на достижении желаемых свойств. Таким образом крем, в частности, должен быть нежирным, не оставляющим пятен и смываемым продуктом с подходящей консистенцией во избежание утечки из тюбиков или других емкостей. Можно применять моно- или двухосновные сложные алкиловые эфиры с прямой или разветвленной цепью, такие как диизопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат, или смесь из сложных эфиров с разветвленной цепью, известную как Crodamol CAP. Их можно применять по-отдельности или в комбинации, в зависимости от желаемых свойств. Альтернативно, можно применять липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла.
Фармацевтические композиции, подходящие для ректального или вагинального введения, означают составы, которые находятся в форме, подходящей для введения ректально или вагинально пациенту и при этом содержат, по меньшей мере, одно соединение данного изобретения. Суппозитории являются частной формой таких составов, которые можно получить путем смешивания соединений данного изобретения с подходящими не вызывающими раздражение эксципиентами или носителями, такими как какао-масло, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычных температурах, но жидкими при температуре тела и, следовательно, тают в прямой кишке или вагинальной полости и высвобождают активный компонент.
Фармацевтическая композиция, вводимая инъекцией, может быть чрезмышечной, внутривенной, интраперитонеальной и/или подкожной инъекцией. Композиции данного изобретения составляют в жидкие растворы, в частности в физиологически совместимые буферы, такой как раствор Хэнка или раствор Рингера. К тому же композиции могут быть составлены в твердой форме и повторно растворены или суспендированы непосредственно перед применением. Также включены лиофилизированные формы. Составы являются стерильными и включают эмульсии, суспензии, водные и неводные инъекционные растворы, которые могут содержать суспендирующие средства, и загустители, и антиоксиданты, буферы, бактериостатические факторы и растворенные вещества, которые делают состав изотоническим, и имеют соответственно отрегулированный рН с кровью предполагаемого пациента, получающего состав.
Фармацевтическая композиция данного изобретения, подходящая для назального или ингаляционного введения, означает композиции, которые находятся в форме, подходящей для введения назально или путем ингаляции пациенту. Композиция может содержать носитель в форме порошка с размером частиц, например, в диапазоне 1-500 микрон (включая размеры частиц в диапазоне от 20 до 500 микрон с шагом в 5 микрон, такие как 30 микрон, 35 микрон и т. д.). Подходящие композиции, где носителем является жидкость, для введения в виде, например, назального спрея или в виде капель в нос, включают водный или масляный растворы активного ингредиента. Композиции, подходящие для аэрозольного введения, можно получить согласно общепринятым способам и их можно доставить с другими терапевтическими средствами. Ингаляционная терапия является легко вводимой посредством дозирующих ингаляторов или любого подходящего ингалятора сухого порошка, такого как Eclipse, Spinhaler® или Ultrahaler®, которые описаны в патентной заявке WO 2004/026380 и патенте США № 5176132.
Фактические уровни дозировки активного ингредиента(-ов) в композициях данного изобретения можно изменять с тем, чтобы получить количество активного ингредиента(-ов), который является эффективным для получения желаемого терапевтического ответа на конкретную композицию и способ введения для пациента. Выбранный уровень дозировки для любого конкретного пациента, следовательно, зависит от ряда факторов, включая желаемый терапевтический эффект, от пути введения, от желаемой длительности лечения, этиологии и тяжести заболевания, состояния, веса, пола, питания и возраста пациента, типа и эффективности каждого активного ингредиента, скоростей абсорбции, метаболизма и/или выведения и других факторов.
Общая суточная доза соединения данного изобретения, вводимая пациенту за одну дозу или дробными дозами, может составлять в количестве, например, от приблизительно 0,001 до приблизительно 100 мг/кг веса тела в сутки и, в частности, 0,01-10 мг/кг/сутки. Например, у взрослого дозы обычно составляют от приблизительно 0,01 до приблизительно 100, в частности от приблизительно 0,01 до приблизительно 10 мг/кг веса тела в сутки путем ингаляции, от приблизительно 0,01 до приблизительно 100, в частности 0,1-70, более конкретно 0,5-10 мг/кг веса тела в сутки путем перорального введения и от приблизительно 0,01 до приблизительно 50, в частности 0,01-10 мг/кг веса тела в сутки путем внутривенного введения. Процентное соотношение активного ингредиента в композиции можно изменять, все же следует составлять пропорцию такую, чтобы получилась подходящая дозировка. Композиции в единицах дозировки могут содержать такие количества или такие их подмножества, которые можно использовать для составления суточной дозы. Очевидно, что примерно в одно время можно ввести несколько стандартных дозированных форм. Дозировку можно вводить настолько часто, насколько необходимо для получения желаемого терапевтического эффекта. Некоторые пациенты могут быстро отвечать на более высокую или более низкую дозу и могут обнаруживать достаточными намного более низкие поддерживающие дозы. Для других пациентов могут быть необходимы долговременные лечения с частотой 1-4 дозы в сутки, в соответствии с физиологическими требованиями каждого конкретного пациента. Само собой разумеется, что для других пациентов будет необходимо прописывать не более одной или двух доз в сутки.
Составы можно получить в стандартной дозированной форме посредством любого из способов, хорошо известных в области фармацевтики. Такие способы включают этап приведения в связь фармацевтически активного ингредиента с носителем, который представляет собой один или несколько вспомогательных ингредиентов. В основном, составы получают путем постоянного и тщательного смешивания активного ингредиента с жидкими носителями или мелкодисперсными твердыми носителями или и тем, и другим, и затем, при необходимости, придания формы продукту.
Составы могут быть представлены в емкостях с единичной дозой или с множественными дозами, например, запаянных ампулах и флаконах с эластомерными пробками, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Приготовленные для немедленного приема инъекционные растворы и суспензии можно получить из стерильных порошков, гранул и таблеток по типу ранее описанных.
Соединения данного изобретения можно получить путем применения или адаптации известных способов, под чем подразумевается способ, используемый до сих пор или описанный в литературе, например, описанные R.C. Larock в Comprehensive Organic Transformations, VCH publishers, 1989.
В реакциях, описываемых далее в данном документе, может быть необходимо защитить функциональные группы, например, гидрокси-, амино-, имино-, тио- или карбоксигруппы, если таковые необходимы у конечного продукта, во избежание их нежелательного участия в реакциях. Традиционные защитные группы можно использовать в соответствии со стандартной практикой, примеры см. T.W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, Inc., 1999.
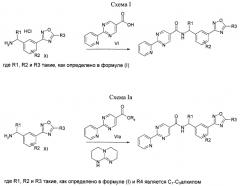
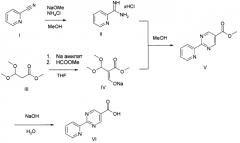
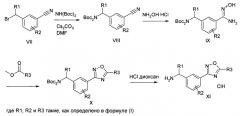
Соединение формулы (I) можно получить (как показано на Схеме I ниже) путем введения в реакцию амина типа XI с пиридилпиримидинилкарбоновой кислотой (получение, показанное на Схеме II) в присутствии дегидратирующего связывающего реагента, такого как DMTMM, в ряде растворителей, включая, без ограничения, DMF. Подходящие связывающие реагенты включают, но без ограничения, DMTMM, карбонилдиимидазол (CDI) и TBTU, DCC, соли фосфония и соли урония. Соединение формулы (I) можно также получить (как показано на Схеме Ia ниже) путем непосредственного связывания амина типа XI с пиридилпиримидиниловым сложным эфиром (получение показано на Схеме II) в присутствии 0,1-1,0 эквивалента 1,5,7-триазабицикло[4,4,0]дец-5-ена (TBD). Реакцию можно проводить в отсутствии растворителя или в присутствии добавленных растворителей, включая, без ограничения, простые эфиры, сложные эфиры, ароматические углеводороды. Применение сильных оснований, отличных от TBD, включая, без ограничения, DBU и тетраметилгуанидин, также дают продукт. Амин XI можно получить посредством способа, детально изображенного на Схеме III. Бензиловый бромид VII можно ввести в реакцию с ди-трет-бутилиминодикарбоксилатом в присутствии оснований, включая, без ограничения, карбонат цезия, в ряде растворителей, включая, без ограничения, DMF, с выходом соединения VIII. Эти соединения типа VIII затем можно ввести в реакцию с гидроксиламином (в присутствии оснований, включая, без ограничения, триэтиламин, в случаях, если используются соли гидроксиламина, такие как гидрохлорид гидроксиламина) в ряде растворителей, включая, без ограничения, метанол, с выходом амидоксима IX. Амидоксим можно ввести в реакцию с соединением, содержащим карбоксильную функциональную группу, включая, без ограничения, метилкарбоксилат, в присутствии основания, включая, без ограничения, карбонат калия либо в присутствии, либо в отсутствии растворителя, включая, без ограничения, толуол (в определенных случаях карбоксильная функциональная группа может служить в качестве растворителя для реакции), с выходом оксадиазола X. На оксадиазол X затем можно воздействовать кислыми условиями, включая, без ограничения, хлороводород в метаноле, с выходом амина XI. В случаях, если необходимо замещение алкила R1 у амина XI, эти амины можно получить согласно Схеме IV (либо в энантиообогащенной, либо в рацемической форме) с применением трет-бутилсульфинамидной методике, разработанной Эллманом.
Схема II
Схема III
Схема IV
Будет понятно, что соединения данного изобретения могут содержать центры асимметрии. Эти центры асимметрии могут независимо быть