Предотвращение гипогликемии у пациентов с сахарным диабетом 2 типа
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к терапии и эндокринологии, и может быть использована для предотвращения тяжелой симптоматической гипогликемии, связанной с концентрацией глюкозы в плазме ниже 50 мг/дл, при сахарном диабете 2 типа. Для этого вводят desPro36Эксендин-4(1-39)-Lys6-NH2 (ликсисенатид) и/или его фармацевтически приемлемую соль, и метформин и/или его фармацевтически приемлемую соль, нуждающемуся в этом субъекту, при этом субъект, подлежащий лечению, имеет значение HbA1c по меньшей мере 8%. Также предложена фармацевтическая комбинация и применение комбинации. Группа изобретений обеспечивает контроль уровня глюкозы в крови и массы тела в течение периода, составляющего 24 недели, у страдающих ожирением пациентов с сахарным диабетом 2 типа моложе чем 50. 3 н. и 16 з.п. ф-лы, 5 ил., 29 табл.
Реферат
Предметом настоящего изобретения является способ лечения сахарного диабета 2 типа AVE0010 (ликсисенатидом) в качестве дополнительной терапии к введению метформина.
Метформин представляет собой гипогликемический агент бигуанид, применяемый при лечении сахарного диабета 2 типа, не отвечающего на модификацию диеты. Метформин улучшает контроль уровня глюкозы в крови посредством улучшения чувствительности к инсулину. Метформин обычно вводят перорально. Однако, контроль сахарного диабета 2 типа у пациентов, страдающих ожирением, посредством метформина может быть недостаточным. Соответственно, у данных пациентов могут потребоваться дополнительные меры для контроля сахарного диабета 2 типа.
Гипогликемия является критическим ограничивающим фактором как при кратковременном, так и при длительном менеджменте гликемией при диабете. Несмотря на постоянные улучшения в менеджменте гликемией при диабете, основанные на популяции данные показывают, что гипогликемия продолжает являться главной проблемой для людей с диабетом как 1 типа, так и 2 типа (American diabetes association, workgroup on hypoglycemia: Defining and Reporting Hypoglycemia in Diabetes. Diabetes Care 28(5), 2005, 1245-1249).
Первым аспектом настоящего изобретения является способ лечения сахарного диабета 2 типа, включающий введение
(a) desPro36Эксендин-4(1-39)-LyS6-NH2 и/или его фармацевтически приемлемой соли, и
(b) метформина и/или его фармацевтически приемлемой соли,
нуждающемуся в этом пациенту.
В частности, способ представляет собой способ предотвращения гипогликемии у пациента с сахарным диабетом 2 типа. Более конкретно, способ представляет собой способ предотвращения симптоматической гипогликемии или тяжелой симптоматической гипогликемии у пациента с сахарным диабетом 2 типа.
Более конкретно, способ представленного изобретения является способом предотвращения гипогликемии у пациента с сахарным диабетом 2 типа, имеющего повышенный риск гипогликемии, в частности у пациента с диабетом 2 типа, имеющего по меньшей мере одно пережитое гипогликемическое событие. Гипогликемическим событием может быть симптоматическое гипогликемическое событие или тяжелое симптоматическое гипогликемическое событие.
В представленном изобретении, гипогликемия представляет собой состояние, при котором пациент с сахарным диабетом 2 типа имеет концентрацию глюкозы в плазме ниже 60 мг/дл (или ниже 3,3 ммоль/л), ниже 50 мг/дл, ниже 40 мг/дл или ниже 36 мг/дл.
С помощью способа представленного изобретения, гипогликемия может быть снижена ниже 12%, ниже 11%, ниже 10%, ниже 9%, ниже 8%, ниже 7%, ниже 6% или ниже 5% у пациентов с сахарным диабетом 2 типа, принимающих комбинацию ликсисенатида и метформина, как описано в данном документе.
В представленном изобретении, "симптоматическая гипогликемия" или "симптоматическое гипогликемическое событие" представляет собой состояние, связанное с клиническим симптомом, который обусловлен гипогликемией, при этом концентрация глюкозы в плазме находится ниже 60 мг/дл (или ниже 3,3 ммоль/л), ниже 50 мг/дл или ниже 40 мг/дл. Клиническими симптомами могут быть, например, потливость, учащенное сердцебиение, чувство голода, беспокойство, тревога, утомляемость, раздражительность, головная боль, потеря концентрации, сонливость, психические расстройства, нарушения зрения, транзиторные сенсорные нарушения, транзиторные двигательные нарушения, спутанность сознания, судороги и кома. В способе представленного изобретения могут быть выбраны один или более клинических симптомов симптоматической гипогликемии, которые указаны в данном документе. Симптоматическая гипогликемия может быть связана с быстрой нормализацией после перорального введения углеводов.
В представленном изобретении, "тяжелая симптоматическая гипогликемия" или "тяжелое симптоматическое гипогликемическое событие" представляет собой состояние с клиническим симптомом, который указан в данном документе, который обусловлен гипогликемией, при этом концентрация глюкозы в плазме находится ниже 36 мг/дл (или ниже 2,0 ммоль/л). Тяжелая симптоматическая гипогликемия может быть связана с острым неврологическим дефицитом, обусловленным гипогликемическим событием. При тяжелой симптоматической гипогликемии, пациенту может потребоваться помощь другого человека, если, например, пациент не может лечиться или помочь себе вследствие острого неврологического дефицита. Определение тяжелой симптоматической гипогликемии может включать все эпизоды, в которых неврологический дефицит является достаточно тяжелым, чтобы не опустить самолечение и в которых соответственно есть основания полагать, что пациенты имеют риск повреждения себя или других. Острым неврологическим дефицитом может быть по меньшей мере острый неврологический дефицит, выбранный из сонливости, психических расстройств, нарушений зрения, транзиторных сенсорных нарушений, транзиторных двигательных нарушений, спутанности сознания, судорог и комы.
Тяжелая симптоматическая гипогликемия может быть связана с быстрой нормализацией после перорального введения углеводов, внутривенного введения глюкозы и/или глюкагона.
Нормогликемия может относиться к концентрации в плазме крови глюкозы, составляющей от 60 мг/дл до 140 мг/дл (что соответствует от 3,3 ммоль/л до 7,8 ммоль/л).
Неожиданно в клиническом испытании было обнаружено, что в процессе лечения пациентов с сахарным диабетом 2 типа ликсисенатидом, в комбинации с метформином, только 5% пациентов имели симптоматические гипогликемические события, тогда как в сравнительном испытании, 14,6% пациентов с сахарным диабетом 2 типа, подвергавшихся лечению комбинацией эксенатида и метформина, сообщали о симптоматической гипогликемии в течение такого же периода. Данные результаты показывают, что комбинация ликсисенатида и метформина может быть использована для предотвращения гипогликемии.
Комбинация ликсисенатида и метформина, как описано в данном документе, также может быть использована для уменьшения и/или предотвращения побочных эффектов противодиабетического лечения пациентов с сахарным диабетом 2 типа.
В представленном изобретении, побочные эффекты комбинации ликсисенатида и метформина исследовали в клиническом испытании лечения пациентов с сахарным диабетом 2 типа ликсисенатидом, в комбинации с метформином (Пример 2). В данном испытании, побочные эффекты описаны посредством возникших после начала применения препарата нежелательных явлений (TEAE).
Побочный эффект может представлять собой состояние моторики желудочно-кишечного тракта и дефекации, например, диарею, неинфекционную диарею, атоническое и гипокинетическое нарушение желудочно-кишечного тракта, не классифицированное в других рубриках, запор, гастроэзофагеальную рефлюксную болезнь. Побочный эффект может также представлять собой желудочно-кишечный признак и симптом, например, диспептический признак и симптом, диспепсию, флатуленцию, метеоризм, увеличение, вздутие живота, желудочно-кишечную и абдоминальную боль (например, исключая боль в полости рта и горле), абдоминальную боль, боль в верхних отделах живота, абдоминальный дискомфорт, симптом тошноты и/или рвоты, тошноту или рвоту. В частности, побочный эффект представляет собой тошноту или рвоту. Более конкретно, побочный эффект представляет собой тошноту.
Неожиданно было обнаружено, что в клиническом испытании побочные эффекты, например, тошнота уменьшались (см., например, Таблицу 29 примера 2), по сравнению со сравнительным испытанием лечения пациентов с сахарным диабетом 2 типа комбинацией эксенатида и метформина.
Побочным эффектом также может быть панкреатит. В течение периода применения исследуемого препарата, 5 (1,6%) подвергавшихся лечению ликсисенатидом пациентов и 9 (2,8%) подвергавшихся лечению эксенатидом пациентов сообщали о случаях изменений панкреатических ферментов, или липазы или амилазы, при "подозрении на панкреатит" (Таблицы 23 и 24 примера 2). Однако случаев острого панкреатита не наблюдалось.
Побочным эффектом также может быть повышенная концентрация кальцитонина в крови. В клиническом испытании, восемь пациентов (4 [1,3%] в каждой группе) сообщали о значении кальцитонина > 20 нг/л (Таблица 25). О значении > 50 нг/л не сообщалось. Пять (1,8%) пациентов в группе ликсисенатида и 8 (3,0%) пациентов в группе эксенатида имели значение кальцитонина > 20 нг/л в течение периода применения исследуемого препарата (Таблица 26).
Данные результаты показывают, что комбинация ликсисенатида и метформина может быть использована для уменьшения и/или предотвращения побочных эффектов противодиабетического лечения пациентов с сахарным диабетом 2 типа. В частности, данные результаты показывают, что комбинация ликсисенатида и метформина может быть использована для уменьшения и/или предотвращения тошноты, панкреатита и/или повышенной концентрации кальцитонина в крови.
Соединения (a) и (b) могут вводиться нуждающемуся в этом пациенту, в количестве, достаточном для того, чтобы индуцировать терапевтический эффект.
Соединение desPro36Эксендин-4(1-39)-Lys6-NH2 (AVE0010, ликсисенатид) является производным эксендина-4. AVE0010 раскрыто, как SEQ ID NO:93 в WO 01/04156:
SEQ ID NO: 1 AVE0010 (44 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-l-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-K-K-NH2
SEQ ID NO: 2 Эксендин-4 (39 AS)
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-l-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2
Эксендины представляют собой группу пептидов, которые могут понижать концентрацию глюкозы в крови. Аналог эксендина AVE0010 отличается отсечением С-конца последовательности исходного Эксендина-4. AVE0010 содержит шесть С-концевых лизиновых остатков, не присутствующих в Эксендине-4.
В контексте представленного изобретения, AVE0010 включает в себя его фармацевтически приемлемые соли. Квалифицированному специалисту в данной области известны фармацевтически приемлемые соли AVE0010. Предпочтительной фармацевтически приемлемой солью AVE0010, используемого в представленном изобретении, является ацетат.
AVE0010 (desPro36Эксендин-4(1-39)-Lys6-NH2) и/или его фармацевтически приемлемая соль могут вводиться посредством подкожной инъекции. Известны подходящие инъекционные устройства, например, так называемые "ручки", содержащие картридж, содержащий активный ингредиент, и инъекционную иглу. AVE0010 и/или его фармацевтически приемлемая соль могут вводиться в подходящем количестве, например, в количестве в диапазоне, составляющем от 10 до 15 мкг на дозу или от 15 до 20 мкг на дозу один раз в день (нарастание дозы от 10 до 15 и до 20 мкг/день. 20 мкг является эффективной поддерживающей дозой).
В представленном изобретении, AVE0010 и/или его фармацевтически приемлемая соль могут вводиться в ежедневной дозе в диапазоне, составляющем от 10 до 15 мкг или в диапазоне, составляющем от 15 до 20 мкг один раз в день (нарастание дозы от 10 до 15 и до 20 мкг/день. 20 мкг является эффективной поддерживающей дозой). AVE0010 и/или его фармацевтически приемлемая соль могут вводиться в виде одной инъекции в день.
В представленном изобретении, может быть использована жидкая композиция, содержащая desPro36Эксендин-4(1-39)-Lysg-NH2 и/или его фармацевтически приемлемую соль. Квалифицированному специалисту известны жидкие композиции AVE0010, подходящие для парентерального введения. Жидкая композиция представленного изобретения может иметь кислый или физиологический pH. Кислый pH предпочтительно находится в диапазоне pH 1-6,8, pH 3,5-6,8 или pH 3,5-5. Физиологический pH предпочтительно находится в диапазоне pH 2,5-8,5, pH 4,0-8,5 или pH 6,0-8,5. pH может быть отрегулирован с помощью фармацевтически приемлемой разбавленной кислоты (обычно HCL) или фармацевтически приемлемого разбавленного основания (обычно NaOH). Предпочтительный pH находится в диапазоне pH 3,5-5,0.
Жидкая композиция может содержать буфер, такой как фосфатный, цитратный, ацетатный. Предпочтительно, она может содержать ацетатный буфер, в количествах до 5 мкг/мл, до 4 мкг/мл или до 2 мкг/мл.
Жидкая композиция представленного изобретения может включать в себя подходящий консервант. Подходящий консервант может быть выбран из фенола, м-крезола, бензилового спирта и сложного эфира п-гидроксибензойной кислоты. Предпочтительным консервантом является м-крезол.
Жидкая композиция представленного изобретения может включать в себя вещество, регулирующее тоничность. Подходящее вещество, регулирующее тоничность, может быть выбрано из глицерина, лактозы, сорбитола, маннитола, глюкозы, NaCl, кальций- или магнийсодержащих соединений, таких как CaCl. Концентрация глицерина, лактозы, сорбитола, маннитола и глюкозы может находиться в диапазоне, составляющем 100-250 мМ. Концентрация NaCl может составлять до 150 мМ. Предпочтительным веществом, регулирующим тоничность, является глицерин.
В дополнение, жидкая композиция может содержать от 0,5 мкг/мл до 20 мкг/мл L-метионина, предпочтительно от 1 мкг/мл до 5 мкг/мл Предпочтительно, она содержит L-метионин.
Метформин представляет собой международное непатентованное название 1,1-диметилбигуанида (номер CAS 657-24-9). В представленном изобретении, термин "метформин" содержит любую его фармацевтически приемлемую соль.
В представленном изобретении, метформин можно вводить перорально. Квалифицированному специалисту известны готовые формы метформина, подходящие для лечения сахарного диабета 2 типа посредством перорального введения. Метформин можно вводить в дозе, составляющей по меньшей мере 1,0 г/день или по меньшей мере 1,5 г/день. Для перорального введения, метформин может быть приготовлен в виде твердой лекарственной формы, такой как таблетка или пилюля.
В представленном изобретении, desPro36Эксендин-4(1-39)-Lys6-NH2 и/или фармацевтически приемлемую соль вводят в дополнительной терапии к введению метформина.
В представленном изобретении, термины «дополнительная», «дополнительное лечение» и «дополнительная терапия» связаны с лечением сахарного диабета 2 типа метформином и AVE0010. Метформин и AVE0010 могут вводиться в пределах временного интервала, составляющего 24 ч. И метформин, и AVE0010 могут вводиться однократной дозой в день. Метформин и AVE0010 могут вводиться посредством различных способов введения. Метформин можно вводить перорально, а AVE0010 можно вводить подкожно.
Субъект, подвергающийся лечению с помощью способа представленного изобретения, страдающий сахарным диабетом 2 типа, может быть тучным субъектом. В представленном изобретении, тучный субъект может иметь индекс массы тела, равный по меньшей мере 30.
Субъект, подвергающийся лечению с помощью способа представленного изобретения, может иметь значение HbA1c в диапазоне, составляющем 7-10%.
Субъект, подвергающийся лечению с помощью способа представленного изобретения, может иметь значение HbA1c, составляющее по меньшей мере 8%, в частности, субъект, подвергающийся лечению с помощью способа представленного изобретения, может иметь значение HbA1c в диапазоне, составляющем от 8% до 10%.
Субъект, подвергающийся лечению с помощью способа представленного изобретения, может иметь значение HbA1c, составляющее ниже 8%, в частности, субъект, подвергающийся лечению с помощью способа представленного изобретения, может иметь значение HbA1c в диапазоне, составляющем 7-8%.
Субъектом, подвергающемуся лечению с помощью способа представленного изобретения, может быть взрослый субъект. Субъект может иметь возраст в диапазоне, составляющем от 18 до 50 лет.
Способ представленного изобретения предпочтительно является способ лечения субъекта, страдающего сахарным диабетом 2 типа, при этом сахарный диабет 2 типа не регулируется должным образом посредством лечения одним метформином, например, дозой, составляющей по меньшей мере 1,0 г/день метформина или по меньшей мере 1,5 г/день метформина в течение 3 месяцев. В представленном изобретении, субъект, страдающий сахарным диабетом 2 типа, который не регулируется должным образом, может иметь значение HbA1c в диапазоне, составляющем 7%-10%.
Еще одним аспектом представленного изобретения является фармацевтическая комбинация, содержащая
(a) desPro36Эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) метформин и/или его фармацевтически приемлемую соль.
Предпочтительно, комбинация представленного изобретения предназначена для использования при лечении сахарного диабета 2 типа.
Предпочтительно, комбинация представленного изобретения предназначена для использования для предотвращения гипогликемии, как описано в данном документе, у пациентов с сахарным диабетом 2 типа.
Более предпочтительно комбинация представленного изобретения предназначена для использования для предотвращения гипогликемии у пациента с сахарным диабетом 2 типа, имеющего повышенный риск гипогликемии, в частности у пациента с диабетом 2 типа, имеющего пережитое по меньшей мере одно гипогликемическое событие. Гипогликемическое событие может быть симптоматическим гипогликемическим событием или тяжелым симптоматическим гипогликемическим событием.
Предпочтительно, комбинация представленного изобретения предназначена для использования для предотвращения побочных эффектов противодиабетического лечения, как описано в данном документе, у пациентов с сахарным диабетом 2 типа. В частности, побочным эффектом является тошнота, панкреатит и/или повышенная концентрация кальцитонина в крови.
Комбинация представленного изобретения может вводиться, как описано в данном документе в контексте способа представленного изобретения. Соединения (a) и (b) комбинации представленного изобретения могут быть получены в виде готовой формы, как описано в данном документе в контексте способа представленного изобретения.
Еще одним аспектом представленного изобретения является применение комбинации, содержащей
(a) desPro36Эксендин-4(1-39)-Lys6-NH2 и/или его фармацевтически приемлемую соль, и
(b) метформин и/или его фармацевтически приемлемую соль,
для изготовления лекарства для лечения сахарного диабета 2 типа.
Лекарство содержит desPro36Эксендин-4(1-39)-Lys6-NH2 и метформин в раздельных готовых формах, как описано в данном документе.
Комбинация представленного изобретения может быть использована для получения лекарства для предотвращения гипогликемии, как описано в данном документе, у пациентов с сахарным диабетом 2 типа.
Комбинация представленного изобретения может быть использована для получения лекарства для предотвращения побочных эффектов противодиабетического лечения пациентов с сахарным диабетом 2 типа, как описано в данном документе. В частности, побочным эффектом является тошнота, панкреатит и/или повышенная концентрация кальцитонина в крови.
Изобретение дополнительно проиллюстрировано посредством последующих Примеров и Чертежей.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
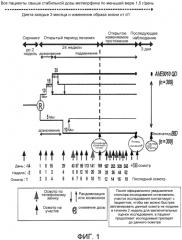
Фиг.1: Дизайн клинического исследования примера 2.
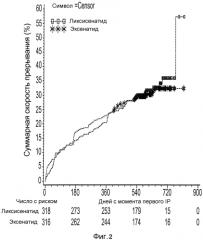
Фиг.2: график Каплана-Майера времени к прекращению лечения вследствие какой-либо причины - рандомизированная популяция.
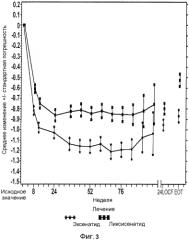
Фиг.3: График среднего изменения HbA1c (%) по сравнению с исходным при осмотре и в конечной точке mITT популяции. EOT = последнее значение в период терапии (LOCF). LOCF = перенос вперед данных последнего наблюдения. Примечание: анализ исключал измерения, полученные после введения резервного препарата и/или после прекращения лечения плюс 3 дня. В течение 24 недели (LOCF), анализ включал измерения, полученные за 3 суток после последней дозы инъекции исследуемого препарата при 11 осмотре или перед ним (24 неделя), или на 169 день, если 11 осмотр (24 неделя) невозможен.
Фиг.4: График среднего изменения глюкозы в плазме натощак (ммоль/л) по сравнению с исходной при осмотре и в конечной точке-mITT популяции. EOT = последнее значение в период терапии (LOCF). LOCF = перенос вперед данных последнего наблюдения. Примечание: анализ исключал измерения, полученные после введения резервного препарата и/или после прекращения лечения плюс 3 дня. В течение 24 недели (LOCF), анализ включал измерения, полученные до 1 дня после последней дозы инъекции исследуемого препарата при 11 осмотре или перед ним (24 неделя), или на 169 день, если 11 осмотр (24 неделя) невозможен.
Фиг.5: График среднего изменения массы тела (кг) по сравнению с исходной при осмотре и в конечной точке-mITT популяции. EOT = последнее значение в период терапии (LOCF). LOCF = перенос вперед данных последнего наблюдения. Примечание: анализ исключал измерения, полученные после введения резервного препарата и/или после прекращения лечения плюс 3 дня. В течение 24 недели (LOCF), анализ включал измерения, полученные за 3 суток после инъекции последней дозы исследуемого препарата при 11 осмотре или перед ним (24 неделя), или на 169 день, если 11 осмотр (24 неделя) невозможен.
Пример 1
24-недельное исследование, сравнивающее ликсисенатид (AVE0010) с ситаглиптином в качестве дополнения к метформину для страдающих ожирением пациентов с сахарным диабетом 2 типа моложе, чем 50
Предметом примера является рандомизированное, двойное слепое, с двойной маскировкой, с 2 параллельными группами, многоцентровое, 24-недельное исследование, сравнивающее эффективность и безопасность ликсисенатида (AVE0010) с ситаглиптином (CAS Количество 486460-32-6) в качестве дополнения к метформину у страдающих ожирением пациентов с сахарным диабетом 2 типа моложе, чем 50 лет и не регулируемым должным образом метформином. Ситаглиптин представляет собой противодиабетическое средство, действующее в качестве ингибитора дипептидилпептидазы 4 (DPP4), приводя к повышению уровня глюкагон-подобного пептида 1, снижая тем самым уровень глюкозы в крови у больных сахарным диабетом.
Основные цели исследования
Основная цель данного исследования состоит в оценке эффективности ликсисенатида в комбинированной конечной точке контроля уровня глюкозы в крови (HbA 1c ) и массы тела по сравнению с ситаглиптином в качестве дополнения к лечению метформином в течение периода, составляющего 24 недели, у страдающих ожирением пациентов с сахарным диабетом 2 типа моложе, чем 50.
Дополнительными Целями Исследование является оценка влияния ликсисенатида на:
- абсолютные изменения в HbA1c и массы тела;
- глюкозу в плазме натощак;
- Глюкозу в плазме, инсулин, C пептид, глюкагон и проинсулин в течение 2-часового стандартизированного пробного приема пищи;
- Резистентность к инсулину, оцененную посредством HOMA-IR;
- Функцию бета-клеток, оцененную посредством HOMA-beta;
- Оценку безопасности и переносимости ликсисенатида;
- Оценку фармакокинетики ликсисенатида, используя метод фармакокинетики популяции, чтобы оценить выработку против антител ликсисенатида.
Конкретные уязвимые популяции:
Женщины, способные к деторождению, использующие контрацепцию.
Критерии включения в исследование
Пациенты (мужчины и женщины) с сахарным диабетом 2 типа, по определению ВОЗ (21), диагностированного в течение по крайней мере 1 года во время скринингового осмотра, с недостаточным регулированием метформином при стабильной дозе, составляющей по меньшей мере 1,5 г/день, в течение по меньшей мере 3 месяцев перед скрининговым осмотром. Пациенты с ожирением (ИМТ ≥30 кг/м2) и в возрасте от 18 лет до менее чем 50 лет.
Критерии исключения из исследования
- HbA1c <7,0% или HbA1c >10% во время скрининга
- Сахарный диабет 1 типа
- Беременность или лактация
- Женщины, способные к деторождению, с неэффективным способом контрацепции
- Глюкоза плазмы натощак при скрининге >250 мг/дл (>13,9 ммоль/л)
- Изменение массы тела, составляющее более чем 5 кг, в течение 3 месяцев, предшествующих скрининговому осмотру
- Панкреатит неясной этиологии, хронический панкреатит, панкреатэктомия, хирургические вмешательства на желудке, воспалительные заболевания кишечника в анамнезе
- Метаболический ацидоз, включая диабетический кетоацидоз в течение 1 года перед скринингом в анамнезе
- Гемоглобинопатия или гемолитическая анемия или переливание продуктов крови или плазмы в течение 3 месяцев перед периодом скрининга
- В течение последних 6 месяцев перед скринингом: в анамнезе инфаркт миокарда, инсульт или сердечная недостаточность, требующая госпитализации.
- Известное в анамнезе злоупотребление лекарственными препаратами или алкоголем в течение 6 месяцев перед периодом скрининга.
- Какая-либо клинически значимая патология, выявленная посредством клинического исследования, лабораторных тестов, ЭКГ либо показателей жизненно важных функций в период скрининга, которая при оценке исследователя или любого младшего исследователя могла бы помешать успешному завершению исследования или ограничивает оценку эффективности, такая как основные системные заболевания, наличие клинически значимой диабетической ретинопатии или наличие макулярного отека, который может потребовать лечение лазером в течение периода исследования.
- Неконтролируемая или неадекватно контролируемая гипертензия в период скрининга с систолическим или диастолическим кровяным давлением в покое > 180 мм рт. ст. или > 110 мм рт. ст., соответственно
- Лабораторные находки в период скрининга:
- Амилаза и/или липаза >3 раз выше верхней границы диапазона лабораторной нормы
- Общий билирубин: >1,5 раза выше верхней границы диапазона лабораторной нормы (за исключением случаев синдрома Жильбера)
- Гемоглобин <11 г/дл и/или нейтрофилы <1500/мм3 и/или тромбоциты <100000/мм3
- Положительный тест на поверхностный антиген гепатита В и/или антитела гепатита С
- Положительный сывороточный тест на беременность у женщин репродуктивного возраста
- Применение других пероральных или инъекционных противодиабетических или гипогликемических веществ, не являющихся метформином (например, сульфонилмочевины, ингибитора альфа-гликозидазы, тиазолидиндиона, эксенатида, ингибиторов DPP-IV, инсулина и т.д.) в течение 3 месяцев перед периодом скрининга
- Нестабильная диета или нестабильное лечение ожирения в течение 3 месяцев перед периодом скрининга
- Применение системных глюкокортикоидов (исключая местное применение или ингаляционные формы) в течение одной недели или более в течение 3 месяцев перед периодом скрининга
- Применение каких-либо исследуемых препаратов в течение 3 месяцев перед скринингом
- Клинически отягощенный анамнез заболевания желудочно-кишечного тракта, связанного с продолжительной тошнотой и рвотой, включая, но без ограничения, парез желудка и гастроэзофагеальную рефлюксную болезнь, требующую медицинского лечения, в течение 6 месяцев перед периодом скрининга
- Какое-либо предшествующее лечение ликсисенатидом (например, участие в предыдущем исследовании ликсисенатида)
- Аллергическая реакция на любой GLP 1-агонист в прошлом (например, эксенатид, лираглутид) или на метакрезол
- В анамнезе тяжелая реакция гиперчувствительности на ситаглиптин.
- Умеренное или тяжелое поражение почек (креатининовый клиренс ниже 50 мл/мин)
Продолжительность периода исследования для субъекта
Максимальная продолжительность составляет 27 недель ± 7 дней (3-недельный скрининг + 24-недельное двойное слепое, с двойной маскировкой, активно-контролируемое лечение + 3-дневное последующее врачебное наблюдение)
| ИССЛЕДУЕМЫЕ ПРОДУКТЫ | |||
| МНН | Шифр соединения | Лекарственная форма | Способ введения |
| Ликсисенатид | AVE0010 | инъекция | подкожно |
| Ситаглиптин | капсулы | капсулы |
| ПОДРАЗДЕЛЕНИЯ ДЛЯ ИССЛЕДОВАНИЯКоличество подразделений: 2 | ||
| Маркировка подразделений | Описание подразделений | Тип подразделений |
| Ликсисенатид | Инъекция ликсисенатида один раз в день утром в течение 1 часа перед завтраком (первые 2 недели двойного слепого периода: доза от 10 до 15 мкг, затем от 15 до 20 мкг), и одна капсула плацебо ситаглиптина принимается утром либо без пищи. На фоне базисной терапии метформином. | Экспериментальное |
| Ситаглиптин | Одна капсула ситаглиптина принимается утром с пищей либо без нее, и инъекция плацебо, соответствующая ликсисенатиду, один раз в день утром в пределах 1 часа до завтрака. На фоне базисной терапии метформином. | Активный калибратор/препарат сравнения |
| КОНЕЧНЫЕ ТОЧКИ | |
| Основная конечная точка (конечные точки) | Временные рамки оценки |
| Процентная доля пациентов со значением HbA1c <7% и потерей массы тела, составляющей по меньшей мере 5% исходной массы тела | 24 недели |
| Дополнительная Конечная точка (конечные точки): | Временные рамки оценки |
| Абсолютное изменение Значений HbA1c | 24 недели |
| Процентная доля пациентов со Значением HbA1c ≤6,5% | 24 недели |
| Абсолютное изменение массы тела | 24 недели |
| Изменение глюкозы плазмы натощак | 24 недели |
| Изменение глюкозы в плазме и функции β-клеток в процессе пробного приема пищи | 24 недели |
| Изменение резистентности к инсулину, оцениваемое с помощью HOMA-IR | 24 недели |
| Изменение функции β-клеток, оцениваемое с помощью ΗΟΜΑ-β | 24 недели |
| Процентная доля пациентов нуждающихся в резервном варианте лечения в течение двойного слепого периода | 24 недели |
Пример 2
Рандомизированное, открытое, с активным контролем, с 2 параллельными группами, многоцентровое 24-недельное исследование с последующей расширенной оценкой эффективности и безопасности AVE0010 по сравнению с эксенатидомом в дополнение к метформину у пациентов с сахарным диабетом 2 типа, не регулируемым должным образом метформином
СУЩНОСТЬ
Проводили рандомизированное, открытое, с активным контролем, с двумя параллельными группами, многоцентровое, многонациональное исследование оценки эффективности и безопасности ликсисенатида по сравнению с эксенатидомом в качестве дополнительного лечения к метформину у пациентов с сахарным диабетом 2 типа. Приблизительная минимальная продолжительность исследования для пациента составила 78 недель (до 2 недель скрининга +24-недельное основное лечение + варьирующая продолжительность +3-дневное последующее врачебное наблюдение). Исследование проводили в 122 центрах в 18 странах. Основной целью исследования было оценить эффективность ликсисенатида при контроле уровня глюкозы в крови по сравнению с эксенатидомом в показателях уменьшения HbA1c (абсолютное изменение) в течение периода, составляющего 24 недели.
Все 634 пациента были рандомизированы в одну из двух групп лечения (318 в группе ликсисенатида и 316 в группе эксенатида). Всех рандомизированных пациентов подвергли исследуемому виду лечения. Демографические и исходные характеристики в целом были одинаковыми между группами лечения. Восемнадцать пациентов (7 пациентов в группе ликсисенатида и 11 пациентов в группе эксенатида) были исключены из популяции mITT для анализов эффективности вследствие отсутствия данных об эффективности после исходного уровня. В процессе всего периода исследуемого вида лечения, 198 (31,2%) пациентов досрочно прервали исследуемый вид лечения. Процентные доли пациентов, которые прервали лечение, были одинаковыми между группами лечения (32,1% для группы ликсисенатида и 30,4% для группы эксенатида). Основной причиной для прекращения лечения были "нежелательные явления" (14,2% в каждой группе) с последующими "другими причинами" (9,1% для ликсисенатида и 9,8% для эксенатида), "отсутствием эффективности" (6,0% для ликсисенатида и 1,9% для эксенатида) и "плохим соблюдением протокола" (2,2% для ликсисенатида и 4,1% для эксенатида).
Средние изменения наименьших квадратов (LS) HbA1c по сравнению с исходным к 24 неделе составили -0,79% для группы ликсисенатида и -0,96% для группы эксенатида (среднее различие LS vs. эксенатид =0,17%). Была продемонстрирована не меньшая эффективность ликсисенатида по сравнению с эксенатидомом, так как верхняя граница двустороннего 95% CI среднего различия LS была меньше, чем предварительно заданный предел не меньшей эффективности, составляющий 0,4%. Превосходство ликсисенатида над эксенатидом не было продемонстрировано.
Ликсисенатид оказался хорошо переносим. Итоговая частота возникших после начала применения препарата нежелательных явлений (TEAE) была сравнима между двумя группами лечения. Шесть пациентов (3 пациента в каждой группе лечения) имели SAE в период терапии, приведшие к смерти. Сорок восемь тяжелых TEAE произошли во время лечебного периода всего исследования с одинаковой частотой встречаемости в каждой группе лечения (8,2% для ликсисенатида и 7,0% для эксенатида). Наиболее часто сообщаемыми TEAE была тошнота (28,6% для пациентов, подвергавшихся лечению ликсисенатидом, 37,7% пациентов, подвергавшихся лечению эксенатидом). Шестнадцать (5,0%) пациентов, подвергавшихся лечению ликсисенатидом, имели симптоматические гипогликемические события, как определено в протоколе, в течение периода терапии, тогда как 46 (14,6%) пациентов, подвергавшихся лечению эксенатидом, сообщали о симптоматической гипогликемии в течение такого же периода. Ни одно из событий симптоматической гипогликемии не было тяжелым. Всего 9 пациентов (6 [1,9%] пациентов, подвергавшихся лечению ликсисенатидом, и 3 [0,9%] пациента, подвергавшихся лечению эксенатидом) сообщили о случаях признанной Комитетом по оценке Аллергических Реакций (ARAC) как аллергической реакции, но ни одна из них не была признана как возможно связанная с исследуемым препаратом.
1. ЦЕЛИ
1.1 ОСНОВНАЯ ЦЕЛЬ
Основной целью данного исследования было оценить эффективность ликсисенатида при контроле уровня глюкозы крови по сравнению с эксенатидомом в качестве дополнительного лечения к метформину в показателях уменьшения HbA1c в течение периода 24 недель у пациентов с сахарным диабетом 2 типа.
1.2 ДОПОЛНИТЕЛЬНАЯ ЦЕЛЬ (ЦЕЛИ)
• Оценить эффективность ликсисенатида, по сравнению с эксенатидомом, для:
- Процентной доле пациентов, достигших HbA1c <7% или HbA1c ≤6,5%,
- FPG - содержанию глюкозы в плазме крови натощак,
- Массы тела,
• Оценить безопасность и переносимость ликсисенатида,
• Оценить влияние переносимости препарата на качество жизни (Оценка пациентом расстройств верхних отделов желудочно-кишечного тракта - качество жизни, PAGI-QOL).
2. ДИЗАЙН ИССЛЕДОВАНИЯ
Это было рандомизированное, открытое, с активным контролем, с двумя параллельными группами, многоцентровое, многонациональное исследование, запланированное у 300 подвергавшихся лечению ликсисенатидом и 300 подвергавшихся лечению эксенатидом пациентов.
Пациенты были разделены посредством значений скрининга HbA1c (<8,0%, ≥8,0%) и Индекса массы тела (BMI <30, ≥30 кг/м2).
Согласно протоколу Поправки 4 (датированному 18 января 2010 года), приблизительная минимальная продолжительность исследования для пациента составляла 78 недель (до 2 недель скрининга +24 недель основного открытого лечения + варьируемая продолжительность +3 дня последующего врачебного наблюдения). Пациенты, которые завершили 24-недельный основной открытый период, прошли переменный открытый расширенный период, который закончился для всех пациентов приблизительно в запланированную дату осмотра (V24) 76 недели для последнего рандомизированного пациента.
Пациентов, которые досрочно прервали исследуемый вид лечения, продолжили исследование до запланированной даты завершения исследования. Им было выполнено последующее врачебное наблюдение согласно процедурам исследования, как указано в поправке протокола (за исключением 3-дневного последующего врачебного наблюдения за безопасностью после лечения и опросника PAGI-QOL).
3. ОСНОВНАЯ И КЛЮЧЕВАЯ ДОПОЛНИТЕЛЬНЫЕ КОНЕЧНЫЕ ТОЧКИ
3.1 ОСНОВНАЯ КОНЕЧНАЯ ТОЧКА
Основным показателем эффективности было абсолютное изменение HbA1c по сравнению с исходным к 24 неделе, которое определяли как: HbA1c на 24 неделе - HbA1c в начале исследования.
Если пациент прервал лечение досрочно или принял резервный вариант лечения в течение основного 24-недельного открытого периода лечения или не имел значения HbA1c при осмотре на 24 неделе, в качестве значения HbA1c на 24 неделе использовали последнее после исходного уровня в период терапии измерение HbA1c в течение основного 24-не