Способ регенерационной очистки медно-тартратных щелочных гальванических электролитов
Иллюстрации
Показать всеИзобретение относится к очистке отработанных щелочных электролитов меднения, регенерацией катионов меди (II) и комплексонов и может быть применено в гальванотехнике и в промышленной экологии. Способ регенерационной очистки отработанных медно-тартратных щелочных электролитов, содержащих катионы меди (II), включает восстановление катионов меди (II) до оксида меди (I) при нагревании, удаление оксида меди (I) и гидротатртата калия из кислых растворов, их регенерацию, при этом в качестве восстановителя применяют соли гидроксиламина, а восстановление осуществляют при pH 10-12, темпертуре 60°C в течение 15 минут и мольном соотношении υ (Cu) : υ (амин)=1:1,1. Способ позволяет максимально полно извлечь из отработанных электролитов все компоненты и очистить воду до требуемых гигиенических показателей. 1 табл.
Реферат
Изобретение относится к очистке отработанных щелочных гальванических электролитов, содержащих катионы меди (II), регенерацией меди и тартратных комплексонов (соли D-винной кислоты), и может быть применено в гальванотехнике и в промышленной экологии.
Процессы нанесения медных покрытий часто осуществляют в щелочной среде. С целью предотвращения образования осадка нерастворимых в воде гидроксидов меди (II) при рН>7 в гальванический электролит вводят комплексоны, типа сегнтовой соли [калий натриевая соль D-винной кислоты (или калия-натрия тартрат)], образующей в щелочной среде с катионами меди (II) растворимые в воде прочные комплексы - тартраты, состав и структура которых зависят от рН раствора, отношений концентраций меди и комплексона. Для получения прочных комплексов используют избыток комплексонов (в несколько раз) от стехиометрической.
При длительной эксплуатации и неоднократных возобновлениях новыми порциями реагентов в щелочных гальванических электролитах образуются различные побочные продукты - устойчивые гидрозоли. Это приводит к изменению электропроводимости, вязкости и других физико-химических свойства электролитов, растворы становятся вязкими, уменьшается скорость диффузии, нарушается адгезия меди к поверхности деталей. Такие отработанные растворы выводят из эксплуатационного цикла, и они подлежат утилизации.
Однако из-за образования в щелочной среде прочных медных комплексов при утилизации этих растворов катионы меди (II) не могут быть удалены в виде малорастворимых гидроксидов. Поэтому отработанные растворы накапливают или утилизируют различными способами.
Известен способ (варианты) [1] очистки электролита хромирования от примесей катионов железа и меди (RU 2433212, 19.12.2011), в котором предложены способы, основанные на достижении в электролите хромирования при рН 1,5-4,0 образования осадков гидроксидов, хроматов и гидроксохроматов железа (III) и гидрокисда меди (II). Данные условия достигаются за счет введения в разбавленные растворы хромирования водных растворов гидразина, гидроксиамина или пероксида водорода, а также за счет гидролиза, который происходит при температуре 70-120°С. В результате содержания концентрации катионов железа и меди снижаются до 1,0-5,0 г/л.
В рассмотренных электролитах катионы меди находятся в свободном от комплексонов состоянии и при оптимальном рН среды и при нагревании, когда реакция гидролиза свободного катиона меди (II) смещается в сторону образования гидроксо - катионов меди (II), что позволяет удалить их из раствора в виде Cu(ОН)2. Введение в растворы восстановителей (гидразин, гидроксиламин или пероксид водорода), приводит к восстановлению хрома (VI) в хром (III). Такой способ [1] удаления катионов меди (II) не может быть применен в электролитах меднения, где катионы меди (II) прочно связаны с лигандами комплексонов и не могут быть переведены в соответствующий гидроксид.
Известен способ [2] (Фелинга реактив. Химический энциклопедический словарь. Гл. ред. И.Л. Кнунянц. - М.: Сов. энциклопедия, 1983-792 с, с. 610) восстановления катионов меди (II) в щелочной среде до оксида меди (I) при нагревании в присутствии восстановителя - альдегидов и восстанавливающих моносахаридов. Реактив Фелинга или фелингова жидкость это водный раствор 10%-ного гидроксида натрия, сульфата меди (II) и тартрата калия-натрия (сегнетова соль). Этот реактив в аналитической химии применяют для качественного и количественного обнаружения альдегидов и восстанавливающих углеводов (моносахаридов типа глюкозы), с которыми при нагревании гидроксид меди (II) дает желто-оранжевое, красное или зеленое окрашивание или образует осадок Cu2O.
Недостаток этого способа восстановления катионов меди (II) заключается в том, что он предусмотрен для обнаружения альдегидов и восстанавливающих углеводов, при условии избытка сульфата меди в растворе. Кроме того, реакция восстановления меди приводит к образованию окрашенных водных растворов, следовательно, такие растворы должны проходить дополнительные стадии очистки и обесцвечивания.
Наиболее близким к настоящему изобретению является способ [3] регенерационной очистки щелочных растворов медного травления (RU 2343225 от 10.01.2009), в котором регенерационную очистку щелочных растворов медного травления, содержащих тартраты щелочных металлов (сегнетова соль) в качестве комплексона, осуществляют восстановлением катионов меди (II) до оксида меди (I) в щелочной среде восстанавливающим моносахаридом при нагревании. Выделяют малорастворимый гидротартрат калия из кислых растворов. Остаточные количества меди (II) из окрашенного раствора удаляют цементацией на железе в кислой среде. Оксид меди (I) и гидротартрат калия регенерируют.
Недостатком этого метода является его низкая эффективность и неудовлетворительные экологические параметры. Остаточное содержание катионов меди в растворе после восстановления моносахаридом составляет 85 мг/л [ПДК(Cu2+)=0,1 мг/л]. Удаление остаточных количеств катионов меди (II) осуществляют железом, для чего раствор подкисляют. После полного удаления катионов меди перед сбросом воду нейтрализуют. Очищенная вода имеет темно-бурое окрашивание.
При снижения концентрации меди (II) [(Cu2+)≤0,1 мг/л] цементацией в кислой среде металлическим железом, расход железа на порядок превышает теоретически необходимым. Это приводит к перерасходу кислоты, что, в конечном счете, приводит к засаливанию очищенной воды.
Кроме сказанного, в качестве восстановителя применяется дорогие пищевые продукты - моносахариды (альдозы типа глюкозы), продуктом окисления которых являются соответствующие кислоты (глюконовая в случае с глюкозой). При нейтрализации водных растворов оксидом кальция образуется в воде растворимый глюконат кальция, наличие которого в растворе повышает ее жесткость и ХПК. Для сброса в коллектор такой окрашенной и грязной воды необходимо ее обесцветить, пропуская через угольные фильтры, а для снижения концентрации солей, ХПК и жесткости осуществить более чем стократное ее разбавление чистой водой.
Таким образом, способ [3] многостадиен и характеризуется неудовлетворительными экономическими и экологическими показателями.
Задача изобретения - усовершенствование, упрощение и повышение эффективности процесса регенерационной утилизации отработанных медь (II) содержащих щелочных гальванических электролитов, количественное выделение катионов меди из растворов с минимальным его загрязнением (засолением).
Технический результат - количественная регенерация из растворов тартратов и катионов меди, очистка сточной воды до достижения концентрации катионов меди значений ниже ПДК.
Это достигается тем, что способ регенерационной очистки отработанных медно-тартратных щелочных гальванических электролитов, содержащих катионы меди (II), восстановлением катионов меди (II) до оксида меди (I) при нагревании, удалением оксида меди (I) и гидротатртата калия из кислых растворов их регенерацией, отличающийся тем, что в качестве восстановителя применяют соли гидроксиламина, а процесс восстановления осуществляют при pH 10-12, температуре 60°С в течение 15 минут и мольном соотношении υ (Cu2+): υ (амин)=1:1,1.
Восстановление меди (II) в щелочных растворах, содержащих комплексы меди (II) с D-винной кислотой (таратраты) в оксид меди (I) осуществляют нагреванием (60°С) отработанных растворов в присутствии соли гидроксиламина сернокислого (или солянокислого) при рН 10-12.
Удаляют из раствора нерастворимый в воде оксид меди (I) и гидротартрат калия при рН 3,5-4,5 фильтрованием.
Гидротартрат калия растворяют в растворе гидроксида натрия и регенерируют сегнетову соль в виде водного концентрата и используют его для приготовления свежих гальванических электролитов.
Оксид меди (I) регенерируют в концентрат сульфата меди (II), окисляя Cu2O кислородом воздуха в сернокислом растворе.
Нейтрализацию очищенного раствора осуществляли оксидом кальция, что позволяет удалить из воды сульфат анионы и следы гидротартрата калия.
Такая последовательность процедур позволяет при минимальных расходах химикатов обеспечить максимально полное извлечение из отработанных медно-тартратных щелочных растворах все компоненты и очистить воду до гигиенических требований, с минимальной засоленностью.
Способ позволяет удешевить, упростить и усовершенствовать процесс, повысить его экологические показатели, так как при использовании недорогого и доступного гидроксиламина в качестве восстановителя продуктами реакции являются азот и вода. После удаления оксида меди (I) образуется чистая и прозрачная в видимой области спектра вода, в которой отсутствуют катионы меди, показатели жесткости и ХПК очищенной воды не превышает гигиенические требования, и она может быть применена в оборотных технологических циклах или сброшена в коллектор без дополнительных процедур очистки.
Ход эксперимента: К 1 литру отработанному гальваническом электролиту содержащему (г/л): сульфат меди (6,4 или 2,6·105 ПДК), гидроксид натрия (10), калий-натрий тартрат (43), карбонат натрия (8), добавляют соль гидрокисламина, нагревают раствор на водяной бане. Оксид меди (I) удаляют из раствора, маточник подкисляют рН 3,5-4,5 при котором выделяется кристаллы гидротартрата калия. К маточному раствору добавляют оксид кальция, до достижения рН 7,5-8. Выпавший осадок - смесь сульфата кальция (гипс) и тартрата кальция - удаляют фильтрованием. Содержание меди в воде определяли фотометрически в виде ее комплекса с диэтилдитиокарбамата натрия при λmax=434-436 нм.
Гидротартрат калия растворяют в растворе гидроксида натрия и регенерируют в сегнетову соль в виде водного концентрата и используют его для приготовления свежих гальванических электролитов. Оксид меди (I) регенерируют в концентрат сульфата меди (II), окисляя Cu2O кислородом воздуха в сернокислом растворе.
Смесь сульфата кальция (гипс) и тартрата кальция может быть использована как добавка при производстве цемента или как вяжущее средство. Очищенная вода может быть использована в оборотных технологических циклах и сброшена в коллектор.
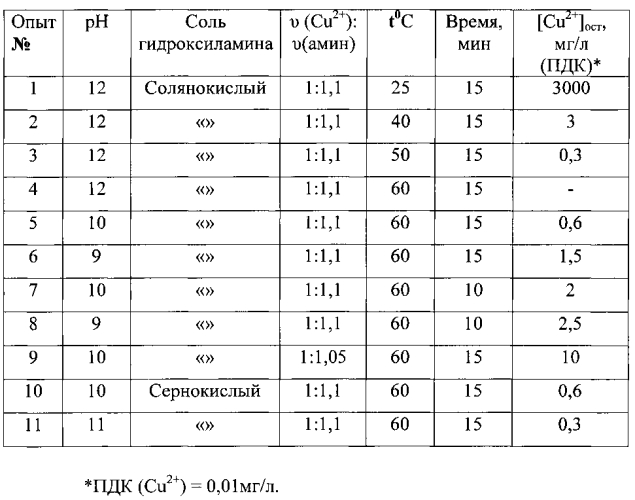
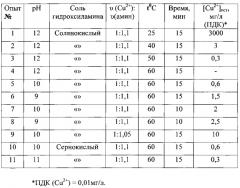
Количественные показатели исследований обобщены в таблице 1. *
Примеры 1-11 показывают, что в качестве восстановителя катионов меди могут быть применены как сернокислые так и солянокислые соли гидроксиламина при, при рН 10-12, температуре 60°С, в течение 15 минут и мольном соотношении υ (Cu2+): υ (амин)=1:1,1
Способ регенерационной очистки отработанных медно-тартратных щелочных гальванических электролитов, содержащих катионы меди (II), включающий восстановление катионов меди (II) до оксида меди (I) при нагревании, удаление оксида меди (I) и гидротатртата калия из кислых растворов, их регенерацию, отличающийся тем, что в качестве восстановителя применяют соли гидроксиламина, а восстановление осуществляют при pH 10-12, темпертуре 60°C в течение 15 минут и мольном соотношении υ (Cu) : υ (амин)=1:1,1.