Стент из оголенного металла с резервуарами, выделяющими лекарственные препараты
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к местному применению терапевтических средств и (или) комбинации терапевтических средств для профилактики и лечения сосудистых заболеваний, а более конкретно к внутрипросветным медицинским устройствам для локальной доставки терапевтических средств и (или) комбинаций терапевтических средств. Стент из оголенного металла с резервуарами, выделяющими лекарственные препараты, предназначенный для имплантации в трубчатый орган живого организма, включает продолговатую трубчатую конструкцию, по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции. Продолговатая трубчатая конструкция имеет люминальную поверхность и аблюминальную поверхность и включает множество взаимосвязанных элементов. Сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, который открывается в люминальную поверхность и аблюминальную поверхность. В состав по меньшей мере одного основного слоя композиции входит полимер, депонированный в по меньшей мере одном резервуаре, приближенном к люминальной поверхности, и ниже аблюминальной поверхности продолговатой трубчатой конструкции. В состав по меньшей мере одного покрывного слоя композиции входит терапевтический агент, депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции. После имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными указанным по меньшей мере одним основным слоем композиции и указанным по меньшей мере одним покрывным слоем композиции. Приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают. Верхняя поверхность слоя резервуара расположена ниже аблюминальной поверхности стента. В соответствии со вторым вариантом выполнения стента в состав по меньшей мере одного основного слоя композиции входит сополимер молочной и гликолевой кислот (PLGA), а в состав по меньшей мере одного покрывного слоя композиции входят сополимер молочной и гликолевой кислот (PLGA), рапамицин и бутилокситолуол (ВНТ). Изобретения снижают потенциальный риск развития тромбоза и (или) эмболии и противорестенозное действие в результате локальной доставки лекарственного препарата. 2 н.п. ф-лы, 49 ил., 10 табл.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ЗАЯВКИ
Настоящая заявка истребует приоритет, заявленный в предварительной заявке на патент США с регистрационным № 61/307040 от 23 февраля 2010 года, и является частичным продолжением поданной ранее заявки № 12/500043 от 09 июля 2009 года.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к местному применению терапевтических средств и (или) комбинации терапевтических средств для профилактики и лечения сосудистых заболеваний, а более конкретно к внутрипросветным медицинским устройствам для локальной доставки терапевтических средств и (или) комбинаций терапевтических средств.
Обзор материалов, использованных при экспертизе заявки
Множество людей страдает болезнями органов кровообращения, причиной которых является прогрессирующая окклюзия кровеносных сосудов, перфузирующих сердце и другие важные органы. Более интенсивная окклюзия кровеносных сосудов у таких людей зачастую приводит к артериальной гипертензии, ишемическому повреждению, инсульту или инфаркту миокарда. Атеросклеротические поражения сосудов, ограничивающие или блокирующие коронарный кровоток, являются основной причиной ишемической болезни сердца. Медицинская процедура, целью которой является увеличение кровотока в артерии, называется чрескожной транслюминальной коронарной ангиопластикой. Чрескожная транслюминальная коронарная ангиопластика является предпочтительным методом лечения стеноза коронарных артерий. Все возрастающее применение этого метода обусловлено довольно высокой частотой успеха и минимальной инвазивностью по сравнению с операцией коронарного шунтирования. Недостатком чрескожной транслюминальной коронарной ангиопластики является риск внезапного закрытия сосуда, которое может произойти непосредственно после процедуры, и рестеноза, который развивается в поздние сроки после процедуры. Кроме того, рестеноз является частым осложнением у пациентов, которые перенесли аутовенозное шунтирование с использованием подкожной вены бедра. Механизм острой окклюзии включает несколько факторов и может быть следствием уменьшения просвета сосуда с результирующим закрытием артерии и (или) отложения тромбоцитов и фибрина вдоль поврежденного участка только что расширенного кровеносного сосуда.
Рестеноз после чрескожной транслюминальной коронарной ангиопластики - более постепенный процесс, вызванный повреждением сосуда. Каждый их множества процессов, включающих тромбоз, воспаление, выделение фактора роста и цитокина, пролиферацию клеток, клеточную миграцию и синтез внеклеточного матрикса, способствует развитию рестеноза.
Хотя точный механизм рестеноза недостаточно изучен, основные этапы этого процесса установлены. В нормальной артериальной стенке скорость пролиферации гладкомышечных клеток низкая, приблизительно менее 0,1% в день. Гладкомышечные клетки в стенках сосудов имеют в основном сократительный фенотип, характеризующийся тем, что от 80 до 90% объема цитоплазмы занимает сократительный аппарат. Доля эндоплазматического ретикулума, комплекса Гольджи и свободных рибосом невелика, и они локализованы в околоядерной области. Внеклеточный матрикс окружает гладкомышечные клетки; он богат гепариноподобными гликозаминогликанами, которые, как предполагается, отвечают за сохранение сократительного фенотипа гладкомышечных клеток (Campbell and Campbell, 1985).
В процессе ангиопластики при расширении коронарного баллонного катетера под давлением происходит повреждение гладкомышечных клеток и эндотелиальных клеток внутри стенок сосудов; в ответ на повреждение инициируется тромботическая и воспалительная реакция. Клеточные факторы роста, такие как тромбоцитарный фактор роста, основной фактор роста фибробластов, эпидермальный фактор роста, тромбин и т.д., высвобождающиеся тромбоцитами, мигрирующими макрофагами и (или) лейкоцитами или непосредственно гладкомышечными клетками, вызывают ответную пролиферацию и миграцию гладкомышечных клеток медии. Эти клетки претерпевают изменение фенотипа: сократительный фенотип меняется на синтетический фенотип, для которого характерно наличие незначительного количества пучков сократительных волокон, хорошо развитого гранулярного эндоплазматического ретикулума, аппарата Гольджи и свободных рибосом. Пролиферация/миграция, как правило, начинается в течение одного-двух дней после травмы и достигает максимума через несколько дней после начала (Campbell and Campbell, 1987; Clowes and Schwartz, 1985).
Дочерние клетки мигрируют в интимальный слой гладкой мускулатуры артерии и продолжают пролиферировать и секретировать значительное количество белков внеклеточного матрикса. Пролиферация, миграция и синтез внеклеточного матрикса продолжаются до того момента, пока не восстановится поврежденный эндотелиальный слой, после чего пролиферация внутри интимы замедляется, что происходит, как правило, в течение 7-14 дней после травмы. Новообразованная ткань называется неоинтима. Дальнейшее сужение сосуда, которое происходит в течение последующих 3-6 месяцев, главным образом, является следствием негативного или констриктивного ремоделирования.
Одновременно с локальной пролиферацией и миграцией клетки воспалительного инфильтрата адгезируются к месту повреждения сосуда. В течение 3-7 дней посттравматического периода клетки воспалительного инфильтрата мигрируют в более глубокие слои стенки сосуда. В экспериментальных моделях на животных, где применялось как введение баллонного катетера, так и имплантация стента, клетки воспалительного инфильтрата присутствовали в месте повреждения сосуда по меньшей мере в течение тридцати дней (Tanaka et al., 1993; Edelman et al., 1998). Таким образом, присутствующие клетки воспалительного инфильтрата могут способствовать развитию как острой, так и хронической фазы рестеноза.
Многочисленные препараты были протестированы на наличие предполагаемого антипролиферативного действия при рестенозе и продемонстрировали некоторый эффект в экспериментальных моделях на животных. К числу препаратов, эффективно сокращающих степень гиперплазии интимы в экспериментальных моделях на животных, относятся: гепарин и гепариновые фрагменты (Clowes, A.W. and Karnovsky M., Nature 265: 25-26, 1977; Guyton, J.R. et al., Circ. Res., 46: 625-634, 1980; Clowes, A.W. and Clowes, M.M., Lab. Invest. 52: 611-616, 1985; Clowes, A.W. and Clowes, M.M., Circ. Res. 58: 839-845, 1986; Majesky et al., Circ. Res. 61: 296-300, 1987; Snow et al., Am. J. Pathol. 137: 313-330, 1990; Okada, T. et al., Neurosurgery 25: 92-98, 1989), колхицин (Currier, J.W. et al., Circ. 80: 11-66, 1989), таксол (Sollot, S.J. et al., J. Clin. Invest. 95: 1869-1876, 1995), ингибиторы ангиотензинпревращающего фермента (АПФ) (Powell, J.S. et al., Science, 245: 186-188, 1989), ангиопептин (Lundergan, C.F. et al. Am. J. Cardiol. 17 (Suppl. B):132B-136B, 1991), циклоспорин A (Jonasson, L. et al., Proc. Natl., Acad. Sci., 85: 2303, 1988), козьи антитела к фактору роста тромбоцитов кролика (Ferns, G.A.A., et al., Science 253: 1129-1132, 1991), тербинафин (Nemecek, G.M. et al., J. Pharmacol. Exp. Thera. 248: 1167-1174, 1989), трапидил (Liu, M.W. et al., Circ. 81: 1089-1093, 1990), траниласт (Fukuyama, J. et al., Eur. J. Pharmacol. 318: 327-332, 1996), гамма интерферон (Hansson, G.K. and Holm, J., Circ. 84: 1266-1272, 1991), рапамицин (Marx, S.O. et al., Circ. Res. 76: 412-417, 1995), стероиды (Colburn, M.D. et al., J. Vasc. Surg. 15: 510-518, 1992), см. также Berk, B.C. et al., J. Am. Coll. Cardiol. 17: 111B-117B, 1991), ионизирующее облучение (Weinberger, J. et al., Int. J. Rad. Onc. Biol. Phys. 36: 767-775, 1996), гибридные токсины (Farb, A. et al., Circ. Res. 80: 542-550, 1997), антисмысловые олигонуклеотиды (Simons, M. et al., Nature 359: 67-70, 1992) и векторы гена (Chang, M.W. et al., J. Clin. Invest. 96: 2260-2268, 1995). Антипролиферативное действие в отношении гладкомышечных клеток in vitro продемонстрировали многие из вышеперечисленных препаратов, включая гепарин и конъюгаты гепарина, таксол, траниласт, колхицин, ингибиторы ангиотензинпревращающего фермента (АПФ), гибридные токсины, антисмысловые олигонуклеотиды, рапамицин и ионизирующее облучение. Таким образом, препараты с различными механизмами ингибирования гладкомышечных клеток могут иметь терапевтический эффект в отношении уменьшения интимальной гиперплазии.
Однако в отличие от экспериментов на животных, попытки предотвратить рестеноз у людей, перенесших ангиопластику, с помощью системных фармакологических препаратов до сих пор не увенчались успехом. Ни комбинация аспирин-дипиридамол, ни тиклопидин, ни антикоагулянтная терапия (гепарин для неотложного лечения, варфарин для длительного применения, гирудин или гирулог), ни блокада рецепторов тромбоксана, ни стероиды не обладают эффективностью при предотвращении рестеноза, хотя ингибиторы тромбоцитов оказались эффективны для предотвращения острой реокклюзии после ангиопластики (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991). Антагонист ГП llb/llla рецепторов тромбоцита Reopro® до сих пор находится на стадии изучения, однако на сегодняшний день окончательного эффекта от применения Reopro® в плане снижения рестенозов после ангиопластики и стентирования не наблюдается. Другие препараты, также не показавшие эффективности в предотвращении рестеноза, включают блокаторы кальциевых каналов, миметики простациклина, ингибиторы ангиотензинпревращающего фермента, блокаторы серотониновых рецепторов и антипролиферативные препараты. Однако указанные препараты должны применяться системно, и достижение терапевтически эффективной дозы может оказаться невозможным. Это связано с тем, что концентрации, необходимые для антипролиферативного (или антирестенозного) эффекта, могут превышать известные токсические концентрации этих препаратов, так что уровень препарата в крови, достаточный для ингибирования гладких мышц, не может быть достигнут (Mak and Topol, 1997; Lang et al., 1991; Popma et al., 1991).
Дополнительные клинические испытания, в которых изучали эффективность использования пищевых добавок, содержащих диетический рыбий жир или холестеринпонижающие средства, в отношении профилактики рестенозов, дали противоречивые или отрицательные результаты. Таким образом, в настоящее время нет клинически доступного фармакологического препарата для предотвращения постангиопластического рестеноза (Mak and Topol, 1997; Franklin and Faxon, 1993: Serruys, P.W. et al., 1993). Современные исследования позволяют предположить, что гиполипидемический/антиоксидантный препарат пробукол может применяться для предотвращения рестеноза, однако данное исследование требует подтверждения (Tardif et al., 1997; Yokoi, et al., 1997). В настоящее время пробукол (Probucol) не утвержден для применения в США, а тридцатидневный период предварительного лечения исключает возможность его применения в случае неотложной ангиопластики. Кроме того, применение ионизирующего излучения показало многообещающие результаты в отношении уменьшения или предотвращения рестенозов после ангиопластики у пациентов с имплантированными стентами (Teirstein et al., 1997). Тем не менее, на сегодняшний день наиболее эффективными способами лечения рестеноза являются повторная ангиопластика, атерэктомия или аортокоронарное шунтирование, так как на данный момент ни одно терапевтическое средство не разрешено для использования с целью предотвращения постангиопластического рестеноза Управлением по контролю за качеством пищевых продуктов и медикаментов.
В отличие от системной терапии лекарственными препаратами, стенты доказали свою эффективность в плане значительного уменьшения рестенозов. Как правило, стенты представляют собой металлические трубочки ячеистой структуры (обычно, но не обязательно, изготовленные из нержавеющей стали), расширяемые при помощи баллона, которые после расширения внутри просвета коронарной артерии, подвергаемой ангиопластике, обеспечивают структурную опору благодаря жесткой поддержке стенки артерии. Эта поддержка способствует обеспечению проходимости просвета сосуда. В двух рандомизированных клинических испытаниях стенты способствовали ангиографическому успеху после чрескожной транслюминальной коронарной ангиопластики путем увеличения минимального диаметра просвета и уменьшения частоты возникновения, но не предотвращали рестеноз через шесть месяцев (Serruys et al., 1994; Fischman et al., 1994).
Кроме того, оказалось, что покрытие стентов гепарином дает дополнительный положительный эффект, выраженный в уменьшении подострых тромбозов после имплантации стента (Serruys et al., 1996). Таким образом, постоянное механическое расширение стенозированной коронарной артерии при помощи стента, как оказалось, в некоторой степени способствует предотвращению рестеноза, а покрытие поверхности стентов гепарином демонстрирует как целесообразность, так и клиническую эффективность локальной доставки лекарственных препаратов непосредственно к месту повреждения ткани.
Как было указано выше, применение гепаринового покрытия на стентах доказало пригодность и клиническую эффективность локальной доставки лекарственного препарата, однако эффективность такого лечения зависит от способа закрепления конкретного лекарственного препарата или комбинации препаратов на устройстве для локальной доставки. Например, способы и материалы, используемые для фиксации препарата/комбинации препаратов на устройстве для локальной доставки, не должны препятствовать действию препарата/комбинации препаратов. Кроме того, используемые процессы и материалы должны обладать биосовместимостью, а также должны удерживать препарат/комбинацию препаратов на устройстве для локальной доставки в процессе доставки и в течение заданного периода времени. Например, удаление препарата/комбинации препаратов в процессе доставки с поверхности устройства для локальной доставки потенциально может стать причиной нарушения работы устройства.
Таким образом, существует потребность в препарате/комбинации препаратов и соответствующих устройствах для локальной доставки с целью предотвращения и лечения повреждений сосудов, вызывающих утолщение интимы, которые имеют либо биологическую причину, например, атеросклероз, либо нанесены механическим путем, например, в результате чрескожной транслюминальной коронарной ангиопластики.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стент, выделяющий рапамицин и являющийся предметом настоящего изобретения, не обладает описанными выше ограничениями, свойственными ранним прототипам.
В соответствии с первым аспектом настоящее изобретение относится к стенту из оголенного металла с резервуарами, выделяющими лекарственный препарат, предназначенному для имплантации в полый орган живого организма. Стент из оголенного металла представляет собой продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность. Продолговатая трубчатая конструкция включает множество взаимосвязанных элементов; сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, проходящий от люминальной поверхности к аблюминальной поверхности, по меньшей мере один основной слой композиции, в состав которого входит полимер, депонированный по меньшей мере в одном резервуаре, приближенном к люминальной поверхности продолговатой трубчатой конструкции, и по меньшей мере один покрывной слой композиции, в состав которого входит терапевтическое средство, депонированное в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными по меньшей мере одним основным слоем композиции и по меньшей мере одним покрывным слоем композиции, и приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают.
В соответствии с другим аспектом настоящее изобретение относится к стенту из оголенного металла с резервуарами, выделяющими лекарственный препарат, предназначенному для имплантации в полый орган живого организма. Стент из оголенного металла включает продолговатую трубчатую конструкцию, имеющую люминальную поверхность и аблюминальную поверхность. Продолговатая трубчатая конструкция включает множество взаимосвязанных элементов; сегмент взаимосвязанных элементов включает по меньшей мере один резервуар, проходящий от люминальной поверхности к аблюминальной поверхности, по меньшей мере один основной слой композиции, в состав которого входит сополимер молочной и гликолевой кислот (PLGA), депонированный по меньшей мере в одном резервуаре, приближенном к люминальной поверхности продолговатой трубчатой конструкции, и по меньшей мере один покрывной слой композиции, в состав которого входят сополимер молочной и гликолевой кислот (PLGA), рапамицин и бутилокситолуол (BHT), депонированный в резервуаре поверх основного слоя композиции и ниже аблюминальной поверхности продолговатой трубчатой конструкции, при этом после имплантации приблизительно 75% аблюминальной поверхности представлено оголенным металлом и приблизительно 25% аблюминальной поверхности занято резервуарами, по меньшей мере частично заполненными по меньшей мере одним основным слоем композиции и по меньшей мере одним покрывным слоем композиции, и приблизительно через девяносто дней после имплантации по меньшей мере один основной слой композиции и по меньшей мере один покрывной слой композиции полностью исчезают.
Стент, являющийся предметом настоящего изобретения, обладает уникальной конструкцией, вкратце описанной выше, и может производиться из кобальто-хромового сплава. Стент сконструирован таким образом, чтобы поддерживать проходимость просвета сосуда и осуществлять доставку сиролимуса к окружающим артерию тканям в целях профилактики и лечения сосудистой патологии, включая рестеноз. Сиролимус входит в состав полимерной матрицы, предпочтительно в сочетании со стабилизирующим агентом, таким как бутилированный гидрокситолуен. Каждый резервуар в составе стента заполняется раствором, содержащим сиролимус, полимер, стабилизирующий агент и растворитель. Процесс заполнения осуществляется в несколько этапов, каждый из которых сопровождается стадией высушивания в целях удаления растворителя. Конструкция каждого резервуара минимизирует выделение сиролимуса в кровоток, при этом максимально способствуя его высвобождению в окружающие стент ткани артериальной стенки.
Стент, являющийся предметом настоящего изобретения, обеспечивает контролируемую, продолжительную и местную доставку сиролимуса непосредственно к окружающим его тканям, с минимальной потерей препарата в кровоток. Настоящий стент предпочтительнее изготавливать из кобальто-хромового сплава, который является менее хрупким и обладает большей эластичностью и прочностью, а также повышенной долговечностью в сравнении со стентами, изготовленными из других материалов.
Стенты с резервуарами, выделяющими лекарственные препараты, имеют ряд преимуществ по сравнению со стентами, выделяющими лекарственные препараты и имеющими стандартное покрытие. Например, резервуары защищают депонированный полимер и лекарственную матрицу или композицию от механического разрушения при прохождении стента по извитым анатомическим структурам и сильно обызвествленным отложениям, которые могут спровоцировать расслоение поверхности стентов со стандартным покрытием. Резервуары обеспечивают большую вместимость и позволяют повысить соотношение лекарственного препарата и полимера благодаря тому, что полимеры в резервуаре не подвергаются растягиванию и деформации, как в случае полимерных покрытий. Резервуары также позволяют использовать меньшую массу полимера и, таким образом, уменьшить опорную толщину на 10-30 микрон. Резервуары позволяют при помощи одного стента осуществить доставку нескольких лекарственных препаратов и (или) терапевтических средств с независимыми профилями высвобождения и выполнить обработку металлических поверхностей стента, не затрагивая при этом его лекарственные и полимерные составляющие. Кроме того, резервуары обеспечивают большую гибкость и вариабельность в отношении выборочной направленной доставки и позиционной и (или) направленной локализованной доставки. Помимо этого, наличие резервуаров обеспечивает лучшую биосовместимость стента и сосуда, так как при имплантации стенка сосуда контактирует с поверхностью стента, выполненной по существу из оголенного металла и практически не содержащей полимеров. Это актуально в том случае, если при заполнении резервуаров композиция располагается в лунке или имеющиеся резервуары используются не в полном объеме, как подробно описано ниже.
Стенты из оголенного металла обладают преимуществами, как вкратце описано выше. Стенты с резервуарами, выделяющими лекарственные препараты, составляющие предмет настоящего изобретения, объединяют в себе лучшие характеристики, присущие стентам из оголенного металла и стентам, выделяющим лекарственные препараты. В примерах осуществления, описанных в настоящем документе, у стентов с резервуарами, выделяющими лекарственные препараты, внешняя или аблюминальная поверхности представлены приблизительно на 75% оголенным металлом и на 25% полимером и лекарственным препаратом. Если при заполнении резервуаров используется не весь объем, и они заполнены таким образом, что слои или вкладки начинаются от люминальной стороны, как описано выше, то участок поверхности, относящийся к аблюминальной стороне, стентов с резервуарами, выделяющими лекарственные препараты, на 75% представлен оголенным металлом, а остальные 25% поверхности образованы открытыми резервуарами. Иными словами, общая площадь внешней поверхности стента приблизительно на 25% состоит из площади резервуаров, остальные 75% площади поверхности составляют несущие элементы конструкции и шарниры. Такое процентное соотношение является исходным значением. Иными словами, во время имплантации стента 75% площади поверхности стента, контактирующей со стенкой сосуда, выполнено из оголенного металла, а 25% площади поверхности стента образовано резервуарами, по меньшей мере частично заполненными полимером и лекарственным препаратом, как подробно описано ниже. Однако ввиду того, что сополимер молочной и гликолевой кислот (PLGA) подвержен биологическому разложению путем гидролиза его сложных эфирных связей, приблизительно через девяносто дней в резервуарах стента не остается полимера и (или) лекарственного препарата. Соответственно, через девяносто дней поверхность стента на 100% представлена оголенным металлом, так как резервуары полностью освобождаются от содержащегося в них лекарственного препарата и полимера. Более конкретно, вся площадь поверхности стента, соприкасающаяся с сосудом, состоит из оголенного металла, и в резервуарах не остается полимера и (или) полимера и лекарственного препарата. Таким образом, благодаря доставленному лекарственному препарату удается ликвидировать рестеноз, а стент из оголенного металла остается и функционирует в качестве поддерживающей конструкции, препятствующей сужению просвета сосуда. Такая конструкция стента из оголенного металла позволяет получить положительный эффект, а именно - снижение потенциального риска развития тромбоза и (или) эмболии и противорестенозное действие в результате локальной доставки лекарственного препарата.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеизложенные и прочие характеристики и преимущества изобретения станут очевидными после более подробного описания предпочтительных вариантов осуществления изобретения, проиллюстрированных с помощью прилагаемых чертежей.
На фиг.1 представлен продольный вид стента (концы не показаны) до расширения; видны наружная поверхность стента и характерная ячеистая структура стента.
На фиг.2 представлен общий продольный вид стента, показанного на фиг.1, который подвергли модификации с целью создания резервуаров.
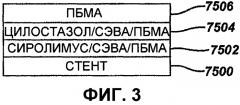
На фиг.3 в виде диаграммы представлен первый пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
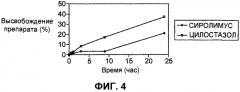
На фиг.4 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого в первом примере осуществления настоящего изобретения.
На фиг.5 в виде диаграммы представлен второй пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.6 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro, характерная для стента, рассматриваемого во втором примере осуществления настоящего изобретения.
На фиг.7 в виде диаграммы представлен третий пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.8 представлены антитромботические свойства покрытий, содержащих смесь сиролимуса и цилостазола в экспериментальной модели кровообращения in vitro с использованием бычьей крови.
На фиг.9 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фиг.11.
На фиг.10 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фиг.11.
На фиг.11 в виде диаграммы представлен четвертый пример осуществления настоящего изобретения, где стент покрыт смесью сиролимуса и цилостазола.
На фиг.12 графически представлена кинетика высвобождения сиролимуса и цилостазола in vivo из стента, показанного на фиг.3.
На фиг.13 графически представлена кинетика высвобождения сиролимуса и цилостазола in vitro из стента, показанного на фиг.3.
На фиг.14 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным на концах устройства.
На фиг.15 представлено изометрическое изображение расширяемого медицинского устройства с лечебным препаратом, размещенным в центральной части устройства, и без лечебного препарата на концах устройства.
На фиг.16 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в различных отверстиях.
На фиг.17 представлено изометрическое изображение расширяемого медицинского устройства с различными лечебными препаратами, размещенными в перемежающихся отверстиях.
На фиг.18 представлено увеличенное боковое изображение расширяемого медицинского устройства с ячейками для лечебных препаратов, расположенными в соединительных элементах.
На фиг.19 представлено увеличенное боковое изображение участка расширяемого медицинского устройства с бифуркационной ячейкой.
На фиг.20 представлено изображение поперечного разреза расширяемого медицинского устройства, содержащего комбинацию первого лекарственного препарата, например, противовоспалительного агента, размещенного в первой группе ячеек, со вторым лекарственным препаратом, таким как антипролиферативный препарат, размещенным во второй группе ячеек.
На фиг.21 в качестве примера графически показана кинетика высвобождения противовоспалительного и антипролиферативного препаратов, доставляемых расширяемым медицинским устройством, представленным на фиг.20.
На фиг.22A, 22B и 22C представлены частично выполненные в форме диаграммы иллюстрации альтернативного варианта осуществления расширяемого медицинского устройства.
На фиг.23A, 23B и 23C представлены примеры лактидов (димеров), используемых в синтезе стереоспецифичных полилактидов.
На фиг.24 представлен поли-L-лактид.
На фиг.25 представлен поли-D-лактид.
На фиг.26A, 26B и 26C представлены схемы покрытия или депонирования с применением чередующихся слоев полимеров, имеющих идентичные терапевтическим средствам химические составы, но различные оптические свойства.
На фиг.27A и 27B представлены схемы покрытия или депонирования с применением растворов, содержащих как поли-D-молочную кислоту, так и поли-L-молочную кислоту в молярном отношении 1:1.
На фиг.28 представлено графическое боковое изображение части стента, выделяющего два лекарственных вещества.
На фиг.29 представлено графическое изображение общего высвобождения лекарственного вещества в процентном соотношении in vivo.
На фиг.30 графически представлено общее количество (вес.) высвободившихся сиролимуса и цилостазола in vivo.
На фиг.31A представлен вид в перспективе гибкого стента в расширенном (развернутом) состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.31B представлен вид в перспективе гибкого стента в сжатом состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.31C представлен вид в перспективе гибкого стента в «вырезанном» (готовом) состоянии в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.32 представлен вид в проекции на плоскость гибкого стента в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.33 представлен вид в проекции на плоскость гибкого стента, показанного на фиг.32, с пространственным разделением компонентов.
На фиг.34A представлен приближенный вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34B представлен приближенный вид в проекции на плоскость несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34C представлен приближенный вид в проекции на плоскость несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.34D представлен приближенный вид в проекции на плоскость органически оптимизированного несущего элемента конструкции гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.35A представлен приближенный вид в проекции на плоскость гибкого шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.35B представлен приближенный вид в проекции на плоскость гибкого шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36A представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36B представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36C представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36D представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36E представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36F представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36G представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36H представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36I представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36J представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36K представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36L представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.36M представлен приближенный вид в проекции на плоскость круглой шарнирной области гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.37 представлен приближенный вид в проекции на плоскость индексного шарнира гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.38 представлен приближенный вид в проекции на плоскость центральной зоны, изображенной на фиг.33, иллюстрирующий угол наклона спирали (витка).
На фиг.39A представлен приближенный вид в проекции на плоскость соединительного элемента конструкции, являющегося частью цикличной структуры, образующей центральную зону гибкого стента, показанного на фиг.32, и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.39B представлен приближенный вид в проекции на плоскость независимого элемента конструкции, являющегося частью цикличной структуры, образующей центральную зону гибкого стента, показанного на фиг.32, и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.40 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.41 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.40, в разобранном состоянии.
На фиг.42 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.43 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.42, в разобранном состоянии.
На фиг.44 представлен вид в проекции на плоскость гибкого стента, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.45 представлен вид в проекции на плоскость гибкого стента, представленного на фиг.44, в разобранном состоянии.
На фиг.46 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.44 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.47 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.42 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.48 представлен приближенный вид в проекции на плоскость независимого элемента конструкции и соединительного элемента конструкции, являющихся частью циклической структуры, образующей центральную зону гибкого стента, показанного на фиг.40 и выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
На фиг.49 представлен вид в проекции на плоскость гибкого стента без накопительных депо, выполненного в соответствии с одним из вариантов осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Препарат (комбинация препаратов) и устройства доставки, охватываемые рамками настоящего изобретения, могут использоваться для эффективного предотвращения и лечения заболеваний сосудов, в частности, заболеваний сосудов, вызванных повреждениями сосудов. Различные медицинские устройства, используемые при лечении заболеваний сосудов, могут в итоге вызывать дальнейшие осложнения. Например, процедура баллонной анг