Способ моделирования пострезекционной гипокальцемии
Иллюстрации
Показать всеИзобретение относится к области медицины. В качестве экспериментальных животных используют самок крыс породы Wistar в возрасте не менее 10 месяцев, которым выполняют тотальную паратиреоидэктомию с одномоментной резекцией ткани щитовидной железы вглубь на расстояние 0,1-0,2 мм от капсул околощитовидных желез. На раневую поверхность щитовидной железы наносят медицинский клей «Сульфакрилат». Способ позволяет получить стабильную, стандартизированную со 100% воспроизводимостью модель гипокальциемии при отсутствии летальности экспериментальных животных. 6 ил., 2 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области медицины, а именно к экспериментальной хирургии, патофизиологии и эндокринологии, и может быть использовано для изучения механизмов нарушения обмена кальция, связанного с удалением околощитовидных желез.
Известно, что послеоперационная гипокальциемия и гипопаратиреоз остаются самыми частыми осложнениями после хирургического лечения заболеваний щитовидной и околощитовидных желез (Аюшеева А.В., Ильичева Е.А., Лепехова С.А. Послеоперационный гипопаратиреоз, способы профилактики и коррекции / Бюллетень ВСНЦ СО РАМП - 2013 - №1 (89). - С.160-164).
Известны различные способы моделирования гипокальциемии.
Так известен способ моделирования гипокальциемии путем удаления околощитовидных желез у экспериментальных животных - собак (Лопухин Ю.М. Экспериментальная хирургия // М.: Москва. - 1971. - С.266-268). Сущность известного способа заключается в следующем. Под общим обезболиванием проводят срединный разрез на шее от щитовидного хряща книзу, не доходя 2 см до яремной вырезки грудины. Продольные мышцы шеи разъединяют тупым путем и обнажают трахею. По бокам от трахеи, в толще сосудисто-нервного влагалища, пальпаторно находят щитовидную железу, которую выпрепаровывают из ложа и устанавливают локализацию околощитовидных желез. Артерию верхней наружной околощитовидной железы перевязывают и удаляют. Околощитовидные железы вылущивают из-под капсулы щитовидной железы с помощью пинцета. Если ткань щитовидной железы на месте удаления околощитовидных желез кровоточит, то через ее паренхиму накладывают отдельный шов, которым стягивают капсулу. После удаления околощитовидных желез на одной стороне щитовидную железу погружают на место и операцию продолжают на противоположной стороне.
К недостаткам данного способа следует отнести то, что известный способ может быть выполнен только на крупных животных, у которых артериальный сосуд околощитовидной железы проходит вне ткани щитовидной железы.
Данный способ не может быть использован для экспериментального животного - крысы, что обусловлено как малым размером этого животного, так и топографо-анатомической особенностью расположения околощитовидных желез. У крыс щитовидная железа с околощитовидными железами представлена единым органокомплексом, что обусловливает сложность в выделении и лигировании питающих сосудов околощитовидных желез.
Кроме этого, к недостаткам данного способа следует отнести отсутствие возможности стандартизации получаемых результатов и воспроизводимости модели, так как в эксперименте использованы нелинейные животные, а разные породы собак имеют разный вес, рост, иммунитет, сроки заживления и т.п.
Наиболее близким по технической сущности к предлагаемому является способ моделирования гипокальциемии, включающий разрез в области шеи экспериментального животного (крысы), выделение щитовидной железы и паращитовидных желез, проведение деструкции ткани околощитовидной и щитовидной желез, ушивание раны (Джиоев И.Г., Козаев А.В., Кабоева Б.Н., Козаев Р.Э. Функционально-морфологическая характеристика почек и состояние антиоксидантной системы у крыс с экспериментальной гипокальциемией // Фундаментальные исследования. - 2013. - №7. - С.301-304).
Известный способ осуществляют следующим образом: после обезболивания и фиксации экспериментального животного - крысы, проводят воротникообразный разрез в области шеи, выделяют щитовидную железу и в ее толще, по обе стороны, находят паращитовидные железы, которые выжигают термокаутером, после чего рану ушивают.
К недостаткам известного способа следует отнести то, что он не обеспечивает возможности получения стабильной модели гипокальциемии, т.к. только у 75% животных уровень общего кальция крови после эксперимента составлял 1,78±0,18 ммоль/л, а у 25% животных общий кальций снижался несущественно (2,18±0,16 ммоль/л), что оставалось близким к уровню общего кальция интактных крыс (2,32±0,19), и таких животных исключали из эксперимента.
К недостаткам известного способа следует отнести и летальность животных, которая в первые сутки после операции составляла 10-20%. Такая летальность экспериментальных животных связана с повреждениями и вовлечением в воспалительный процесс щитовидной железы. Кроме этого, разрушение околощитовидных желез термокаутером снижает воспроизводимость и эффективность модели, т.к. выжигается плохо контролируемый объем ткани околощитовидных желез, а неразрушенные участки ткани способны регенерировать в различные сроки послеоперационного периода. Следовательно, известный способ не позволяет получить высоковоспроизводимую стандартизированную модель гипокальциемии.
Задачей заявляемого изобретения является разработка способа моделирования пострезекционной гипокальциемии при тотальной паратиреоидэктомии стандартного лабораторного животного.
Техническим результатом предлагаемого способа является обеспечение возможности получения стабильной, стандартизированной и высоковоспроизводимой модели гипокальциемии при снижении летальности экспериментальных животных.
Технический результат достигается тем, что способ моделирования пострезекционной гипокальциемии включает выполнение разреза в области шеи экспериментального животного - крысы, выделение щитовидной железы, удаление паращитовидных желез и ушивание раны.
Отличительные приемы предлагаемого способа заключаются в том, что в качестве экспериментальных животных используют самок крыс породы Wistar в возрасте не менее 10 месяцев. Экспериментальному животному в области шеи выполняют угловой разрез и проводят тотальную паратиреоидэктомию. При этом одномоментно резецируют ткань щитовидной железы вглубь на расстояние 0,1-0,2 мм от капсул околощитовидных желез. После чего на раневую поверхность щитовидной железы наносят медицинский клей «Сульфакрилат».
Сопоставительный анализ заявляемого технического решения с прототипом показал, что предлагаемый способ отличается от известного вышеперечисленными приемами и, следовательно, соответствует критерию изобретения «новизна».
Использование в качестве экспериментальных животных крыс породы Wistar обусловлено тем, что у крыс-самок десятимесячного возраста околощитовидные железы ограничены выраженной соединительно-тканной капсулой и лежат на капсуле щитовидной железы, приподнимаясь над ее поверхностью. Данная особенность была установлена авторами предлагаемого способа при исследовании топографической анатомии околощитовидных желез этих животных. Так авторами установлено, что у крыс в возрасте 6-ти месяцев околощитовидные железы располагаются под фиброзной капсулой щитовидной железы и полностью погружены в ее паренхиму и практически не дифференцируются. С увеличением возраста (10 месяцев) соединительно-тканная капсула становится выраженной, околощитовидная железа возвышается над латерокраниальной поверхностью ткани щитовидной железы. Эта особенность обеспечила возможность сохранения максимального объема интактной ткани щитовидной железы и упростила техническое исполнение паратиреоидэктомии.
Использование подбора животных по половому и возрастному критерию позволяет стандартизировать получаемые результаты, а также повысить воспроизводимость модели, вследствие максимального снижения вариабельности топографо-анатомического расположения околощитовидных желез по отношению к щитовидной железе.
Угловой разрез кожи при доступе к околощитовидным железам позволяет избежать размещения кожного шва непосредственно над зоной операции, что благоприятно сказывается на репаративных процессах и предотвращает вовлечение щитовидной железы в формирование рубца.
Удаление околощитовидных желез с резекцией 0,1-0,2 мм прилежащей ткани щитовидной железы обеспечивает устойчивую гипопаратемию (отсутствие функции околощитовидных желез) и отсутствие возможности регенерации. За счет такого объема операции получаемая модель гипокальциемии устойчива, что позволяет использовать ее в хроническом эксперименте.
Нанесение клея «Сульфакрилат» обеспечивает надежный гемостаз раневой поверхности щитовидной железы. Кроме этого, клей «Сульфакрилат» обладает антисептическими свойствами, что также профилактирует инфекционные осложнения (Толстиков А.Г., Толстиков Г.А., Воробьева А.И., Марченко В.Т., Кривошапкин А.Л. Пат. РФ 2156140. «Клей медицинский». Опубл. 20.09.2000, бюл. №26).
В доступной литературе авторами не выявлено способа моделирования пострезекционной гипокальциемии по отличительным признакам заявляемого способа, что позволяет сделать вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Способ, составляющий заявляемое изобретение, предназначен для использования в экспериментальной медицине. Возможность его осуществления подтверждена описанными в заявке приемами и средствами, следовательно, заявляемое изобретение соответствует критерию патентоспособности «промышленная применимость».
Заявляемый способ осуществляют следующим образом.
Экспериментальным животным - крысам, самкам породы Wistar, десятимесячного возраста с массой 200-300 г, после обезболивания и фиксации на столике А.И. Сеченова в положении на спине, на левой половине вентральной поверхности шеи ножницами выстригают шерсть, затем кожу обрабатывают антисептиком. С использованием ножниц производят угловой разрез кожи, с формированием лоскута косынкообразной формы, вершина которого обращена к боковой поверхности шеи, кожный лоскут отпрепаровывают, отводят на зажиме вправо. Попеременно тупым и острым путем, с использованием ножниц и пинцета, мобилизуют слюнные железы в бессосудистой зоне. Грудино-подъязычные мышцы тупым путем разделяют по срединной линии и отводят на держалках в верхней и нижней третях в противоположные стороны. Визуализируют гортань и трахею. Подводят операционный микроскоп, устанавливают увеличение ×12,5. При помощи микрохирургических инструментов (пинцет, ножницы) мобилизуют боковые поверхности обеих долей щитовидной железы от щитогрудинных мышц и сосудисто-нервных пучков шеи. После мобилизации боковых поверхностей щитовидной железы визуализируют околощитовидные железы с обеих сторон по дорсолатеральным поверхностям верхних третей боковых долей щитовидной железы (фиг.1 - 1). Подводят объектив микроскопа с увеличением ×25. Пинцетом за фиброзную капсулу подтягивают кверху околощитовидную железу, ножницами отсекают околощитовидную железу без нарушения целостности ее капсулы, резецируя при этом щитовидную железу вглубь на расстояние 0,1-0,2 мм от ее капсулы. После чего осуществляют гемостаз нанесением на поверхность дефекта ткани щитовидной железы 0,01 мл клея «Сульфакрилат», который равномерно тонкой пленкой распределяется по поверхности дефекта (фиг.2 - 2). Грудино-подъязычные мышцы сопоставляют узловым швом. Кожу ушивают непрерывным швом.
Предлагаемый способ поясняется примером конкретного выполнения.
Исследование проводилось на 30 белых крысах-самках породы «Wistar», 10-месячного возраста, с массой тела 200-250 г.
Животных содержали в условиях вивария при свободном доступе к воде и пище, что соответствует нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ» (виварий I категории, вет. удостоверение 238 №000360 от 30 апреля 2013 г., служба ветеринарии Иркутской области) по утвержденным СОП (Лепехова С.А. Программа стандартных операционных процедур: лабораторные животные (прием, содержание, уход и контроль здоровья животных в вивариях медицинского учреждения): учеб. пособие) / С.А. Лепехова. - Иркутск: НЦРВХ СО РАМН; ИГМУ, 2012. - 96 с.). Опыты на животных выполняли в соответствии с правилами гуманного обращения с животными, регламентированными «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных».
В асептических условиях и под общей анестезией животное фиксировали на столике А.И. Сеченова в положении на спине. Обработка операционного поля: на левой половине поверхности шеи выстригали шерсть ножницами, кожу обрабатывали антисептиком «Бонадерм».
С помощью методов рандомизации животные были распределены на группы следующим образом:
№1 (n=12) опытная группа с моделированием пострезекционной гипокальциемии по заявляемому способу;
№2 (n=12) контрольная группа животных с моделированием гипокальциемии разрушением околощитовидных желез при помощи электрокоагуляции (способ прототип);
№3 (n=6) группа здоровых животных, содержащихся в условиях, одинаковых с экспериментальными.
Животных выводили из эксперимента на 3 и 14 сутки, при этом исследовали: общий и иммунологический анализ крови, концентрацию ионизированного кальция, паратиреоидный гормон крови. Забор крови для лабораторного исследования проводили у всех крыс в утренние часы на голодный желудок. Ионизированный кальций определяли с использованием электродного метода (EasyLite), паратиреоидный гормон - с использованием радиоиммунологического метода (IRMA РТН Imunotech).
При выведении животных из эксперимента выполняли гистологическое исследование органокомплекса в зоне операции (трахея, пищевод, гортань, щитовидная железа). Препараты окрашивали гематоксилином и эозином.
За норму приняты показатели, полученные у шести здоровых животных (группа №3).
Статистический анализ проводили при помощи непараметрических тестов в программе Statistica 6.0, результаты представляли в форме медианы с интерквартильным размахом.
Результаты исследования
В контрольной группе (способ прототип) двое животных (16,7%) умерли к исходу первых послеоперационных суток. Для изучения степени воспалительной реакции, процессов репарации, радикальности удаления околощитовидных желез было проведено гистологическое исследование зоны операции на 3-и и 14-е сутки послеоперационного периода.
При гистологическом исследовании на 3-и сутки у животных контрольной группы (фиг.3) выявлен коагуляционный некроз ткани поверхностных отделов щитовидной железы (фиг.3 - 3) и прилежащих волокон скелетной мышцы с демаркационной зоной воспаления в виде экссудата из лейкоцитов (фиг.3 - 4) с сохранившимися участками ткани щитовидной железы (фиг.3 - 6) и прилежащих волокон скелетной мышцы (фиг.3 - 5).
На 14-е сутки эксперимента у животных этой группы при гистологическом исследовании выявлено наличие большого объема развивающейся соединительной ткани с проникновением фибробластов в строму щитовидной железы (фиг.5 - 8), коагуляционный некроз скелетной мышцы (фиг.5 - 9), диффузная инфильтрация лейкоцитами (фиг.5 - 10).
В опытной группе погибших животных не было. При гистологическом исследовании на 3-и сутки эксперимента у животных этой группы на светооптическом уровне выявлена щитовидная железа без признаков некроза (фиг.4 - 6), волокна скелетной мышцы без признаков некроза (фиг.4 - 5), полость, содержащая массы коралловидной формы (клей «Сульфакрилат») (фиг.4 - 7) с минимальной реакцией лейкоцитов по периферии.
При гистологическом исследовании на 14-е сутки эксперимента у животных опытной группы определены: щитовидная железа с сохраненными фолликулами (фиг.6 - 6) и формирующуюся «тонкую» соединительнотканную капсулу (фиг.6 - 11), волокна скелетной мышцы с сосудами (фиг.6 - 5), полость с небольшим количеством клея «Сульфакрилат» (фиг.6 - 7).
Полученные данные свидетельствовали, что клей «Сульфакрилат» не оказывает повреждающего влияния на ткань щитовидной железы, снижает воспалительную реакцию, обеспечивает надежный окончательный гемостаз и ведет к уменьшению рубцового процесса в области операции.
Для подтверждения нарушений кальциевого обмена авторами заявляемого способа проведены лабораторные исследования уровней следующих показателей крови: паратиреоидного гормона, ионизированного кальция.
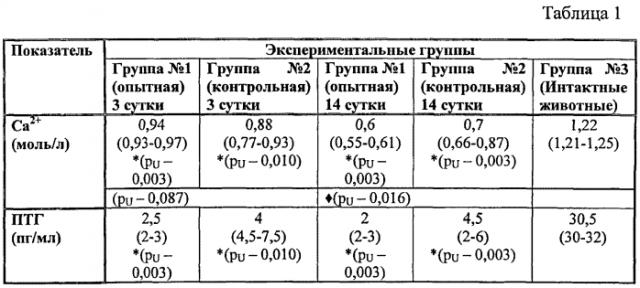
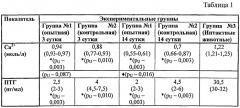
Так, в таблице 1 приведены результаты исследования показателей ионизированного кальция (Са2+) и паратиреоидного гормона крови (ПТГ) при сниженной функции околощитовидных желез, в динамике (медиана, квартили).
Из приведенных данных следует, что при моделировании гипокальциемии по известному способу (группа №1, опытная) уровни ионизированного кальция колебались в пределах от 0,6 до 0,9 ммоль/л, уровни паратиреоидного гормона от 2 до 8 пг/мл. Тогда как в группе животных с моделированием гипокальциемии по заявляемому способу (группа №2, контрольная) уровень ионизированного кальция находился в узких пределах от 0,52 до 0,64 ммоль/л. Уровни паратиреоидного гормона составили от 1 до 3 пг/мл. Следовательно, в опытной группе уровни паратиреоидного гормона и ионизированного кальция были значимо ниже, чем в группе контроля, что свидетельствуют о развитии стойкой гипокальциемии у 100% животных.
Для оценки системной воспалительной реакции авторами предлагаемого способа также были проведены исследования лейкоцитарного профиля, фагоцитарной активности.
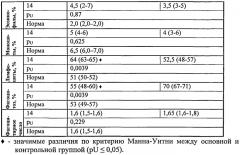
Так, в таблице 2 приведены результаты сравнительного анализа количества лейкоцитов, изменений в лейкоцитарной формуле, фагоцитоза, фагоцитарного числа на 14-е сутки после моделирования гипокальциемии (медиана, квартили).
У животных группы контроля к 14-м суткам выявлено повышение общего числа лейкоцитов, фагоцитарной активности, фагоцитарного числа.
В опытной группе показатели количества лейкоцитов, фагоцитарной активности были достоверно ниже, что показывает меньшую воспалительную реакцию в основной группе.
Таким образом, предлагаемый способ позволяет моделировать стандартизированную, высоковоспроизводимую (100%) пострезекционную стойкую гипокальциемию, характеризующуюся низким уровнем ионизированного кальция и паратиреоидного гормона, начиная с третьих суток исследования, в условиях ограничения воспаления, сохранности иммунного ответа и при отсутствии летальности экспериментальных животных.
При воспроизведении предложенной модели течение пострезекционной гипокальциемии в раннем послеоперационном периоде соответствует таковому в клинической практике, что дает возможность изучения как механизмов развития метаболических нарушений, так и их коррекции.
Способ моделирования пострезекционной гипокальциемии, включающий разрез в области шеи экспериментального животного - крысы, выделение щитовидной железы, удаление паращитовидных желез и ушивание раны, отличающийся тем, что в качестве экспериментальных животных используют самок крыс породы Wistar в возрасте не менее 10 месяцев, которым в области шеи выполняют разрез, выделяют околощитовидные железы и проводят тотальную паратиреоидэктомию с одномоментной резекцией ткани щитовидной железы вглубь на расстояние 0,1-0,2 мм от капсул околощитовидных желез, после чего на раневую поверхность щитовидной железы наносят медицинский клей «Сульфакрилат».